El hígado graso agudo del embarazo es una complicación infrecuente, pero potencialmente mortal, que puede ocurrir durante el tercer trimestre de embarazo.
Fue descrito por Sheehan en 1940 e inicialmente se pensó que era inevitablemente un trastorno mortal. Sin embargo, el diagnóstico precoz y la finalización inmediata de la gestación han mejorado el pronóstico de esta patología, y hoy en día la mortalidad materna es la excepción y no la regla, pudiendo conseguirse en la mayoría de los casos una completa recuperación de la paciente.
Presentamos el caso de una paciente de 28 años, con una gestación gemelar bicorial biamniótica, que durante la semana 38 de gestación desarrolló esta patología de forma aguda.
Acute fatty liver of pregnancy is a rare but life-threatening complication that can occur during the third trimester.
This complication was described by Sheehan in 1940 and was initially thought to be fatal in all cases. However, early diagnosis and immediate pregnancy termination have improved the prognosis of this disease. Maternal mortality is now the exception and not the rule, and complete recovery is usually achieved.
We report the case of a 28-year-old patient with a diamniotic dichorionic twin gestation who developed acute fatty liver of pregnancy in week 38.
El hígado graso agudo del embarazo es una complicación que ocurre únicamente durante la gestación en seres humanos y que se caracteriza por una infiltración grasa microvesicular de los hepatocitos1. Como resultado de la infiltración grasa, el hígado es incapaz de mantener su función normal y a consecuencia de esto tiene lugar un fallo hepático con hipoglucemia, alteración de la coagulación y encefalopatía2,3.
Es una patología infrecuente, que se produce generalmente durante el tercer trimestre de la gestación. La enfermedad siempre está presente antes del parto, aunque no siempre se diagnostica hasta después de que este ocurra.
Se ha asociado el hígado graso agudo del embarazo con uno de los defectos hereditarios en la beta-oxidación mitocondrial de los ácidos grasos, la deficiencia de cadena larga 3-hidroxiacil CoA deshidrogenasa (LCHAD), y esto sugiere que en algunas mujeres afectadas y sus fetos podría haber una deficiencia enzimática hereditaria en la beta-oxidación que predispondría a la madre a este trastorno4–6.
El diagnóstico de esta entidad es clínico, basándose en la forma de presentación, con los síntomas y signos característicos, y apoyándose en las pruebas de laboratorio. Las pruebas de imagen son útiles fundamentalmente para descartar otras patologías.
Caso clínicoPresentamos el caso de una paciente de 28 años, primigesta, con un embarazo gemelar espontáneo bicorial biamniótico en la semana 38 de gestación.
Como antecedentes personales la paciente tiene colon irritable y está amigdalectomizada. Debemos destacar de sus antecedentes familiares: su madre con hepatitis C activa y su padre con hipertensión arterial y diabetes mellitus.
La gestación tuvo un curso normal hasta la edad gestacional de 33 semanas, con cribado de cromosomopatías del primer trimestre de bajo riesgo en ambos gemelos, ecografía morfológica con 2 fetos de sexo masculino sin alteraciones, O¿Sullivan alterado con sobrecarga oral de glucosa de 100 g normal, serologías negativas para hepatitis C, VIH y toxoplasmosis, inmunizada frente a la rubéola y la hepatitis B.
Durante la semana 33 de la gestación la paciente acudió a urgencias con clínica de dinámica uterina, epigastralgia, náuseas y vómitos, siendo ingresada por amenaza de parto prematuro y gastroenteritis aguda. Recibió tratamiento tocolítico con atosiban y 2 dosis de corticoides para la maduración pulmonar fetal, además de medidas para el control de la sintomatología digestiva. En ese momento, las analíticas no presentaron ninguna alteración del perfil bioquímico ni de la coagulación y fue dada de alta asintomática y tras haber conseguido una tocólisis efectiva.
Acudió nuevamente con sensación de dinámica uterina, náuseas y vómitos a las 38 semanas de gestación. En la analítica se objetivó que las funciones hepática y renal estaban alteradas, con aspartato aminotransferasa (AST) 494 U/L, alanina aminotransferasa (ALT) 700 U/L, fosfatasa alcalina (FA) 1.925 U/L, y creatinina 1,4 mg/dl. El hemograma puso de manifiesto 13.630 leucocitos y 275.250 plaquetas. El estudio de coagulación estaba alterado con tiempo de protrombina (TP) 32,1%, ratio internacional normalizado (INR) 2,1, tiempo parcial de tromboplastina activado (TTPA) 64,1 segundos y fibrinógeno 127,2 mg/dl.
Se decidió la finalización de la gestación mediante cesárea, naciendo 2 fetos varones, el primero de 2.640 g y Apgar de 6/9/10, y el segundo de 2.580 g y Apgar de 7/9/9.
En el postoperatorio inmediato la paciente presentó una hemorragia importante con atonía uterina que se solventó con medidas farmacológicas, y posteriormente tuvo lugar un empeoramiento progresivo de la clínica siendo necesario el ingreso en una unidad de cuidados intensivos. La paciente se encontraba obnubilada, bradipsíquica y con asterixis (encefalopatía grado II); tenía ictericia conjuntival, de mucosas y piel, poliuria y polidipsia. Además, la paciente presentaba taquicardia sinusal a 160 lat/min, con cifras de tensión arterial normales en todo momento y sin objetivarse proteinuria.
Las pruebas de laboratorio objetivaron una disminución de hemoglobina y plaquetas, además de un empeoramiento de los tiempos de coagulación, con TP 16%, INR 4, TTPA 154 segundos y fibrinógeno 68,9 mg/dl. El perfil hepático continuaba alterado, con cifras de bilirrubina total 6,1 mg/dl, AST 194 U/L, ALT 276 U/L y FA 844 U/L. La paciente presentó episodios de hipoglucemias que precisaron perfusión continua de glucosa intravenosa. Se transfundieron concentrados de hematíes, plaquetas y plasma.
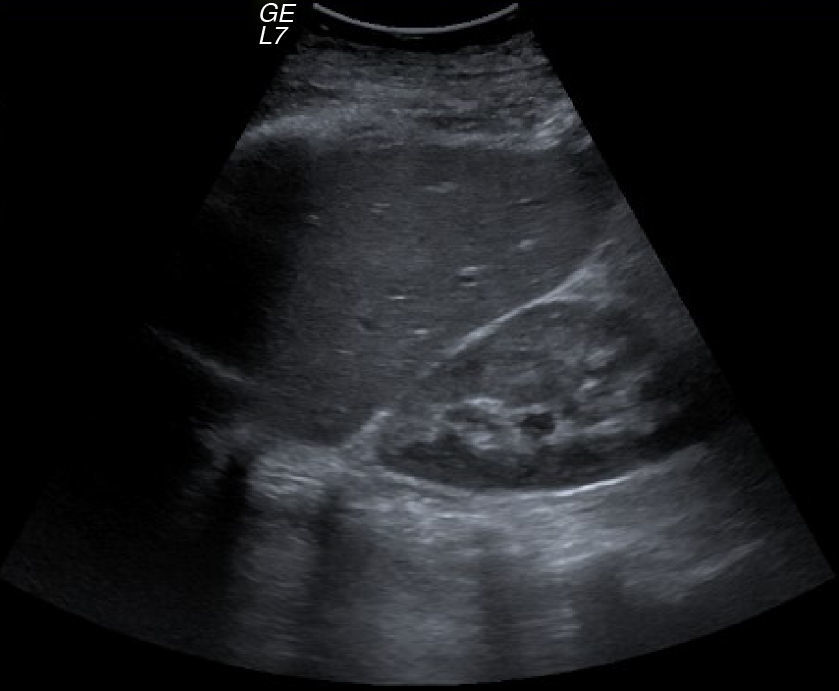
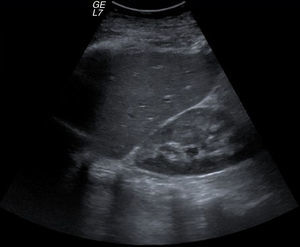
La ecografía Doppler hepática objetivó un hígado con aumento generalizado de la ecogenicidad de forma leve, sin dilatación de la vía biliar intra ni extrahepática y con permeabilidad de la porta, suprahepáticas y arteria hepática, con flujos dentro de la normalidad (fig. 1).
Se descartaron, mediante la serología, la infección por hepatitis A, hepatitis B, hepatitis C, VIH, toxoplasma, citomegalovirus, Brucella y Salmonella.
La paciente evolucionó favorablemente, aunque precisó múltiples transfusiones de concentrados de hematíes, plaquetas y plasma. Las transaminasas no presentaron cifras en rango normal hasta pasados 60 días desde el comienzo del cuadro.
El estudio genético para el déficit de LCHAD es negativo, sin encontrar ninguno de los alelos para la mutación p.E5110Q. Todas las pruebas solicitadas para el estudio etiológico hepático también son negativas, la alfa 1 antitripsina, ceruloplasmina, LKM anticuerpos, anticuerpos mitocondriales y el estudio de aminoácidos en suero y orina.
Se realizó un estudio exhaustivo de los recién nacidos, con resultados normales, y con el estudio genético para LCHAD también negativo en ambos.
DiscusiónEl hígado graso agudo del embarazo es una entidad poco frecuente, con una incidencia aproximada de 1 en 7.000 a 1 en 20.000 partos7–10. Es más común en embarazos múltiples y, posiblemente, en mujeres que tienen bajo peso9.
Los síntomas iniciales más frecuentes son náuseas o vómitos (aproximadamente el 75% de las pacientes), dolor abdominal (especialmente epigástrico, en el 43-50%), anorexia e ictericia (31-37%). Cerca de la mitad de las pacientes tienen signos de preeclampsia en la presentación o en algún momento durante el curso de la enfermedad11.
Pueden ocurrir complicaciones, como coagulación intravascular diseminada, encefalopatía hepática, insuficiencia renal, diabetes insípida central con poliuria y polidipsia, hemorragia posparto, pancreatitis e incluso fallo multiorgánico12–14.
El diagnóstico de hígado graso agudo del embarazo es generalmente clínico, estando basado fundamentalmente en la forma de presentación, las pruebas de laboratorio y las pruebas de imagen.
Las mujeres con hígado graso agudo del embarazo tienen pruebas hepáticas anormales, con elevación de la aminotransferasa sérica que puede ir desde valores modestos hasta 1.000 U/l. Los niveles de bilirrubina sérica también suelen estar elevados. El recuento de glóbulos blancos puede ser mayor que el que generalmente se observa en el embarazo, un cambio que no es específico. El recuento de plaquetas puede disminuir con o sin otros signos de coagulación intravascular diseminada, que se asocia a una reducción marcada en la antitrombina III15. Las pacientes gravemente afectadas también tienen elevaciones de amoníaco sérico, prolongación del tiempo de protrombina, y la hipoglucemia causada por insuficiencia hepática. La insuficiencia renal aguda e hiperuricemia están a menudo presentes16.
Las pruebas de imagen del hígado se utilizan principalmente para excluir otros diagnósticos, como un infarto o hematoma hepático. Algunos autores han informado de la presencia de grasa en la ecografía o la tomografía computarizada, pero estas pruebas son más útiles de forma retrospectiva, cuando se comparan las imágenes obtenidas durante el apogeo de la enfermedad con las obtenidas varios meses más tarde17,18.
La biopsia hepática es diagnóstica, mostrando la imagen característica, que es la infiltración grasa microvesicular de los hepatocitos. Las gotitas de grasa rodean al núcleo que está situado centralmente, dando al citoplasma un aspecto espumoso. La infiltración grasa es importante en la zona central y media del lóbulo19. Debido a que la biopsia hepática es una técnica invasiva, no se realiza de forma rutinaria; además, debe ser abordada con precaución durante el embarazo y sobre todo en casos en que exista una coagulopatía.
Se ha observado que algunas enfermedades hepáticas que ocurren durante la gestación, como el síndrome de HELLP o el hígado graso agudo del embarazo, son significativamente más frecuentes en aquellas gestaciones con fetos afectados por algún defecto hereditario en la oxidación de los ácidos grasos20. Esta asociación fue descrita por primera vez por Schoeman, en 1991, en un caso LCHAD e hígado graso agudo del embarazo4. Desde entonces, la LCHAD se ha asociado a ambas patologías maternas2,5,6,20–22. Sin embargo, es muy difícil establecer esta relación, ya que tanto la patología materna como los defectos de la oxidación de los ácidos grasos son patologías muy infrecuentes, ocurriendo estos últimos en 1:10.000-12.000 nacimientos23,24.
La LCHAD forma parte de una proteína trifuncional de la membrana mitocondrial que participa en la beta-oxidación de la cadena larga de los ácidos grasos25, catalizando el tercer paso en la beta-oxidación de los ácidos grasos en la mitocondria (la formación de 3-cetoacil-CoA reductasa desde 3-hidroxiacil-CoA). Esta actividad metabólica proporciona la mayor parte de la energía para el corazón y el músculo esquelético, y es esencial para el metabolismo hepático de los ácidos grasos de cadena larga. El gen para esta proteína ha sido clonado y se han identificado mutaciones asociadas con esta deficiencia. La mutación más común, G1528C, localizada en el cromosoma 2, se asocia con aproximadamente el 60% de las deficiencias de LCHAD26,27. Esta mutación puede causar una alteración en la oxidación de los ácidos grasos en pacientes heterocigotas durante el embarazo. Bajo circunstancias normales, un individuo heterocigoto para mutaciones enzimáticas que afectan a la oxidación de los ácidos grasos no tendrá una oxidación anormal de los ácidos grasos. Sin embargo, si una mujer heterocigota tiene un feto que es homocigoto para dicha mutación, los ácidos grasos fetales se acumularán y pasarán a la circulación materna, acumulándose en el hígado y afectando a su funcionalidad28,29.
El papel de la LCHAD en la patogenia del hígado graso agudo del embarazo se ha ilustrado en una serie de estudios25,30. Sin embargo, algunos investigadores no han podido confirmar la asociación con la LCHAD31 y hoy en día se reconoce que el hígado graso agudo del embarazo puede también ocurrir sin que exista ninguna mutación en este gen32. Esto sugiere que las bases metabólicas del hígado graso agudo del embarazo son bastantes heterogéneas y que el mecanismo por el cual un defecto del metabolismo lipídico fetal causa un daño hepático materno no es del todo conocido. Algunos estudios33 han demostrado que en la placenta de estas pacientes existe un compromiso en la función mitocondrial, que genera un estrés oxidativo y desencadena la alteración metabólica.
El 80% de los niños con LCHAD nacieron de madres diagnosticadas de hígado graso agudo del embarazo o síndrome de HELLP34. En el momento del diagnóstico, los niños habitualmente tienen fallo hepático severo, cardiomiopatía severa y encefalopatía hipoglucémica. Estos síntomas pueden llegar a ser irreversibles y el trastorno puede ser letal en algunos casos. El tratamiento puede mejorar el pronóstico a largo plazo. Incluso los niños que son diagnosticados y tratados tienen riesgo de presentar retraso psicomotor35. Una vez que se diagnostica, estos niños deben ser alimentados con una fórmula apropiada, baja en ácidos grasos de cadena larga y suplementada con triglicéridos de cadena media36.
Por lo tanto, es muy importante que recién nacidos de madres que hayan presentado hígado graso agudo durante el embarazo sean estudiados para descartar esta alteración metabólica. Los padres deben ser informados de que hay un 25% de probabilidad de recurrencia si ambos son portadores del gen defectuoso34. Las pruebas para detectar las variantes genéticas conocidas de esta LCHAD están disponibles y deben ser consideradas en las mujeres afectadas y en sus hijos, al menos por el gen G1528C, que es la mutación más común20,28,34,37,38. Sin embargo, las pruebas solo para la mutación G1528C no excluyen la deficiencia de LCHAD, que puede ser causada por otras mutaciones.
No existe un tratamiento médico específico para el hígado graso agudo del embarazo. De hecho, el tratamiento principal es la finalización inmediata de la gestación, por lo general de forma urgente, una vez conseguida la estabilización materna.
La estabilización materna requiere la infusión de glucosa y la reversión de la coagulopatía mediante la administración de plasma fresco congelado, y concentrados de hematíes y plaquetas, según sea necesario. Se debe prestar atención al estado de los líquidos debido a que la baja presión oncótica plasmática puede llevar a un edema pulmonar8.
Las pruebas de función hepática y la coagulopatía por lo general comienzan a normalizarse poco después del parto, aunque puede observarse un empeoramiento transitorio durante los primeros días, seguido de la mejoría definitiva. En la mayoría de los casos más graves, sobre todo cuando el diagnóstico se ha retrasado, puede haber muchos más días de enfermedad que requiere manejo en una unidad de cuidados intensivos, que puede incluir la ventilación mecánica a causa de coma, diálisis por insuficiencia renal aguda, la nutrición parenteral debido a la pancreatitis asociada o incluso la cirugía para tratar el sangrado de una cesárea anterior.
La mayoría de los pacientes gravemente enfermos se recuperan y no tienen secuelas de la enfermedad hepática en sí8. La tasa de mortalidad materna se ha estimado en un 18% y la mortalidad neonatal en un 7-58%7,9,18. Otros estudios han descrito a pacientes que requieren trasplante de hígado, pero es poco probable que se necesite si se lleva a cabo un diagnóstico temprano y finalización de la gestación inmediata39,40.
No cabe duda de que la finalización de la gestación es crucial en el tratamiento del hígado graso agudo del embarazo. Una vez que se diagnostica o existe una alta sospecha, la gestación debe finalizarse tan pronto como sea posible. Algunos estudios7 han documentado que si el intervalo que pasa desde el comienzo de la patología hasta el parto es de una semana, el 100% de las pacientes sobreviven. Si el intervalo es mayor de 2 semanas, el 30% no sobreviviría.
No existe un criterio unificado sobre el mejor método de finalización de la gestación, aunque parece que la cesárea es el método de elección preferido por la mayoría de los autores, a no ser que el parto vaginal pudiera llevarse a cabo de una forma muy precoz. Previamente a la cirugía, es importante la transfusión de plasma, plaquetas y concentrado de hematíes en pacientes con alteración de la coagulación, para disminuir la posible pérdida hemática14.
El hígado graso agudo puede repetirse en embarazos posteriores, incluso si la búsqueda de la mutación LCHAD es negativa4,7,30,31,41,42. Sin embargo, el riesgo exacto de recurrencia es desconocida. Las mujeres afectadas deben ser advertidas de esta posibilidad y los embarazos posteriores pueden llevarse a cabo siempre que la mujer entienda y acepte los riesgos, y se realice un control exhaustivo durante la gestación.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.