El estudio Women’s Health Initiative investigators (WHI) 20021, en el que se valoraba el papel de la terapia hormonal sustitutiva (THS) como medida preventiva sobre la salud de 16.608 mujeres estadounidenses posmenopáusicas sanas con útero intacto, se interrumpió ya que se observó un incremento significativo del riesgo de coronariopatía, ictus, tromboembolia pulmonar y cáncer de mama.
La Agencia Española del Medicamento (AEM), de forma coordinada con el resto de agencias europeas, revisó la evidencia científica derivada del ensayo clínico WHI y emitió un comunicado2 (AEM 2002/07) en el que advertía de los probables efectos adversos de la THS. Se recomendaba no utilizar el tratamiento combinado con estrógenos y progestágenos a largo plazo como prevención de la enfermedad cardiovascular, aunque no se descartaba el beneficio del tratamiento a corto plazo de los síntomas climatéricos.
Posteriormente, nuevas publicaciones confirmaron un incremento de los riesgos de la THS, y la AEM publicó una nueva nota informativa3 (AEM 2004/01) con nuevas recomendaciones más restrictivas sobre el tratamiento de la osteoporosis y de los síntomas climatéricos. Por primera vez, las recomendaciones hacían referencia a todas las especialidades de THS, tanto a los que contenían estrógenos exclusivamente como a los que contenían estrógenos y progestágenos combinados, así como a la tibolona.
El objetivo de este estudio fue evaluar el impacto que las alertas farmacéuticas tuvieron sobre la prescripción de THS después de las distintas comunicaciones de riesgos y beneficios de la THS que se difundieron en la literatura científica, desde el año 2002 hasta el 2004.
MATERIAL Y MÉTODOSe realizó un estudio retrospectivo sobre la prescripción de THS en el servicio de atención primaria (SAP) Alt Penedès-Garraf. Este territorio está constituido por 7 áreas básicas de salud (ABS) con cobertura sanitaria a una población total de 212.658 habitantes (padrón de 31 de diciembre de 2004).
Los datos de prescripción de la población estudiada se obtuvieron a través de la aplicación de farmacia del Instituto Catalán de la Salud (ICS). Se monitorizaron todas las prescripciones de THS realizadas por médicos del ICS de nuestro SAP, efectuadas en el modelo de receta oficial de asistencia pública del Servicio Catalán de la Salud (CatSalut) y que fueron facturadas por las oficinas de farmacia, por lo que no se incluyeron en el estudio las recetas privadas. Se consideraron las especialidades farmacéuticas con indicación terapéutica en la menopausia correspondientes a los principios activos estrógeno más progestágeno, estradiol, estrógenos conjugados y tibolona.
Para el análisis sobre el consumo de THS se establecieron períodos trimestrales según las publicaciones de las alertas de seguridad. Se consideró período basal al trimestre anterior a la notificación de la primera alerta (AEM 2002/07) y se le denominó período P1-2002. El segundo período fue la postalerta inmediata (trimestre en el que se emitió la nota informativa) (P2-2002). Finalmente, se estableció el período postalerta tardía (P3-2002), que se correspondía al análisis de la prescripción trimestral al año de su comunicación. Para evaluar el efecto de la segunda alerta farmacéutica (AEM 2004/01) se determinaron períodos similares: período basal (P1-2004), período postalerta inmediata (P2-2004) y período postalerta tardía (P3-2004). Denominamos variación postalerta inmediata a la variación observada al comparar los períodos P1/P2 y variación postalerta tardía al comparar los períodos P1/P3, tanto para la alerta AEM 2002/07 como la AEM 2004/01.
Se monitorizó trimestralmente el consumo de THS en dosis diaria definida (DDD) cada 1.000 mu-jeres/día (DHD mujeres) total y por principio activo, todo ello para el global del SAP, las ABS y los especialistas de ginecología y obstetricia de atención primaria (PASSIR).
La unidad de medida que se utilizó fue la unidad técnica internacional de medida de consumo de medicamentos. La DDD es un concepto que se aproxima al número de tratamientos diarios de un fármaco o grupo de fármacos establecido a nivel internacional por la Organización Mundial de la Salud (OMS) y que se expresa por 1.000 habitantes/día (DHD), en nuestro estudio referida a la población de mujeres (DHD mujeres).
RESULTADOSLa población inicial media del territorio estudiado era de 184.142 personas, de las cuales 82.738 eran mujeres. Se observó un incremento del 13,3% en la población durante el período de estudio (2001-2004) hasta llegar a 208.576 personas, de las cuales 88.470 eran mujeres (crecimiento del 6,9%).
Al evaluar la prescripción de THS posterior a la primera nota informativa (tabla 1), se observó una disminución inmediata del 5,5% en el primer período postalerta 2002 en el global del SAP. Este descenso alcanzó una reducción del 29,6% al año. A pesar de la solidez de estos resultados, no todas las áreas de salud que componían el SAP tuvieron la misma tendencia. La reducción en el período postalerta inmediata 2002 para el ABS 2 fue del 25,1% (reducción máxima), mientras que, por el contrario, en el área básica 6 no sólo no se produjo una reducción en el consumo, sino un aumento que fue del 11,9%. Se observa un efecto similar en el período postalerta tardía, en que se observó una reducción del 50% para el ABS 4 y del 6,4% para el ABS 5.
El efecto de la nota informativa del 2004 se refleja en la tabla 2. La reducción inicial en la prescripción fue del 29,8%, y llegó al 56,9% al año. De nuevo, se evidenció una variabilidad entre ABS, con un rango de reducción del 6,5 al 43,4% en la variación postalerta inmediata 2004, y del 32,3 al 73,4% en la variación postalerta tardía 2004.
Al analizar la prescripción efectuada por los especialistas ginecólogos, observamos que la prescripción de THS, en DHD, se incrementó un 11,1% en el período postalerta inmediata 2002 y respondió a las comunicaciones de riesgos y beneficios de forma tardía, con una reducción modesta en la prescripción de un 6,6% al año y un 24,7% al año y medio. Las disminuciones experimentadas a partir de la comunicación de la segunda nota informativa fueron del 39,4% para el período postalerta inmediata (P2-2004) y del 64,3% al año (P3-2004) (tablas 1 y 2).
Tabla 1. Variación en la prescripción del THS en dosis diaria definida cada 1.000 mujeres/día para el global del SAP y diferenciada por ABS y ginecólogos del PASSIR. Año 2002
Tabla 2. Variación en la prescripción de THS en dosis diaria definida 1.000 mujeres/día para el global del SAP y diferenciada por ABS y ginecólogos del PASSIR. Año 2004
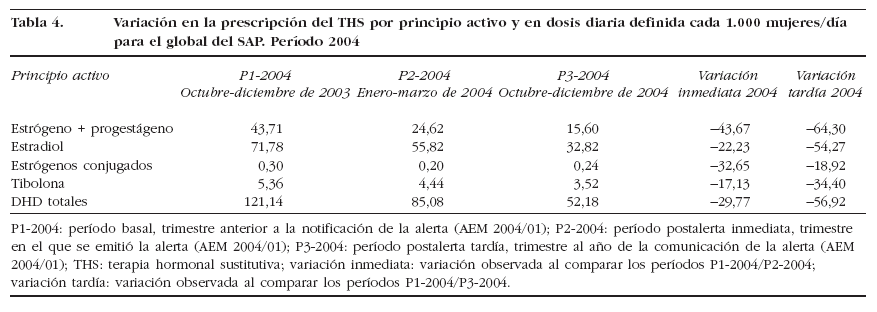
Las variaciones más significativas por principio activo se observaron para el estradiol y el estrógeno más progestágeno, que llegaron a disminuir un 28,8 y un 31,8%, respectivamente, en el P3-2002 (tabla 3) y un 54,3 y un 64,3%, respectivamente, en el P32004 (tabla 4).
Tabla 3. Variación en la prescripción de THS por principio activo y en dosis diaria definida cada 1.000 mujeres/día para el global del SAP. Año 2002
Tabla 4. Variación en la prescripción del THS por principio activo y en dosis diaria definida cada 1.000 mujeres/día para el global del SAP. Período 2004
DISCUSIÓNLa utilización de hormonoterapia sustitutiva en nuestro ámbito respondió a la comunicación de los riesgos y beneficios de la AEM, aunque de forma variable según la alerta (AEM 2002/07; AEM 2004/01), y según el colectivo de médicos ginecólogos y médicos generales de cada ABS estudiada.
En el global del SAP, la reducción del consumo al año de la primera alerta (2002) fue del 29,6% y de la segunda (2004), del 56,9%. En la interpretación global de estos datos, hay que tener en cuenta que en la alerta 2004 el grado de utilización en el período basal era menor debido al impacto de la primera.
Respecto al impacto de las alertas en el colectivo de ginecólogos de nuestro ámbito, observamos una respuesta tardía y de menor intensidad a la alerta 2002 (reducción del 6,6%). La respuesta a la alerta del 2004 fue similar a la del resto de los profesionales del SAP.
El consumo de THS en nuestro país en mujeres mayores de 40 años se ha estimado, en algunos estudios, como bajo comparado con el de otros países4. Este diferente punto de partida podría explicar, en parte, que el impacto de la alerta-2002 a corto plazo fuera modesto respecto a lo sucedido en países como EE. UU., Canadá y Nueva Zelanda. En estos países en los que la prevalencia de utilización de estos medicamentos era más alta, el efecto de los resultados del estudio WHI fue inmediato: se observaron reducciones más evidentes en la utilización de THS5-8.
Posteriormente al estudio WHI (2002), numerosas publicaciones, artículos científicos y recomendaciones de uso racional se suceden en el ámbito internacional por lo que se explica, en parte, la tendencia progresiva de reducción en el uso de THS.
En un estudio estadounidense que se llevó a cabo en San Francisco6 y que tenía como objetivo examinar si los estudios HERS y WHI tuvieron un impacto en el uso de THS en las mujeres posmenopáusicas, se concluyó que los resultados del HERS generaron una disminución del uso de THS del 1% por trimestre, mientras que los resultados del estudio WHI tuvieron como consecuencia una reducción del 18% en la prescripción de estos fármacos. Haas et al6 justificaron estas diferencias en la reducción del consumo por el hecho de que los resultados del estudio WHI fueron ampliamente difundidos a la vez que más dirigidos a las mujeres posmenopáusicas.
Hersh et al7 observaron que la prescripción de THS después de los resultados del estudio HERS II y WHI empezó a disminuir y alcanzó el nivel más bajo en julio 2003, por lo que se pudo concluir que muchas pacientes o bien interrumpieron el tratamiento o bien disminuyeron las dosis. Wysowski et al8 encontraron que el número de prescripciones orales de estrógenos, o combinación de estrógeno más progestágeno, dispensadas a pacientes ambulatorios, de julio de 2002 a junio de 2003, se había reducido un 32% y los preparados transdérmicos, un 10%. Guay et al5 observaron, después de la publicación del estudio WHI, reducciones mensuales del 28% en las prescripciones de THS.
En España, al igual que en otros países como Finlandia9 y Holanda10, se generó un amplio debate sobre la validez de los resultados del WHI en nuestro entorno. Tanto las agencias reguladoras (AEM) como el panel de expertos de la Asociación Española para el Estudio de la Menopausia11 analizaron los resultados del estudio. Sus conclusiones iniciales fueron que los datos que se aportaban no debían modificar de forma sustancial la actuación en la prescripción de estos fármacos. Se recomendaba individualizar la prescripción de estos fármacos valorando e informando de sus riesgos y beneficios. Se argumentaba que los resultados sólo eran aplicables al uso de estrógenos en combinación con un progestágeno administrado de forma continua y que era posible que otros tipos de compuestos hormonales, otras dosis y otras pautas de administración de los estrógenos combinados con progestágenos produjesen efectos distintos de los observados en el estudio WHI. Todo ello podría explicar la variabilidad entre ABS, así como el menor impacto observado entre el grupo de ginecólogos. Se observó una variabilidad amplia en la respuesta de las distintas ABS a la comunicación de los riesgos de la THS por la AEM, tanto para el período de respuesta inmediata como para la respuesta tardía. Los rangos de variación fueron importantes en ambos análisis temporales y probablemente condicionados por los mensajes dubitativos de la AEM y de las publicaciones del momento.
Respecto al impacto de las alertas en el colectivo de ginecólogos de nuestro ámbito, observamos una respuesta de menor intensidad a la alerta 2002 que en la del año 2004. La prescripción de THS se incrementó, tras la publicación de la alerta 2002, un 11,9%, posiblemente por las controversias surgidas respecto a la aplicabilidad de los resultados del estudio WHI a la población española. Los resultados de un reciente estudio12 en el que se pasó una encuesta sobre la relevancia del estudio WHI (noviembre de 2002 a enero de 2003) a más de 3.500 ginecólogos españoles, aportaron la conclusión de que los ginecólogos encuestados conocían ese estudio y declaraban que estos resultados no podían ser extrapolados a su entorno. Sin embargo, los autores señalaron que, después de su publicación, un 10% de los tratamientos se retiraron, y se limitaron sus indicaciones y se redujo la duración de los tratamientos.
El perfil de utilización de THS en España y, como se observa en nuestro trabajo, por principio activo es diferente del utilizado en EE. UU.7, donde los estrógenos equinos conjugados, solos o asociados a progestágenos, eran los más utilizados y los que experimentaron más cambios en la prescripción después de los resultados del estudio WHI. El mayor impacto sobre la prescripción por principio activo en nuestro entorno se observó en los principios activos más utilizados, es decir, las especialidades con estradiol y estrógeno más progestágeno, por vía tanto transdérmica como oral.
En la prescripción de los tratamientos existen múltiples factores (conocimientos, habilidades, experiencia, formación continuada, presión asistencial, población atendida y comorbilidad) que influyen en la implementación de las evidencias, sin olvidar a todos los agentes implicados: médico, paciente, especialistas, expertos, industria, medios de comunicación y organización sanitaria. Todos ellos explicarían la variabilidad observada en función del colectivo profesional de ginecólogos y médicos generales estudiados.
Este trabajo, como cualquier estudio longitudinal, presenta una serie de limitaciones. Además de las limitaciones propias del diseño, hay que tener en cuenta que los datos analizados provienen de la facturación de recetas, a partir de los cuales sólo se puede hacer una estimación de la población expuesta y no de población realmente expuesta. Los datos tampoco aportan información de la indicación, de la dosis empleada ni de la duración de los tratamientos.
Finalmente, creemos que sería muy interesante y conveniente realizar un estudio posterior a éste en el que se valoraran las indicaciones clínicas y la adecuación de los tratamientos con hormonoterapia sustitutiva.
Correspondencia:Sra. I. Rosich. Manuel Marqués, s/n. Vilanova i la Geltrú. Barcelona. España. Correo electrónico: irosich.cp.ics@gencat.net
Fecha de recepción: 14/5/2007. Aceptado para su publicación: 12/9/2007.