Estudiar el impacto de la introducción del cribado combinado en el primer trimestre para el síndrome de Down en los procedimientos invasivos de diagnóstico prenatal, junto con el cambio de criterio edad de los 35 a los 38 años como indicación de obtención de cariotipo.
Material y métodosSe hizo un estudio retrospectivo poblacional sobre los procedimientos invasivos de diagnóstico prenatal efectuados en el Hospital de Cabueñes de Gijón, comparando un primer período, del 31 de abril de 2004 al 30 de enero de 2006 (sin programa de cribado), con un segundo período, del 31 de enero de 2006 al 30 de enero de 2008 (con programa de cribado), y diferenciando en el segundo período el impacto aislado del cribado (del 31 de enero de 2006 al 30 de enero de 2007) del asociado con el cambio de criterio de edad materna a los 38 años como indicación de procedimiento invasivo (del 31 de enero de 2007 al 30 de enero de 2008).
ResultadosEn el segundo período hay una reducción global del 31,2% de procedimientos invasivos, un 21,6% imputable exclusivamente al cribado combinado. Para gestantes de 35 o más años se realizaron un 30,74% menos de amniocentesis en el segundo período, tendencia que se mantiene para las de 38 años, con una disminución del 25,92%. Un 30% de las gestantes de 38 o más años del segundo período eligieron la prueba invasiva sólo en razón de su edad, frente al 61,53% del segundo período.
ConclusionesEl cribado combinado tuvo un gran impacto en los procedimientos invasivos, aumentando su eficiencia y permitiendo incrementar, además, las tasas de detección.
To study the impact of introducing first-trimester combined Down syndrome screening on invasive prenatal testing for prenatal diagnosis, together with the criteria change from 35 to 38 years old as the indication for obtaining the fetal karyotype.
Material and methodsA retrospective population-based study was carried out of invasive tests for prenatal diagnosis performed at the Cabueñes Hospital in Gijón (Spain). A first period from 31-1-2004 to 30-1-2006 (without the screening program) was compared with a second period from 31-1-2006 to 30-1-2008 (with the screening program). During the second period the impact of screening (31-1-2006 to 30-1-2007) was differentiated from that linked to changing the maternal age criteria to 38 years old as the indication for invasive testing (31-1-2007 to 30-1-2008).
ResultsDuring the second period there was an overall reduction of 31.2% in invasive testing; 21.6% was exclusively attributable to first-trimester combined Down syndrome screening. In expectant mothers aged 35 or more at delivery, the number of amniocentesis performed in the second period was reduced by 30.74%; this tendency was maintained for pregnant women aged 38 years or more, showing a reduction of 25.92%. In the second period, 30% of the expectant mothers aged 38 years or more chose to have an invasive test due to their age compared with 61.53% in the first period.
ConclusionsFirst-trimester combined Down syndrome screening had a major impact on invasive testing, increasing its efficiency and, moreover, allowing detection rates to be improved.
El patrón de referencia para el diagnóstico prenatal del síndrome de Down (SD) es la obtención del cariotipo fetal. Parece evidente que no procede cariotipar a toda la población gestante pues los costes económicos, de infraestructura sanitaria y de pérdidas de fetos sanos imputables a los procedimientos invasivos serían inaceptables. Se han desarrollado diferentes estrategias para seleccionar a un grupo de gestantes de mayor riesgo de tener un feto portador de SD. En los años setenta se fijó la edad materna de 35 años como criterio de riesgo1 (sensibilidad 30-50%); en los años ochenta aparecieron los primeros marcadores bioquímicos que dieron lugar al triple cribado del segundo trimestre2–5 (sensibilidad del 60% para el 5% de falsos positivos); en los años noventa se produjo un hito en el diagnóstico prenatal con la introducción de la medida de la translucencia nucal (TN)6 (sensibilidad del 65-75% para el 5% de falsos positivos) y alrededor del año 2000 aparecieron las primeras publicaciones de cribado combinado en el primer trimestre7–9 que, en posteriores grandes estudios, demostraron unas tasa de detección del 85% para el 5% de falsos positivos10,11. La tendencia en los programas de cribado de SD es intentar aumentar las tasas de detección, reduciendo los procedimientos invasivos innecesarios y al mismo tiempo que el criterio aislado de edad materna avanzada va perdiendo peso. Así, la presencia de marcadores ecográficos en el segundo trimestre permite modificar el riesgo obtenido en el cribado y expresarlo numéricamente en un nuevo riesgo, confiriéndonos una segunda oportunidad12,13, con una sensibilidad entre el 67 y el 82% para una tasa de falsos positivos del 4,4 al 14%14. Lo mismo se ha intentado complementando el cribado con «nuevos marcadores» deI primer trimestre: hueso nasal15, ductus venoso16,17 y regurgitación tricuspídea18, o aplicando en el primer trimestre marcadores ya conocidos del segundo trimestre19. Otras estrategias incluyen la aplicación de combinaciones de parámetros bioquímicos en diferentes edades gestacionales, solos o asociados a la ecografía: pruebas cuádruple, integrada, integrada sérica, secuencial, contingente-secuencial, etc.20.
El impacto que produzca la adición de estos marcadores queda por determinar, pero el cribado combinado en el primer trimestre parece consolidado, la proporción de gestantes con 35 o más años va en aumento y los procedimientos invasivos conllevan riesgo de aborto, de ahí que muchas mujeres, al tener la posibilidad de conocer su riesgo individual, personalizado, podrían declinar someterse a otras pruebas. El propósito de este estudio es precisamente evaluar el impacto del cribado combinado en los procedimientos invasivos.
MATERIAL Y MÉTODOSSe realizó un estudio retrospectivo poblacional de 4 años que comparó 2 períodos consecutivos de 2 años. primer período, del 31 de enero de 2004 al 30 de enero de 2006: cribado por edad materna (indicación para procedimiento invasivo de 35 o más años al parto), medida de la TN y ecografía del segundo trimestre; y segundo período, del 31 de enero de 2006 al 30 de enero de 2008: cribado combinado del primer trimestre manteniendo la edad de 35 años en el primer año (del 31 de enero de 2006 al 30 de enero de 2007) y cambiando el criterio a 38 años en el segundo año (del 31 de enero de 2007 al 30 de enero de 2008). El estudio incluyó los 8.553 partos ocurridos en nuestro hospital en estos 4 años. La edad materna al parto era ≥ 35 años en el 25,7% de los partos del primer período (2004-2006) y en el 27,5% del segundo período (2006-2008).
Todas las gestantes dieron su consentimiento informado para la práctica de cribado combinado del primer trimestre y se trabajó en 2 fases, realizando la determinación de proteína plasmática A asociada al embarazo y la fracción β libre de la gonatropina coriónica (fβ-HGC) a las 10 semanas y la ecografía a las 12 semanas, midiendo la TN de acuerdo con los criterios de la Fetal Medicine Foundation21,22. La exploración ecográfica se realizó por ecografistas experimentados; se inició por vía vaginal y se concluyó, en la mayoría de los casos, por vía abdominal, utilizando un ecógrafo Voluson 730 expert (GE Medical Systems) o un Thosiba Xario (Thosiba Medical Systems). El cálculo de riesgo se hizo con el programa PRISCA Software 4.0, Typolog Software Ltd & Co. KG (Contractor SIEMENS Medical Solutions Diagnostics, Germany) y el nivel de corte utilizado para ofrecer la obtención de cariotipo fetal fue un riesgo estimado ≤ 1/270. Los resultados se comunicaron a las gestantes al finalizar la ecografía. La Consejería de Salud del Principado de Asturias disponía que a todas las gestantes de 35 años en adelante se les ofrezca procedimiento invasivo, criterio que se modificó a raíz de la introducción del cribado combinado; a partir del 31 de enero de 2007 la edad se cambió a 38 años. A todas las gestantes con una edad ≥ 35-38 años (según el período estudiado) y a aquellas con un riesgo establecido ≤ 1/270 se les proporcionó una cita en nuestra consulta de diagnóstico prenatal, donde se les explicó pormenorizadamente el significado de la prueba de cribado combinado, el valor de la edad materna como criterio único y los riesgos de los procedimientos invasivos, y se respondieron todas las cuestiones plantea das; no se interfirió en la toma de decisiones. También se les proporcionó el formulario de consentimiento informado. La obtención del cariotipo fetal se realizó por amniocentesis en casi el 98% de los casos y en el resto, por biopsia corial. El seguimiento de los recién nacidos se hizo a través de la sección de neonatología y de la comisión de perinatología del hospital y de la Comisión de Defectos Congénitos del Principado de Asturias; se abarcó así a todos los nacidos en nuestra comunidad.
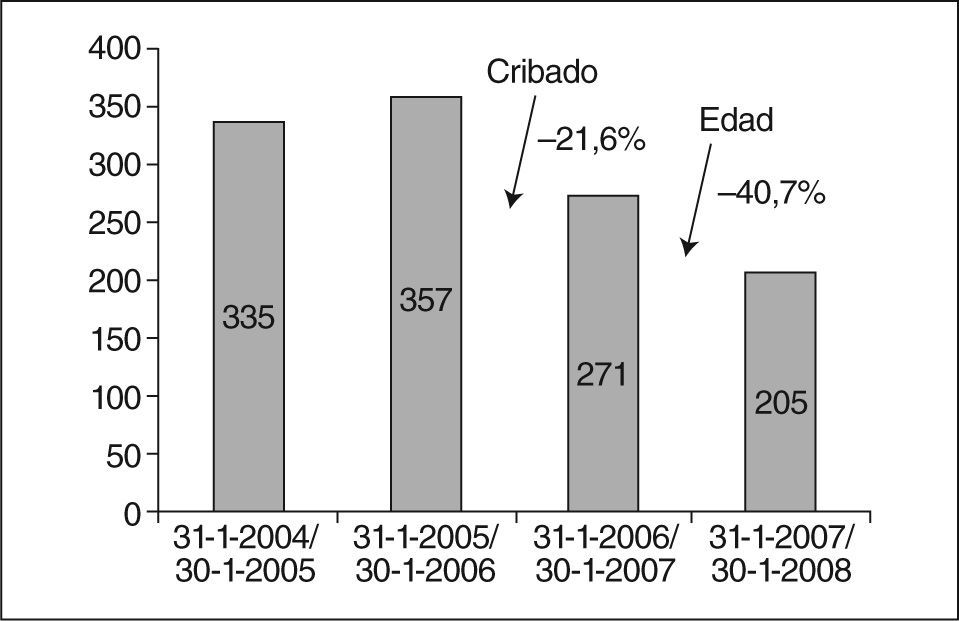
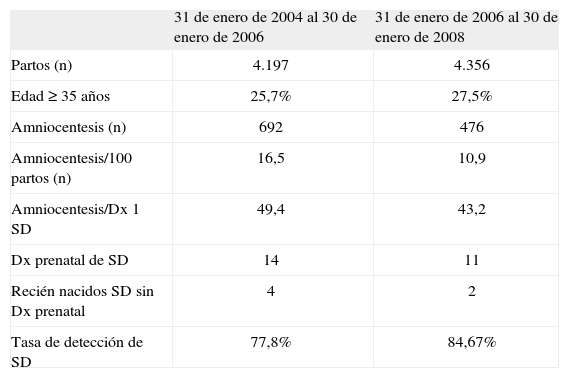
RESULTADOSDe un total de 692 amniocentesis en el primer período, se pasó a 476 en el segundo período, lo que representa un 31% menos. El primer año de funcionamiento el cribado combinado supuso una reducción de un 22% de amniocentesis con respecto a la media de 2 años previos; atribuimos este impacto exclusivamente al programa. El segundo año se produjo el cambio de criterio de edad materna de 35 a 38 años como indicación de procedimiento invasivo y durante ese año la reducción fue del 41% respecto de la media del segundo período, pero este impacto ya se debe a la suma de ambos factores: cribado y cambio de edad (fig. 1). Esta disminución de pruebas invasivas se produjo sin un coste en la detección prenatal de SD, y es más, con una mejoría (tabla 1). Todos los casos con diagnóstico prenatal de SD optaron por la interrupción legal del embarazo.
Número de amniocentesis y detección de síndrome de Down
| 31 de enero de 2004 al 30 de enero de 2006 | 31 de enero de 2006 al 30 de enero de 2008 | |
| Partos (n) | 4.197 | 4.356 |
| Edad ≥ 35 años | 25,7% | 27,5% |
| Amniocentesis (n) | 692 | 476 |
| Amniocentesis/100 partos (n) | 16,5 | 10,9 |
| Amniocentesis/Dx 1 SD | 49,4 | 43,2 |
| Dx prenatal de SD | 14 | 11 |
| Recién nacidos SD sin Dx prenatal | 4 | 2 |
| Tasa de detección de SD | 77,8% | 84,67% |
Dx: diagnóstico; SD: síndrome de Down.
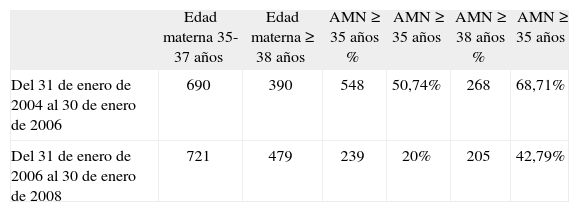
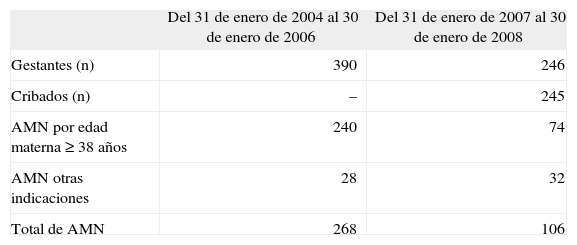
Para una población de 1.080 gestantes con edad de 35 años o más al parto en el primer período, se realizó amniocentesis al 51% de ellas, en tanto que en el segundo período, para 1.200 gestantes de iguales características, se realizó amniocentesis al 20% (tabla 2). Se analizó la población de gestantes con edad ≥ 38 años en ambos períodos (que pudieron acogerse libremente al procedimiento invasivo, independientemente de los resultados del cribado) y resulta que en el primer período se obtuvo el cariotipo del 69% de ellas, mientras que en el segundo período se obtuvo en el 43%. Siguiendo con el grupo de gestantes de 38 o más años al parto en el segundo año desde la implantación del cribado, sólo un 30% eligió la amniocentesis en razón de su edad (tabla 3).
Edad materna total y de amniocentesis
| Edad materna 35-37 años | Edad materna ≥ 38 años | AMN ≥ 35 años % | AMN ≥ 35 años | AMN ≥ 38 años % | AMN ≥ 35 años | |
| Del 31 de enero de 2004 al 30 de enero de 2006 | 690 | 390 | 548 | 50,74% | 268 | 68,71% |
| Del 31 de enero de 2006 al 30 de enero de 2008 | 721 | 479 | 239 | 20% | 205 | 42,79% |
AMN: amniocentesis.
No sólo debe evaluarse el impacto del cribado en la cantidad de procedimientos invasivos, sino también en la calidad de sus indicaciones. Así, en el primer período (sin cribado) casi el 80% de las indicaciones eran por edad materna avanzada, en tanto que en el segundo período (con cribado) esta indicación supuso el 50% y en el segundo año un 30% (cambio edad de 35 a 38 años). Las indicaciones malformación-marcadores ecográficos, antecedentes personales o familiares y otros se mantuvo constante durante los 4 años del estudio (fig. 2).
DISCUSIÓNEs un concepto arraigado entre profesionales sanitarios y gestantes, pese a su escaso rendimiento como criterio aislado, que la edad materna de 35 años marca una barrera de riesgo de trisomía 21, en la que es casi preceptivo un procedimiento invasivo para obtención del cariotipo fetal. Aunque ciertamente conocemos que este riesgo aumenta con la edad materna, también sabemos que se modifica sustancialmente con los marcadores bioquímicos y los hallazgos ecográficos, pero cuesta transmitir este concepto a una población obstétrica cada vez más demandante, más envejecida y más proclive a recurrir a la vía judicial si algo no resulta bien en su embarazo.
Se han evaluado los 2 primeros años tras la aplicación del cribado: 4.048 cribados, tasa de detección para trisomía 21 del 90,9% en gestación única y del 84,6% incluidas las múltiples, para un 4% de falsos positivos. Estos resultados son acordes con los encontrados en la bibliografía científica10,11,23.
Debemos resaltar que se trata de una población envejecida (27,5% de gestantes con edad de 35 o más años), lo que debería generar una mayor cantidad de pruebas invasivas, tanto por edad como por una mayor tasa de falsos positivos en el cribado. En nuestra serie, del total de cribados positivos, un 60,6% tenía 35 o más años y la tasa de falsos positivos aumentó desde el 1,2% para menores de 25 años hasta el 15,5% para las mayores de 37 años. El factor edad debe tenerse muy en cuenta al valorar el impacto del cribado, pues no es lo mismo trabajar con una población como la nuestra que con otra en la que sólo el 11,2% tenía más de 35 años y se alcanzan tasas de cribados positivos del 2,9%, como ha señalado Quiroga et al24 recientemente.
Para edades maternas de 35 o más años tuvimos una reducción del 30,7% de técnicas invasivas del primer al segundo período, pero nos preguntamos cuántas mujeres con edades comprendidas entre los 35 y los 37 años del segundo año y del segundo período hubieran decidido realizarse una amniocentesis si se lo hubiéramos permitido. Desconocemos este dato, pero sí lo tenemos para el grupo de 38 o más años, en el que se practicaron un 25,9% menos de amniocentesis en el segundo período respecto del primero, lo que confirma el impacto del cribado en un grupo de mayor edad, que al disponer de una referencia numérica «objetiva e individualizada» puede contrastarla con el riesgo de pérdida gestacional. Este resultado podría estar sesgado, pues la tasa de cribados falsos positivos aumenta con la edad materna y quizá algunas mujeres de este grupo, si su cribado hubiera sido negativo, no habrían optado por procedimiento invasivo. Para intentar aproximarnos a la realidad, nos limitaremos a los casos del último año (cribado ya consolidado y conocido por las gestantes, cobertura poblacional del 99,5% y grupo con libre acceso a prueba invasiva independiente de los resultados del cribado), en que la única indicación era edad la de 38 o más años, con cribado negativo y hallazgos ecográficos normales (74/246), lo que supone un 30% de amniocentesis, o lo que es lo mismo, el 70% no optó por el procedimiento invasivo sólo por su edad. Para el mismo grupo de edad, en los 2 años previos a la introducción del cribado, optaron por amniocentesis con indicación de edad materna avanzada (≥ 38 años) un 61,5% (240/390).
Ya en los años noventa25, hay múltiples referencias bibliográficas sobre la necesidad de reducir procedimientos invasivos en gestantes de mayor edad tras la aplicación de las diferentes estrategias de cribado que se iban incorporando: cribado en el segundo trimestre, TN, sonograma genético, etc., con resultados dispares, aunque en ocasiones excelentes. Valorando el impacto del cribado en el segundo trimestre y la aplicación de marcadores ecográficos del segundo trimestre, Benn et al26 analizaron el período 1991-2002 (21,7% de mujeres de 35 años en 2002) y reportaron una disminución del 50% en los procedimientos invasivos y que un 68% de las mujeres optaron por no someterse a ellos sólo por su edad. Pinette et al27, con sonograma genético, publicaron una disminución del 61% en los procedimientos invasivos, sin disminución de las tasas de detección. Zoppi et al28 analizaron el impacto de la medida de la TN en mujeres referidas para consejo sólo por edad materna avanzada y comunicaron que un 30% de ellas declinaron someterse a obtención de cariotipo fetal, en tanto que Caughey et al29 refirieron que sólo un 31% (238/756) de mujeres de 35 o más años con cribado negativo por TN eligieron la prueba invasiva. Chasen et al30 también se ocuparon de las decisiones de una serie de 4.029 gestantes de 35 o más años (media 37 años), en las que unas tenían cribado con TN y otras no, y el impacto fue más modesto: el 1,9% de las mujeres a las que se medía la TN elegían biopsia corial frente al 7,1% de las que no se les medía, pero la tasa de las que elegían amniocentesis no se modificó por el cribado con TN. Wray et al31 compararon 2 períodos de 1 año (con y sin cribado del primer trimestre) en gestantes de 35 o más años referidas para consejo genético y comunicaron una reducción del 45% en la elección de técnicas invasivas (el 71 frente al 26%). Müller et al32 publicaron un gran estudio poblacional, que abarca los años 1995-2005, con un 12,5% (1995) y un 18,7% (2005) de gestantes de 35 o más años y que evalúa el impacto del cribado del segundo trimestre y del primer trimestre (introducido en el año 2000 y aplicado al 49% de gestantes en el 2005) en los procedimientos invasivos, con un resultado del 43% en 1995 frente al 24,8% en 2005, y con una reducción del 18,2% que debe atribuirse al cribado. Nicolaides et al33 publicaron una serie de 30.564 gestantes, con un 48,5% de edad ≥ 35 años, en las que el cribado resultó negativo en 27.999 (91,6%) y sólo un 4,6% de ellas eligió la prueba invasiva, hecho que los autores atribuyen al establecimiento de una buena comunicación con la gestante y a que muchas mujeres consideran importante objetivar numéricamente su riesgo individual por cribado a la hora de decidir la obtención de cariotipo fetal y asumir los riesgos inherentes al procedimiento.
Estamos convencidos de que el cribado combinado en el primer trimestre contribuye a un uso más racional de los procedimientos invasivos, al tiempo que mejora las tasas de detección de SD. En nuestra serie, en el primer período (sin cribado) la tasa de detección del SD fue del 77,7% y precisamos de 49,4 amniocentesis para diagnosticar 1 SD, en tanto que en el segundo período (con cribado) la detección fue del 90,9%, con 43,2 amniocentesis por diagnóstico, similar a los datos de Muller et al32, que bajaron de 86 a 40 procedimientos invasivos para diagnosticar 1 SD tras la introducción del cribado en el primer trimestre, sin merma en las tasas de detección. Aunque los cribados que difieren sus resultados hasta el segundo trimestre tienen una menor tasa de falsos positivos y podrían resultar en un mejor coste-efectividad20, muchas mujeres preferirán la precocidad de los resultados que aporta el cribado combinado34 si han de decidir someterse a un procedimiento invasivo y a una eventual terminación de la gestación.