El papel de la resonancia magnética (RM) en ginecología, especialmente en el campo de la ginecología oncológica, ha ido adquiriendo una creciente importancia durante las dos últimas décadas. En el momento actual existe una sólida evidencia científica que apoya su uso en la patología pélvica tumoral, inflamatoria y malformativa. Datos recientes apoyan además un creciente papel en el estudio de la patología mamaria. En cualquier caso, y tal y como analizaremos en nuestro trabajo, su aplicabilidad en el ámbito de nuestra especialidad parece ir aumentando progresivamente, haciendo de esta técnica de imagen una prueba complementaria más, aplicable al estudio de la fisiopatología del tracto genital.
The role of magnetic resonance imaging (MRI) in gynecology has become increasingly important in the last few decades, especially in gynecologic oncology. Currently, there is strong evidence to support the use of this imaging modality in distinct pelvic diseases such as tumors, inflammations and malformations. Recent studies support a growing role for MRI in the diagnosis of breast disease. As shown in the present review, the applicability of MRI in the physiopathology of genital tract diseases seems to be progressively increasing. MRI should therefore be considered as one more option that can be employed in gynecology.
En 1946, Félix Bloch en Stanford y Edward Puncell en Harvard demostraron que ciertos núcleos atómicos, bajo campos magnéticos intensos, pueden absorber energías de radiofrecuencia y generar a su vez una señal (también de radiofrecuencia) capaz de ser captada por una antena receptora. La frecuencia de la cual estos núcleos podían absorber la energía de radiofrecuencia se llamó frecuencia de resonancia y el experimento «resonancia magnética nuclear», que pudo emplearse posteriormente para la realización de espectroscopia de elementos.
La resonancia magnética (RM) es una técnica radiológica que utiliza el magnetismo, las ondas de radio y un soporte informático para obtener imágenes de las estructuras del cuerpo. El equipo de RM es un tubo rodeado de un imán circular gigante. El paciente se tumba sobre una camilla móvil que se introduce dentro del imán, que crea un potente campo magnético que alinea los protones de los átomos de hidrógeno del cuerpo, que se exponen acto seguido a ondas de radio. Esto afecta a los protones del organismo, que producen una señal muy débil y que es detectada por un receptor especial. La información recibida se procesa en un ordenador y se expresa en forma de imagen cuya resolución es muy detallada y capaz de detectar cambios mínimos en las estructuras corporales.
Las primeras imágenes de RM fueron publicadas por Paul Laterbury, en 1973, quien aplicó dicho procedimiento a dos probetas llenas de agua. En 1979 se obtuvieron las primeras imágenes de un cráneo humano y dos años más tarde se instaló en Londres el primer prototipo de tomógrafo por RM nuclear. En 1983, el American College of Radiology considera por primera vez a la tomografía por RM como técnica estándar en el campo del diagnóstico médico, y en diciembre de 1983 se obtiene en España la primera tomografía en un centro médico de Barcelona. Desde entonces, su papel en el campo de la medicina y la ginecología en particular, ha ido adquiriendo una mayor importancia de un modo paralelo a su extensión de uso, que ha resultado extraordinariamente creciente durante las dos últimas décadas1.
Actualmente, la RM puede considerarse la prueba de elección en la diferenciación de las patologías ginecológicas congénitas, inflamatorias y tumorales, y es especialmente electiva en la estadificación del carcinoma de endometrio y cervix, y en el diagnóstico diferencial de patología ovárica (particularmente en la endometriosis, fibromas, dermoides-teratomas y quistes hemorrágicos).
A pesar de su extensa aplicabilidad y validez en el campo de nuestra especialidad, el ginecólogo se encuentra, generalmente, poco familiarizado con esta técnica, a diferencia de lo que ocurre con la ecografía. Tal circunstancia, unida a la escasa accesibilidad, principalmente por motivos económicos, condiciona que esta técnica de imagen no se haya implantado como práctica habitual en la actualidad. Si a ello unimos que, al ser una técnica relativamente «joven», existen importantes carencias en torno a relevantes aspectos de ésta (como la falta de protocolos adecuados de uso y la ausencia, en algunos centros, de personal especializado en RM de pelvis femenina, lo que conlleva errores durante el aprendizaje), podremos llegar a entender el hecho de que aun hoy día algunos ginecólogos desconfíen de la técnica.
En el presente trabajo pretendemos arrojar algo de luz sobre aquellos aspectos de la RM que mayor confusión y duda generan en el ginecólogo general cuando se enfrenta al estudio de la patología del tracto genital.
Objetivos- 1.
Mostrar al ginecólogo la utilidad real de la RM en el estudio del tracto genital, sus limitaciones y sus ventajas.
- 2.
Enumerar aquellas patologías en las cuales la RM se considera como técnica diagnóstica de imagen de elección.
- 3.
Establecer aquellas situaciones en las cuales la RM puede ser útil sin ser la prueba de elección.
Revisión bibliográfica de las principales fuentes consultadas tradicionalmente por los ginecólogos y radiólogos de nuestro país: Protocolos de las respectivas Sociedades Españolas de Radiología Médica y Obstetricia y Ginecología, guías del Institute for Clinical Systems Improvement, Practice Guideline Cancer Care Ontario, American College of Obstetricians and Gynecologists, Singapore Ministry of Health, American Brachiterapy Society y el College of American Pathologists. También se consultaron las Guidelines Advisory Commitee, Nacional Guideline Clearinghouse, Library Cochrane y Pub Med, así como algunos de los libros considerados como referencia sobre la materia2–4.
ResultadosEl papel de la RM en ginecología, especialmente en el campo de la oncología, ha adquirido una mayor importancia durante las dos últimas décadas. En el momento actual la evidencia científica indica que la RM es una técnica útil para valorar la patología tumoral pélvica5,6, con un rendimiento superior a la tomografía computarizada (TC) en la estadificación de los tumores malignos de endometrio y cérvix, y que además puede servir de ayuda en la diferenciación entre la fibrosis posradioterapia y la recidiva tumoral7. En cuanto a la detección de adenopatías, su rendimiento diagnóstico es similar al de la TC, ya que ambas técnicas se basan en el criterio del tamaño ganglionar para el diagnóstico de metástasis. Sin embargo, la reciente incorporación de contrastes específicos de RM para el estudio de ganglios linfáticos promete ser un arma de extraordinaria utilidad para determinar la afectación metastásica ganglionar.
Aparte de su indudable papel en el diagnóstico de la patología pélvica, en algunas situaciones clínicas la RM ha demostrado ser un eficiente recurso sanitario, capaz de disminuir el coste económico al eliminar o reducir la necesidad de otros procedimientos diagnósticos o quirúrgicos, más caros o agresivos8.
Los actuales usos recomendados de la RM en el estudio de la patología del tracto genital comprenden:
- 1.
Valoración de anomalías congénitas. La RM se considera la modalidad de imagen idónea para el estudio de anomalías congénitas, con una precisión comunicada9 cercana al 100%.
- 2.
Caracterización de masas anexiales. Existen cuatros masas benignas del ovario con rasgos característicos en la RM3:
- –
Teratomas maduros.
- –
Endometriomas.
- –
Quistes hemorrágicos.
- –
Fibromas ováricos.
- –
- 3.
Diagnóstico de patología benigna uterina: leiomiomas y adenomiosis.
- 4.
Detección, estadificación y seguimiento de procesos pélvicos malignos. Es útil en la estadificación del carcinoma de cérvix, endometrio, ovario, vagina y vulva.
- 5.
Valoración del suelo pélvico10 y la pelvimetría. La RM dinámica del suelo pélvico posee una sensibilidad del 100% para el diagnóstico de cistocele, un 87% para el enterocele y un 76% para el rectocele, con una especificidad entre el 50 y el 100% para los distintos compartimentos11.
- 6.
Evaluación de malformaciones fetales cuando la ecografía presente dudas.
- 7.
Lesiones en pacientes embarazadas (masas pélvicas, neoplasias y dolor pélvico), si bien no se recomienda durante el primer trimestre (asunto éste último en discusión).
- 8.
Estudio de mamas densas. Las principales indicaciones admitidas actualmente para la RM de la mama son12:
- –
Estadificación locorregional en el cáncer de mama.
- –
Búsqueda de carcinoma oculto en metástasis axilares de origen desconocido.
- –
Monitorización de la quimioterapia y otros tratamientos sistémicos neoadyuvantes.
- –
Sospecha de recidiva tumoral en pacientes con cirugía conservadora.
- –
Estudio de secreción mamaria no filiada por otros métodos.
- –
Cribado en pacientes con riesgo incrementado de cáncer de mama. Dentro de este grupo se incluyen las pacientes con riesgo genético.
- –
- 9.
Estudio de la hipófisis para descartar prolactinomas.
Factores que limitan el uso de la RM:
- 1.
No se deben realizar RM a pacientes con implantes cocleares, clips metálicos, marcapasos, algunas prótesis ortopédicas, cuerpos extraños intraoculares, algunos tatuajes y válvulas cardíacas, embarazadas en el primer trimestre (en discusión, como ya comentamos), lactantes (si se requiere contraste gadolinio) y pacientes con claustrofobia (si bien existen resonancias abiertas que en algunos casos han solucionado este problema).
- 2.
Existen artefactos en la imagen por movimientos del paciente (intestino, diafragma, etc.).
- 3.
Su coste en principio es mayor que el de otras técnicas, aunque paradójicamente puede resultar más rentable al reducir el coste final del proceso.
- 4.
Accesibilidad. Muchos hospitales no disponen de resonancia magnética.
La RM es una prueba incruenta y exenta de radiación con una amplia aplicabilidad en el campo de la ginecología. Aunque su aplicación paradigmática se encuentra en el ámbito de la ginecología oncológica, su utilidad clínica ha demostrado trascender esta faceta, de modo que cualquier ginecólogo debiera contemplar hoy en día su uso como un recurso diagnóstico más dentro del extenso arsenal de técnicas exploratorias disponible.
El tratamiento de la patología oncológica ginecológica dependerá del estadio tumoral y de las condiciones clínicas de la paciente. En la actualidad, la estadificación más comúnmente aceptada para el cáncer ginecológico del tracto genital inferior se basa en el sistema de clasificación de la Federación Internacional de Ginecología y Obstetricia (FIGO), que contempla una estadificación basada en criterios clínicos, radiológicos y quirúrgicos.
Las posibilidades terapéuticas son múltiples. Por ello, es necesario hacer un estudio previo al tratamiento lo más preciso posible para hacer la elección terapéutica más adecuada. Por tanto, sería fundamental en la sospecha de cáncer de ovario valorar la posible afectación peritoneal para establecer el tipo de cirugía, del mismo modo que en el cáncer de endometrio resultará de gran ayuda tener información útil sobre el porcentaje de invasión miometrial y la posible afectación cervical (para decidir sobre la posible linfadenectomía) y en el cáncer de cérvix conocer si los parametrios están afectados para desestimar el tratamiento quirúrgico. Las técnicas de imagen como la ecografía, la TC, y sobre todo la RM, desempeñan un papel fundamental en el proceso de diagnóstico, como en la estadificación y el seguimiento, y por consiguiente en el manejo terapéutico de las pacientes.
A pesar de no estar incorporada de manera oficial al sistema de estadificación de la FIGO, la RM es universalmente aceptada como la técnica de imagen más fiable y precisa para el diagnóstico, estadificación, planificación terapéutica y seguimiento de los carcinomas de cérvix y endometrio. En el caso del carcinoma de ovario, la técnica preferida para la estadificación, planificación y seguimiento suele ser la TC (influidos, en gran medida, su mayor disponibilidad y menor precio), si bien la RM, como ya dijimos, es más útil para caracterizar masas ováricas y permite valorar mejor que la TC la existencia de invasión local por contigüidad de trompas, útero, vejiga, recto y uréteres4.
La RM ofrece suficiente información para la toma de decisiones en el planteamiento terapéutico del cáncer de cérvix, y diferencia entre estadios quirúrgicos y aquellos tributarios de quimiorradioterapia. Su precisión en la estadificación oscila entre el 75 y el 96%, y es superior a la exploración clínica y la TC1.
El cáncer de cérvix se estadifica según la clasificación clínica de la FIGO. Sin embargo, este sistema de clasificación tiene algunas limitaciones: no incorpora el estado de los ganglios linfáticos y puede sobreestadificar hasta el 25% en estadio I y subestadificar hasta el 75% del estadio III. La RM ha demostrado ser superior a la TC y a la exploración física para valorar la infiltración del parametrio13,14. El criterio que ofrece mayor valor predictivo negativo en la detección de infiltración parametrial es la preservación o no del anillo hipointenso estromal en toda su circunferencia15,16(fig. 1). En cuanto a la sensibilidad de la RM para detectar la infiltración vesical o del recto, oscila entre el 71 y el 100%, y la especificidad entre el 88 y el 91%1. La RM también permite valorar la extensión de la lesión al cuerpo uterino o la vagina (si se objetivara una interrupción de la hipointensidad normal de la pared vaginal), así como la hidronefrosis secundaria a infiltración vesical/ureteral16. Sin embargo, para la detección de metástasis a distancia, por ejemplo de tórax, es más útil la TC. La RM tiene mejor rendimiento que el examen bajo anestesia y la ecografía transrectal para evaluar el tamaño del tumor primitivo y el estado de los ganglios linfáticos.
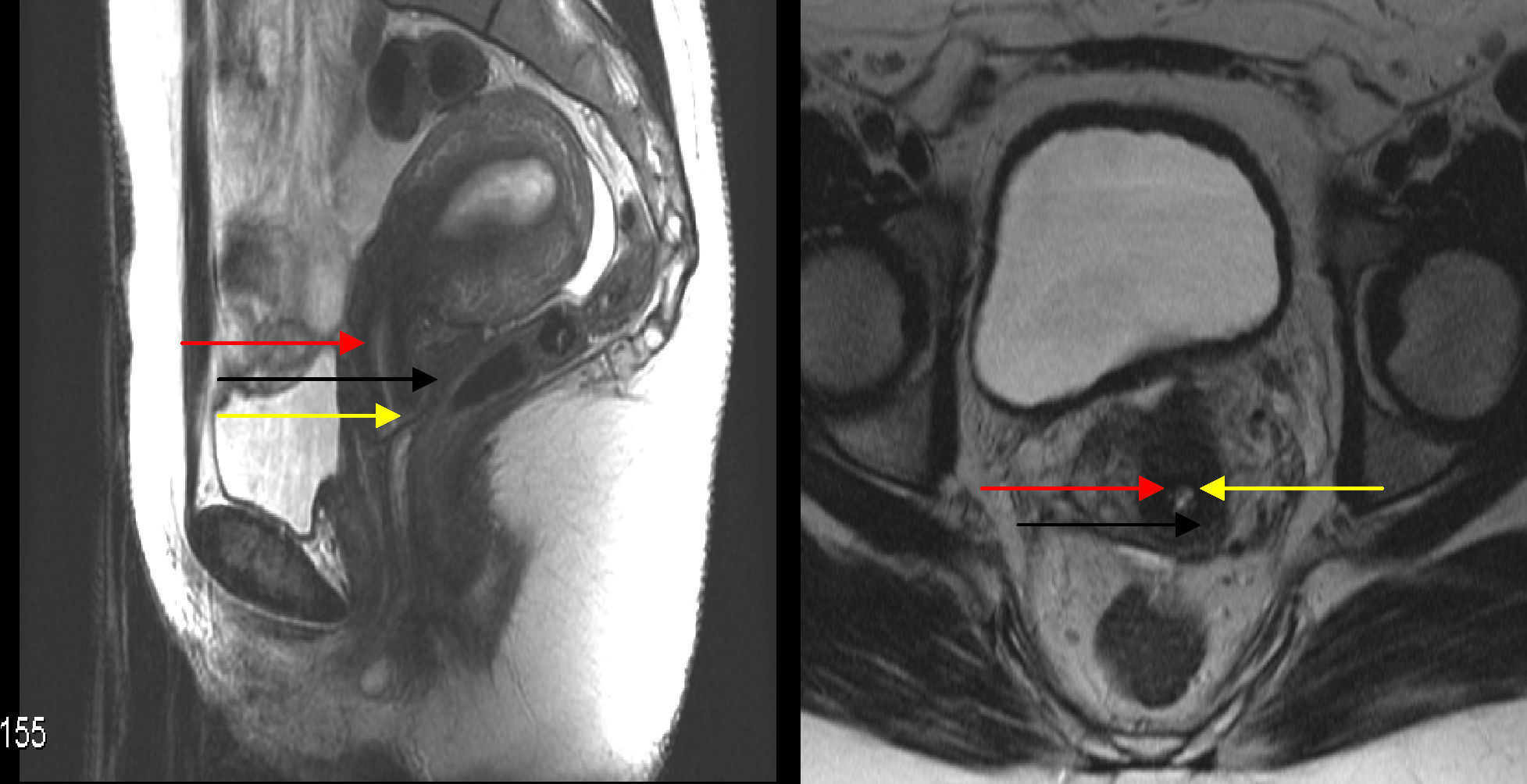
Anatomía del cérvix por resonancia magnética. Distinguimos 3 capas de dentro a fuera. Endocervix: la pimera capa –la más interna– corresponde a la mucosa endocervical y es la más brillante (más blanco), en secuencias en T2 de manera similar al complejo endometrial del útero (flecha amarilla). Estroma interno: la segunda capa –capa media– corresponde a la capa interna del estroma cervical fibromuscular. Es la más hipointensa (más negra). Se suele continuar con la zona de unión del útero (flecha roja). Forma un anillo hipointenso (negro) alrededor del endocérvix hiperintenso (blanco) La interrupción de este anillo hipointenso, fácilmente distinguible en los cortes axiales, es sugestiva de invasión tumoral. Estroma externo: la tercera capa –la más externa– corresponde al estroma cervical fibromuscular externo, de señal intemedia (gris).Se suele continuar con el miometrio externo (flecha negra).
La RM debe también considerarse como técnica de elección en el control de las pacientes tratadas de cáncer de cérvix, y es muy útil para diferenciar los cambios inflamatorios (secundarios a cirugía o radioterapia) del tumor residual. La persistencia de una lesión hiperintensa en secuencias T2 tras 12 meses de la finalización del tratamiento radioterápico podría ser sugestivo de enfermedad residual16. Sin embargo, y para valorar la existencia de complicaciones posquirúrgicas se prefiere la TC, aunque la RM es la técnica de elección para descartar la existencia de fístulas.
En cuanto al cáncer de endometrio, no se recomienda la RM como método de diagnóstico. La ecografía transvaginal será la primera prueba ante la sospecha y el diagnóstico nos lo dará la biopsia endometrial. La RM se recomienda únicamente como método de estadificación del cáncer de endometrio ya diagnosticado, teniendo mayor precisión que la TC y la ecografía para determinar la infiltración del cuello uterino y el miometrio17, factores ambos que se correlacionan con el riesgo de que existan metástasis ganglionares. La exactitud global de la RM para la estadificación se sitúa entre el 85 y el 93%18–21. Por ello, la RM debe también considerarse como una técnica fiable a la hora de seleccionar a las pacientes que sólo requieren biopsia ganglionar frente a las que deben someterse a linfadenectomía por un equipo quirúrgico especializado22. La incidencia de adenopatías metastásicas (pélvicas, paraaórticas o ambas) pasa de un 3% en los casos de invasión superficial del miometrio (estadio IB) a un 46% en los que la invasión es profunda (estadio IC)1.
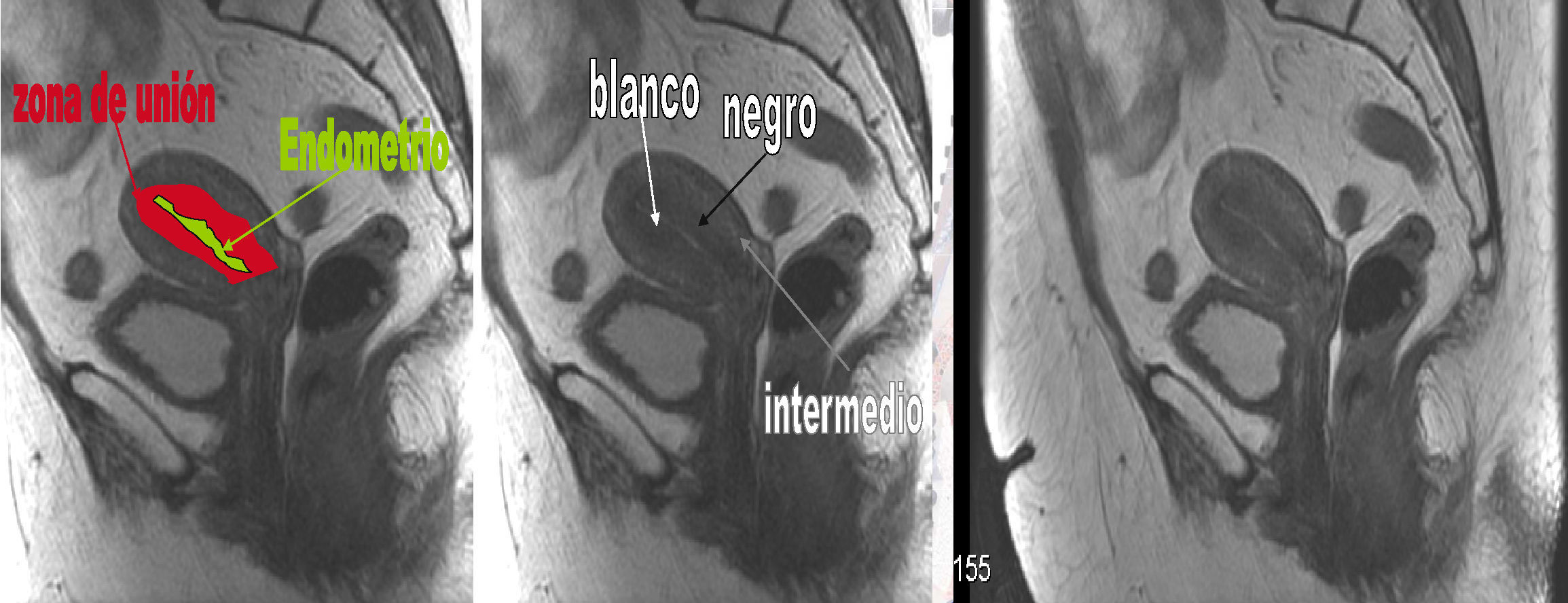
La demostración por RM de una zona de unión normal (indemnidad de la parte más interna del miometrio, que sirve de límite anatómico entre endometrio y miometrio23) puede considerarse un procedimiento adecuado e incruento para la detección sistemática de invasión miometrial, lo que sugiere la presencia de enfermedad no invasiva (fig. 2). Las secuencias potenciadas de mayor precisión para valorar la profundidad de la invasión miometrial son T2 en las mujeres premenopáusicas (en las que se aprecia mejor la zona de unión) y en T1 con contraste más útil en las mujeres posmenopáusicas (en las que la zona de unión se hace menos evidente) o en los casos de adenomiosis, que alteran también la zona de unión. En general, el tumor endometrial en las secuencias potenciadas en T2 aparecerá hiperintenso (más blanco) respecto al miometrio adyacente. En secuencias en T1 con contraste el tumor endometrial aparecerá como tejido hipovascular hipointenso (más oscuro) con respecto a miometrio hiperintenso normal (más blanco), que realza con contraste.
Anatomía zonal del útero. La anatomía del útero se aprecia mejor en secuencias potenciadas en T2. Las secuencias potenciadas en T1 no distinguen el endometrio del miometrio. En mujeres en edad reproductiva, el cuerpo uterino presenta tres capas diferentes en secuencias T2 de dentro a fuera. Endometrio: la capa más interna. Hiperintenso (blanco). Miometrio interno o zona de unión (ZU), cercana al endometrio: hipointenso (negro). Debe ser homogéneo y menor de 12mm. Miometrio externo: la capa más externa de intensidad intermedia (más blanco que la ZU y más oscuro que el endometrio).
Como antes se señaló, en la detección de adenopatías la RM presenta una fiabilidad similar a la TC, su sensibilidad es baja (entre el 43-73%24) y se define mediante un criterio de tamaño: se consideran sospechosas de malignidad aquellas adenopatías mayores de 1cm de eje menor25. No obstante, recientemente han aparecido nuevos agentes de contraste linfoespecíficos compuestos de partículas ultrapequeñas de óxido férrico (USPIO), que pueden detectar afectación metastásica adenopática independientemente del tamaño26.
La RM pélvica es, por tanto, un buen método para la estadificación prequirúrgica de los carcinomas de endometrio. Es una prueba sencilla e incruenta de alta sensibilidad para valorar si existe invasión miometrial y con un altísimo valor predictivo positivo (VPP). Aunque el valor predictivo negativo (VPN) sea bajo cuando se valora la existencia de invasión miometrial superficial, éste asciende marcadamente cuando se evalúa la invasión miometrial profunda, considerada realmente el factor de mal pronóstico27.
Respecto a la patología ovárica, la RM demuestra un alto valor en la caracterización de las masas anexiales.
Detectada una masa anexial, el estudio de ésta se basa en una tríada diagnóstica fundamental (examen pélvico, métodos de imagen y marcadores tumorales)28. Si bien la ecografía (transvaginal o abdominal) con Doppler es la primera técnica de diagnóstico que se debe realizar ante la sospecha de masa anexial, la RM obtiene mayor precisión diagnóstica en la caracterización de estas masas respecto a la ecografía o la TC. A pesar de ello, se recomienda su empleo como técnica de segunda elección cuando la ecografía es dudosa29–32.
El diagnóstico diferencial de cualquier masa ovárica con sospecha de malignidad debe plantearse con afecciones benignas que presenten aspectos de lesiones sospechosas: endometriosis, quiste hemorrágico, absceso o miomas pediculados. En este contexto, pueden resultar de extraordinaria ayuda las secuencias con supresión de la señal de la grasa, ya que ayudan a diferenciar entre un contenido graso y hemático (fig. 3).
Caracterización de masas ováricas. A) Caso 1. Formación ovárica (flecha roja) que es hiperintensa (blanca) en secuencias en T1 (imagen de la izquierda) y en secuencias con supresión grasa (imagen de la derecha). Las imágenes ováricas que podrían verse hiperintensas en T1 son formaciones con sangre o grasa. Como la formación se comporta como hiperintensa en técnica de supresión grasa, es decir, no se borra como la grasa (flecha amarilla), corresponde a sangre. Diagnóstico: endometrioma. B) Caso 2. En este caso, la formación ovárica (flecha roja) en secuencia en T1 (imagen de la izquierda) se comporta, al igual que en el primer caso, como hiperintensa, por lo que podría ser grasa o sangre. La imagen se vuelve hipointensa en las técnicas con supresión grasa (imagen de la derecha), al igual que el resto de la grasa de la pelvis, por lo que el diagnóstico será de formación con tejido graso (dermoide o teratoma).
Los tumores mucinosos tienden a mostrarse hiperintensos en T1 debido a la alta concentración proteica en el material mucoide35. Por otra parte, el aumento de intensidad de señal de los componentes sólidos de un tumor tras la inyección del contraste por vía intravenosa distingue los verdaderos crecimientos tumorales de los coágulos o depósitos de detritus que pueden tener una apariencia ecográfica similar.
La capacidad de la RM para diferenciar lesiones benignas de malignas en el ovario oscila entre el 50 y el 90%. Además, presenta como ventajas sobre la ecografía transvaginal su capacidad de determinar con mayor precisión la afectación por contigüidad de los órganos vecinos.
En consonancia con las recomendaciones del Gynecologic Oncology Group y de la European Guidelines for Staging Ovarian Cancer de la EORTC, la estadificación del cáncer de ovario es quirúrgica y debe incluir histerectomía abdominal total con doble anexectomía, muestra de ganglios paraaórticos y retroperitoneales, escisión del omento y biopsias de peritoneo, diafragma y cualquier región sospechosa, apendicectomía y citología del lavado peritoneal33. En la valoración prequirúrgica de aquellas pacientes con una masa ovárica presumiblemente maligna, es preferible el uso de la TC helicoidal frente a la RM para demostrar o descartar la afectación de la pared intestinal, omento, ganglios e hígado. Sin embargo, la RM puede ser igual o más segura en la detección de enfermedad metastásica34.
Finalmente, y en lo que respecta al papel de la RM en el estudio de la patología no oncológica del tracto genital inferior, señalaremos que la RM permite caracterizar y localizar de forma eficaz a los leiomiomas, determinando el tipo según ubicación en las capas del miometrio. La RM se utiliza también para el estudio de anomalías congénitas y destaca por su capacidad para realizar un correcto diagnóstico diferencial entre útero septo y útero bicorne (el contorno externo del fundus uterino en el útero septado aparecerá convexo, liso o mínimamente indentado, a diferencia del útero bicorne). La RM también es útil en el diagnóstico de adenomiosis, caracterizada por el hallazgo de estroma endometrial aberrante en el interior del miometrio. Suele encontrarse un engrosamiento de la zona de unión (de 12mm o superior), con múltiples nódulos puntiformes hiperintensos en T2. Menos frecuentemente, pueden verse nódulos hiperintensos en T1, que corresponderían a contenido hemorrágico.
La constante innovación en el campo de la RM ha permitido la aparición de nuevas tecnologías como la difusión, la perfusión y la espectroscopia, que podrían tener en un futuro próximo un papel destacado para mejorar el rendimiento diagnóstico de la RM en el estudio de las principales enfermedades ginecológicas.
Conclusiones- 1.
La evidencia actualmente disponible hace que la RM pueda considerarse la prueba de elección en la diferenciación de las patologías ginecológicas congénitas, inflamatorias y tumorales, y es especialmente electiva en la estadificación del carcinoma de endometrio y cervix, y en el diagnóstico diferencial de patología ovárica (particularmente en endometriosis, dermoides o teratomas y quistes hemorrágicos).
- 2.
En cualquier caso, debemos concebir la RM (y las demás técnicas de imagen) como técnicas complementarias de diagnóstico que en ningún caso podrán sustituir a la clínica28 y a una correcta exploración de la paciente.
- 3.
A pesar de que la RM no está incorporada oficialmente al sistema de estadificación de la FIGO, al no ser una prueba accesible económicamente, está considerada como la técnica de imagen más precisa para el diagnóstico, la estadificación, la planificación terapéutica y el seguimiento de los carcinoma de cérvix y endometrio, y es prácticamente igual de útil que la TC para la estadificación, la planificación y el seguimiento de los carcinomas ováricos36. Por ello, creemos se debería revaluar la utilización de RM como técnica de estadificación dentro de los protocolos asistenciales de las diversas patologías referidas (o al menos en el cáncer de cérvix y endometrio).
- 4.
Dado el uso creciente de la RM en patología ginecológica, consideramos necesaria la puesta en marcha de actividades formativas para el ginecólogo, que le permitan adquirir unas nociones básicas para la correcta interpretación de los informes e imágenes radiológicas que en su actividad diaria solicita.
Los autores declaran no tener ningún conflicto de intereses.