Estudiar la posibilidad de inducir endometriosis interna/externa en rata wistar, a través de un nuevo modelo microquirúrgico, que denominamos PGR 1.
Sujetos y métodosSe han utilizado 11 ratas Wistar, a las que se ha realizado un autotransplante de fragmento uterino, sobre la cicatriz resultante de la cirugía necesaria para su obtención. Después de 8 semanas se les practicó una nueva intervención, para la inspección de la cavidad abdominal y la toma de muestras relevantes para su estudio anatomopatológico.
ResultadosMacroscópicos: adherencias que afectaban fundamentalmente a la zona del implante; vesículas amarillentas. Microscópicos: vesículas/quistes; fenómenos inflamatorios; neovascularización; endometriosis interna en un animal.
ConclusionesEste nuevo modelo de implante nos puede ayudar a comprender mejor los mecanismos involucrados en la aparición de endometriosis, tanto interna como externa.
To study the possibility of inducing internal or external endometriosis in Wistar rats through a new microsurgical model known as PGR 1.
Subjects and methodsEleven Wistar rats underwent autologous transplantation of a uterine fragment over a deliberately created scar. After 8 weeks, a further intervention was carried out to inspect the abdominal cavity and take samples for pathological analysis.
ResultsMacroscopic results consisted of adhesions mainly affecting the implant and yellow vesicles. Microscopic findings consisted of vesicles/cysts, inflammatory phenomena, neovascularization, and internal endometriosis in one animal
ConclusionsThis new implant model could enhance our understanding of the mechanisms involved in the development of endometriosis, both internal and external.
La endometriosis es una enfermedad ginecológica que afecta fundamentalmente a las mujeres en edad reproductiva. Se define por la presencia de tejido endometrial, funcional, fuera de la cavidad uterina y puede provocar dolor pélvico e infertilidad en la mujer que la padece.
Todavía no se conocen con exactitud los mecanismos subyacentes al establecimiento y el desarrollo de esta patología. Los modelos animales1 permiten estudiar la secuencia temporal de los eventos involucrados en la génesis y en la progresión de la enfermedad. Además, esta enfermedad se produce de forma espontánea sólo en los seres humanos y los primates no humanos, por lo que hay problemas prácticos relacionados con los modelos utilizados para su estudio.
Las líneas actuales de investigación, basadas principalmente en la teoría de la menstruación retrógrada, descrita por Sampson en 1927, han ido estableciendo los múltiples factores bioquímicos, inmunológicos y moleculares implicados en la fisiopatología de la endometriosis2. Si se tiene en cuenta que el implante endometriósico requiere cinco pasos fundamentales —adhesión, invasión, reclutamiento, angiogénesis y proliferación— para desarrollarse, serán los dos primeros procesos, los que deberíamos estudiar, con la perspectiva de encontrar algún factor que facilite su diagnóstico o tratamiento2-4.
Dentro de esta línea de investigación hemos querido estudiar el comportamiento de un autotransplante de fragmento uterino en la rata Wistar, sobre una cicatriz creada para conseguirlo.
Material y métodosPara la realización del presente trabajo, empleamos once ratas Wistar hembra con un peso aproximado de 200 g y una edad de 10 semanas. Los animales fueron proporcionados y estabulados por el servicio de biomedicina y biomateriales, de los Servicios de Apoyo a la Investigación, de la Universidad de Zaragoza.
Todos los procedimientos fueron llevados a cabo siguiendo un protocolo de actuación autorizado por la comisión de ética para la experimentación animal de la Universidad de Zaragoza (número de registro PD 12/10).
Los animales fueron identificados en el momento de la estabulación con las siglas CPC y el número desde 01 al 11, correlativamente. Todos los animales fueron pesados en una báscula de precisión para animal vivo marca Mettler Toledo.
Material quirúrgicoTodos los procedimientos quirúrgicos fueron realizados bajo condiciones de esterilidad.
Para la realización de los procedimientos microquirúrgicos utilizamos un microscopio operatorio binocular de la marca Leica.
Instrumental quirúrgico convencional para la realización de la laparatomía:
- –
Bisturí estéril desechable del n.° 11.
- –
Porta agujas macroquirúrgico.
- –
Pinzas de disección de Adson.
- –
Tijeras de corte de Mayo.
- –
Tijeras de disección de Metzenbaum.
Instrumental microquirúrgico empleado para la inducción experimental de endometriosis:
- –
Porta agujas microquirúrgico.
- –
Pinzas de disección microquirúrgicas.
- –
Tijeras de Westcott.
- –
Bisturí eléctrico bipolar marca Martin.
Todos los animales fueron sometidos a anestesia general inhalatoria, empleando un aparato de anestesia para pequeños animales marca Abbott, con vaporizador de anestesia marca Draguer, usando como gas anestésico el sevoflurano vehiculizado con oxígeno. Para la inducción anestésica de estos animales, se utilizó una cámara de inducción de anestesia de animal de laboratorio de metacrilato, conectada al aparato de anestesia con un 5% de concentración del gas anestésico sevoflurano. El mantenimiento de la anestesia se realizó mediante mascarilla rostral para rata, conectada al aparato de anestesia, con la misma concentración de gas anestésico que la utilizada en la cámara de inducción.
Primera laparotomíaCon el animal anestesiado, se procede al rasurado y desinfección del abdomen, para realizar una laparotomía media infraumbilical, mediante una incisión de aproximadamente unos 3cm de longitud (fig. 1).
Tras conseguir una adecuada exposición y observación de los cuernos uterinos (fig. 1), tomamos el cuerno izquierdo y medimos, por medio de una regla estéril milimetrada, 15mm, desde el cuello uterino hacia el infundíbulo, donde realizamos una incisión transversal de las tres capas histológicas (serosa, muscular y mucosa endometrial) del cuerno, pero manteniendo la vascularización mesometrial. A 5mm de dicha incisión, practicamos otra de las mismas características, para obtener el segmento que nos servirá de implante (fig. 1).
La superficie antimesentérica del segmento así obtenido es seccionada longitudinalmente en todo su espesor (fig. 2), consiguiendo una exposición total de la mucosa endometrial. Seguidamente, los extremos resultantes del cuerno uterino izquierdo, son anastomosadas término-terminalmente, mediante una sutura seromuscular de acido poliglicólico 8/0, necesitando 5-6 puntos. Dicha anastomosis, es cubierta a su vez por la mucosa endometrial del segmento («del mismo modo que una salchicha es envuelta por el pan en un perrito caliente», por este motivo denominamos al implante «PGR-1 hot dog»).
Los bordes antimesentéricos del implante se suturan, con 4 puntos seromusculares (dos en cada lado), con sutura de ácido poliglicólico de 8/0, al cuerno anastomosado, de manera que quede implantado el segmento cubriendo parcialmente la anastomosis término-terminal, evitando una compresión excesiva que pudiera dañar el contenido envuelto (fig. 3).
Una vez realizado el implante, se procede a la desvascularización del mismo mediante una electrocoagulación bipolar (figs. 4 y 5).
Finalmente, se cierra la laparotomía sutura continua de ácido poliglicólico de 4/0 para la fascia y 5-6 puntos de seda de 3/0 para la piel.
Tras las intervenciones todos los animales recibieron el siguiente tratamiento:
- –
Profilaxis antibiótica con cefazolina 1mg/rata. Durante tres días consecutivos.
- –
Analgesia con meloxicam 0,08mg/rata. Durante tres días consecutivos.
- –
Anestesia local en bordes de la herida con 1 cc de bupivacaína. Una sola infiltración después de haber realizado la intervención microquirúrgica.
Ocho semanas después del procedimiento de inducción de endometriosis, se procede a realizar la segunda laparatomía en todos los animales.
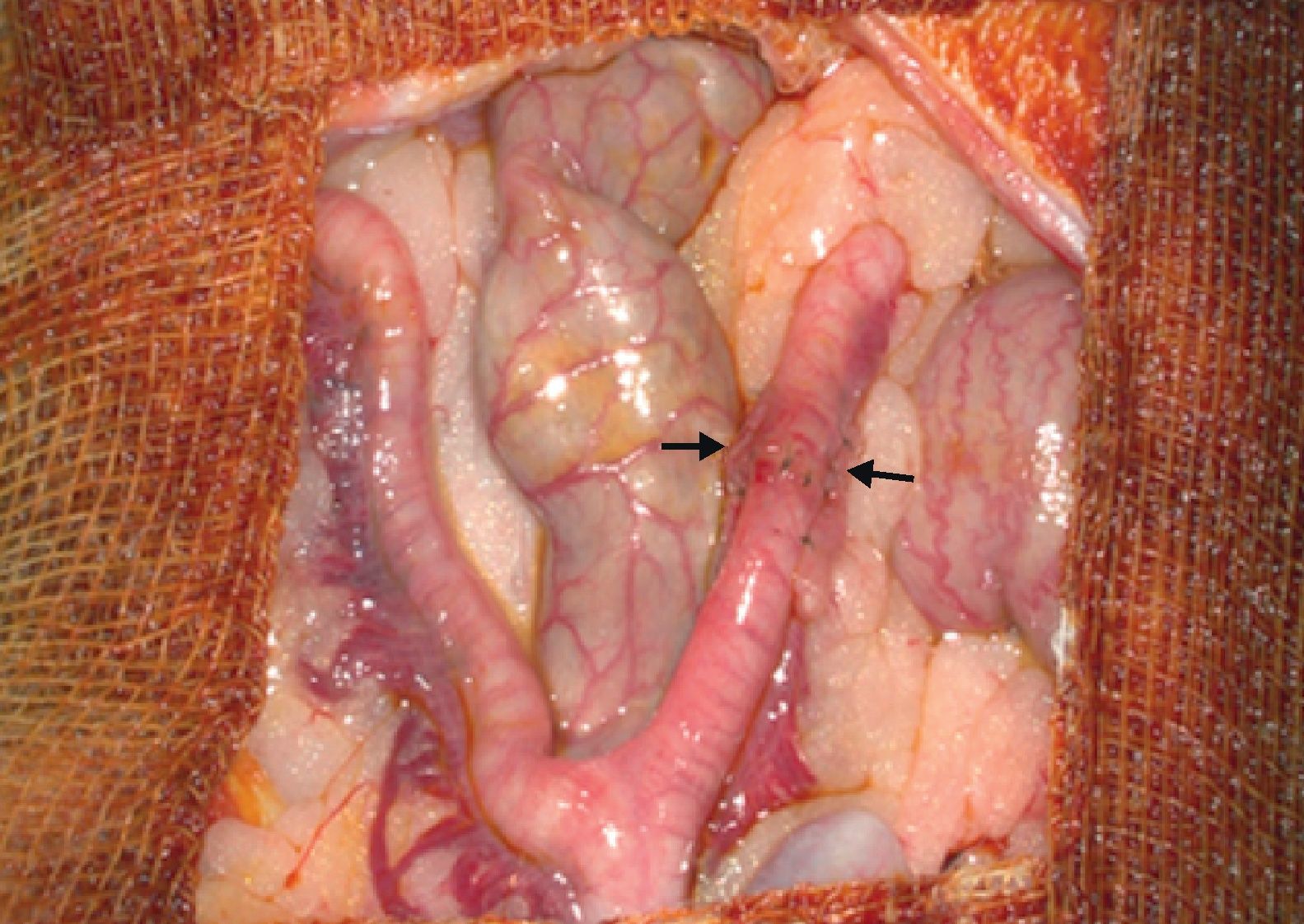
Una vez identificado el implante, se comprueba su aspecto macroscópico observando su coloración, presencia de adherencias o necrosis. Se revisa toda la cavidad abdominal y finalmente se realiza una histerectomía y anexectomía bilateral, para estudio anatomopatológico.
Por último, se procede al sacrificio del animal anestesiado, con sobredosis de pentobarbital sódico vía intracardiaca.
Material para estudio anatomo-patológicoAparato reproductor de 11 ratas hembra con inducción microquirúrgica experimental de endometriosis.
Las muestras fueron fijadas en formaldehído al 10% neutro durante 24h y transferidas posteriormente a etanol 70°. De este material se obtuvieron secciones longitudinales del cuerno derecho, del cuerno uterino izquierdo y de zona de vagina y unión de ambos cuernos uterinos. Estas muestras fueron procesadas por métodos histológicos rutinarios, obteniéndose secciones a 3μm que fueron teñidas con el método de hematoxilina-eosina (HE).
ResultadosHallazgos macroscópicosEn los 11 animales, a las ocho semanas del autotrasplante uterino, al inspeccionar la cavidad peritoneal nos encontramos, en mayor o menor grado, en todos los animales:
Estas lesiones afectaban principalmente al cuerno uterino sometido al implante.
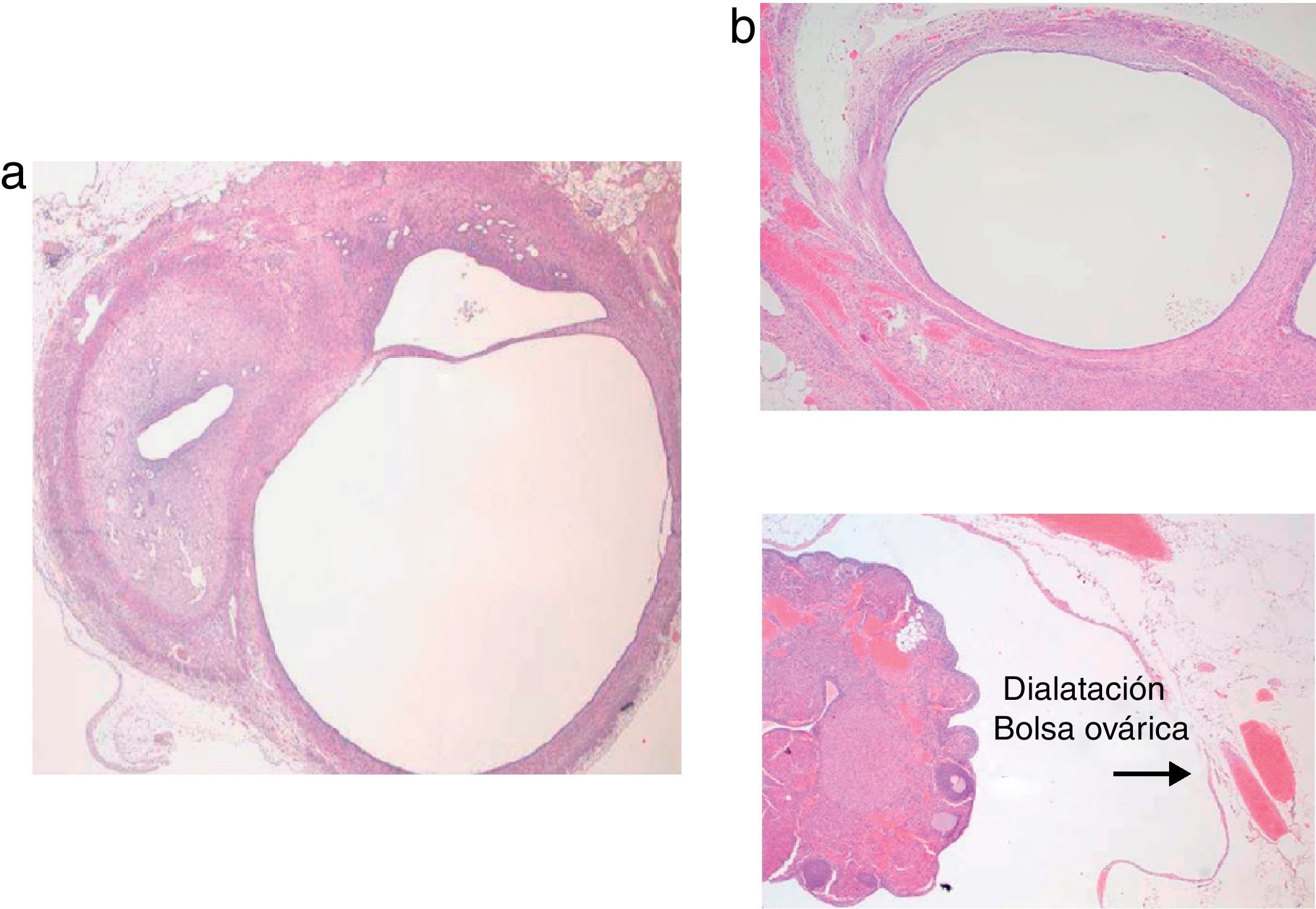
Hallazgos microscópicosEn los 11 animales, comparando los hallazgos microscópicos con el cuerno uterino normal, donde distinguimos las capas histológicas: mucosa, muscular y serosa (fig. 7A), apreciamos en la zona del implante del cuerno autotrasplantado, una vesícula/quiste de paredes aplanadas, con todas o algunas de las capas histológicas (fig. 7B).
También encontramos una intensa vascularización que no solo afectaba a la zona del implante (fig. 8A), sino también a la bolsa ovárica y al cuerno uterino y bolsa ovárica contralaterales.
Otro de los hallazgos microscópicos que nos llamó la atención fue la observación de una dilatación de la bolsa ovárica, sin existir obstrucción del cuerno uterino, tanto en el lado intervenido como en el contralateral, con una marcada angiogénesis (fig. 8B).
También apreciamos una reacción inflamatoria peritoneal, con aumento de la vascularización y aparición de micromineralizaciones, localizada fundamentalmente en la zona de grasa mesometrial próxima al implante.
La zona de unión de ambos cuernos uterinos, así como la vagina presentaban aspecto normal y no hemos encontrado células endometriales recubriendo las vesículas amarillas más lejanas al implante.
En 1 de los 11 animales, distinguimos glándulas y estroma endometriales entre los haces musculares desorganizados, en la zona de cuerno uterino donde asentaba el autotransplante (fig. 9).
DiscusiónAsí como la endometriosis es una enfermedad relativamente frecuente en mujeres en edad reproductiva, en animales es rara. Quizá sea también más difícil de diagnosticar, como explica Ortega5,6.
Teniendo en cuenta la teoría de la menstruación retrógrada, como causa de la endometriosis, en animales este fenómeno es más difícil de producirse, ya que en muchos de ellos existe una bolsa ovárica que facilita la captación ovular y aísla el peritoneo pélvico de los fluidos uterinos. Además, la menstruación como tal fenómeno solo se produce en las monas. Por este motivo los primates son los modelos animales ideales para el estudio y la investigación de endometriosis en humana, pero debido a su alto coste, problemas éticos y difícil manejo se han propuesto otros modelos animales, de los que la rata Wistar es uno de los más utilizados.
Desde que Vernon y Wilson1 describieran la técnica microquirúrgica para inducir la endometriosis en rata Wistar, otros autores6,7 han introducido variantes de la misma como:
- –
Localización anatómica del implante.
- –
Composición del mismo: serosa, muscular, mucosa; o solo mucosa.
En nuestro trabajo, la variación ha consistido en el lugar de colocación del implante. Este lo situamos alrededor de una cicatriz uterina del cuerno izquierdo, producida por la obtención del implante (fragmento uterino que contenía serosa, muscular y mucosa uterina). El motivo era intentar averiguar si, además de una endometriosis externa, se podría producir además una endometriosis interna.
La endometriosis inducida en rata Wistar viene definida:
- –
Macroscópicamente, por la aparición de vesículas amarillentas, además de presencia de procesos adherenciales. En nuestro modelo se cumple este precepto. Así, como Quereda7 hemos hallado, además del proceso adherencial, vesículas conteniendo líquido estral amarillento, rodeadas o no de las capas uterinas que constituían el fragmento autotrasplantado.
- –
Microscópicamente, se encuentran vesículas/quistes, fenómenos inflamatorios y marcada neoangiogénesis. Estos procesos están localizados fundamentalmente en la zona del implante o próximos a él. En nuestro caso, hemos hallado estos fenómenos y además una neoangiogénesis en localizaciones más distales al implante, como en las zonas anexiales que además presentaban una dilatación de la bolsa ovárica, sin existir obstrucción del cuerno uterino. Este hecho hablaría a favor de la existencia de substancias proinflamatorias, en respuesta a la presencia de un elemento extraño por su localización, el implante uterino, con probable implicación de los macrófagos peritoneales8 y las citocinas9 por ellos liberadas, fundamentalmente el factor de necrosis tumoral y el factor de crecimiento endotelial vascular10. Alcázar11 también describe este fenómeno de la angiogénesis en humana, al observar un incremento de la vascularización durante la exploración ecográfica de los ovarios de mujeres con endometriomas, con una relación directa con la presencia de dolor pélvico, en relación a las que no presentaban endometriomas ováricos.
Otra diferencia en nuestro trabajo, en relación con otras técnicas de inducción de endometriosis en rata Wistar es: la posibilidad de estudiar la endometriosis interna o adenomiosis. Pensamos que este hecho diferencial pueda estar motivado por el tipo de implante, que abrazado a la cicatriz puede desarrollar una endometriosis interna. En nuestro estudio, solo ha ocurrido en uno de los animales, mientras que la aparición de vesículas y la angiogénesis se han producido en todos los modelos descritos. Serían necesarios por tanto más estudios y aplicar métodos estadísticos para confirmar el implante PGR-1 hot dog como método válido, para producir endometriosis interna en rata Wistar.
La intención final de este trabajo, tras validar el implante, como así parece al compararlo con los resultados de inducción de endometriosis en rata wistar, obtenidos por otros autores1,6,7, sería ver cómo responde a las nuevas terapias desarrolladas para curar la enfermedad endometriósica en humana, aliviar el dolor que produce o mejorar las posibilidades de fertilidad en la mujer que la padece, tanto de forma natural, como utilizando técnicas de reproducción asistida12.
ConclusionesPor tanto, en cuanto a nuestro trabajo con este modelo de inducción de endometriosis: interna y externa, que denominamos PGR- 1 hot dog creemos más que posible la siguiente secuencia de hechos.
- 1.
El implante PGR-1 permanece viable y responde a las hormonas ováricas. Es decir, se revasculariza y no se necrosa.
- 2.
El líquido estral generado por la mucosa uterina del implante se vierte al peritoneo y a la sutura termino-terminal, ocasionando una reacción inflamatoria.
- 3.
La reacción inflamatoria producida por el vertido de líquido endometrial en peritoneo entre otros, provocaría una peritonitis local, una neoangiogénesis local y a distancia, desencadenando un aislamiento del implante por la grasa miometrial, vejiga e intestino, que impedirá finalmente la salida de más líquido estral.
- 4.
El líquido estral a distancia forma las vesículas más amarillentas, más densas, hipotéticamente el líquido más antiguo.
- 5.
El líquido estral acumulado en el implante va adelgazando el mismo, ya que se ha taponado su salida por el mecanismo anteriormente descrito, ocasionando un adelgazamiento de la pared de implante que formaría una vesícula que contendría un líquido más seroso, menos amarillento y que alcanzada una presión determinada impediría finalmente el funcionamiento de la mucosa uterina o produciría su fragmentación, liberando el contenido. Por este motivo, a veces no visualizamos el implante completo.
- 6.
El líquido estral proveniente de los cuernos uterinos, incluido el cuerno uterino izquierdo abrazado por el implante, drenaría por su espacio natural, sin ocasionar dilatación intraluminal. Por tanto, creemos que la hiperemia y la dilatación de los ovarios en algunas ratas y dado que se producen también a veces en el ovario contralateral al lado del implante, se produciría por el líquido estral del implante y no como consecuencia de la obstrucción del cuerno uterino. Este hecho nos parece relevante por el especial tropismo que muestran las células endometriales sobre el ovario y trompa, lugares de frecuente localización de endometriosis en humana.
Este nuevo tipo de autotransplante uterino en rata Wistar nos puede ayudar a entender mejor los mecanismos fisiopatológicos implicados en la aparición de la endometriosis: interna y externa.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Al Instituto Aragonés de Ciencias de la Salud.
Al equipo de microcirugía: Dra. González Pastor, Dra. Pastor Oliver y al Dr. Gómez-Arrue Azpiazu.
Al personal del Servicio de Biomedicina y Biomateriales de los Servicios de Apoyo a la Investigación de la Universidad de Zaragoza: Alicia Arnal Ortiz, Aurora García Encina, Luís Mógica Lozano, Carmen Navarro Lapeña y María Pérez Palomero.
A la Unidad de Apoyo a la Investigación, Anatomía Patológica: Dra. Alba de Martino Rodríguez.
A la Unidad de Apoyo a la Investigación y Separación Celular: Dr. J .Godino.