Analizar los resultados de 4 años de aplicación del programa de cribado combinado del primer trimestre y su impacto sobre las tasas de detección de síndrome de Down, cobertura poblacional y procedimientos invasivos.
Sujetos y métodosEstudio retrospectivo poblacional de 8 años consecutivos (17.564 gestaciones que contienen 51 síndromes de Down), en 2 periodos: 31 de enero de 2002 a 30 de enero de 2006, sin cribado (8.182 gestaciones y 24 síndromes de Down) y 31 de enero de 2006 a 30 de enero de 2010, con cribado (8.382 gestaciones y 27 síndromes de Down). El cribado se aplicó en 2 fases: bioquímica a la 10 semana y ecografía a la 12 semana. Se comparan los resultados del cribado con los del periodo precedente basado en la edad materna y la medida de la translucencia nucal.
ResultadosLa cobertura poblacional fue de 93%. La tasa de detección de síndrome de Down por aplicación del cribado combinado ha sido del 89% (91% para feto único) para un 3,5% de falsos positivos y se realizaron 824 procedimientos invasivos (34,3 para 1 diagnóstico). En los 4 años previos a la aplicación del cribado, la tasa de detección era del 71% y se realizaron 1.406 procedimientos invasivos (87,8 para un diagnóstico).
ConclusiónEl cribado combinado ha mejorado las tasas de detección para síndrome de Down en un 18%, al tiempo que ha permitido reducir en un 41% los procedimientos invasivos.
To analyze the 4-year results of first-trimester combined screening and its impact on rates of Down syndrome detection, population coverage and invasive procedures.
Subjects and methodsWe performed a retrospective population-based study over 8 consecutive years (17,564 gestations with 51 cases of Down syndrome) divided in two periods: from January 31, 2002 to January 30, 2006 without combined screening (8,182 gestations and 24 cases of Down syndrome) and from January 31, 2006 to January 30, 2010 with combined screening (8,382 gestations and 27 cases of Down syndrome). Combined screening was applied in two phases: biochemical analysis was performed in the 10th week of pregnancy and ultrasound examination in the 12th week. We compared the results of screening with the previous period based on maternal age and fetal nuchal translucency measurement.
ResultsPopulation coverage was 93%. The rate of Down syndrome detection due to the application of combined screening was 89% (91% for a single fetus) with a false-positive rate of 3.5%. There were 824 invasive procedures (34.1 to diagnose one episode). During the 4 years prior to the application of combined screening, the detection rate was 71% with 1,406 invasive procedures (87.8 to diagnose one episode).
ConclusionCombined screening has improved the Down syndrome detection rate by 18% and has reduced the use of invasive procedures by 41%.
El Síndrome de Down (SD) es la cromosomopatía más frecuente y en ausencia de cribado prenatal cabe esperar 1-2 casos por cada 1.000 nacimientos. Además de ser una de las principales causas de discapacidad, estos niños tienen un incremento en la incidencia de malformaciones congénitas, particularmente cardiacas y gastrointestinales y su esperanza de vida está entre los 50-60 años1. En puridad, todas las gestantes pueden tener un feto afectado y es precisamente la detección de un aumento en el riesgo la principal indicación para efectuar procedimientos invasivos (PI) durante la gestación (amniocentesis, biopsia corial), única manera de efectuar el diagnóstico. Es evidente que no procede someter a PI a toda la población gestante pues los costes económicos, de infraestructura sanitaria y de pérdidas de fetos sanos serían inaceptables. Tras la aplicación de diferentes estrategias de selección de riesgo, se ha impuesto el cribado combinado de I trimestre entre la 11-13+6 semanas (s.), que aplica una combinación de edad materna, medida ecográfica de la translucencia nucal fetal (TN) y cuantificación en suero materno de la proteína plasmática A asociada a la gestación (PAPP-A) y de la fracción libre de la gonadotrofina coriónica humana (fβ-HGC). De trabajar en un solo tiempo haciendo la bioquímica y TN en el mismo día (OSCAR: one-stop clinics for assessment of risk)2 se tiende a trabajar en las edades gestacionales que se han mostrado más discriminatorias, alrededor de la 10s. para la bioquímica y de la 12s. para la TN3. Ha pasado más de una década de las primeras publicaciones4 y las tasas de detección (TD) se mantienen entre 80-90% para 5% de falsos positivos (FP), con pequeñas variaciones.
En este trabajo se expondrán los resultados globales tras 4 años de aplicación del programa de cribado combinado del primer trimestre en comparación con el periodo de 4 años precedente y se analizará su impacto sobre la cobertura poblacional, TD y procedimientos invasivos.
Material y métodosSe realiza un estudio retrospectivo poblacional de los 4 primeros años de aplicación del cribado combinado del primer trimestre en el Hospital de Cabueñes de Gijón, del 31 de enero de 2006 al 30 de enero de 2010. En este periodo hubo un total de 9.032 partos, se realizaron 8.382 cribados y hubo 27 SD. Para evaluar el impacto sobre los PI se estableció la comparación con otro periodo consecutivo de 4 años previo a la aplicación del cribado, en los que la indicación para PI eran la edad materna y la medida de la TN: 31 de enero de 2002 al 30 de enero de 2006, con 8.182 partos y 24 SD, abarcando por tanto el estudio 17.564 gestaciones y 51 casos de SD. Cabe resaltar, por su influencia sobre la tasa de cribados, que la edad materna era de 35 o más años en el 27% de nuestras gestantes. Se precisó de consentimiento informado. Se trabajó en 2 fases, lo que requiere una logística de programación más compleja y una buena coordinación con atención primaria para una adecuada captación y cumplimiento de los tiempos para cada fase. Fijamos la 10s. para la determinación de la bioquímica (PAPP-A y fβ-HGC) y la 12s. para la ecografía, midiendo la TN de acuerdo con los criterios de la Fetal Medicine Foundation5,6. Para la determinación de los marcadores bioquímicos se utilizó el analizador Inmulite 2000. La exploración ecográfica se realizó por ecografistas experimentados; se inició vía vaginal y se concluyó en la mayoría de los casos por vía abdominal utilizando un ecógrafo Voluson 730 expert (GE Medical Systems) o un Thosiba Xario (Thosiba Medical Systems). El cálculo de riesgo se hizo con el programa PRISCA Software 4.0, Typolog Software Ltd & Co. KG (Contractor SIEMENS Medical Solutions Diagnostics, Germany) y el nivel de corte utilizado para ofrecer obtención de cariotipo fetal fue un riesgo estimado igual o inferior a 1/270. Los resultados se comunicaron a las gestantes al finalizar la ecografía. La obtención del cariotipo fue por biopsia corial en el 2,8% y por amniocentesis en el resto. El seguimiento de los recién nacidos se hizo a través de la sección de neonatología y de la comisión de perinatología del hospital y de la Comisión de Defectos Congénitos del Principado de Asturias, abarcando así todos los nacidos en nuestra comunidad.
ResultadosSobre 9.032 partos en el periodo de estudio se realizaron 8382 cribados, representando una cobertura poblacional del 93%. La edad gestacional media en la realización de la bioquímica fue de 9,9s. (objetivo: 10s.) y de 12,3s. para la ecografía (objetivo: 12s.). La tasa de cribados positivos para T-21 fue del 3,8% (318/8382). Si añadimos los positivos para T-18 y negativos para T-21 (358/8382), la tasa de cribados positivos totales fue de 4,3%. Descontando los 22 verdaderos positivos para T-21, tendremos una tasa de FP para T-21 del 3,5% y descontando los verdaderos positivos para T-18, habrá una tasa del 3,8% de FP para ambas trisomías.
La media de la edad materna y la mediana son en nuestra población de 32,1 y 32,4 años respectivamente, con un 27% de gestantes de 35 o más años, lo que debe tenerse muy en cuenta a la hora de establecer las comparaciones en términos de total de cribados positivos y FP, pues ambos aumentan a medida que lo hace la edad materna (tabla 1). Debe considerarse que el grupo de gestantes de 38 o más años representa el 9,6% del total de nuestra serie y aportan el 45% del total de cribados positivos para SD. La misma proporción se encuentra para los FP, 2% hasta 38 años y 16% a partir de 38 años.
La TD de SD por cribado fue de 91% para feto único con un 3,5% de FP (tabla 2). Si se incluyen gestaciones gemelares, la TD fue del 88% (tabla 3).
Número de amniocentesis y detección de SD (incluye gestaciones gemelares)
| 31 de enero de 202 a 30 de enero de 2006 Precribado | 31 de enero de 2006 a 30 de enero de 2010 Poscribado | |
| N.° de partos | 8.182 | 9.032 |
| Edad ≥ 35 años al parto | 25% | 27% |
| N.° de AMN | 1.406 | 824 |
| N.° AMN/100 partos | 17,2 | 9,2 |
| N.° AMN/Dx 1 SD | 87,8 | 34,3 |
| N.° de Dx Pren de SD | 17 | 24 |
| RN con SD sin Dx Pren | 7 | 3 |
| Tasa de detección SD | 71% | 89% |
AMN: amniocentesis; Dx: diagnóstico. Dx Pren: diagnóstico prenatal.;RN: recién nacidos; SD: síndrome de Down.
En los 4 años de estudio hubo 27 casos de SD: 25 tienen cribado (22 positivo y 3 negativo) y 2 casos no tienen cribado. Tuvimos 23 interrupciones legales del embarazo: 22 cribados positivos y 1 caso no cribado tras hallazgo ecográfico de ventriculomegalia en la primera visita a la 17s. Hubo 4 recién nacidos: 1 cribado negativo con feto sin malformaciones, 1 cribado negativo gemelar con feto sin malformaciones, 1 cribado negativo con malformaciones en eco del tercer trimestre y diagnóstico prenatal por amniocentesis que resultó en muerte intrauterina a la 38 s. y 1 caso no cribado con feto sin malformaciones.
La edad materna media fue de 32,1 años (mín. 15, máx. 47). En los casos de SD que participaron en el cribado, la edad materna era de 38 o más años en el 64% de las gestantes.
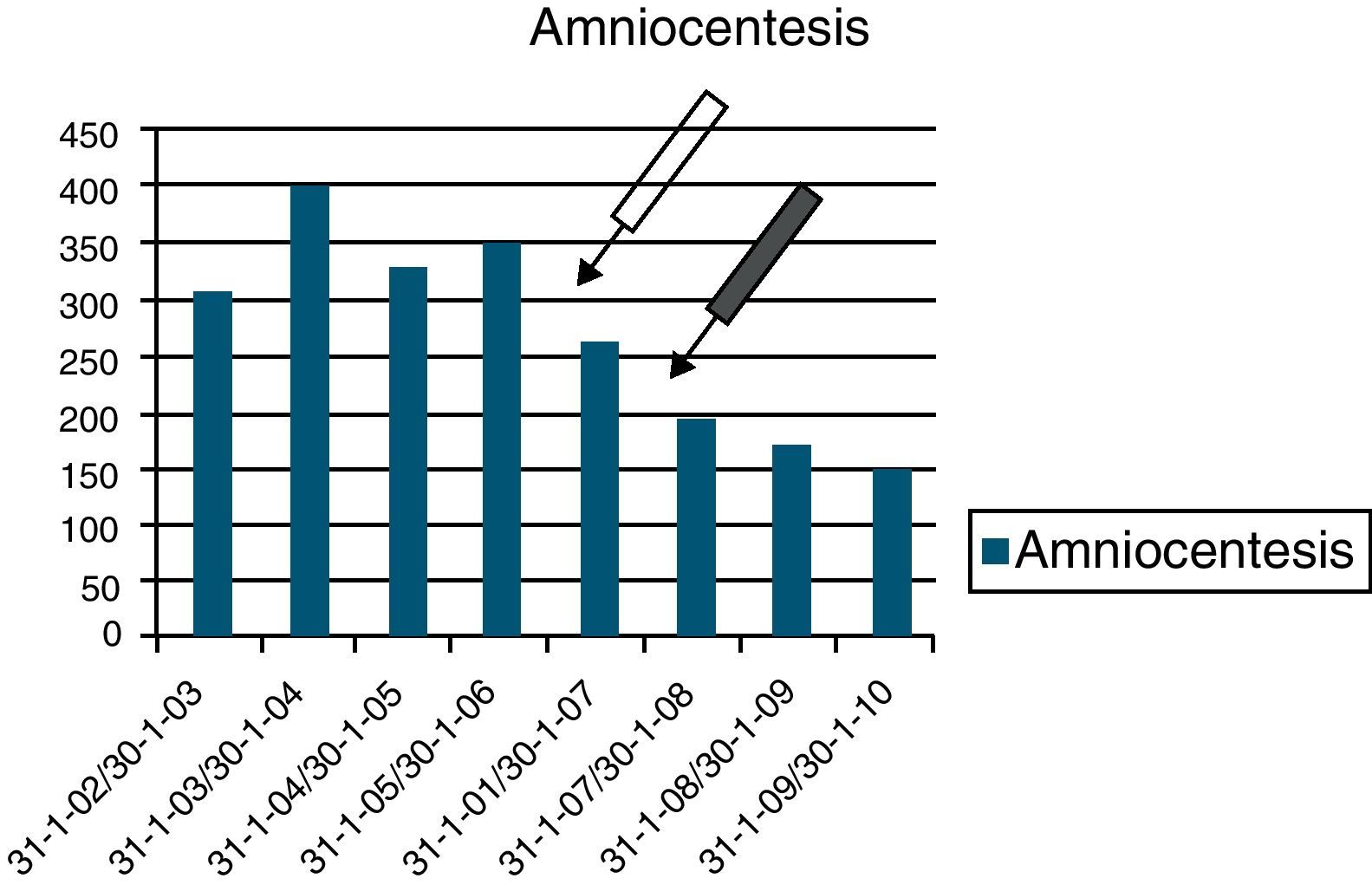
En los 4 años previos a la aplicación del cribado habíamos efectuado 1.406 PI, en tanto que en los 4 años tras su aplicación se hicieron 824, lo que supone un descenso del 41%. La obtención del cariotipo fue por biopsia corial en el 2,8% y por amniocentesis en el resto. El primer año de funcionamiento del cribado combinado supuso una reducción de un 22% y este impacto debe ser atribuido exclusivamente al programa. A partir del segundo año (enero de 2007) se produjo el cambio de criterio de edad materna de 35 a 38 años como indicación de PI en nuestra comunidad (fig. 1). Así, en los 4 años precribado teníamos una media de 17,1 PI por cada 100 partos, pasando en los 4 años poscribado a 9,2 y siendo de 7 por cada 100 partos en el último año (fig. 2). Para el diagnóstico de 1 caso de SD se precisaban 87,8 PI antes de la introducción del cribado, pasando a 34,3 tras su aplicación. El cambio de escenario queda reflejado en la tabla 3. Se estudian 17.564 gestaciones que contienen 51 casos de SD y observamos que en los últimos años se produce un aumento en el número de partos y en la edad materna, lo que debería generar una mayor cantidad de PI; sin embargo, estos disminuyen y lo que es más importante, la TD prenatal de SD aumenta, pasando del 71 al 89%.
En nuestro medio, las mujeres de 38 o más años pueden acogerse a PI libremente, solo con solicitarlo e independientemente de los resultados del cribado. Cuando la única indicación de PI es la edad materna avanzada, hemos comparado los 2 años previos con los 2 últimos años de la aplicación del cribado, que consideramos ya consolidado y es precisamente en este grupo donde ha sido mayor el impacto del programa: previo al cribado, el 62% de las gestantes de 38 o más años nos solicitaban obtención del cariotipo fetal solo en razón de su edad, pasando a un 24% tras conocer los resultados del cribado (tabla 4).
Gestantes con edad ≥ 38 años y amniocentesis
| 31 de enero de -2004 a 30 de enero de 2006 Precribado | 31 de enero de 2008 a 30 de enero de 2010 Poscribado | |
| N.° gestantes ≥ 38 años | 390 | 572 |
| N.° de cribados | – | 517 |
| AMN por EM ≥ 38 años | 240 (62%) | 140 (24%) |
| AMN otras indicaciones | 28 | 71 |
| N.° total de AMN | 268 (69%) | 212 (37%) |
AMN: amniocentesis; EM: edad materna.
La medida de la TN debe realizarse entre la 11-13+6 s. Sabemos que se pierde sensibilidad cuanto más la retrasemos, pero no debemos olvidar que la ecografía de I trimestre tiene otros objetivos, como es la búsqueda de malformaciones de expresión precoz y es precisamente la 12s. la que concilia mejor ambos propósitos7. Es posible el análisis de la bioquímica entre la 9-13+6 s. Las diferencias en los valores de PAPP-A entre fetos trisómicos y euploides son mayores en la gestación precoz; sin embargo, para la fβ-HGC la diferencia se incrementa con la edad gestacional, aunque la importancia de esta diferencia es menor que para la PAPP-A y por ello se considera óptima la extracción de la bioquímica entre la 9-10s. La mayoría de los grupos publican TD para SD entre el 81 y el 90% para un 5% de FP8-10 y parece que trabajando en 2 fases óptimas podrían elevarse hasta un 93-94%3,8,11. Ello concordaría con nuestros resultados, en los que obtuvimos una TD de SD del 91% para 3,5% de FP (feto único) trabajando en 2 fases, con edad gestacional media de 9,9s. y 12,3s. para la bioquímica y la ecografía respectivamente. La TD para T-18ha sido del 93% para 0,5% de FP, de acuerdo con el 91-100% reseñadas por diferentes autores12-14 para una tasa similar de FP, aunque llama la atención que en otras series se consiguen peores resultados, del 67% de TD para 0,4% de FP15. Nuestra tasa de cribados positivos para SD es del 3,8%, peor que la publicada en nuestro medio por Quiroga, que es del 2,9%; sin embargo, su población de 35 o más años es del 11%16. Nuestros resultados son muy parecidos a los publicados por otros autores15,17-19, con medias de edad materna de 30,7 a 33 años y con TD de 80-89% para FP de 2,7-5%.
Rozenberg19 encuentra una prevalencia de SD de 3,4/1.000 gestaciones y Sood20 de 2,6/1.000, muy similar a la encontrada por nosotros de 2,9/1.000 (17.564 gestaciones que contienen 51 casos de SD) y en concordancia con la del FASTER Trial de 3 casos por cada 1.000 gestaciones21.
El cribado combinado del primer trimestre ha sido bien acogido por médicos y gestantes, propiciando un cambio de mentalidad sobre el concepto de riesgo por edad materna como criterio único para obtener el cariotipo fetal. Esto se pone de manifiesto en la comparación de 8 años que hemos establecido (4 años previos y 4 años con cribado), reduciéndose en un 41% los PI y lo que es más importante, aumentando la TD de SD desde un 71% hasta un 89%. Pasamos de 17,1 a 9,2 PI por cada 100 partos. Müller22 en un estudio de 10 años evalúa el impacto del cribado del segundo y primer trimestre sobre los PI, pasando del 43% en 1995 al 25% en 2005. Wray23 compara dos periodos de 1 año (con y sin cribado del primer trimestre) en gestantes de 35 o más años referidas para consejo genético y comunica una reducción del 45% en la elección de técnicas invasivas (71% vs 26%). Parece además, que esta tendencia se consolida a la baja, pues en el último año hemos pasado a 7% de PI, más cercano al 5,5% de la serie de Rozenberg19. Queda demostrado que el cribado combinado del primer trimestre contribuye a un uso más racional de los PI al tiempo que mejora la TD de SD: en los 4 años previos al cribado precisábamos de 87,8 PI para diagnosticar 1 caso de SD, en tanto que a raíz del cribado precisamos 34,3, en consonancia con la serie de Müller22, que pasaron de 86 a 40. Como habíamos publicado previamente24, el impacto del cribado es más manifiesto en el grupo de edad de 38 o más años, que pudieron acogerse libremente a PI, independientemente de los resultados del cribado. En este grupo, las amniocentesis por indicación exclusiva de edad avanzada pasaron de 62% en la época precribado a 24% tras su aplicación.
Clásicamente, la ecografía de la 20s. es considerada un filtro, una segunda oportunidad para cribado de cromosomopatías, pero la introducción del cribado del primer trimestre ha modificado el escenario. Si alcanzamos TD de 90% por cribado, significa que llegan muy pocos fetos con SD a la ecografía (10%), lo que obliga a replantearnos su papel y nos abre un nuevo interrogante: los fetos con SD que se escapan del cribado, ¿serán los que tendrán marcadores o malformaciones en la ecografía?, ¿o serán aquellos que se escaparán casi siempre? En este momento no hay respuesta clara. En nuestra serie, los 3 recién nacidos vivos con SD no presentaban malformaciones al igual que los 5 casos que se «escaparon» del cribado y de la ecografía en la serie de Rozenberg19. Al someter a la población a un buen método de cribado, como es el combinado, el papel del sonograma genético queda cuestionado25,26 y serán necesarias nuevas investigaciones en grandes series para redefinir su papel. Incluso algunos autores desaconsejan explícitamente su aplicación20 por no encontrar mejorías en la TD y proponen limitarse solo al edema nucal y a la presencia de malformaciones27. En este mismo sentido se ha manifestado la guía NICE1. No debe olvidarse que los PI conllevan riesgos. Una revisión efectuada en mi hospital sobre 1.681 amniocentesis con seguimiento hasta la 22 semana de gestación arrojaba un 0,6% de pérdidas gestacionales relacionadas con el procedimiento. Para muchos autores el beneficio del sonograma genético no solo es incierto, sino que contribuye a aumentar la ansiedad y la tasa de anmiocentesis19,28. Recientemente, Benacerraf29 se expresaba en estos términos: «Los marcadores menores aportan solo un 4% de incremento en la TD de SD y contribuyen a aumentar en 12 veces la tasa de FP», con los procedimientos invasivos que ello conlleva.
Tampoco se acaban de incorporar con el suficiente peso los marcadores «clásicos» del primer trimestre, pese a que ya tienen cierto recorrido: ductus venoso30 desde el año 1998, Hueso nasal31 desde el 2001 y regurgitación tricuspídea32 desde 2003. Parecía promisoria su incorporación al cribado del primer trimestre33. En algunos casos, como el hueso nasal, la controversia es muy amplia, y hay autores que no le encuentran ninguna utilidad34. Quizás las dificultades técnicas de obtención o de interpretación en el caso del ductus venoso y la regurgitación tricuspídea influyan en su falta de generalización35. En una revisión reciente de Borrell36, apunta que la asociación del cribado combinado con hueso nasal, ductus venoso o regurgitación tricuspídea puede alcanzar TD para SD del 93% para un 2,5% de FP y en el mismo sentido se pronuncia Nicolaides, señalando una TD del 96% para 2,5% de FP11. Continúan las aportaciones para intentar mejorar la sensibilidad y optimizar los PI y en este sentido es interesante el trabajo de Kagan37, en el que se aplican diferentes estrategias de cribado en el primer trimestre, en una política de test contingente en la que la primera evaluación está basada en diferentes marcadores ecográficos y una segunda evaluación con test bioquímicos, a la que llegarían un 20% de gestantes. Modificaría el nivel de corte de 1/300 a 1/100 según recomendaciones del National Screening Committee de Inglaterra y postula que no solo pueden incrementarse las TD hasta un 96% para un 2,6% de FP, sino que además redundaría en una racionalización de costes y una disminución de pruebas invasivas innecesarias.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.