La miocardiopatía periparto es una enfermedad con una elevada morbimortalidad y que, a pesar de sus riesgos potenciales, no es posible prevenirla. Por ello, solo podremos actuar sobre los factores de riesgo asociados a su aparición y sobre las complicaciones una vez diagnosticada.
Debido a su baja incidencia, es difícil el conocimiento real de esta enfermedad, ya que se basa en artículos publicados sobre series reducidas de casos.
El propósito de esta revisión es realizar una descripción de la fisiopatología, las manifestaciones clínicas, el diagnóstico y el tratamiento de la enfermedad, enfocada principalmente en el manejo obstétrico de la gestante.
Peripartum cardiomyopathy is a serious disease with high morbidity and mortality. Despite its potential risks, prevention is not possible. Therefore, the only feasible strategy is to treat the risk factors and associated complications.
Due to the low incidence of peripartum cardiomyopathy, is difficult to achieve real knowledge of this disease, which is based on small case series.
This review aims to describe the pathophysiology, clinical manifestations, diagnosis and treatment of peripartum cardiomyopathy, with special emphasis on the obstetric management of pregnant women.
La miocardiopatía periparto es un trastorno poco común asociado al embarazo tardío y al puerperio, con consecuencias potencialmente letales1. El cuadro clínico es el de una insuficiencia cardiaca que puede ser difícil de diagnosticar porque los síntomas suelen ser similares a los de un embarazo normal. La etiología es desconocida2, aunque se ha descrito que puede relacionarse con la alteración en el procesamiento de la prolactina, el desequilibrio angiogénico y procesos inflamatorios o inmunológicos. Se han identificado factores de riesgo que se asocian directamente a esta patología. El tratamiento es similar al empleado en otros tipos de disfunción del ventrículo izquierdo, modificando aquellos fármacos que no son seguros para el embarazo o la lactancia3. Las mujeres afectadas pueden recuperar la función normal del corazón o progresar a una insuficiencia cardiaca grave que puede requerir soporte mecánico o trasplante cardiaco4. Incluso en aquellas mujeres en las que se produce recuperación total tras el embarazo, existe riesgo de recurrencia en embarazos posteriores5.
Se presenta a continuación un caso clínico de insuficiencia cardiaca secundaria a miocardiopatía dilatada periparto en el tercer trimestre de la gestación.
Descripción del caso clínicoPaciente de 29 años de edad, de raza caucásica, sin hábitos tóxicos. Como antecedentes personales presenta hipotiroidismo subclínico en tratamiento con levotiroxina. No refiere intervenciones quirúrgicas ni alergias medicamentosas conocidas. Madre y hermana gemelas sin otros antecedentes familiares de interés, no cardiopatías conocidas en la familia.
Se trata de una primigesta con una gestación gemelar bicorial biamniótica controlada en Consultas Externas de Patología Obstétrica con diagnóstico de crecimiento intrauterino retardado tipo i del segundo gemelo y en tratamiento con ácido acetilsalicílico 100mg/24h por detección de un índice de pulsatilidad de las arterias uterinas patológico.
La paciente ingresa en la semana 34+2 con el diagnóstico de rotura prematura de membranas. Se administra la primera dosis de betametasona intramuscular para la maduración pulmonar fetal, antibioterapia por vía intravenosa y tocólisis con atosibán, sin conseguir que ceda la dinámica uterina.
De manera brusca, la paciente comienza a referir taquicardia y sensación de dificultad respiratoria. La saturación de oxígeno es del 89% y la auscultación pulmonar presenta crepitantes pulmonares bibasales. Se realiza una interconsulta urgente al Servicio de Cardiología, que decide realizar una ecocardiografía transtorácica que se describe como «ventrículo izquierdo ligeramente dilatado con hipoquinesia generalizada de ventrículo izquierdo y septo, y disfunción sistólica severa. Fracción de eyección del ventrículo izquierdo (FEVI) 30-35%, con alteración diastólica de tipo restrictivo. Ventrículo derecho no dilatado con función normal. Insuficiencia mitral ligera sin otras valvulopatías significativas. Pericardio y raíz de aorta, normales».
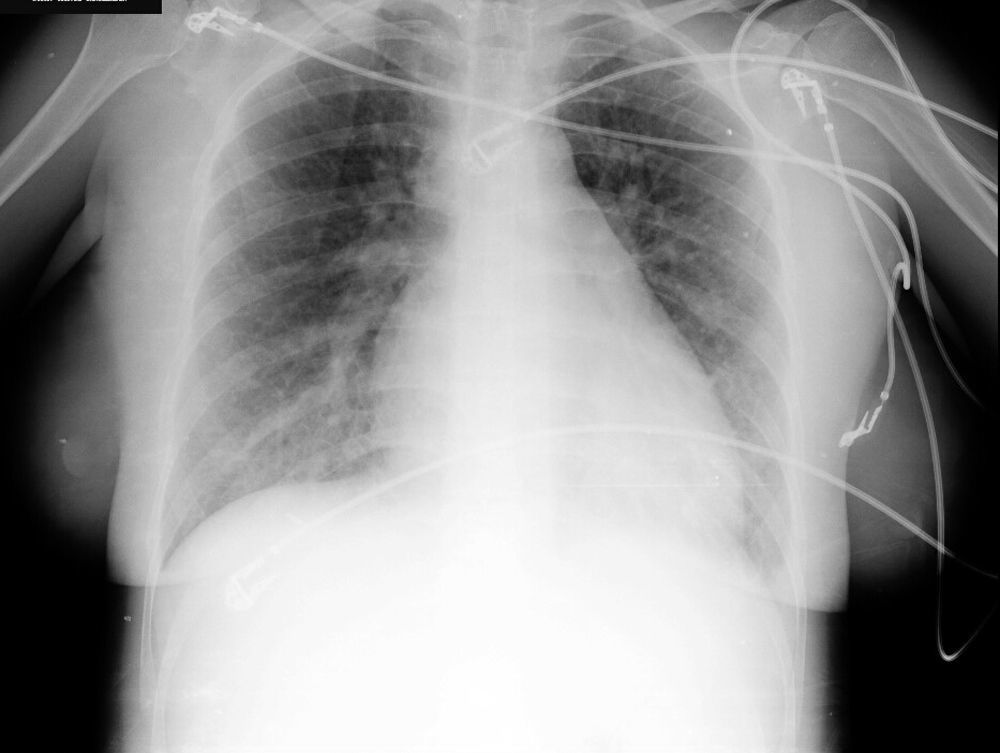
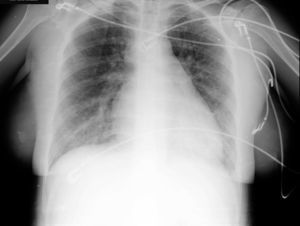
El hemograma y la bioquímica presentan valores dentro de los límites normales. Se realiza una radiografía de tórax (fig. 1) que evidencia un índice cardiotorácico aumentado y signos de redistribución vascular sin otros infiltrados patológicos.
Ante estos hallazgos, y dada la situación hemodinámica de la paciente, se aconseja finalizar la gestación con el diagnóstico de insuficiencia cardiaca y edema agudo de pulmón en el contexto de una miocardiopatía dilatada periparto con disfunción sistólica severa.
Se realiza una cesárea electiva bajo anestesia epidural en la que la paciente muestra tendencia a la hipotensión arterial, pero que transcurre sin incidencias. Se extrae un primer recién nacido mujer de 1.681 g, Apgar 8/8 y pH arterial 7,28, y un segundo recién nacido mujer de 1.541 g, Apgar 5/9 y pH arterial 7,24.
La paciente permanece las primeras 24 h postoperatorias en la Unidad de Recuperación Postanestesia, donde se inicia tratamiento con furosemida, espironolactona e inhibidores de la enzima conversiva de angiotensina (IECA), y se suprime la lactancia materna con bromocriptina.
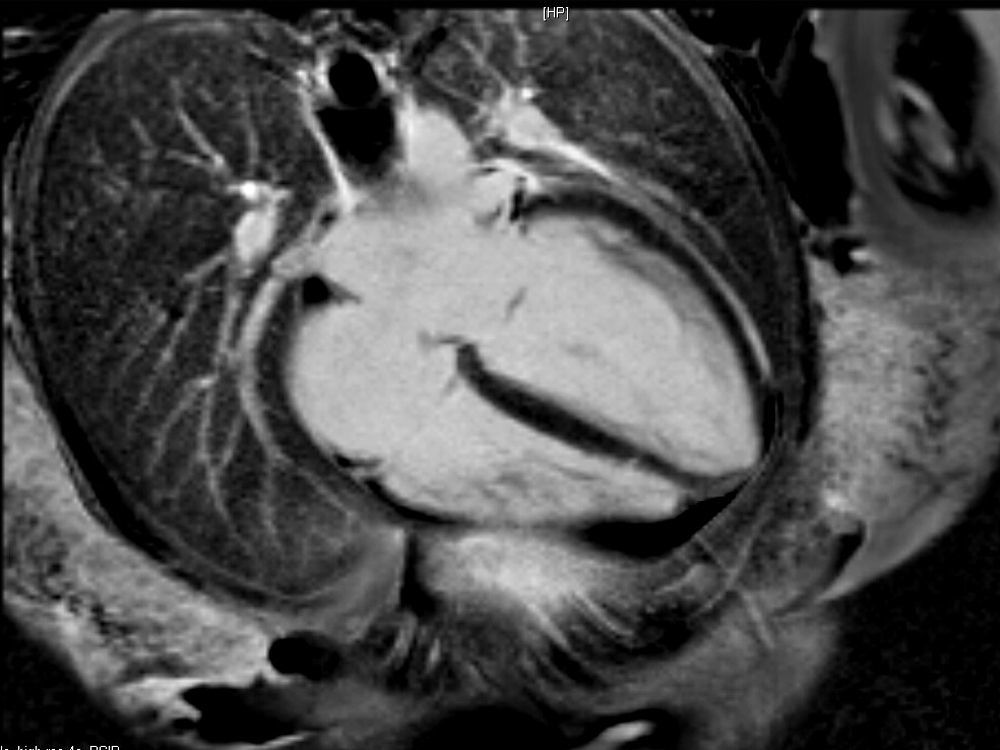
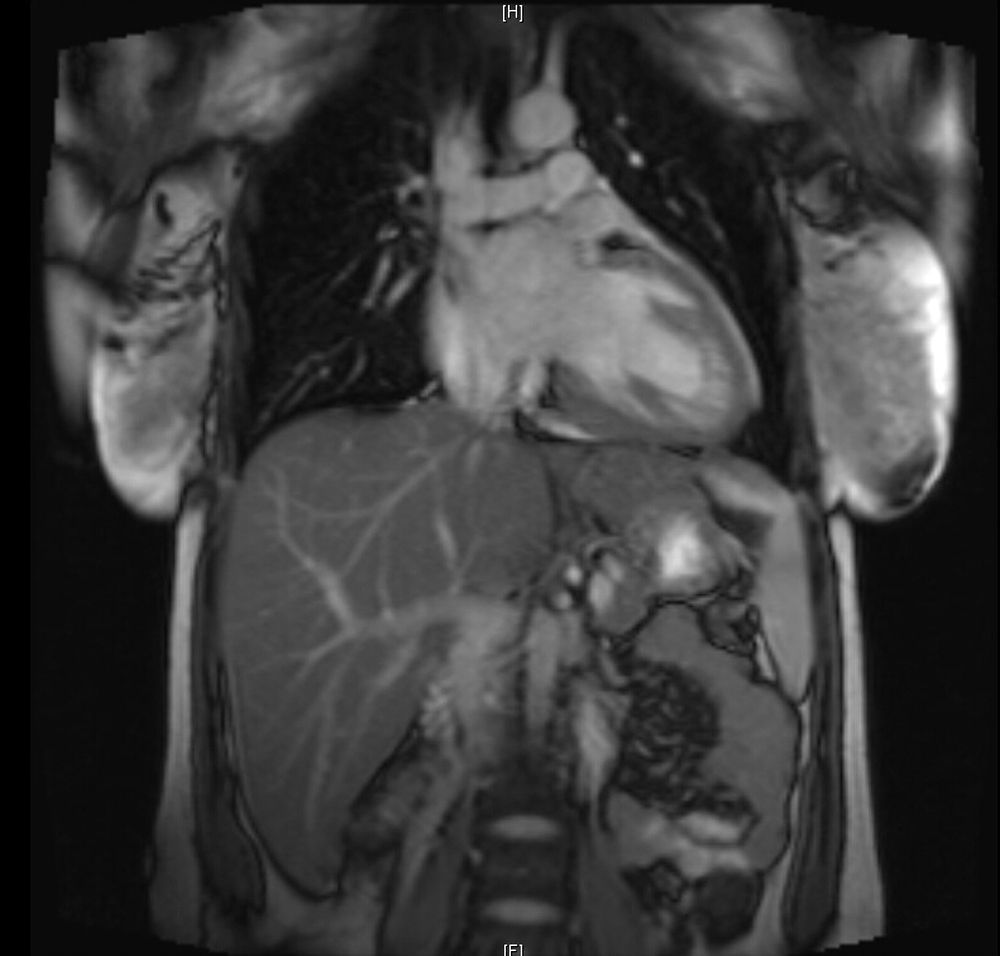
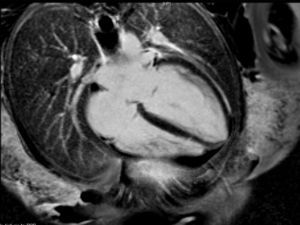
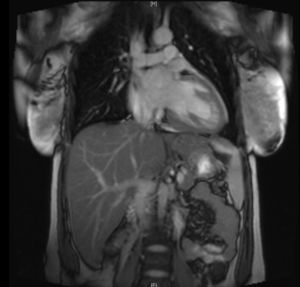
La paciente evoluciona favorablemente, por lo que es trasladada al Servicio de Cardiología, donde se reajusta el tratamiento, presentando buena evolución a lo largo de los días. Se realiza una resonancia magnética nuclear (figs. 2 y 3), que es informada como: «ventrículo izquierdo dilatado, con disfunción moderada del mismo y edema en región apical. FEVI 42%».
Se decide dar el alta al décimo día tras la cesárea, con una disfunción sistólica moderada, citando a la paciente para controles posteriores. Desde el punto de vista ginecológico, la paciente presenta buena evolución puerperal.
DiscusiónDefiniciónDemakis et al. establecieron por primera vez los criterios diagnósticos de la miocardiopatía periparto en 19711, que incluyen: a) desarrollo de insuficiencia cardiaca en el último mes de embarazo o en los 5 meses siguientes al parto; b) ausencia de causa identificable de fallo cardiaco, y c) ausencia de enfermedad cardiaca demostrable previa al último mes de embarazo. Posteriormente, se describe la necesidad de incorporar un nuevo criterio: la alteración de la función del ventrículo izquierdo demostrable por ecografía (FEVI<45%).
A pesar de que la mayoría de casos descritos de esta enfermedad ocurren durante los últimos meses de gestación, también se han detectado casos durante el segundo trimestre. Por ello, para evitar el infradiagnóstico de la miocardiopatía periparto, la Sociedad Europea de Cardiología en 2010 definió esta enfermedad con las siguientes características6: a) desarrollo de la insuficiencia cardiaca hacia el final del embarazo o en los meses siguientes al parto; b) la ausencia de otra causa identificable para la insuficiencia cardiaca, y c) la disfunción sistólica del ventrículo izquierdo con fracción de eyección casi siempre inferior al 45%. El ventrículo izquierdo puede o no puede estar dilatado.
IncidenciaLa incidencia real de esta enfermedad es desconocida6,7. En Estados Unidos, Canadá y Europa se trata de una patología rara, cuya incidencia estimada oscila entre 1/2.500-4.000 recién nacidos vivos. Sin embargo, esta entidad presenta una gran variabilidad geográfica, llegándose a describir incidencias de 1/1.000 en Sudáfrica, 1/300 en Haití y 1/100 en Zaria (Nigeria), probablemente en relación con la costumbre local de ingerir una sal de lago deshidratada (kanwa) durante el puerperio.
EtiologíaLa causa subyacente de la miocardiopatía periparto no ha sido claramente definida2. Se han desarrollado diferentes hipótesis para tratar de explicar el mecanismo etiopatogénico de esta enfermedad:
- 1.
Desequilibrio angiogénico relacionado con el déficit de factor de crecimiento endotelial vascular8.
- 2.
Alteración en el procesamiento de prolactina9.
- 3.
Proceso inflamatorio10.
- 4.
Respuesta inmunitaria anormal11.
- 5.
Enfermedad familiar.
- 6.
Factores hemodinámicos en relación con el aumento del gasto cardiaco que se produce en el embarazo.
Tradicionalmente, se han descrito numerosos factores de riesgo que se asocian al desarrollo de la miocardiopatía periparto, entre los que se encuentran: edad mayor de 30 años, ascendencia africana, embarazo múltiple, historia de preeclampsia, eclampsia o hipertensión posparto, abuso de cocaína y tratamiento tocolítico por vía oral a largo plazo (> 4 semanas) con betaagonistas adrenérgicos, tales como terbutalina.
En este caso, la gestación gemelar pudo ser un factor de riesgo predisponente para desarrollar la enfermedad. Además, aunque la multiparidad se ha considerado un factor de riesgo para la miocardiopatía periparto, los estudios han demostrado que la mayoría de las veces ocurre durante el primer o segundo embarazo, como fue el caso de esta paciente.
Presentación clínica y diagnósticoLa presentación clínica de esta patología es similar a la de una insuficiencia cardiaca de cualquier etiología (disnea, ortopnea, tos, taquicardia, crepitantes, edemas…).
En nuestro caso clínico, la paciente presentaba taquicardia y disnea, síntomas que en una paciente en trabajo de parto no resultan llamativos. Debido a que existe una superposición significativa entre los síntomas relacionados con el embarazo (especialmente hacia el final del mismo) y la insuficiencia cardiaca, el diagnóstico puede pasar inadvertido o retrasarse1,6.
El manejo inicial de esta patología consiste en realizar una historia clínica y una exploración física completa con el objetivo de descartar una cardiopatía previa al embarazo, identificar posibles causas y valorar la gravedad del proceso. En cuanto a las pruebas complementarias, se debe realizar un electrocardiograma y una ecocardiografía. Otros estudios, como los niveles de péptido natriurético, la radiografía de tórax, la resonancia magnética cardiaca y el cateterismo cardiaco, podrían ser útiles en casos seleccionados.
Los cultivos virales y bacterianos generalmente no se indican porque los resultados de estas pruebas no son específicos. La obtención de biopsia endomiocárdica está en entredicho, ya que no revela datos importantes para el manejo clínico de la paciente y tiene bajo rendimiento diagnóstico.
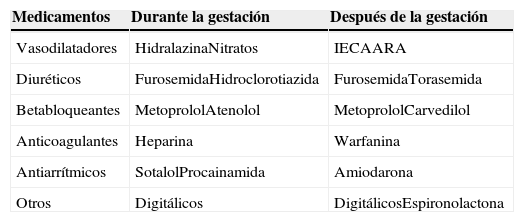
TratamientoEl tratamiento será similar al de cualquier otra insuficiencia cardiaca sistólica3. Los objetivos del tratamiento médico incluyen la administración de oxígeno y la ventilación asistida cuando sea necesario, la estabilización hemodinámica, el alivio de los síntomas y, cuando sea posible, terapias crónicas que mejoren los resultados a largo plazo. La elección y la seguridad de los medicamentos dependen de si van a ser utilizados durante el embarazo o después del mismo (tabla 1).
Tratamiento de la miocardiopatía periparto
| Medicamentos | Durante la gestación | Después de la gestación |
|---|---|---|
| Vasodilatadores | HidralazinaNitratos | IECAARA |
| Diuréticos | FurosemidaHidroclorotiazida | FurosemidaTorasemida |
| Betabloqueantes | MetoprololAtenolol | MetoprololCarvedilol |
| Anticoagulantes | Heparina | Warfanina |
| Antiarrítmicos | SotalolProcainamida | Amiodarona |
| Otros | Digitálicos | DigitálicosEspironolactona |
Debido a que los IECA y los antagonistas de receptores de angiotensina-ii están contraindicados en el embarazo, la combinación de hidralazina y nitratos es el tratamiento vasodilatador por vía oral de elección para el tratamiento de la insuficiencia cardiaca sistólica crónica durante el embarazo. Es aconsejable el uso de diuréticos para el alivio sintomático de la congestión pulmonar. Los betabloqueantes también son un componente importante del régimen de tratamiento crónico para los pacientes con insuficiencia cardiaca por disfunción sistólica.
Aunque los datos son limitados, se sugiere la anticoagulación en aquellas pacientes que presentan un trombo intracardiaco o evidencia de embolia sistémica. Sin embargo, algunos expertos prefieren anticoagular directamente a aquellas pacientes con disfunción sistólica severa del ventrículo izquierdo. La fibrilación auricular se produce ocasionalmente en pacientes con miocardiopatía periparto, en cuyo caso serían indicativas de tratamiento con fármacos antiarrítimicos.
Las pacientes con insuficiencia cardiaca aguda sistólica con un estado de bajo gasto y/o edema pulmonar persistente a pesar de oxígeno, diuréticos y vasodilatadores pueden beneficiarse del apoyo inotrópico por vía intravenosa (dobutamina, dopamina, milrinona). Ese apoyo debe iniciarse tan pronto como sea necesario y se retirará tan pronto como la perfusión de órganos y/o el edema pulmonar mejoren6.
Las pacientes que no responden a la terapia convencional requerirán un soporte mecánico (dispositivo de asistencia biventricular) que se mantiene generalmente hasta que mejora la función cardiaca (puente a la recuperación) o hasta que la paciente se someta a un trasplante de corazón (puente al trasplante). Informes recientes demuestran que la tasa de trasplante varía de 4 a 23%, con una excelente supervivencia postrasplante4.
Se están desarrollando estudios para entender el mecanismo etiológico de la miocardiopatía periparto y desarrollar nuevos tratamientos. Las terapias experimentales que se están investigando actualmente se basan en el uso de:
- 1.
La bromocriptina: se ha observado respuesta beneficiosa al tratamiento con bromocriptina en pacientes con miocardiopatía periparto12. Sin embargo, los datos disponibles son insuficientes para recomendar su uso rutinario. En el caso de nuestra paciente, se decidió el uso de bromocriptina para inhibir la lactancia en lugar de cabergolina.
- 2.
Inmunosupresores: aunque el tratamiento inmunosupresor ha sido utilizado en pacientes con miocardiopatía periparto y miocarditis comprobada por biopsia, su eficacia no está clara13.
- 3.
Inmunoglobulina por vía intravenosa: se ha intentado en pacientes con miocarditis o de reciente aparición miocardiopatía dilatada, sin evidencia clara de beneficio clínico14.
Existen pocos datos disponibles acerca del momento y la vía del parto en pacientes con miocardiopatía periparto. Las decisiones deben ser tomadas por un equipo multidisciplinario, incluyendo especialistas en cardiología, obstetricia, anestesia y pediatría, para facilitar una adecuada intervención.
En las mujeres que desarrollan insuficiencia cardiaca severa, se sugiere finalizar gestación de forma temprana por indicación cardiovascular materna. Se prefiere el parto por cesárea electiva en las mujeres que requieren tratamiento inotrópico o soporte circulatorio mecánico, pudiendo ser necesario finalizar el embarazo de manera urgente en mujeres que presenten inestabilidad hemodinámica6,15.
Para el resto de las mujeres, los riesgos y los beneficios de un parto prematuro deben ser considerados y discutidos con la paciente. La Sociedad Europea de Cardiología en 20106 informó que no es necesario un parto antes de tiempo si las condiciones maternas y fetales son estables. Sin embargo, deben tenerse en cuenta las cuestiones específicas de la paciente, incluyendo la edad gestacional, las condiciones cervicales, el estado fetal y el potencial impacto cardiovascular.
Algunos expertos sugieren que la lactancia materna debe evitarse debido a los posibles efectos de la prolactina. Sin embargo, en un estudio diseñado para examinar predictores de recuperación ventricular encontró que en 37 de 55 pacientes que optaron la lactancia materna ninguna presentó efectos adversos y que la tasa de recuperación de la función ventricular izquierda fue significativamente mayor en las mujeres en periodo de lactancia16. Por esta razón, algunos autores recomiendan que las mujeres que están clínicamente estables no deberían inhibir la lactancia materna siempre que sea compatible con sus medicamentos para la insuficiencia cardiaca.
PronósticoTradicionalmente, se han descrito tasas de mortalidad materna de hasta el 25% debido a la miocardiopatía periparto1,2. Sin embargo, investigaciones recientes afirman que los resultados de la miocardiopatía periparto han mejorado, con tasas de supervivencia de hasta el 90 y el 95% tras la introducción del dispositivo mecánico y trasplante cardiaco.
De las pacientes que sobreviven, se han observado tasas de recuperación de la función ventricular en un 54% de los casos. En la mayoría de los estudios, la recuperación de la función del ventrículo izquierdo ocurre durante los 6 primeros meses tras el diagnóstico.
El riesgo de recurrencia en un embarazo posterior5 depende de la FEVI en el momento del diagnóstico y de la recuperación posterior de la función cardiaca.
Las mujeres con FEVI ≤ 25% en el momento del diagnóstico o disfunción persistente del ventrículo izquierdo tienen un alto riesgo de insuficiencia cardiaca recurrente, por lo que se debe aconsejar evitar futuros embarazos. Se pueden utilizar métodos de anticoncepción hormonal no estrogénicos (por el riesgo de tromboembolismo), como el implante de etonogestrel, el dispositivo intrauterino (DIU) de cobre o el DIU liberador de levonorgestrel. También se pueden someter a métodos de esterilización definitiva tanto la paciente como su pareja.
Por último, y como ocurrió el caso de nuestra paciente, aquellas con FEVI > 25% al momento del diagnóstico o con función cardiaca recuperada, el riesgo de recurrencia en embarazos posteriores es mucho menor, pero es más elevado que en la población general. Estos pacientes deben recibir asesoramiento e información acerca de los posibles riesgos y seguimiento exhaustivo en caso de embarazo.
Responsabilidades éticasProtección de personas y animalesLos autores declaran que para esta investigación no se han realizado experimentos en seres humanos ni en animales.
Confidencialidad de los datosLos autores declaran que han seguido los protocolos de su centro de trabajo sobre la publicación de datos de pacientes.
Derecho a la privacidad y consentimiento informadoLos autores han obtenido el consentimiento informado de los pacientes y/o sujetos referidos en el artículo. Este documento obra en poder del autor de correspondencia.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.