La concurrencia de miomas uterinos en la gestación es del 0,3-2,6%, aun menor en el caso de la leiomiomatosis múltiple, e implica complicaciones obstétricas y sistémicas en la gestante. La cesárea más histerectomía programada es un procedimiento que no aumenta la morbimortalidad materna y disminuye las posibles complicaciones puerperales. Exponemos los casos de 2 pacientes, con gestaciones a término y con indicación obstétrica de cesárea e indicación ginecológica de histerectomía. En ambas se practicaron las 2 intervenciones en un mismo acto quirúrgico. Las pacientes no presentaron ningún tipo de complicación postoperatoria y el tiempo de estancia hospitalaria total se vio reducido al 50%.
The prevalence of leiomyomas in pregnant women ranges from 0.3 to 2.6% while that of multiple uterine leiomyomatosis is even lower. These myomas provoke obstetric and systemic complications in pregnant women. Planned cesarean hysterectomy does not increase maternal morbidity and mortality rates and reduces puerperal complications. We present two cases of pregnant women at term with an obstetric indication for cesarean section and a gynecological indication for hysterectomy. Both procedures were performed in the same intervention. There were no postoperative complications and hospital stay was reduced by 50%.
Los miomas uterinos son la patología tumoral benigna más frecuente durante la edad reproductiva de la mujer y cursa de forma asintomática hasta un 80%1,2. La concurrencia de miomas uterinos en la gestación es del 0,3-2,6%3,4, pero la leiomiomatosis múltiple con grandes miomas es más infrecuente (0,02%), si bien es cierto que esta frecuencia puede incrementarse en los últimos años por el aumento de la edad materna.
Las complicaciones que pueden provocar de forma general los miomas durante la gestación (amenaza de parto prematuro, desprendimiento de placenta, presentaciones fetales anómalas, obstrucciones del tracto urinario, neuropatía, algias por degeneración roja…), así como en el puerperio (principalmente, hemorragias anemizantes, cuadros de abdomen agudo secundarios a la necrosis de los grandes miomas…), si bien esto ocurre con muy poca frecuencia, en torno al 1,4%5. El manejo de esta afección durante el embarazo ha sido clásicamente conservador, dado el bajo número de complicaciones. No obstante, todas estas complicaciones pueden aumentar conforme aumentan el número y el tamaño de los miomas6 y ello nos puede plantear otra conducta obstétrica en estas gestaciones.
CASOS CLÍNICOSCaso 1Paciente primigesta, de 42 años, sin antecedentes de interés, salvo esterilidad primaria de 10 años de evolución no estudiada, sin controles ginecológicos. La actual gestación es espontánea y la paciente fue diagnosticada de útero polimiomatoso en la ecografía de la semana 12. En su semana 26 de gestación fue remitida a nuestro centro por sospecha de hematoma retroamniótico de más de 100mm de diámetro máximo. A la exploración las constantes eran normales y no refería dinámica ni aumento del tono uterino y presenta una genitorragia mayor que regla. La ecografía muestra una placenta posterior y lateral izquierda con borde inferior cerca de cuello sin cubrirlo, sin signos de hematoma ni desprendimiento. El útero presenta múltiples miomas, dos de ellos previos a la presentación, de 68 × 50mm y de 58 × 57mm, otro lateral de 53 × 27mm y uno fúndico de 165 × 117mm, con aspecto de degeneración, todos ellos intramurales. La biometría fetal correspondía a la edad gestacional. La cantidad de líquido amniótico era normal y los índices flujométricos de la arteria umbilical (AU) estaban en un percentil 50. La longitud cervical era de 42mm y el cérvix está cerrado y formado. El cardiotocograma no evidenció alteración de la frecuencia cardíaca fetal (FCF), pero sí dinámica regular cada 12min, no percibida por la paciente. La analítica al ingreso era normal, excepto por una anemia con una hemoglobina de 10,5g/dl, 34,4% de hematocrito, VCM de 77,5fl, HCM de 23,6pg y CHCM del 30,5%. Se pautaron 2 dosis de corticoides y se inhibió la dinámica con 10mg de nifedipino por vía oral. La evolución posterior de la paciente es satisfactoria con ausencia de genitorragia o dinámica. El tratamiento diario de mantenimiento constó de nifedipino 60mg de liberación mantenida, 400mg de progesterona natural micronizada por vía vaginal, 5mg de ácido fólico y 160mg de sulfato ferroso. La paciente presentaba una buena evolución clínica y analítica. En los controles ecográficos sucesivos se evidenció un crecimiento del mioma fúndico que llegó a alcanzar los 200mm, un hematoma retroamniótico organizado de 36 × 57 × 38mm y un cambio de la presentación a transversa dorsoinferior. La analítica previa a la cesárea mostró una hemoglobina de 11,7g/dl y un hematocrito de 36,7%.
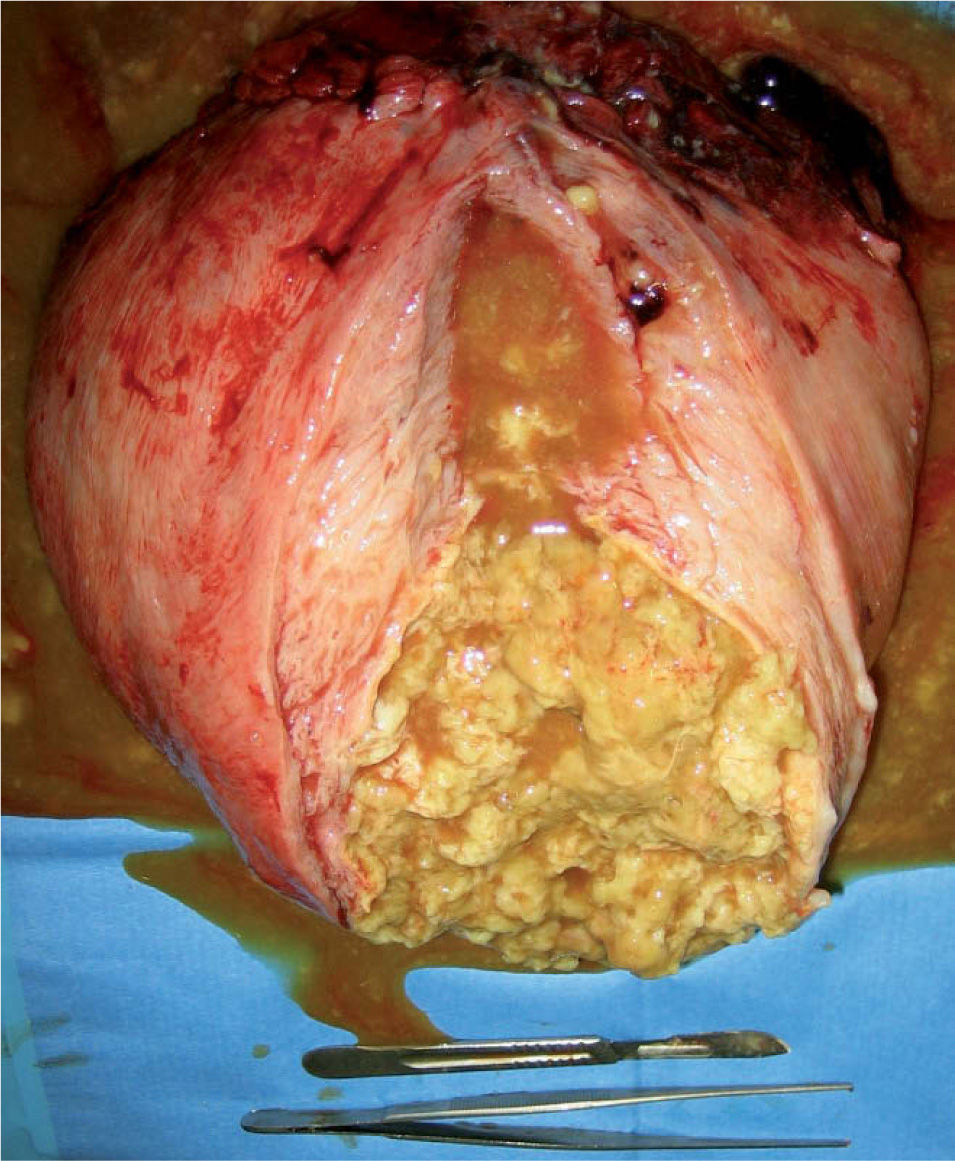
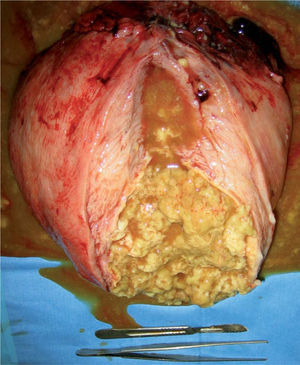
La paciente expresó su deseo de no tener descendencia posterior, por lo que se indicó cesárea más histerectomía subtotal en la semana 36 por presentación transversa, mioma en segmento y útero polimiomatoso con mioma gigante; se extrajo un recién nacido varón, de 2.650g, una puntuación en la prueba de Apgar 6/10 pHa = 7,30 y pHv= 7,32, líquido amniótico claro y placenta de 600g. El peso de la pieza extirpada fue de 5.200g (fig. 1). Tres días después de la operación, la hemoglobina era de 10,1g/dl y el hematocrito de 31,7%. La paciente fue dada de alta a los 4 días. A los 2 meses, la evolución era satisfactoria. El resultado de la anatomía patológica fue de leiomiomatosis múltiple y degeneración grasa del mioma mayor.
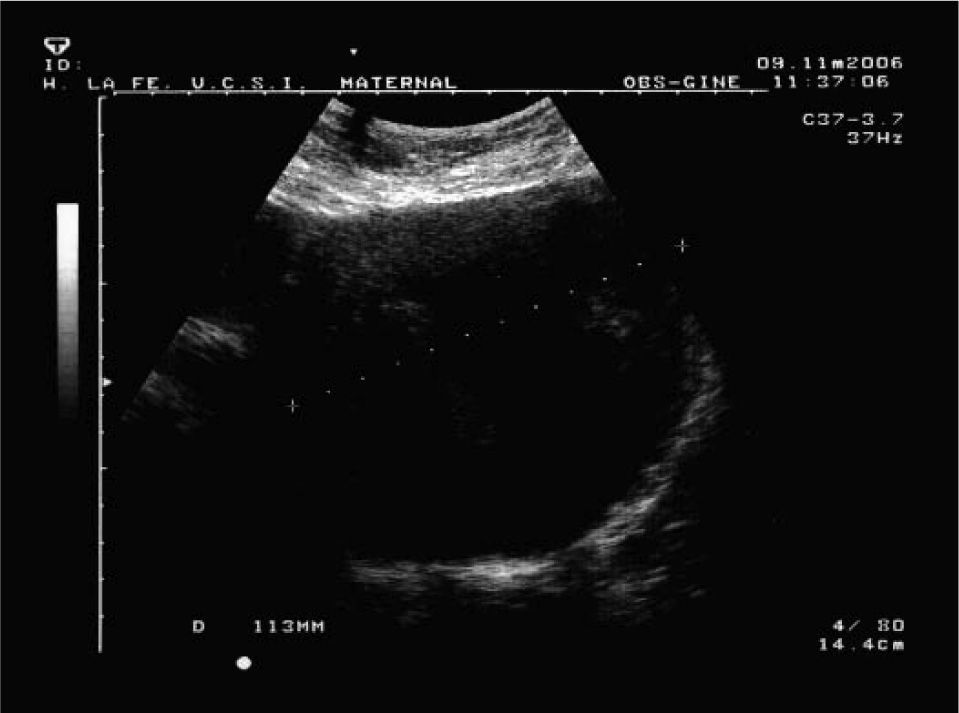
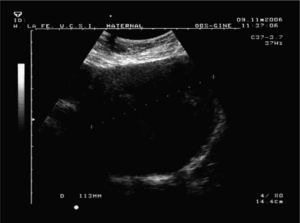
Caso 2Paciente de 38 años, que cursa su segunda gestación, con antecedentes personales de miomectomía laparotómica 7 años antes, en la que se extirparon 8 miomas intramurales. Su primera gestación fue espontánea y terminó en un aborto diferido. La actual gestación también es espontánea y en la semana 33 ingresó debido a una rotura prematura de membranas (RPM). El curso de la gestación había sido normal, excepto por una diabetes gestacional diagnosticada en semana 26 y que estaba siendo bien controlada con dieta. Las constantes eran normales, había ausencia de dinámica clínicamente evidenciable y un Bishop de 0; el líquido amniótico era claro y fluía espontáneamente. La ecografía mostró una placenta anterior media, sin signos de hematoma ni desprendimiento. El útero presentaba múltiples miomas en la cara anterior; 4 de ellos estaban situados en zona media (de 44 × 44mm) y otro previo a la presentación, en el segmento uterino, de 113mm de diámetro (fig. 2), todos ellos intramurales. La FCF era normal y la biometría correspondía a la edad gestacional, con un peso estimado de 2.285-2.085g (Hadlock1-Shepard); se evidenció un oligoamnios moderado y los índices flujométricos de la AU y la ACM se encontraban en un percentil 90. La longitud cervical era difícilmente valorable porque el cuello estaba desplazado por el mioma del segmento. El cardiotocograma no evidenció alteración de la FCF ni dinámica uterina. La analítica al ingreso (bioquímica, hemograma, hemostasia) mostró: 12.700 leucocitos/μl, hemoglobina de 11,1g/dl, hematocrito de 35,6% y el resto de los parámetros dentro de los rangos de la normalidad. Se ingresó a la paciente y se inició el protocolo de RPM con toma de cultivos y PCR semanales, antibioprofilaxis inicial con eritromicina y maduración pulmonar. En la ecografía practicada en la semana 34 se evidenció anhidramnios, con el resto de los parámetros biométricos y flujométricos normales. En el cultivo cervical realizado esa misma semana se aisló Klebsiella pneumoniae, Pseudomonas aeruginosa y Haemophilus influenzae, que se interpretó como contaminación. La PCR y el hemograma permanecieron normales en todo momento. La analítica previa a la cesárea mostró una hemoglobina de 11,7g/dl y un hematocrito de 36,9%. Los leucocitos eran de 10.800/μl.
La paciente expresó su deseo de no tener descendencia posterior por lo que en la semana 36 se indicó cesárea e histerectomía por RPM de larga evolución, partes blandas desfavorables, miomectomía múltiple previa y útero polimiomatoso. Se extrajo un recién nacido varón, de 2.650g, una puntuación en la prueba de Apgar de 8/10, pHa 7,32 y pHv 7,38, líquido amniótico claro y escaso, y placenta de 690g. La anestesia fue raquídea. Dos días después de la operación, la hemoglobina era de 10,3g/dl y el hematocrito de 32,8%. La paciente fue dada de alta a los 4 días. Al mes, la evolución era satisfactoria. La anatomía patológica informó la pieza como útero polimiomatoso.
DISCUSIÓNLos miomas uterinos poseen receptores tanto de estrógenos como de progesterona7, por lo que clásicamente se ha postulado que el embarazo acelera su crecimiento, especialmente durante el primer trimestre3. En los últimos años se han publicado trabajos que cuestionan esta afirmación. Algunos, como el de Aarón et al8, no encuentran crecimiento del mioma en ningún momento. Winter-Muram et al9 no observan cambios en el tamaño del mioma en 82 de sus 86 pacientes estudiados y Neiger et al10 encontraron un ligero aumento en el primer trimestre y una disminución en el puerperio, pero estos cambios no son significativos respecto a la talla inicial. Otros autores, como Lev-Toaff et al6 o Rosati et al3, en cambio, encuentran aumentos significativos, entre un 31,6 y un 50% de los pacientes. Lo que sí se observa en todos los estudios es que los miomas más grandes son los que menos cambian de tamaño durante el embarazo. Esto podría explicarse por un mecanismo de regulación negativa sobre los receptores estrogénicos ejercido por la alta concentración de estrógenos durante el embarazo11. En cualquier caso, los estudios ecográficos de los miomas durante el embarazo presentan una serie de sesgos que hay que tener en cuenta, tales como el escaso número de pacientes, la inclusión de pacientes sintomáticas cuyo dolor refleja un crecimiento más rápido del tumor, cambios de forma del mioma e identificación de cada tumor cuando éstos son múltiples o hay sombras proyectadas por la propia gestación, principalmente sobre miomas situados en la cara posterior.
Clásicamente, se han descrito múltiples complicaciones durante la gestación, asociadas a la existencia de miomas durante ésta. Existe cierto consenso sobre la relación de esas complicaciones y la situación de los miomas, especialmente respecto a la placenta, así como el número o el tamaño de éstos5. Se han publicado numerosos estudios al respecto; no obstante, son frecuentes la aparición de distintos sesgos en esos estudios. Uno de los más rigurosos realizados hasta el momento es el llevado a cabo por Coronado et al12. Al igual que otros estudios, los autores evidencian un aumento de la frecuencia de abruptio placentae (odds ratio [OR] = 3,87; intervalo de confianza [IC] del 95%, 1,63-9,17), sangrado en el primer trimestre (OR = 1,82; IC del 95%, 1,05-3,20), trabajo de parto disfuncional (OR = 1,85; IC del 95%, 1,26-2,72), presentación de nalgas (OR = 3,98; IC del 95%, 3,07-5,16), rotura prematura de membranas (OR = 1,79; IC del 95%, 1,20-2,69), polihidramnios (OR = 2,44; IC del 95%, 1,02-5,84), parto pretérmino (OR = 1,47; IC del 95%, 1,16-1,87), recién nacidos de bajo peso (OR = 1,99; IC del 95%, 1,51-2,62), puntuación en la prueba de Apgar a los 5min inferior a 7 (OR = 2,49; IC del 95%, 1,49-4,15) y terminación de la gestación mediante cesárea (OR = 6,39; IC del 95%, 5,46-7,50). Este último punto puede estar relativamente sesgado por el hecho de la detección en la cesárea de miomas asintomáticos durante la gestación. Nuestras pacientes presentaron RPM pretérmino y una placenta previa marginal, lo que obligó a un ingreso prolongado. En el caso clínico número uno, pese a no cumplir los criterios de APP, especialmente en lo que a modificación cervical se refiere, presentaba una dinámica uterina marcada que se acompañaba de sangrado igual a regla. Tras comprobar la situación placentaria por ecografía y el bienestar fetal decidimos, iniciar una tocólisis con el fin de parar el sangrado, todo ello bajo un estricto control clínico y cardiotocográfico. La utilización de nifedipino y progesterona para tal fin se realizó sobre la base de los datos publicados en la literatura científica13-15. El uso de tocólisis de mantenimiento se realizó con el fin de disminuir la frecuencia e intensidad de las contracciones, pues éstas se asociaban a sangrado en todo momento y no con fines profilácticos respecto a una APP16.
El manejo de los miomas durante la gestación es conservador debido a que la mayoría corresponde a hallazgos ecográficos que cursan de forma asintomática4. Si hay clínica presente, y ésta no es controlable de otra forma (especialmente el dolor), puede ser necesario un abordaje anteparto. Si bien es un procedimiento que puede realizarse con éxito en pacientes seleccionadas17-19 no está exento de un aumento de morbilidad19,20. En nuestro centro, no somos partidarios de la miomectomía gestacional.
Respecto a la conducta obstétrica para la finalización de la gestación, si es por vía vaginal el manejo del mioma es diferido. El manejo poscesárea de los miomas, especialmente de aquellos de gran tamaño, es controvertido: hay autores que abogan por un manejo diferido de los miomas, a menos que éstos sean pediculados18, debido al aumento de morbilidad que supone la miomectomía poscesárea, mientras que otros no evidencian ese aumento21. En el caso de pacientes con características similares a las nuestras, la exéresis del mioma en el momento de la cesárea comporta un gran riesgo hemorrágico debido al gran tamaño, situación y alta vascularización del lecho quirúrgico. Otra opción útil, cuando se quiere realizar un manejo conservador, para disminuir las complicaciones poscesárea de los miomas, así como para reducir su tamaño, es la ligadura de las arterias uterinas. Este procedimiento ha demostrado su eficacia en cuanto a la disminución de pérdidas hemáticas, reducción postoperatoria del tamaño de los miomas y disminución de la necesidad de cirugía posterior, sin comprometer la fecundidad posterior22.
También hay autores que en pacientes con deseos genésicos ya cumplidos, y en presencia de una indicación ginecológica de histerectomía junto con una indicación obstétrica de cesárea, propugnan por una histerectomía programada en el momento de la cesárea23. Esta actitud no implicaría un aumento de la pérdida hemática, riesgo infeccioso o lesiones de órganos adyacentes, a diferencia de la histerectomía poscesárea en una situación de emergencia, en cambio representa una reducción del coste y el tiempo de hospitalización respecto a dos operaciones separadas, con mayor satisfacción para la paciente al evitar una segunda intervención. En nuestras pacientes, la caída de la hemoglobina fue de 1,4 y 1,6g/dl, cantidad similar a la de una cesárea. En el caso concreto de los miomas gigantes, esta opción también nos permite disminuir la tasa de complicaciones puerperales, como es la pérdida hemática o los cuadros dolor y de abdomen agudo postoperatorio24. La presencia de madres primigestas en la cuarta década de la vida hará aumentar estos casos en nuestro quehacer diario y un buen planteamiento como solución del problema es la cesárea asociada a histerectomía, que es una decisión que debe tomarse junto con la paciente tras haber informado de las opciones posibles.