PROGRESOS
DE OBSTETRICIA
Y GINECOLOGÍA
Volumen 41
Número 2
Marzo 1998
REVISIÓN DE CONJUNTOP. Viscasillas
Miomectomía histeroscópica y fertilidadServicio de Ginecología y Obstetricia
Hospital de Sant Pau
Barcelona
Correspondencia:
P. Viscasillas
Servicio de Ginecología y Obstetricia
Hospital de Sant Pau
Av. Sant Antoni M.ª Claret, 167
08025 Barcelona
Histeroscopic myomectomy and fertilityViscasillas, P. Miomectomía histeroscópica y fertilidad. Prog Obstet Ginecol 1998;41:77-87Aceptado para publicación 16/7/97RESUMEN
Existen tres técnicas histeroscópicas para el tratamiento de los miomas. La histeroscopia quirúrgica convencional con tijeras, la resectoscopia y la histeroscopia quirúrgica mediante laser. No parecen existir diferencias entre ellas en cuanto a eficacia, si bien la resectoscopia es la más frecuentemente empleada. El porcentaje de gestaciones en las pacientes estériles tratadas histeroscópicamente de miomas es de 59% y el 75% de las gestaciones finalizan permitiendo la obtención de un hijo vivo. La tasa de complicaciones inmediatas es de un 2%. Parece pues aconsejable tratar histeroscópicamente los miomas submucosos de las pacientes estériles.
PALABRAS CLAVE
Mioma submucoso; Cirugía histeroscópica; Resectoscopia; Miomectomía; Esterilidad.
ABSTRACT
There are three modalities of histeroscopic surgery to treat the submucous myoma: Scisors, resectors and lasers. It seems that the efficacy of all of them are similar but the resector is more expanded. After these kind of surgery the pregnancy rate in the group of infertile patients is 59% and 75% of the pregnancies end with a live baby. The rate of complications is 2%. Histeroscopic surgery of the submucous myoma is recommanded in the infertile patient
KEY WORDS
Submucous myoma; Histeroscopic surgery; Resectoscopy; Myomectomy; Infertility.
HISTORIA
La intervención clásica para tratar los miomas, en las pacientes que no renuncian a una gestación, ha sido la miomectomía por vía laparotómica. La primera miomectomía se atribuye a Amussta en París en 1842 (1), pero los principios quirúrgicos de la miomectomía laparotómica actual los propuso Alexander en 1898 (2) y Bonney, quien en 1946, publicó más de 800 miomectomías efectuadas por él personalmente en Londres (3). Para efectuar una miomectomía de un mioma submucoso, se empleaba una incisión en la línea media uterina, ya que es la zona del útero menos vascularizada, y en la cara anterior, ya que es más improbable que genere adherencias entre el útero y los anejos, y además puede peritonizarse más fácilmente con el peritoneo vesical. De hecho Bonney, al no disponer de los métodos diagnósticos actuales, abría sistemáticamente la cavidad endometrial de esta forma en busca de miomas submucosos y, acostumbrado a esta incisión, incluso la recomendaba para extirpar los miomas de la cara posterior uterina. Los resultados publicados sobre la miomectomía laparotómica para tratar los miomas submucosos no son desfavorables, sin embargo teóricamente la incisión de la cavidad uterina puede comprometer un futuro embarazo (4), promover que termine en cesárea y favorecer las adherencias postcirugía (5).
El primer intento de tratar una tumoración de la cavidad uterina mediante el histeroscopio se atribuye a Pantaleoni (6), quien en 1869 diagnosticó una «vegetación poliposa» en el fondo uterino, la cual trató mediante una sustancia cáustica introducida a través de la vaina del histeroscopio y manifestó: «este nuevo sistema permite tanto la exploración como la cura de las lesiones». Duplay y Clado (7) escribieron en 1898 un libro de 225 páginas sobre histeroscopia en el cual había una pequeña sección que incluía la biopsia, la extracción de cuerpos extraños, la polipectomía y la fragmentación de fibromas.
Actualmente se efectúan miomectomías por vía histeroscópica mediante el resectoscopio o bien con tijeras o con láser, introducidos a través del canal operatorio de un histeroscopio quirúrgico. Los primeros que sugirieron el uso de un resectoscopio para el tratamiento de los miomas, fueron Norment y colaboradores (8), pero las primeras resectoscopias de miomas fueron comunicadas por Neuwirth en 1978 (9). En 1984 Deutschmann y Lueken (10) publicaron su casuística con el empleo de tijeras en pacientes postmenopáusicas y Donnez, en el mismo año, la suya basada en la utilización del láser de neodinio-YAG (11). La técnica más común es la resectoscopia y en menor medida el láser y las tijeras.
TÉCNICAS HISTEROSCÓPICAS
Histeroscopia quirúrgica convencional con tijeras
Se precisa un histeroscopio con un canal operatorio que permita el uso de tijeras. El medio de distensión utilizado puede ser el CO2 o bien preferentemente un medio líquido, ya que éste lava mejor la cavidad endometrial.
Esta opción puede aplicarse sólo a los miomas pequeños pediculados, y de localización favorable, ya que si son de implantación fúndica, la sección del pedículo puede ser difícil, al hallarse éste en un plano paralelo al de la tijera. La técnica consiste en seccionar el pedículo con la tijera y luego extraer la tumoración con una pinza, que puede retirarse del útero conjuntamente con el histeroscopio. Si la tumoración es grande, será difícil o imposible de extraer, pues aunque se consiga seccionar el pedículo, luego, una vez libre, no podrá fragmentarse ni extirparse intacta, aunque podría expulsarse espontáneamente, pero también es posible que la tumoración ya libre, pero en contacto con la pared uterina, se revascularice y se implante de nuevo en otro lugar (12).
Resectoscopia
El resectoscopio es un instrumento de cirugía urológica que ha sido adoptado por los ginecólogos. Permite una resección de los miomas submucosos, incluso si son sésiles o de gran tamaño, mediante un asa que no es más que el electrodo activo de un circuito de corriente monopolar generada por una unidad electroquirúrgica. Dicha asa tiene forma de U, y un diámetro de sección que suele ser de unos 4 mm, se conecta a una cánula móvil, desplazable por una empuñadura, dentro de la cual se monta una óptica histeroscópica de 0 grados o mejor de visión oblicua. Por fuera se acoplan dos vainas que permiten un doble circuito de líquidos, uno interno para la irrigación y otro externo para la recuperación de los fluidos, permitiendo así una buena distensión de la cavidad uterina y un buen lavado de la misma, favoreciendo la cirugía a pesar de que puedan producirse hemorragias. Existen resectoscopios de varios calibres oscilando entre los 6 y los 9 mm de diámetro.
Los medios de distensión idóneos son líquidos no electrolíticos no conductores de la corriente eléctrica y permiten, por tanto, la electrocirugía. El más utilizado es la glicina al 1,5%. Pueden administrarse por la simple acción de la gravedad, pero lo ideal es disponer de una bomba que permita regular la irrigación y además disponga de un mecanismo de seguridad que detenga el flujo si la presión aumenta excesivamente (13).
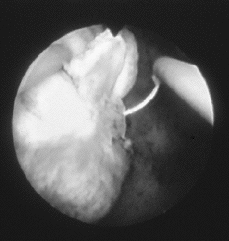
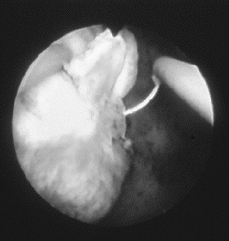
La técnica de la resectoscopia precisa anestesia paracervical, peridural o general y habitualmente dilatación del orificio cervical interno. Después de inspeccionar la cavidad uterina se cauterizan los vasos superficiales del mioma con una corriente de coagulación de 50-70 W y seguidamente se procede a la resección metódica del mioma, comenzando por la parte más prominente, y desplazando el asa, siempre desde el fondo uterino hasta el cérvix para un mejor control. Se elegirá la mínima corriente de corte que permita un paso fácil del asa, lo cual corresponde a 50-120 W. Si hay que efectuar hemostasia de algún vaso sangrante, se recurre de nuevo a la corriente de coagulación. Los fragmentos se pueden evacuar al exterior uno a uno con el asa, o bien al finalizar la intervención, al retirar el histeroscopio, pudiendo emplearse un aspirador o una legra (Fig. 1).
Si el mioma es sésil y por tanto una porción del mismo es intramural, puede resecarse la porción que hace relieve dentro de la cavidad endometrial. Se ha observado que el endometrio puede recubrir aposteriori la superficie seccionada del mioma restante (14), pero también puede ocurrir que se necrose y también es posible que siga desarrollándose, es por ello que hay autores que prefieren la resección total de los miomas sésiles cuando la porción intramural no es superior a la submucosa, ya que en estos casos se ha descrito que, a medida que avanza la resección de la porción submucosa, la porción intramural va sobresaliendo hacia la cavidad por la contracción del miometrio facilitando la resección completa del tumor (15). Hallez da un paso más y propugna el tratar incluso a los miomas que de forma mayoritaria se hallan dentro del miometrio, es decir, que a diferencia de los otros, el relieve endouterino forma un ángulo obtuso con la superficie endometrial. Para ello reseca la porción del miometrio que cubre internamente el mioma, y luego la parte interna del mismo que es accesible al asa, creando un cráter, y acto seguido retira el resectoscopio y mediante un tacto vagino-abdominal, ejerce una presión digital con la mano izquierda sobre el mioma, el cual reduce algo sus dimensiones debido al cráter que se ha efectuado, y se desplaza hacia la cavidad uterina haciéndolo accesible a una resección más segura que se efectuará después (16). Este autor nunca ha podido comprobar una buena epitelización endometrial de un mioma resecado parcialmente y en el caso de que la última técnica descrita resulte difícil o peligrosa es más partidario de efectuar una miomectomía laparotómica clásica que una histeroscopia incompleta. Habitualmente, durante la resección se puede distinguir dónde acaba el mioma y donde empieza el endometrio, ya que el endometrio es más rosado y vascularizado. Cuando la miomectomía histeroscópica es completa, la herida quirúrgica se recubre primero de una capa de fibrina y a los dos meses máximo ya está tapizada por el endometrio que ha proliferado centrípetamente.
Láser
Diversos tipos de láser se han empleado en histeroscopia quirúrgica. El Kriptón, el argón y el Nd-YAG. El Nd-YAG ha sido el más difundido, pero sólo conocemos una publicación que recoja resultados sobre el tratamiento de los miomas submucosos con láser por vía histeroscópica (11). El láser de CO2 no resulta adecuado para la histeroscopia quirúrgica porque su energía se absorbe por los fluidos, lo que obligaría a utilizar gas como medio de distensión, pero el gas no lava la cavidad uterina y el humo que se crea enturbiaría la visión. Los láseres empleados en histeroscopia se transmiten por fibras de cuarzo que se introducen a través del canal operatorio del histeroscopio siendo conveniente que éste tenga un deflector para dirigir adecuadamente el haz de energía lumínica al punto de impacto. La potencia de salida adecuada es de 80 W, aproximadamente.
Se han descrito dos técnicas de cirugía histeroscópica con Nd-YAG: la de contacto y la de no contacto (17,18), y ambas son usadas en las miomectomías. Se puede tratar el pedículo de los miomas separando la fibra del láser unos milímetros de su superficie, de esta forma se consigue un efecto de coagulación que puede llegar hasta unos 7 mm de profundidad. Para la disección del mioma se emplea la técnica de contacto. En los casos, en que la mayor parte del mioma se halla dentro del miometrio, Donnez y cols. proponen un abordaje en dos tiempos (11): después de un tratamiento de ocho semanas con análogos del Gn-RH, se efectúa una miomectomía parcial resecando la porción más protuberante del mioma y después se dispara repetidamente el laser, lo más perpendicularmente posible al mioma intramural restante, en varios puntos, avanzando con la fibra una distancia de 5-10 mm y consiguiendo así una coagulación en profundidad con la finalidad de disminuir la vascularización. Una segunda cirugía se realiza después de otras ocho semanas de tratamiento con análogos. El mioma, entonces, es blanquecino, hace relieve en la cavidad y se puede disecar de forma completa. El mioma es abandonado en la cavidad uterina, y los autores creen que se necrosa, y probablemente se expulsa, espontáneamente durante la menstruación siguiente, ya que en ningún caso han hallado restos de mioma en los controles histeroscópicos efectuados ambulatoriamente después de la intervención de un total de 60 pacientes. Los miomas pequeños podrían vaporizarse totalmente con la técnica de contacto, pero esta técnica es lenta y no permite el estudio histológico de la pieza.
TRATAMIENTOS FARMACOLÓGICOS ASOCIADOS
El tratamiento médico previo a la cirugía influye decisiva y positivamente en ésta. Los análogos de la Gn-RH son los que mejor y más frecuentemente desempeñan esta misión. Dichos agentes terapéuticos derivan de la hormona hipotalámica LH-RH al cambiar los péptidos 6 y 10 de su estructura de aminoácidos y son 40-200 veces más potentes que la LH-RH nativa ya que los cambios mencionados confieren una mayor afinidad para los receptores LH-RH hipofisarios y una mayor resistencia a la degradación proteolítica (19).
Al inicio de la administración de los análogos, suben los niveles de gonadotrofinas y la concentración de los esteroides sexuales, pero, si prosigue la administración, se suprime el eje hipofiso-ovárico induciéndose un estado pseudomenopáusico (20). Existen preparados de depósito que permiten una administración mensual. Los efectos secundarios de un tratamiento prolongado con estas drogas son debidos al estado hipoestrogénico que producen y son generalmente bien tolerados. La peor secuela es la osteoporosis, pero sólo se produce a partir de los seis meses de tratamiento (21). Filicori (22) fue el primero en publicar la acción de los análogos reduciendo el volumen de los miomas. La regresión suele corresponder al 50% del volumen inicial y se alcanza antes de la decimosegunda semana de tratamiento dependiendo, al parecer, de la disminución del nivel estrogénico (23,24) si bien los miomas de un pequeño grupo de pacientes no responden al tratamiento probablemente porque no son estrógeno-dependientes (25). Una vez que el tratamiento con análogos se interrumpe, los fibromas vuelven a crecer invariablemente, alcanzando el tamaño original unos cuatro meses más tarde (21,23), de forma que este tratamiento no puede ser una alternativa al tratamiento quirúrgico en la paciente estéril pero sí una ayuda. Diferente es el caso de una paciente premenopáusica con contraindicación quirúrgica en la que es posible el tratamiento con análogos que se puede combinar con un tratamiento con estroprogestágenos para evitar la afectación ósea. Kessel (26), en 1988, publicó el tratamiento con análogos de 14 pacientes antes de efectuarles una miomectomía por vía laparotómica y postula que este proceder puede mejorar la fertilidad de las pacientes. El tratamiento con análogos es especialmente interesante como preparación de una miomectomía resectoscópica. La reducción del tamaño tumoral puede hacer posible la resección de los nódulos grandes, y facilitar y abreviar la de los otros, pero además se produce una atrofia endometrial, lo cual por un lado asegura una mejor visión y por otro produce una menor absorción del líquido de distensión (11,27), a lo cual también contribuye la reducción de la cavidad uterina y la reducción de la vascularización endometrial y arterial en el miometrio y en los miomas según ha podido comprobarse mediante observaciones ultrasónicas con Doppler pulsado (28), además los análogos, al evitar menometrorragias, permiten la recuperación de la hemoglobina (11), lo cual puede facilitar una donación sanguínea para una autotransfusión posterior si fuera necesario. Con todo, hay que decir que el uso de los análogos no es universal y autores con tanta experiencia como Hallez no los utilizan (16), la crítica que se les ha efectuado es que la reducción uterina que producen puede dificultar la introducción y la movilización del histeroscopio quirúrgico.
Los gestágenos también se han propuesto para involución de los fibromas, pero no se ha podido demostrar su eficacia y es posible que aumenten la vascularización pélvica (30,29). También se ha abogado por el uso del danazol, dado que reduce la vascularización de los endometriomas. Coutinho trató con gestrinona a 47 pacientes con fibromas y en el 73% obtuvo una disminución del tamaño uterino (31). Hay otras medicaciones que pueden complementar la cirugía. Los antibióticos previenen las infecciones. Dillon propuso en 1962, inyectar vasopresina en los tejidos a intervenir mediante cirugía ginecológica convencional para mitigar, mediante su efecto vasoconstrictor la hemorragia peroperatoria (32). Esta droga también se ha usado en los tratamientos histeroscópicos de los miomas y en estas circunstancias también podría dificultar la intravasación de medio de distensión. Corson y Brooks inyectan sistemáticamente a ambos lados del cérvix 5 ml de una solución de 20U de vasopresina diluidos en 40 ml de suero fisiológico (33). Los estrógenos pueden utilizarse para favorecer la proliferación del endometrio y evitar las sinequias después de la intervención, siendo los más empleados el etinilestradiol y los estrógenos conjugados equinos en tandas de dos a ocho semanas (15).
RESULTADOS
La postura de los diferentes autores que han publicado sobre el tratamiento farmacológico asociado a la cirugía histeroscópica del mioma, no siempre coincide, si bien la mayoría, al igual que nosotros, son partidarios del empleo sistemático de los análogos del Gn-RH y, eventualmente, de los estrógenos cuando se tratan miomas situados especularmente en la cara anterior y posterior del útero.
Numerosos autores han comunicado sus resultados después de efectuar miomectomías por vía abdominal en pacientes estériles. Buttram y Reiter (5) revisaron 18 publicaciones correspondientes al período comprendido entre los años 1931 y 1980, las cuales sumaban un total de 1.202 intervenciones tras las que en 480 pacientes (40%) se consiguió embarazo y en una serie de 76 pacientes en que la única causa de esterilidad era el mioma, la tasa de gestación fue del 54%. También recopilaron un total de 1.941 miomectomías en pacientes en las que se registró el porcentaje de abortos antes y después de la cirugía, siendo estas cifras, respectivamente, de 41% y 19%. Unas cifras similares obtuvo Verkauf (30) al analizar siete trabajos publicados entre los años 1983 y 1991 en los que en total se sumaban 40 miomectomías en pacientes con varios factores de esterilidad alterados y 79 en pacientes cuyo único factor de esterilidad era el mioma siendo la tasa de gestación de 50% y 59% respectivamente. En estas revisiones, los autores no contemplan la localización de los miomas extirpados y consideran conjuntamente los subserosos, los intramurales y los submucosos.
En la literatura hay dos trabajos sobre resultados del tratamiento quirúrgico no endoscópico del mioma submucoso en la paciente estéril. García y Tureck (34) y, Reyniak y Corenthal (35), expusieron sus resultados correspondientes a pacientes a quienes extirparon miomas submucosos mediante laparotomía y, de un total de 34 pacientes, resultaron 44% de gestaciones.
Varios autores han comunicado sus resultados después de efectuar miomectomías histeroscópicas y recientemente Ubaldi y colaboradores (36) han revisado la bibliografía al respecto. En la tabla 1 recogemos los porcentajes de embarazos clínicos, embarazos con feto vivo y la técnica empleada por los diversos equipos.
Hay que destacar que las series son cortas y sólo dos autores tienen más de 20 casos. La eficacia de la técnica es considerable, ya que de un total de 164 pacientes estériles tratadas con miomectomías histeroscópicas, 97 han quedado gestantes, lo que supone el 59,1%. Asimismo es notable que el 75% de los embarazos finalizan con el nacimiento de un hijo vivo. En 51 paciente el mioma era la única causa de esterilidad y de ellas 32 gestaron (62%) siendo el 55% el porcentaje de embarazos en el grupo en que existía otra patología asociada. Estos resultados sugieren que los miomas submucosos influyen negativamente en la fertilidad y parece pues razonable tratar esta patología y tambien los otros factores de esterilidad concomitantes que puedan existir. No parecen existir diferencias significativas entre las diversas técnicas quirúrgicas a pesar de que probablemente con el resector se hayan tratado miomas de mayor tamaño que con las tijeras y el láser. En la figura 2 se ven los resultados en porcentaje de gestaciones según técnicas.
En nuestro centro, hasta diciembre de 1996, hemos efectuado un total de 75 histeroscopias quirúrgicas en pacientes estériles, de ellas 15 fueron resectoscopias de miomas submucosos. No hemos efectuado el seguimiento de todos los casos pues en muchas la intervención es reciente, pero se puede destacar el que una paciente quedó gestante a los cuatro meses de la cirugía a pesar de que presentaba una esterilidad primaria de seis años y tenía, como única patología, un mioma sésil de gran tamaño, 6 cm de diámetro después de ser tratada con análogos del Gn-RH, que pudo extirparse de forma completa en un solo tiempo quirúrgico sin complicaciones.
No existen estudios que busquen factores predictivos del fracaso de la miomectomía histeroscópica en relación con la fertilidad, pero sí en relación a la sintomatología. Cravello y col. (42), en un total de 196 pacientes que consultaban por menometrorragias, comprobaron cómo el resultado anatómico de la intervención es determinante ya que hallaron diferencias estadísticamente significativas entre pacientes con cavidades normales postcirugía (6,9% de fracasos por persistencia de hemorragias) y las que tenían restos de miomas por una resección incompleta de los mismos (23,6% de fracasos). Es posible que este factor tenga también significado en la fertilidad, pero no se ha estudiado (tabla 2).
COMPLICACIONES
En la tabla 3 recogemos las complicaciones publicadas por los autores considerados en la tabla 1, correspondientes a las miomectomías histeroscópicas que han efectuado, no sólo en pacientes estériles, sino por cualquier indicación. Surgieron complicaciones en 17 intervenciones de un total de 865 lo que supone un porcentaje de un 2%. Todas pudieron corregirse, la mortalidad fue nula. Estas cifras coinciden con las de la estadística de la Asociación Americana de Ginecólogos Laparoscopistas (AAGL), que muestran un 2% de complicaciones en 14.000 histeroscopias diagnósticas (43).
La complicación más frecuente es la perforación uterina, la cual puede producirse antes de la histeroscopia al dilatar el cérvix, durante la histeroscopia o después, al evacuar los restos de mioma. La mayoría de estos traumatismos no comportan hemorragias uterinas de gravedad ni lesiones en otros órganos vecinos, si bien para evitar estos contratiempos se ha aconsejado la laparoscopia simultánea, pero dicha intervención no suele efectuarse sistemáticamente, aunque es útil al iniciarse en la cirugía histeroscópica y cuando el mioma a resecar es grande e intramural, así como también eventualmente para coagular los vasos sangrantes en las perforaciones uterinas (44). La perforación uterina es fácil de sospechar ya que la cavidad uterina se colapsa y la visión se torna hemática dentro de la cavidad endometrial. Si el histeroscopio está situado fuera de la pared uterina, se pueden ver las asas intestinales. Se aconseja retirar los instrumentos, finalizar la histeroscopia y si hay dudas de si hay una hemorragia intraabdominal, efectuar una laparoscopia y administrar antibióticos.
La intravasación en exceso de los medios de distensión, genera el síndrome de intoxicación acuosa que consiste en la asociación de hipervolemia por el paso de líquido al torrente circulatorio, hiponatremia, por dilución intravascular, hiperpotasemia por la destrucción de hematíes e hiperglucemia por el contenido en glucosa de los líquidos empleados. La hiponatremia por debajo de 130 mmol/l puede conducir a una encefalopatía que curse según el grado de la misma con irritabilidad, confusión, náuseas, cefalea, ceguera y, finalmente, coma (45). La intoxicación acuosa por los medios de distensión ocurre cuando los senos venosos del útero o del mioma se abren y el medio de distensión pasa masivamente al torrente circulatorio. Ello acaecerá dependiendo del uso de fármacos asociados (análogos Gn-RH, vasopresina), la superficie resecada, la vascularización, el tiempo empleados, la presión de irrigación elegida, la bomba de irrigación de que se disponga y la técnica del operador. Es importante efectuar un balance de líquidos y controlar rigurosamente al paciente, si se calcula que se han absorbido 1000 ml de glicina, sorbitol u otras soluciones hipo-osmolares. Cantidades inferiores de sustancias hiper-osmolares, como el dextrano de alto peso molecular, pueden producir complicaciones habiéndose descrito edema pulmonar a partir de una absorción de 175 ml en un caso de metroplastia histeroscópica (46). Las características particulares de algunos medios les confieren otros riesgos potenciales. La glicina al 1,5% puede causar encefalopatías además de por el mecanismo descrito, por propia toxicidad o por la de su catabolito, el amoniaco, que se forma al ser catabolizado en el hígado ya que ambos atraviesan la barrera hemato-encefálica, pero ello es excepcional si los controles son adecuados (47).
Ocasionalmente se han descrito shocks anafilácticos producidos por el dextrano de alto peso molecular que han sido resueltos con antihistamínicos (48). Se piensa que las pacientes pueden sensibilizarse por la ingesta de azúcares de ciertos aditivos alimentarios. Excepcionalmente se ha atribuido al dextrano una toxicidad directa sobre el capilar pulmonar y quizá una coagulopatía transitoria por liberación de tromboplastina (49), pero en estudios experimentales no ha sido posible confirmar dicha hipótesis (50) y probablemente el edema pulmonar se deba a la sobrecarga hídrica que produce el dextrano por el aumento de presión osmótica (51). El dextrano tiene propiedades anticoagulantes que podrían favorecer las hemorragias peroperatorias y se han descrito casos de coagulación intravascular diseminada asociados a su uso (52). Posiblemente actúe prolongando el tiempo de sangría al unirse a las membranas celulares del endotelio vascular y al disminuir los niveles de fibrinógeno y de los factores V, VIII y IX. El tratamiento de un shock hipervolémico incluye el uso de diuréticos (40-80 mg de furosemida por vía parenteral), ventilación asistida y corrección del desequilibrio electrolítico (52).
Las hemorragias severas son excepcionales, pero en caso de producirse, si no se pueden cohibir coagulando los vasos sangrantes, es útil colocar una sonda de Foley dentro de la cavidad uterina e hincharla con 6-30 ml de suero según el tamaño de la cavidad y retirarla al cabo de cuatro horas (53). Excepcionalmente se podrían producir complicaciones por el efecto térmico de la corriente eléctrica o del láser. Se ha publicado una quemadura intestinal con el láser de Nd-YAG sin que se hubiera producido perforación uterina durante una ablación endometrial histeroscópica (54).
Además de estas complicaciones inmediatas, se puede producir, con relativa frecuencia, una complicación tardía: la sinequias uterinas. Dicha complicación es probable que aparezca si se trata de lesiones que asientan en la cara anterior y en la cara posterior de la cavidad uterina entrando en contacto los miometrios de las 2 caras al finalizar la intervención. Los autores que efectúan histeroscopias de control, varias semanas después de hacer miomectomías histeroscópicas, han hallado sinequias en un porcentaje que oscila entre el 10 y el 24% (16,42). Para evitar esta complicación, se ha postulado el tratamiento con estrógenos ya citado anteriormente, después de la intervención para promover la proliferación del endometrio (37). Si se efectúa una histeroscopia de control al mes de la cirugía histeroscópica, es muy fácil lisar las sinequias halladas con el simple contacto con el extremo del histeroscopio diagnóstico, ya que son de tipo mucoso.
En ocasiones es preciso reintervenir a las pacientes miomectomizadas por la aparición de otras tumoraciones, pero si la exéresis ha sido completa no se trata de recidivas, sino de nuevos miomas. Hallez (16) refiere un 6,6% de reintervenciones después de haber efectuado previamente 243 miomectomias histeroscópicas completas por diversas indicaciones. La tasa de miomectomías iterativas, después de una primera intervención clásica por vía abdominal es de 6,8% (30).
RESUMEN
Existen tres técnicas histeroscópicas para el tratamiento de los miomas. La histeroscopia quirúrgica convencional con tijeras, la resectoscopia y la histeroscopia quirúrgica mediante láser. No parecen existir diferencias entre ellas en cuanto a eficacia, si bien la resectoscopia es la más frecuentemente empleada. El porcentaje de gestaciones en las pacientes estériles tratadas histeroscópicamente de miomas es de 59% y el 75% de las gestaciones finalizan permitiendo la obtención de un hijo vivo. La tasa de complicaciones inmediatas es de un 2%.
Parece pues aconsejable tratar histeroscópicamente los miomas submucosos de las pacientes estériles.
1 Babaknia A, Rock JA, Jones HW. Pregnancy success following abdominal myomectomy for infertility. Fertil Steril 1978;30: 644-7.
2 Bonney V. The techniques and results of miomectomy. Lancet 1931;222:171-7.
3 Bonney V. The technical minutiae of extended myomectomy and ovarian cystectomy. London: PB. Hoeber; 1946.
4 Berkeley AS, De Cherney AH, Polan ML. Abdominal myomectomy and subsequent fertility. Surg Gynecol Obstet 1983;156:319-22.
5 Buttram VC, Reiter RC. Uterine leiomyomata: etiology, symptomatology and management. Fertil Steril 1981;36:433-45.
6 Pantaleoni DL. On endoscopic examination of the cavity of the womb. Med Press Circ 1869;8:26-34.
7 Duplay S, Clado S. Traité D''Hysteroscopie. Rennes, Simon, 1989.
8 Norment WB, Sikes CH, Berry FX, Bird I. Hysteroscopy. En: Turcle R, ed. Surg Clin North Am Chicago 1957;1377-86.
9 Neuwirth RS. A new tecnique for and additional experience with hysteroscopic resection of submucous fibroids. Am J Obstet Gynecol 1978;131:91-4.
10 Deutschmann C, Lueken RP. Hysteroscopic findings in postmenopausal bleeding. En: Siegler AM, Lindemann HJ, ed. Hysteroscopy: Principles and practice. Philadelphia. Lippincott, 1984. p. 180.
11 Donnez J, Gillerot S, Bourgonjon D, Clerckx F, Nisolle M. Neodymium: YAG laser hysteroscopy in large submucous fibroids. Fertil Steril 1990;54:999-1003.
12 Salat-Baroux J. Comunicación personal.
13 Viscasillas P, Bordas JR, Suñol J, Saiz MJ, Pares P, Esteban Altirriba J. Histeroscopia diagnóstica y terapéutica en esterilidad. Clin Invest Gin Obst 1992;19:5,221-31.
14 Neuwirth RS. Hysteroscopic resection of submucous myomes. The cervix 1988;6:325-31.
15 Loffer F. Removal of large symptomatic intrauterine growths by the hysteroscopic resectoscope. Obstet Gynecol 1990;76:836-40.
16 Hallez JP. Single stage total hysteroscopic myomectomies: indications, techniques and results. Fertil Steril 1995;63:703-8.
17 Goldrath MH, Fuller T, Segal S. Laser photovaporization of endometrium for the traitment of menorrhagia. Am J Obstet Gynecol 1981;140:14-21.
18 Loffer FD. Hysteroscopic endometrial ablation with the Nd-YAG laser using a non-touch technique. Obstet Gynecol 1987;69:679-86.
19 McLachlan RI, Healy DL, Burger AG. Clinical aspects of LHRH analogs in gynaecology: a review. Br J Obstet Gynaecol 1986;99:200-6.
20 Fraser HM. LHRH analogues: Their clinical physiology and delivery systems. Ballieres Clin Obstet Gynaecol 1988;2:639-58.
21 Friedman AJ, Barbieri RL, Benacerraf BR, Schiff I. Treatment of leiomyomata with intramural or subcutaneus leuprolide a gonadotrophin releasing hormone agonist. Fertil Steril 1987;48:560-4.
22 Filicori M, Hall DA, Loughlin JS, Rivier J, Vale W, Crowley WF. A conservative approach to the management of uterine leiomymoma: pituitary desensitization by a luteinizing hormone-releasing hormone analogue. Am J Obstet Gynecol 1983;147:726-7.
23 Coddington CC, Collins RL, Shawker TH, Anderson R, Loriaux DL, Winkel CA. Long acting gonadotrophin hormone releasing hormone analogue used to treat uteri. Fertil Steril 1986;45:624-9.
24 Maheux R, Lemay A, Merat P. Use of intranasal luteinizing hormone releasing hormone agonist in uterine leiomyomas. Fertil Steril 1987;43:229-33.
25 Vollehoven BJ, Lawrence AS, Healy DL. Uterine fibroids: A clinical review. British Journal of Obstetrics and Gynaecology 1990;97:285-98.
26. Kessel B, Liu J, Mortola J, Berga S, Yen SSC. Treatment of uterine fibroids with agonist analogs of gonadotrophin releasing hormone. Fertil Steril 1988;49:538-41.
27 Van Boven M, Singelyn F, Donnez J, Gribomont BF. Dilutional hiponatremia associated with intrauterine endoscopic laser surgery. Anesthesiology 1989;3:71-4.
28 Matta WHM, Stabile I, Shaw RW, Campbell S. Doppler assessment of uterine blood flow changes in patients with fibroids receiving the gonadotrophin releasing hormone agonist buserelin. Fertil Steril 1988;46:1083-5.
29 Goodman AL. Progesterone therapy in uterine fibromyoma. J Clin Endocrinol Metab 1946;6:402-8.
30 Verkauf BS. Myomectomy for fertility enhancement and preservation. Fertil Steril 1992;58:1-15.
31 Coutinho EH, Boulanger GA, Gonzalves MT. Regresion of uterine leiomyomas after treatment with gestrinone an anti-oestrogen, antiprogesterone. Am J Obstet Gynecol 1986;155:761-7.
32 Dillon TF. Control of blood loss during gynecologic surgery. Obstet Gynecol 1962;19:428-35.
33 Corson SL, Brooks PG. Resectoscopic myomectomy. Fertil Steril 1991;55:1041-4.
34 García CR, Tureck RW. Submucosal leiomyomas and infertility. Fertil Steril 1984;42:16-9.
35 Reyniak JV, Corenthal L. Microsurgical laser technique for abdominal myomectomy. Microsurgery 1987;8:92-8.
36 Ubaldi F, Tournaye H, Camus M, Van der Pas H, Gepts E, Devroey P. Fertility after histeroscopic myomectomy. Human Reproduction Update 1995;1:81-90.
37 Hallez JP, Netter A, Cartier R. Methodical intrauterine resection. Am J Obstet Gynecol 1987;156:180-4.
38 Brooks PG, Loffer FD, Serden SP. Resectoscopic removal of symptomatic intrauterine lesion. J Reprod Med 1989;34:435-7.
39 Valle RF. Histeroscopic removal of submucous myomas. J. Gynaecol Surg 1990;6:89-96.
40 Hucke J, Campo RL, De Bruyne F, Abon Freikha A. Die hysteroskopische resection submukoser myoma. Geburtshilfe Frauenheilkd 1992;52:214-8.
41 Golbenberg M, Sivan E, Sharabi Z, Bider D, Rabinovici J, Seidman DS. Outcome of histeroscopic resection of submucous myomas for infertility. Fertil Steril 1995;64:714-6.
42 Cravello LD, Ercole, Azoulay P, Boubli L, Blanc B. Le traitment hysteroscopique des fibromes uterins. J. Gynaecol Obstet Biol Reprod 1995;24:374-80.
43 American Association of Gynecologic Laparoscopist. 1988 Survey of Office Hysteroscopy: National Statistics. J Reprod Med 1990;35:584-91.
44 Grainger DA, De Cherney AH. Hysteroscopic management of uterine bleeding. Baillieres Clin Obstet Gynaecol 1989;156:180-4.
45 Harrison III RH, Boren JS, Robinson JR. Dilutional hyponatremic shock: another concept of the transurethral prostatic resection reaction. The Journal of Urology 1956;75:95-110.
46 Leake JF, Murphy AA, Zacur HA. Non cardiogenic pulmonary edema: a complication of operative hysteroscopy. Fertil Steril 1985;48:497-9.
47 Wendt L. Experimental hyperglycinaemia and evaluation of the efficacy therapy in non keotic hyperglycinaemia. J Munt Def Res 1979;23:195-201.
48. Ahmed N, Falcone T, Tulandi T, Houle G. Anaphylactic reaction because of intrauterine 32% dextran-70 installation. Fertil Steril 1991;55:1014-6.
49 Zbella EA, Moise J, Larson SA. Non cardiogenic pulmonary edema secondary to intrauterine instillation of 31% dextran 70. Fertil Steril 1985;43:479-80.
50 Schinagl EF. Hyskon (32% dextran 70) hysteroscopic surgery and pulmonary edema. Anesth analg Curr Res 1990;70:223-4.
51 Witz CA, Silverberg KM, Burns WN, Schenken RS, Olive DL. Complications associated with the abortion of hysteroscopic fluid media. Fertil Steril 1993;60:745-56.
52 Mc Lucas B. Intrauterine applications of the resectoscopie. Surgery Gynecology Obste 1991;172:425-31.
53 De Cherney A, Polan M. Hysteroscopic management of intrauterine lesions and intractable uterine bleeding. Obstet Gynecol 1983;61:392-7.
54 Perry CP, Daniell JF, Gimpelson RJ. Bowel injury grow Nd-YAG endometrial ablation. J Gynecol Surg 1990;6:199-203.
| Figura 1.Fotografía histeroscópica correspondiente a la resección histeroscópica de un mioma submucoso. |
| Tabla 1 | Miomectomía histeroscópica en pacientes estériles. Resultados | |||||||||
| Año | N.º pac. estériles | Ges. (%) | Hijos vivos (%) | Técnica | ||||||
| Hallez y cols. (37) | 1987 | 11 | 7 (64) | 5 (71) | Resec. | |||||
| Brooks y cols. (38) | 1989 | 15 | 5 (33) | NE | Resec. | |||||
| Loffer (15) | 1990 | 12 | 8 (67) | 7 (87) | Resec. | |||||
| Donnez y cols (11) | 1990 | 24 | 16 (67) | NE | Láser | |||||
| Valle y cols. (39) | 1990 | 16 | 10 (62) | 8 (80) | Tijeras | |||||
| Corson y Brooks (33) | 1991 | 13 | 10 (78) | 8 (80) | Resec. | |||||
| Hucke y cols. (40) | 1992 | 8 | 4 (50) | 2 (50) | Resec. | |||||
| Goldenberg y cols (41) | 1994 | 13 | 7 (54) | NE | Resec. | |||||
| Motashaw (36) | 1994 | 11 | 7 (63) | 4 (54) | Resec. | |||||
| Devroey (36) | 1994 | 11 | 5 (45) | 2 (40) | Resec. | |||||
| Hallez (16) | 1995 | 31 | 18 (58) | NE | Resec. | |||||
| Total | 164 | 97 (59) | 36 (75) | |||||||
| NE: no especificado. | ||||||||||
| Modificado de Ubaldi y cols. (36). | ||||||||||
| Tabla 2 | Factores predictivos de fracaso de miomectomía resectoscópica en pacientes con menometrorragias | |||||||
| Factores estudiados | % de fracasos | Significancia | ||||||
| (n = 116) | estadística | |||||||
| N.° de fibromas | 1/>1 | 12/19 | | |||||
| Localización | 0/1+2 | 13/16 | | |||||
| Miomectomía previa | Sí/No | 18/14 | | |||||
| Histerometría | <10/>10 | 12/19 | | |||||
| Trat. previo gestágenos | Sí/No | 14/12 | | |||||
| Trat. previo análogos | Sí/No | 14/14 | | |||||
| Resultado anatómico | N/Pat. | 7/24 | + | |||||
| De Cravello y cols. (42). | ||||||||
Tijeras n = 16
Resector n = 131
Láser n = 24
Total n = 171
Laparotomía n = 34
% gestaciones80
60
40
20
0
6763585544
| Figura 2.Tratamiento histeroscópico del mioma submucoso en pacientes estériles. Resultados según técnica. |
| Tabla 3 | Complicaciones inmediatas de la miomectomía histeroscópica | ||||||||||||||
| Alt. | Edem. | Perf. | Les. | Hem. | |||||||||||
| Autor | Año | N.° pac. | elec. | pul. | uter. | Intest. | sev. | Endo. | |||||||
| Hallez y cols. (37) | 1987 | 61 | -- | -- | 1 | -- | -- | -- | |||||||
| Brooks y cols. (38) | 1989 | 90 | -- | -- | 1 | -- | -- | 1 | |||||||
| Loffer (15) | 1990 | 53 | 1 | 1 | 1 | -- | -- | -- | |||||||
| Donnez y cols. (11) | 1990 | 60 | -- | -- | -- | -- | -- | -- | |||||||
| Valle y cols. (39) | 1990 | 52 | -- | -- | -- | -- | -- | -- | |||||||
| Corson y Brooks (33) | 1991 | 92 | -- | -- | 1 | -- | 1 | 1 | |||||||
| Hucke y cols. (40) | 1992 | 39 | -- | -- | 1 | 1 | -- | -- | |||||||
| Goldenberg y cols. (41) | 1994 | 13 | NE | NE | NE | NE | NE | NE | |||||||
| Motashaw (36) | 1994 | 73 | -- | -- | 1 | -- | 3 | -- | |||||||
| Devroey (36) | 1994 | 14 | -- | -- | 1 | -- | -- | -- | |||||||
| Hallez (16) | 1995 | 284 | -- | -- | 1 | -- | -- | -- | |||||||
| Viscasillas y cols. | 1995 | 35 | -- | -- | 1 | -- | -- | -- | |||||||
| Total | 866 | 1 | 1 | 9 | 1 | 4 | 2 | ||||||||
| Modificado de Ubaldi y cols. (36). | |||||||||||||||
BIBLIOGRAFÍA