INTRODUCCION
Las neoplasias sincrónicas son las tumoraciones que aparecen en un mismo paciente cercanas en el tiempo1. Ocurren de forma infrecuente; se considera que el 0,7% de la patología maligna ginecológica corresponde a tumores sincrónicos de endometrio y ovario. Hay una cierta tendencia a la asociación de las tumoraciones de endometrio y ovario2. Las pacientes en las que se presenta suelen ser nulíparas; de hecho, algunos autores3 creen que éste es un factor de posible aparición de neoplasia sincrónica en las mujeres que padecen una neoplasia endometrial4.
En general, estos tumores se suelen diagnosticar en un estadio temprano, son de bajo grado y de pronóstico favorable4. Todavía falta unanimidad en ciertos puntos con respecto a estas asociaciones: no está clara la vía metabólica a través de la cual se desarrollan, ya que se han obtenido resultados contradictorios sobre la importancia de la alteración del sistema de reparación de apareamientos incorrectos del ADN para su desarrollo. Tampoco está claro cuál es el método idóneo para diferenciar si se trata de 2 neoplasias independientes o si una lesión es metástasis de la otra, sobre todo tras la aparición de los nuevos métodos de biología molecular. No hay un protocolo universal terapéutico, ya que algunos autores apoyan la idea de que es posible mantener una actitud conservadora en estos casos2.
CASO CLINICO
Mujer de 45 años de edad, gravida 1, para 1 (G1P1), con antecedentes de apendicectomía, hipertensa y en tratamiento con atenolol. Su fórmula menstrual era 3/25. La paciente refirió que en los últimos 6 meses sus menstruaciones eran más abundantes.
Consultó por la presencia de hipermenorrea. En la ecografía transvaginal la línea endometrial era de 18 mm, observamos una imagen ecogris heterogénea de aspecto regular que ocupaba el fondo de saco de Douglas, de 6 * 4 cm de tamaño, con flows de baja resistencia, junto a una moderada cantidad de líquido libre. Realizamos un legrado ginecológico hemostático. En el seguimiento en el servicio de consultas externas recibimos el resultado anatomopatológico de la muestra remitida: adenocarcinoma (ADC), bien diferenciado de endometrio, de grado nuclear 1 y arquitectural 1.
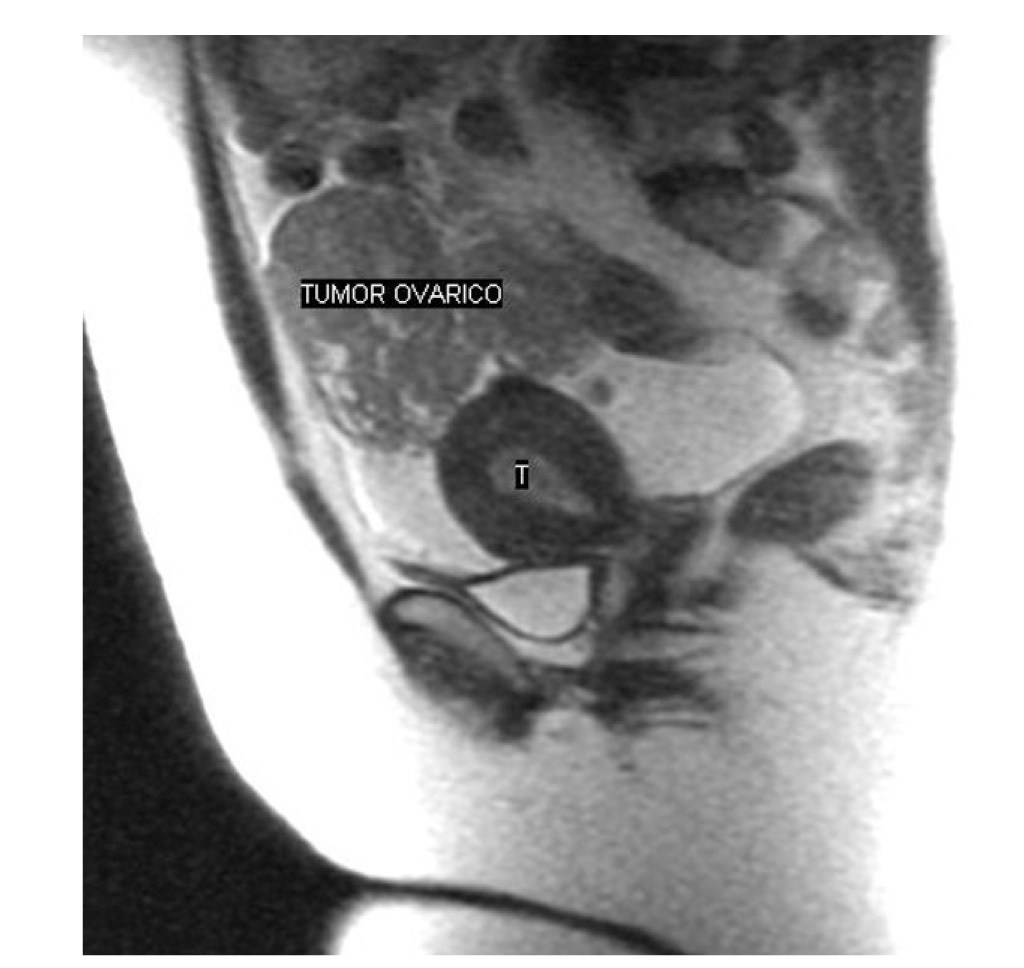
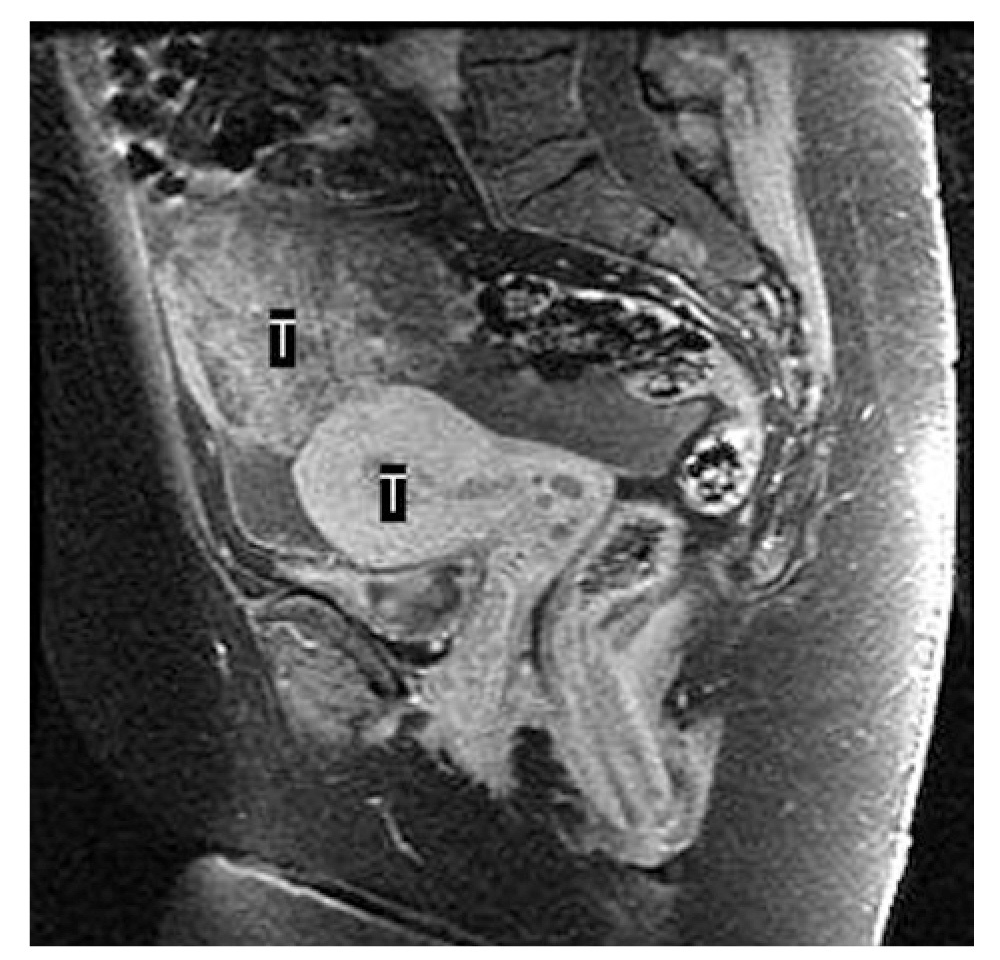
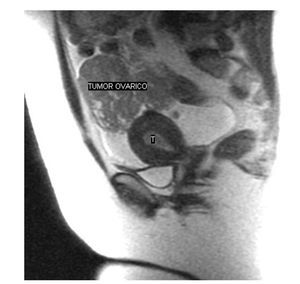
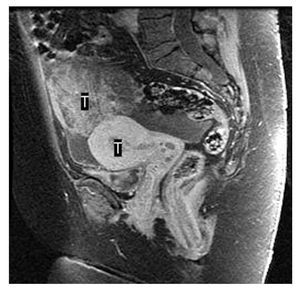
En la resonancia magnética (RM) solicitada se puso de manifiesto una masa en la cavidad endometrial, probablemente una neoplasia de grado 1B, y una tumoración pélvica intraperitoneal de 6 * 7 cm de tamaño, compatible con neoplasia ovárica o carcinomatosis peritoneal (figs. 1 y 2). El Ca 12.5 fue de 303 U/ml.
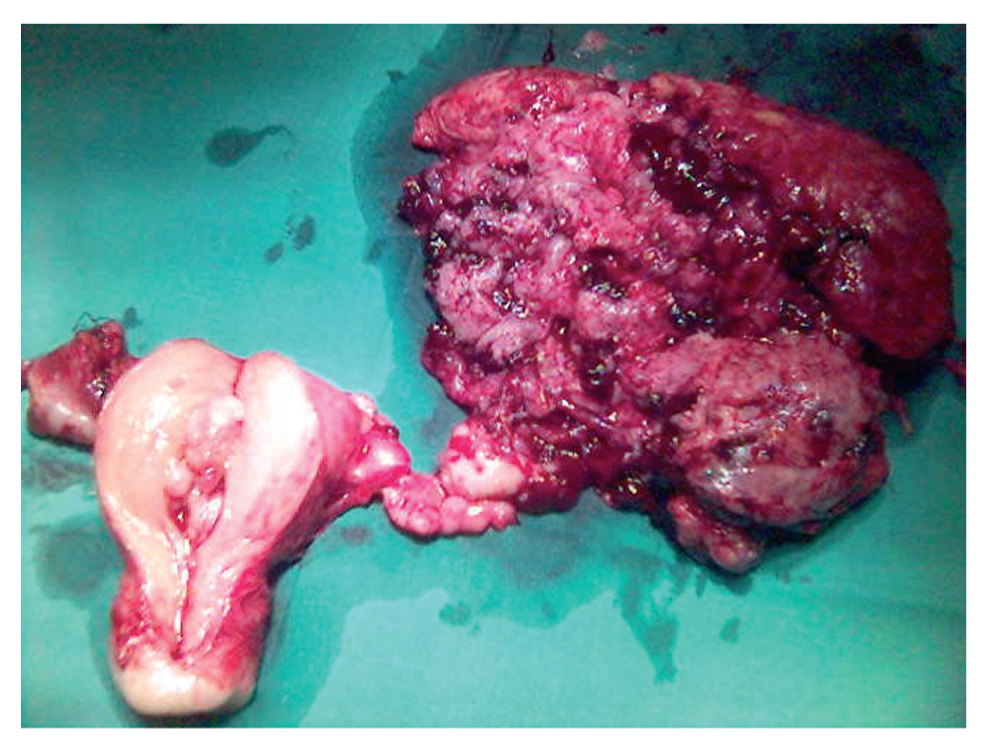
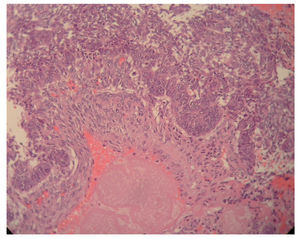
Figura 1. Tumoración ovárica de consistencia muy friable de 14 cm de diámetro, que rompía la cápsula.
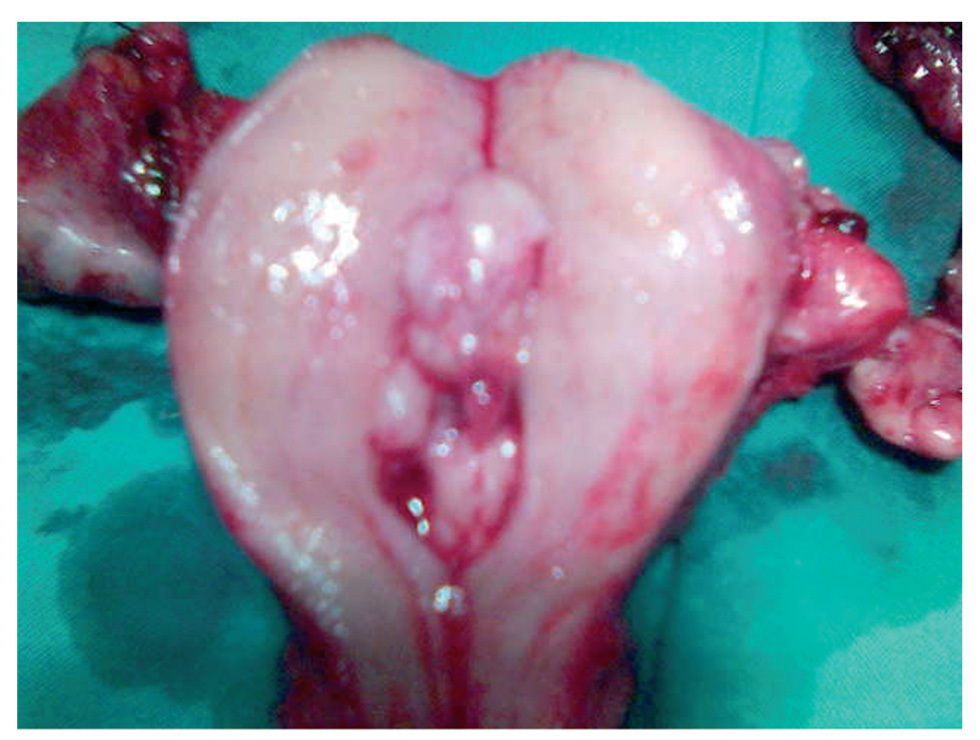
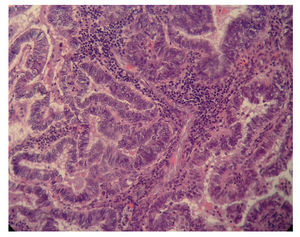
Figura 2. Neoplasia endometrial que microscópicamente no invadía el miometrio.
La paciente se sometió a cirugía reglada para carcinoma ovárico, siguiendo el protocolo: aspiración de líquido ascítico (aproximadamente 2 l, que se remitió a anatomía patológica), revisión de la cavidad abdominal, incluidas las cúpulas diafragmáticas, las gotieras paracólicas, la superficie hepática y el bazo, así como las asas intestinales y las áreas linfáticas, ilíacas y retroperitoneales, todo ello con resultado negativo.
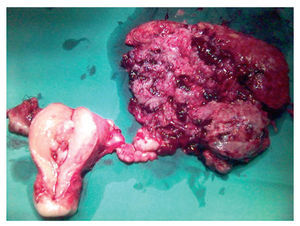
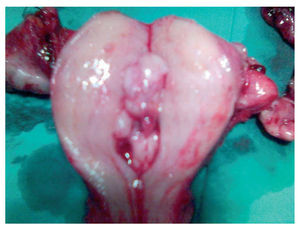
Evidenciamos una tumoración en el anexo izquierdo (AI), friable, de 14 cm (fig. 3), que rompía la cápsula ovárica, un anexo derecho (AD), de aspecto normal, y una tumoración endometrial (fig. 4), que aparentemente no infiltraba el miometrio.
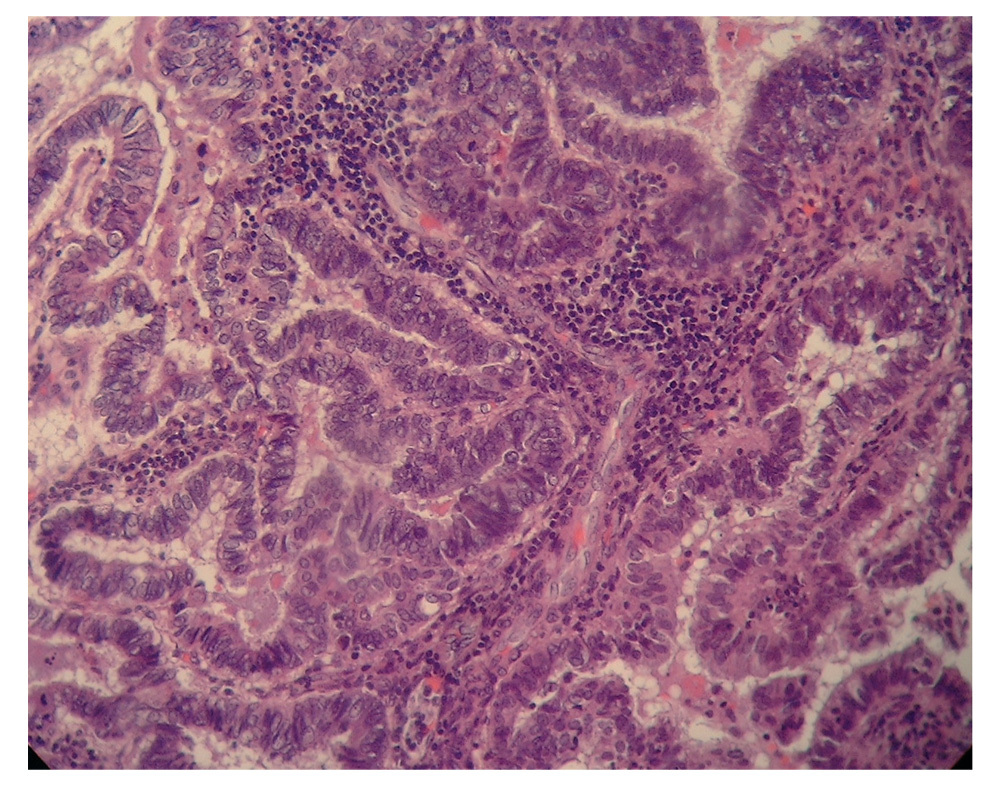
Figura 3.Imagen de un corte de endometrio: histología endometriode.
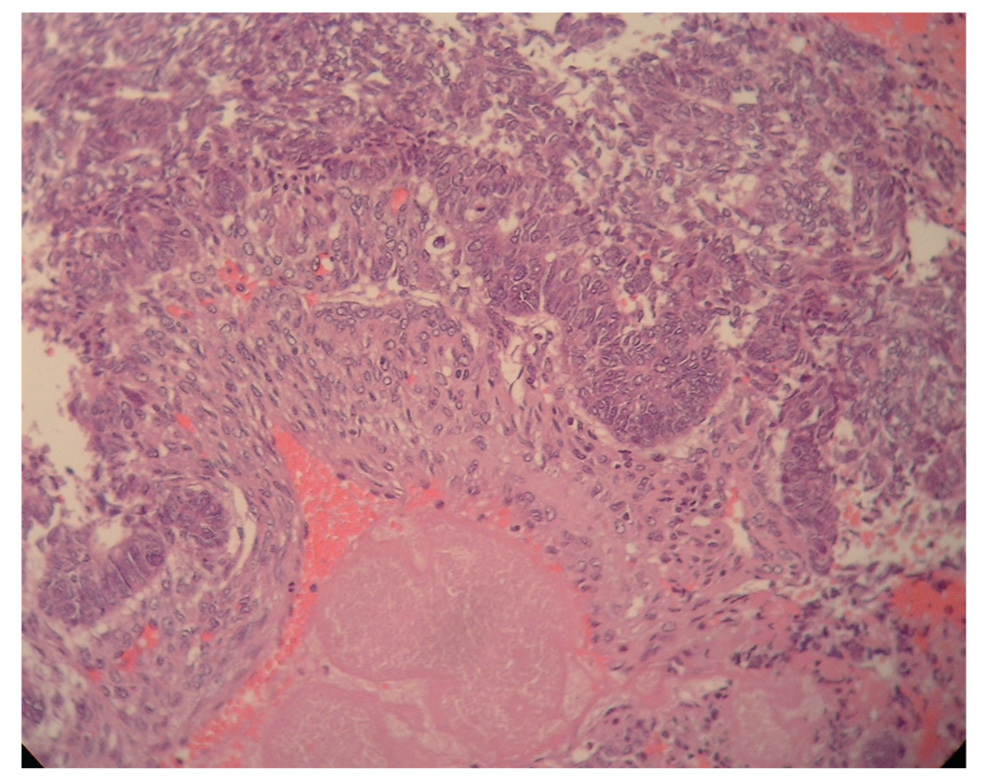
Figura 4.Corte de tejido ovárico: imagen de histología de adenocarcinoma endometrioide ovárico.
Se practicó una histerectomía total con doble anexectomía y omentectomía. No se realizó apendicectomía, ya que la paciente estaba previamente apendicectomizada. Conseguimos una citorreducción del 100%.
El resultado anatomopatológico de la pieza quirúrgica fue de un adenocarcinoma endometrial tipo endometrioide, de grado citológico 1, que infltraba menos del 50% del espesor miometrial (FIGO IB G1) (fig. 5), junto con ADC sincrónico de AI tipo endometrioide, de grado citológico 2 (FIGO IC) (fig. 6).
Figura 5.Imagen por resonancia magnética de tumor en el anexo izquierdo y en el dondometrio.
Figura 6.Imagen de los 2 tumores.
La paciente siguió su tratamiento en el departamento de oncología, completándolo con un total de 4 ciclos de quimioterapia adyuvante con taxol y carboplatino.
En este momento, 14 meses después de la intervención quirúrgica, y tras revisiones ginecológicas cada 3 meses, la paciente se encuentra asintomática; la exploración clínica es normal y, por tanto, está libre de enfermedad.
DISCUSION
Hay algunas neoplasias que aparecen asociadas a otras con mayor frecuencia, como la neoplasia endometrial y de ovario2.
La incidencia de las neoplasias sincrónicas de endometrio y ovario varía según los autores. Un 0,7-10% de las pacientes con neoplasia endometrial presenta también afección del ovario, y un 10-20% de las pacientes con neoplasia ovárica la presentan también en el útero1,4,5.
En la mayoría de las ocasiones, el hallazgo de la afección ovárica en las pacientes con tumoración endometrial se produjo durante la cirugía o en la revisión histológica de la pieza después de la ooforectomía. Sólo el 11% de las neoplasias ováricas se descubrió previamente a la cirugía a través de un examen pélvico o una prueba de imagen, como la tomografía computarizada4. Aparece en el 20% de los pacientes con adenocarcinoma endometrioide de ovario6.
Uno de los problemas más frecuentes ante una afectación de ovario y endometrio es discernir si realmente se trata de 2 neoplasias primarias que ocurren simultáneamente, o si una es afección secundaria de la otra, ya que en las tumoraciones ováricas la afección endometrial metastásica es frecuente, y viceversa. Las implicaciones que esto conlleva son importantes, ya que el pronóstico será muy diferente en un caso u otro, y también el tratamiento1. Será trascendente terapéuticamente saber si tenemos un ADC de endometrio en estadio FIGO III, un carcinoma ovárico en estadio FIGO II, o si son neoplasias primarias sincrónicas de estadios iniciales, ya que en este último tipo será suficiente un abordaje conservador con una histerectomía con doble anexectomía, a diferencia de los otros2.
A pesar de los múltiples estudios realizados sobre esta cuestión, todavía no hay ningún criterio aceptado unánimemente que pueda diferenciar si se trata de 2 neoplasias sincrónicas o si una es secundaria a la otra. Esta distinción será más sencilla si los 2 tumores son de tipos histológicos no similares, aunque éstos suponen una minoría (3,6%), ya que si en las 2 localizaciones son de la misma histología (p. ej., endometrioide), como ocurre frecuentemente, será complicado4. Cabe destacar que hay unos criterios clásicos, basados en las características histológicas, propuestos por Ulbright y Roth. Con el fin distinguir los tumores primarios de los metastásicos (tabla 1), estos criterios sirven de comparación para los resultados obtenidos a través de las técnicas más recientes7. Otros autores consideraban que la afección endometrial constituía un tumor primario si medía no más de 2 cm, estaba bien diferenciado o era mínimamente invasivo2. Todo esto han sido intentos para aclarar el problema, aunque estos criterios no se han llegado a validar5.
Más recientemente, y con el mismo objetivo de intentar obtener un criterio para diferenciar las neoplasias sincrónicas de una afección metastática secundaria a otra neoplasia, se están desarrollando técnicas por análisis molecular y, aunque las muestras son de un número pequeño de pacientes, se están llevando a cabo grandes avances. La base en la que se sustentan estas técnicas es que si se trata de 2 tumores distintos, que han aparecido próximos en el tiempo, poseerán distintos marcadores moleculares, y si por el contrario se trata de un mismo tumor que en su crecimiento ha metastatizado a otro órgano, compartirán idénticos marcadores.
Según distintos grupos de trabajo, se han estudiado varios marcadores, entre ellos los patrones de inactivación de cromosomas, las mutaciones en los genes PTEN, p53 o k-ras, la detección del virus del papiloma humano (VPH) o la pérdida de alelos en q17, en un esfuerzo por definir las relaciones entre los linajes celulares de estas 2 neoplasias5.
Según este punto de partida, se han realizado estudios recientes. Entre ellos, el del grupo de Moreno et al8 pudo establecer un método de diferenciación: los tumores sincrónicos tenían características idénticas, tanto de localización de betacateninas como el patrón de inestabilidad de microsatélites, y los que eran 2 neoplasias independientes diferían.
Tanto empeño se pone en conocer el origen de 2 neoplasias que aparecen al mismo tiempo en 2 localizaciones distintas porque el pronóstico será radicalmente distinto.
La mayoría de autores está de acuerdo en el buen pronóstico de las neoplasias sincrónicas2,6,9. Algunos resultados demuestran el excelente pronóstico: el 81,2% libre de enfermedad a los 5 años, supervivencia del 73-100%4, ninguna recidiva tras 53 meses de seguimiento6. En general, uno de los factores que les confieren un mejor pronóstico es que, en su mayoría, son tumores en estadios iniciales (I)5. Los de estadio I en ambas localizaciones tienden a tener una mejor tasa de período libre de enfermedad4. Además, la presencia de una neoplasia en endometrio, la mayoría de las veces sintomática, podrá poner de manifiesto tumores ováricos que pasarían asintomáticos hasta alcanzar estadios mucho más avanzados.
Aun así, incluso los casos con metástasis presentan mejor pronóstico de lo esperado por causa desconocida5. Se considera que tienen mejor pronóstico los tumores con una misma histología, excepto si el tumor endometrial es de alguna variante inusual (papilar, células claras, mucinoso o mixto)1.
Se ha asociado a un peor pronóstico en algunas series la edad joven de la paciente (menos de 65 años), el estadio III (único factor relacionado con la recurrencia tumoral10), la invasión miometrial profunda (factor más asociado a mal pronóstico10) o la presencia de histología desfavorable (tumores serosos, carcinosarcoma, tumor de Brenner)8. A pesar de estas asociaciones, ninguna ha alcanzado significación estadística4.
La forma de presentación más frecuente, según la literatura médica, es mediante hipermenorrea (80%)8, coincidiendo con la clínica de nuestro caso. Además, coincide con la teoría2 de que las pacientes con histología endometrioide en ambas localizaciones suelen ser más jóvenes.
En general, la histología endometrioide en tumores ováricos es la que más frecuentemente se asocia con la aparición de neoplasias sincrónicas endometriales. Para algunos autores2, tal es la relevancia de los tipos histológicos, que se propuso una clasificación basándose en un grupo de tumores endometrioides en ambas localizaciones, otro de no endometrioides en endometrio y un tumor de idéntica histología en 1 o 2 ovarios, y un último grupo de histología endometrioide en endometrio y no endometrioide en ovario. El mejor pronóstico lo tuvieron las pacientes del segundo grupo. Aunque lo más frecuente es el primer grupo, que se corresponde con el tipo histológico de nuestra paciente2,5,10. Curiosamente, la histología endometrioide es infrecuente en neoplasias ováricas esporádicas (el 10-20%), cuya histología más habitual son los carcinomas serosos5. Los grados más frecuentes son el I y el II en ambas localizaciones4.
Las propuestas acerca del tratamiento óptimo varían según los diferentes autores. Algunos defienden la realización de histerectomía (HA) con doble anexectomía (DA), omentectomía, toma de muestras de ganglios paraaórticos, biopsias peritoneales y citología con toma de muestra de hemidiafragma derecho5. Otros, más conservadores, creen que si son de bajo grado y estadio en ambas localizaciones, sería suficiente con realizar HA y DA1,2. La experiencia de otras series apunta hacia la necesidad de quimioterapia adyuvante basada en cisplatino, sobre todo para el tratamiento de la afección ovárica y cuando se trate de estadios y grados avanzados. Estos autores sugieren que en casos poco avanzados, y más aún si son los 2 endometrioides, será suficiente con la cirugía4. Por otra parte, si conseguimos diferenciar que se trata de una neoplasia endometrial con metástasis ováricas, se deberá ampliar la pauta de tratamiento5.
Correspondencia:
Dra. M. Sanz Cortés.
Departamento de Ginecología y Obstetricia. Hospital Clínico Universitario de Valencia.
Avda. Blasco Ibáñez, 17.
46010 Valencia. España.
Correo electrónico: magdasanz@hotmail.com
Fecha de recepción: 5/12/05. Aceptado para su publicación: 16/3/06.