Obstetricia
Estudio morfofuncional de la lesión endotelial en la preeclampsia: cultivo de células endoteliales de la vena umbilical
J. Bellart
R. Gilabert1
V. Piera1
E. Aguilar
M. Jové1
R. M. Miralles
Servei de Ginecologia i Obstetricia
Hospital Universitari de Tarragona Joan XIII
Facultat de Medicina i Ciències de la Salut
Universitat Rovira i Virgili. Tarragona
1 Unitat d''Anatomia Humana i Embriologia. Facultat de Medicina i Ciències de la Salut.
Universitat Rovira i Virgili. Reus
Correspondencia:
Jordi Bellart
Servei de Ginecologia i Obstetricia
Hospital Universitari de Tarragona Joan XXIII
Mallafré i Guasch, 4
43007 Tarragona
Morphologic and functional study of the endothelial dysfunction in preeclampsia: culture of endothelial cells from the umbilical vein
Bellart J, Gilabert R, Piera V, Aguilar E, Jové M, Miralles RM. Estudio morfofuncional de la lesión endotelial en la preeclampsia: cultivo de células endoteliales de la vena umbilical. Prog Obstet Ginecol 1999;42:113-119.
Fecha de recepción: 30/6/98
Aceptado para publicación 16/11/98
RESUMEN
Se analiza la cinética del cultivo de células endoteliales obtenidas de la vena umbilical procedente de gestaciones normales o complicadas con preeclampsia. Los cultivos de células procedentes de gestaciones con preeclampsia muestran una menor adherencia celular al inicio del cultivo (menor viabilidad), una cinética de cultivo más lenta, desadherencia y muerte celular al final del cultivo (apoptosis). Los resultados indican que la lesión endotelial, característica de la preeclampsia, puede ser reproducida in vitro mediante el cultivo del endotelio umbilical y sugieren que esta metodología tiene un gran potencial biológico para el estudio de la fisiopatología de la preeclampsia.
PALABRAS CLAVE
Hipertensión; Embarazo; Preeclampsia; Endotelio; Cultivo.
ABSTRACT
The culture kinetics of endothelial cells from the umbilical vein of normal and preeclamptic pregnancies was studied. Endothelial cell cultures from preeclamptic pregnancies showed kinetic disorders (slow development of adherent cell layer) and cell detachment and death. The results indicate that endothelial injury in preeclampsia can be sustained in vitro and studied through the culture of umbilical endothelial cells and suggest that this can be a great biological model in vitro to study the physiopathology of the preeclampsia.
KEY WORDS
Hypertension; Pregnancy; Preeclampsia; Endothelium; Culture.
INTRODUCCION
La preeclampsia (PE) es una de las complicaciones más importantes durante la gestación y una de las principales causas de morbimortalidad materna y fetal. La etiología de este síndrome continua siendo desconocida y su fisiopatología no está totalmente determinada. Distintas hipótesis intentan explicar el origen de la PE (ver Ref. 1 para revisión). No obstante, todas las hipótesis tienen un punto final común para explicar los síntomas y signos de la PE: la activación y/o lesión de las células endoteliales. En este sentido, se ha demostrado la existencia de cambios morfofuncionales en el endotelio vascular de gestantes con PE(2-4).
La mayoría de trabajos que estudian la fisiopatología de la PE están basados en resultados plasmáticos que muestran una activación de la coagulación y un incremento de los marcadores de lesión endotelial(5-7).
Varios autores han sugerido la existencia de un factor plasmático en las pacientes afectas de PE capaz de activar y, posteriormente, lesionar la célula endotelial. No obstante, este factor aún no ha podido ser identificado y su mecanismo de acción es desconocido. Diferentes estudios han intentado su identificación mediante la exposición de células normales al plasma/suero de pacientes PE. A pesar de ello, los resultados obtenidos por distintos autores no son coincidentes debido, fundamentalmente, a la metodología utilizada(8-14).
El estudio morfológico de la vena umbilical de gestaciones complicadas con PE muestra anomalías en el endotelio indicativas de lesión celular(15). Las anomalías morfológicas descritas en el cordón umbilical procedente de gestaciones complicadas con PE son similares a las descritas en otros órganos(2-4) y a las observadas en los vasos umbilicales procedentes de embarazos complicados por hipertensión gestacional sin proteinuria(16). No obstante, en el caso de gestaciones con PE, se observa una mayor lesión celular que en la hipertensión gestacional, especialmente una mayor extensión de zonas erosionadas (desendotelización) y de anomalías celulares.
A pesar de que la extrapolación de los resultados obtenidos in vitro al organismo vivo es siempre especulativa, los cultivos de células endoteliales pueden aportar una información valiosa sobre el origen y/o los mecanismos celulares implicados en la PE.
En este trabajo nos propusimos realizar cultivos de células endoteliales procedentes de vena umbilical de gestaciones con PE, basándonos en las siguientes premisas: i) la disfunción endotelial está en la base fisiopatologíca de la PE, ii) las anomalías morfológicas halladas en la vena umbilical son similares a las descritas en órganos maternos, iii) las células endoteliales procedentes de vena umbilical son uno de los pocos tipos celulares fáciles de obtener y representan una excelente fuente de tejido fetoplacentario para estudiar las patologías asociadas al embarazo. En trabajos previos(17,18), en los que se realizan cultivos de células endoteliales obtenidos de vena umbilical de gestaciones complicadas por diabetes gestacional, se demostraron alteraciones en la cinética de cultivo, en el metabolismo glucolítico y producción de óxido nítrico, lo que pone de manifiesto la utilidad de esta metodología en el estudio de patologías asociadas al embarazo.
El objetivo de este trabajo ha sido el analizar la morfología y cinética del cultivo de células endoteliales obtenidas de la vena umbilical, en un intento de demostrar su utilidad en el estudio de la lesión endotelial en la PE y su reproductibilidad in vitro.
MATERIAL Y MÉTODOS
Pacientes
El grupo control estaba constituido por 25 gestantes normotensas, sin antecedentes de enfermedad hipertensiva, diabetes o patología autoinmune. La PE severa (n = 6) se definió como una presión sanguínea superior o igual a 160/110 mmHg, proteinuria (> 5 g/l/24 h) y afectación multiorgánica(19). Los datos clínicos y de laboratorio analizados fueron: edad materna, paridad, edad gestacional al parto, presión arterial, proteinuria, forma de finalizar el parto y peso de los recién nacidos.
Tras el parto, los cordones umbilicales se lavaron con tampón fosfato para eliminar los restos de sangre, se sumergieron en tampón fosfato a 4 °C y se trasladaron al laboratorio con el mínimo intervalo de tiempo.
Cultivo de células endoteliales
Las células endoteliales se aislaron según el método de Jaffe y cols.(20) a partir de la vena del cordón umbilical de gestaciones sin complicaciones (n = 25) y complicadas por PE severa (n = 6). Las células endoteliales fueron obtenidas mediante tratamiento enzimático de la vena umbilical con colagenasa (0,25 mg/ml) y se cultivaron en frascos de plástico de 25 cm2 previamente gelatinizados. Al medio de cultivo (M199 medium) que contenía L-glutamina (2 mM) y bicarbonato sódico, se le añadió suero bovino fetal (20%), penicilina (100 U/ml) y estreptomicina (100 mg/ml). Tras el contaje celular, todos los cultivos se iniciaron con 8 x 106 células/frasco. Las células fueron cultivadas a 37 °C y 5% CO2. En días alternos, el medio de cultivo fue totalmente cambiado, y se contaron las células del sobrenadante. Coincidiendo con el cambio de medio, se evaluó el desarrollo de la capa adherente en un microscopio de contraste de fases hasta su confluencia (ocupación del 100% de la superficie del frasco de cultivo por células endoteliales). En este momento, las células adheridas al frasco de cultivo se trataban con tripsina/EDTA (0,01/0,02%) para su obtención en suspensión y, se realizaba el contaje en un hemocitómetro. La viabilidad celular fue determinada tras el tratamiento con colagenasa, en el sobrenadante obtenido a días alternos durante todo el período de cultivo y en la fracción adherente tras el tratamiento con tripsina, mediante la técnica de exclusión del azul de trypan. Todos los reactivos eran de Sigma S. A. (Madrid).
Análisis estadístico
Los datos clínicos y de laboratorio se expresan como media y rango. Los resultados obtenidos en el grupo control (gestación sin complicaciones) y en el de PE se compararon mediante la prueba no-paramétrica U-Mann-Whitney. Los valores de p < 0,01 fueron considerados estadísticamente significativos.
RESULTADOS
Datos clínicos
De acuerdo con los criterios diagnósticos, la presión sanguínea sistólica y diastólica, y los niveles de proteinuria fueron significativamente más elevados en el grupo de gestantes con PE. No obstante, no se detectaron diferencias en la edad materna ni en la presión sanguínea antes de las 20 semanas de gestación. El número de primíparas y el de partos por cesárea fue superior en el grupo de gestantes afectas de PE, mientras que la edad gestacional en el momento del parto y los pesos de los recién nacidos fueron inferiores (tabla 1).
Tabla 1 Datos clínicos | ||
| Normotensas (n = 25) | Preeclampsia (n = 6) | |
| Edad materna, años | 29 (20-43) | 28 (25-32) |
| Presión arterial, mmHg | ||
| < 20 semanas | 115/65 | 116/71 |
| tercer trimestre/diagnóstico | 108/62 | 170/108* |
| Proteinuria | | ++* |
| Edad gestacional al parto, semanas | 40 (38-42) | 31 (28-39)* |
| Peso recién nacidos, kg | 3,4 (2,9-4,2) | 1,6 (0,9-2,9)* |
| Primigrávidas, % | 56 | 100* |
| Cesáreas, % | 13 | 75* |
| Media (rango). *p < 0,01. | ||
Cultivos de células endoteliales
El número de células obtenido, tras la digestión con colagenasa de la vena umbilical, fue menor en el grupo de PE que en los controles, coincidiendo con una menor longitud del cordón umbilical procesado. No obstante, el número de células obtenido por centímetro de cordón no mostraba diferencias estadísticamente significativas y la viabilidad celular fue similar a la de los controles (tabla 2).
Tabla 2 Cultivos de células endoteliales de gestaciones sin complicaciones y con preeclampsia | |||
| Normotensas n = 25 | Preeclampsia n = 6 | ||
| Inicio del cultivo | |||
| Longitud del cordón, cm | 20 (7-30) | 12,5 (5-20) | |
| EC pos-colagenasa, x106 | 43 (35-51) | 26 (10-32)* | |
| EC x106 /cm cordón | 1,7 (1,3-1,8) | 1,3 (1,0-1,7) | |
| Viabilidad celular, % | > 98 | > 98 | |
| EC x106 /frasco | 8 | 8 | |
| EC adheridas a las 24h x106 /frasco | 6 (5,5-7) | 4,5 (3-5)* | |
| Confluencia de la monocapa | |||
| Días para la confluencia | 5 (3-7) | 9 (9-11)* | |
| Células no-adherentes, x106 | 0,23 (0,1-0,3) | 4,2 (3,8-5,3)* | |
| Viabilidad no-adherentes, % | > 98 | 30 (10-40)* | |
| EC adheridas, x106 | 29 (24-36) | 15 (7-18)* | |
| Viabilidad EC adheridas, % | > 98 | 82 (60-95)* | |
| EC = Células endoteliales. Media (rango). *p < 0,01. | |||
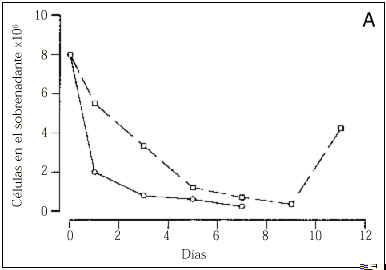
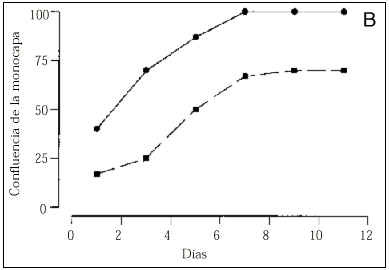
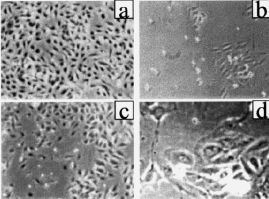
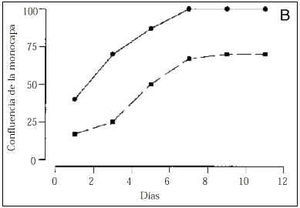
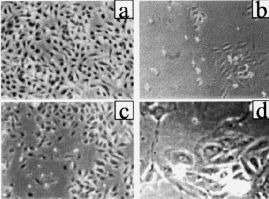
El número de células adheridas a las 24 horas del inicio del cultivo, y extrapolable al número de células viables, fue menor en los cultivos procedentes de gestaciones con PE (tabla 2). Asimismo, durante todo el período de cultivo, el número de células recogido en el sobrenadante fue mayor en el grupo de PE que en los controles (Fig. 1A). A los cinco días, los cultivos control mostraban una monocapa confluente (ocupaba el 100% de la superficie de cultivo), de aspecto homogéneo, constituida por células grandes y poligonales en las que destacaba un núcleo de forma oval situado en el centro de la célula. En cambio, los cultivos realizados con células procedentes de gestaciones con PE presentaban una constitución de la monocapa más lenta (Fig. 1B). Así, ningún cultivo de PE era confluente a los siete días de incubación y, cuando las células adherentes ocupaban casi el 75% de la superficie del frasco de cultivo (aproximadamente a los nueve días), se observaba una retracción celular, aparecían espacios acelulares en la monocapa y se apreciaban células desadheridas de aspecto redondeado y refringentes (Fig. 2). Cuando las células que se habían desprendido de la monocapa fueron recogidas en el sobrenadante, la prueba de viabilidad revelaba que el 30% de estas células no excluía el azul de trypan, indicando que eran células no viables. Al analizar las células que permanecían adheridas, se detectó que su número era inferior al de los controles y, a pesar de que la viabilidad celular se mantenía superior al 80%, ésta era inferior a la de los controles donde más del 98% de las células excluían el azul de trypan tras el tratamiento con tripsina (tabla 2).
Figura 1.Número de células obtenidas en el sobrenadante de los cultivos (gráfico A) y porcentaje de ocupación de la superficie del frasco de cultivo (gráfico B). En la línea continua están representadas los cultivos controles y en la discontinua los cultivos procedentes de gestaciones con preeclampsia.
Figura 2. Microfotografías obtenidas en el microscopio de contraste de fases de cultivos procedentes de gestación sin complicaciones a los cinco días (A; x 200) y procedentes de gestaciones con preeclampsia a los cinco días (B; x200) y a los nueve días (C; x 200 y D x 400).
DISCUSION
En la bibliografía no hemos hallado ningún trabajo en el que se estudie la cinética de cultivo de células del endotelio umbilical procedentes de gestaciones complicadas con PE. Orpana y cols.(21) analizan la producción de óxido nítrico por las células endoteliales de la vena umbilical de gestaciones con PE. No obstante, en este trabajo no se evalúa la cinética del cultivo, y la comparación de sus resultados con los presentados en este trabajo, plantea numerosos problemas metodológicos. Así, Orpana y cols. no pueden determinar el número de células obtenido tras el tratamiento con colagenasa, dificultando el poder establecer un número de células constante al inicio del cultivo. Es de suponer que, la dificultad que exponen dichos autores en la determinación del número de células, radica en la insuficiente dispersión celular tras el tratamiento enzimático. En general, la longitud de los cordones procedentes de gestaciones con PE es menor que la de los utilizados como controles; consecuentemente, el número total de células obtenido tras el tratamiento enzimático es menor en las venas umbilicales de PE que en los controles. Así, la determinación y establecimiento de un número constante de células al inicio del cultivo es imprescindible para obviar alteraciones en la cinética atribuibles exclusivamente al número de células inicial. Sin embargo, coincidiendo con Orpana y cols., no hemos hallado diferencias en la viabilidad celular tras el tratamiento con colagenasa.
Otra diferencia metodológica es la sustancia empleada para preparar el frasco de cultivo. Orpana
y cols.(21) emplean «matrigel» (mezcla rica de proteínas de la matriz extracelular), que puede enmascarar o hacer imperceptibles alteraciones en la expresión de estas proteínas o de sus receptores(22). En nuestro estudio, con los frascos preparados con gelatina, se demuestra que la capacidad de adhesión (valorada por el número de células adheridas a las 24 horas del inicio del cultivo y por el número de células obtenido en el sobrenadante durante todo el período de cultivo) es menor en las células procedentes de gestaciones con PE. Resultados similares han sido hallados al cultivar células trofoblásticas de gestaciones con PE(23) y ponen en evidencia alteraciones de la membrana celular (receptores, moléculas de adhesión celular) o en la secreción de componentes de la matriz extracelular(22).
Otra de las dificultades al comparar resultados radica en que estos autores(21) mantienen tan sólo 48 horas las células en cultivo y utilizan placas de 1 cm2; mientras que nuestros cultivos se han mantenido hasta que la monocapa era confluente (cinco-nueve días) en frascos de 25 cm2. Cabe destacar que, a las 48 horas, no se apreciaban diferencias significativas entre los grupos control y PE. En cambio, a partir de los cinco días, mientras que los cultivos control mostraban una monocapa bien desarrollada, los de PE ocupaban tan sólo el 50% de la superficie del frasco de cultivo. Resultados similares han sido aportados en los cultivos realizados con células endoteliales de gestaciones complicadas por diabetes gestacional(17). Asimismo, se pusieron de manifiesto alteraciones microscópicas (contracción celular), y fenómenos de desadherencia y muerte celular en las últimas etapas de los cultivos procedentes de gestaciones con PE. Este fenómeno no ha sido referido en la diabetes gestacional, pudiéndose atribuir a una mayor afectación de la célula endotelial(16), demostrable también por una mayor alteración de los indicadores plasmáticos de lesión endotelial en la PE que en la diabetes gestacional(14,24).
El hecho que las principales anomalías se produzcan al final del cultivo, puede relacionarse con la secreción de alguna sustancia citotóxica en el propio cultivo o poner de manifiesto una lesión irreversible tras la exposición a un factor plasmático in vivo. Fenómenos de desadherencia y muerte celular de características similares a los descritos en este trabajo, se han observado cuando las células endoteliales se cultivan en presencia de anticuerpos antiendotelio(25), de productos de degradación del fibrinógeno o fibrina(26,27,28), de fibronectina(9), o cuando se induce la expresión de factor tisular, relacionándose con fenómenos de apoptosis(29,30). Estos resultados son interesantes, ya que todos estos fenómenos se han asociado, en algún u otro sentido, con la PE. Así, se ha demostrado la existencia de anticuerpos antiendotelio en el suero de gestantes con PE(31) y un aumento de los niveles plasmáticos de factor tisular y fibronectina(5,7). Por otra parte, las alteraciones morfológicas del endotelio de gestantes con PE se han asociado a fenómenos de apoptosis(16) y se ha puesto de manifiesto un aumento de la fibronectina extra e intracelular en el endotelio de los vasos umbilicales de gestaciones con PE(15). También se ha evidenciado un incremento de los productos de degradación del fibrinógeno/fibrina (D-dímero) hasta niveles que podrían ser tóxicos para la célula endotelial(7,26).
Hasta el momento, los trabajos realizados con células endoteliales y destinados al estudio de la PE, se basan en la existencia de un factor citotóxico circulante en el plasma/suero de estas pacientes; así, se realizan cultivos de células normales y se las expone a este plasma/suero(8-14). No obstante, los resultados obtenidos por distintos autores son contradictorios. Estas contradicciones son debidas, en muchos casos, a razones metodológicas. Así, se aportan resultados obtenidos con células umbilicales, deciduales o líneas celulares continuas. Tampoco existe homogeneidad en la dosis de plasma/suero utilizada ni en el tiempo de exposición, obteniéndose los resultados más significativos en exposiciones largas, sugiriendo un posible efecto tiempo-dependiente como sucede con el D-dímero y en nuestros resultados(8,26). El estudio de la citotoxicidad mediante distintas técnicas (exclusión de azul de trypan, secreción de isótopos radioactivos como el 51Cr) ofrecen también resultados distintos(32,33,34). Asimismo, se han aportado datos que sugieren que los efectos del plasma y del suero, sobre las células endoteliales en cultivo, son diferentes, indicando que podría tratarse de dos factores o que el factor sería sensible a los fenómenos de coagulación y, en consecuencia, no detectable en el suero(13). Una variable añadida, es el momento de recogida del plasma/suero en las gestantes: en algunos casos se obtiene preparto y corresponden a mujeres que han recibido tratamiento farmacológico(35), mientras que en otros estudios se realiza en el momento del diagnóstico.
La poca homogeneidad de los resultados obtenidos, permite hipotetizar que el cultivo de células umbilicales procedentes de gestaciones con PE puede aportar una mayor información sobre la génesis de esta patología. Nuestros resultados indican que la lesión endotelial, al igual que en la diabetes gestacional(17,18), puede ser reproducida y mantenida in vitro. No obstante, para determinar con exactitud el tipo de alteración celular que tiene lugar en la PE y su origen son necesarios más resultados. Asimismo, la profundización en el mecanismo de acción de un posible factor promotor, capaz de poner de manifiesto esta alteración e inducir la lesión endotelial, puede ser una base para la mejora terapéutica y clínica de estas pacientes.
AGRADECIMIENTOS
Los resultados corresponden parcialmente al Premio Nubiola de la Sociedad Catalana de Ginecología y Obstetricia en su convocatoria de 1997.
Con el Soporte del FIS 99/0733.
BIBLIOGRAFIA
1 Dekker, Rodgers GA, van Geijn HP. Endothelial dysfunction in preeclampsia. Part I: Primary prevention therapeutic perspectives. J Perinat Med 1996;24:99-117.
2 Shanklin DR, Sibai BM. Ultrastructural aspects of preeclampsia. I. Placental bed and uterine boundary vessels. Am J Obstet Gynecol 1989;161:735-41.
3. Shanklin DR, Sibai BM. Ultrastructural aspects of preeclampsia. II. Mitochondrial changes. Am J Obstet Gynecol 1990;163:943-53.
4 Barton JR, Hiett AK, O''Connor WN, Nissen SE, Greene JW. Endomyocardial ultrasctrutural findings in preeclampsia. Am J Obstet Gynecol 1991;165:389-91.
5 Friedman SA, De Groot CJ, Taylor RN, Golditch BD, Roberts JM. Plasma celullar fibronectin as a measure of endothelial involvement in preeclampsia and intrauterine growth retardation. Am J Obstet Gynecol 1994;170:838-41.
6 Bellart J, Gilabert R, Fontcuberta J, Miralles RM, Cabero L. Coagulation and fibrinolytic parameters in normal and hypertensive pregnancies. Hypertens Preg 1998;17:115-23.
7 Bellart J, Gilabert R, Angles A, Piera V, Miralles RM, Monasterio J, Cabero L. Tissue factor levels and high ratio of fibrinopeptide A to D-dimer as a measure of endothelial procoagulant disorder in preeclampsia. Br J Obstet Gynecol (en prensa).
8 Baker PN, Davidge ST, Barankewicz J, Roberts JM. Plasma of preeclapmtic women stimulates and then inhibits endothelial prostacyclin. Hypertens 1996;27:56-61.
9. De Jager CA, Shephard EG, Robson SC, Jasikiewicz K, Froese S, Anthony J, Kirsch RE. Degradation of fibronectin in association with vascular endothelial disruption in preeclampsia. J. Lab. Clin. Med. 1995; 125: 522-30.
10 Endresen MJ, Lorentzen B, Herniksen T. Increased lipolytic activity and high ratio of free fatty acids to albumin in sera from women with preeclampsia leads to triglyceride accumulation in cultured endothelial cells. Am J Obstet Gynecol 1992;167:440-7.
11 Gallery EDM, Rowe J, Campbell S, Hawkins T. Effect of serum on secretion of prostacyclin and endothelin-1 by decidual endothelial cells from normal and preeclamptic pregnancies. Am J Obstet Gynecol 1995;173:918-23.
12 Rodgers GM, Taylor RN, Roberts JM. Preeclampsia is associated with a serum factor cytotoxic to human endothelial cells. Am J Obstet. Gynecol 1988;159:908-14.
13 Smárason AK, Sargent IL, Redman CWG. Endothelial cell proliferation is suppressed by plasma but not serum from women with preeclampsia. Am J Obstet Gynecol 1996;174:787-93.
14 Taylor RN, Casal DC, Jones LA, Varma M, Martin JN, Roberts. Selective effects of preeclamptic sera on human endothelial cell procoagulant protein expression. Am J Obstet Gynecol 1991;165:1705-10.
15 Bellart J, Gilabert R, Jove, M, Piera V, Miralles RM. Morfología del endotelio de los vasos umbilicales en gestaciones normales y gestaciones complicadas con preeclampsia. Prog Obstet Ginecol 1998 (en prensa).
16 Pugnaloni A, Salvolini E, Lucarini G, Staffolani R, Cester N, Mazzanti L, Castaldini C, Tietz C, Biagini G, Romanini C. The human umbilical vein in normal, hypertensive and diabetic pregnancies: immunomorphological and ultrastructural evidence. Gynecol Obstet Invest 1995;39:239-46.
17 Sobrevia L, Jarvis SM, Yudilevich DL. Adenosine transport in cultured human umbilical vein endothelial cells is reduced in diabetes. Am J Physiol 1994;267:c39-47.
18 Sobrevia L, Cesare P, Yudilevich DL, Mann GE. Diabetes-induced activation of system y+ and nitric oxide synthase in human ebdothelial cells: association with membrane hyperpolarization. J Physiol 1995;489:183-92.
19 National high pressure education program working group report on high blood pressure in pregnancy. Am J Obstet Gynecol 1990;163:1691-712.
20 Jaffe EA, Nachman RL, Becker CG, Minick CR. Culture of endothelial cells from umbilical veins. J Clin Invest 1973;52:2745-56.
21 Orpana AK, Avela K, Ranta V, Viinikka L, Ylikorkala O. The calcium-dependent nitric oxide production of human vascular endothelial cells in preeclampsia. Am . Obstet Gynecol 1996;174:1056-60.
22 Kanayama N, Terao T. Plasma fibronectin receptor levels during pregnancy complicated by preeclampsia and abruptio placentae. Gynecol Obstet Invest 1992;33:147-52.
23 Pijnenborg R, Luyten C, Vercruysse L, Van Assche FA. Attachment and differentiation in vitro trophoblast from normal and preeclamptic human placentas. Am J Obstet Gynecol 1996;175:30-6.
24 Bellart J, Gilabert R, Fontcuberta J, Carreras E, Miralles, RM, Cabero L. Coagulation and fibrinolyisis parameters in normal pregnancy and in gestational diabetes. Am J Perinatology 1998;15:479-86.
25 Pober JS, Bevilacqua MP, Mendrick DL, Lapierre LA, Fiers W, Gimbrone MA. Two distinct monokines, interleukin 1 and tumor necrosis factor, each independently induce biosynthesis and transient expression of the same antigen on the surface of cultured human vascular endothelial cells. J Immunol 1986;136:1680-7.
26 Dang CH, Bell WR, Kaiser D, Wong A. Disorganization of cultured vascular endothelial cell monolayers by fibrinogen fragment D. Science 1985;227:1487-90.
27 Ge M, Tang G, Ryan TJ, Malik AB. Fibrinogen product fragment D induces endothelial cell detachment by activation of cell-mediated fibrinolysis. J Clin Invest 1992;90:2508-16.
28 Kessler CM, Bell WR. Stimulation of fibrinogen synthesis: a possible functional role of fibrinogen degradation products. Blood 1980;55:40-7.
29 Nakamura N, Shidara Y, Kawaguchi N y cols. Lupus anticoagulant autoantibody induces apoptosis in umbilical vein endothelial cells: Involvement of annexin V. Biochem Biophy Res Comm 1994;205:1488-93.
30 Zoellner H, Hofler M, Beckmann R, et al. Serum albumin a specific inhibitor of apoptosis in human endothelial cells. J Cell Sci 1996;109:2571-80.
31 Rappaport VJ, Hirata G, Kim H, Jordan SC. Anti-vascular endothelial cell antibodies in severe preeclampsia. Am J Obstet Gynecol 1990;162:138-46.
32 Lorentzen B, Endresen MJ, Hovig T, Haug E, Henriksen T. Sera from preeclamptic women increase the content of triglycerides and reduce the release of prostacyclin in cultured endothelial cells. Thromb Res 1991;63:363-72.
33 Zammit VC, Whitworth JA, Brown MA. Preeclampsia: The effects of serum on endothelial cell prostacyclin, endothelin, and cell membrane integrity. Am J Obstet Gynecol 1996;174:737-43.
34 Endresen MJ, Testi E, Lorentzen B, Henriksen T. Sera of preeclamptic women are not cytotoxic to endothelial cells in culture. Am J Obstet Gynecol 1995;172:196-201.
35 Baker PN, Stranko CP, Davidge ST, Davies PS, Roberts JM. Mechanical stress eliminates the effects of plasma from patients with preeclampsia on endothelial cells. Am J Obstet Gynecol 1996;174:730-6.