ARTÍCULOS ORIGINALES
Obstetricia
Morfología del endotelio umbilical en gestaciones normales y complicadas con preeclampsia
J. Bellart
R. Gilabert1
E. Aguilar
M. Jové1
V. Piera1
R. M. Miralles
Servei de Ginecologia i Obstetrícia. Hospital Universitari de Tarragona Joan XXIII. Facultat de Medicina i Ciéncies de la Salut. Universitat Rovira i Virgili. Tarragona
1 Unitat Anatomia Humana i Embriologia. Facultat de Medicina i Ciències de la Salut. Universitat Rovira i Virgili. Reus
Correspondencia:
Jordi Bellart
Servei de Ginecologia i Obstetrícia. Hospital Universitari de Tarragona Joan XXIII.
Mallafré i Guasch, 4
43007 Tarragona (Spain)
Morphology of the umbilical endothelium in normal pregnancy and in pregnancy complicated by preeclampsia
Bellart J, Gilabert R, Aguilar E, Jové M, Piera V, Miralles RM. Morfología del endotelio umbilical en gestaciones normales y complicadas con preeclampsia. Prog Obstet Ginecol 1999;42: 179-188.
Fecha de recepción: 9/6/98
Aceptado para publicación 22/7/98
RESUMEN
Objetivo: Estudiar la morfología del endotelio umbilical en gestaciones normales y complicadas con preeclampsia.
Sujetos y métodos: Estudio morfológico, al microscopio óptico y electrónico, de cordones umbilicales procedentes de gestaciones sin complicaciones (n = 10) y complicadas con preeclampsia (n = 6).
Resultados: El estudio morfo-funcional del endotelio umbilical procedente de gestaciones complicadas con preeclampsia muestra signos de activación y de lesión celular. Las alteraciones morfológicas pueden resumirse en: i) incremento del número y tamaño de las vesículas de secreción y de protusiones en las células endoteliales, ii) aumento del colágeno, fibrina, fibronectina intra- y extracelular y de las vesículas lipídicas en la pared vascular, iii) vacuolización de las células endoteliales y presencia de lipófagos en la pared vascular, iv) desorganización y erosión del endotelio.
Conclusiones: Los resultados confirman la existencia de una lesión endotelial en la preeclampsia y sugieren que el endotelio umbilical puede ser un buen modelo para su estudio.
PALABRAS CLAVE
Hipertensión; Embarazo; Preeclampsia; Endotelio; Fibronectina; Morfología.
ABSTRACT
Objective:The study of umbilical endothelium in normal and preeclamptic pregnancies.
Subjectes and methods:Optic and ultrastructural analysis of umbilical endothelium obtained from non-complicated pregnancies (n = 10) and preeclamptic pregnancies (n = 6).
Results:A morpho-functional study of umbilical vessels obtained from preeclamptic pregnancies show both activation and lesion of endothelial cells. The cellular abnormalities can be summarized as: i) an increase in the number and size of secretion bladders and microvilli-like protrusions in the endothelium, ii) increase in collagen and fibrin fibers, intra- and extracellular fibronectin content and lipidic vesicles in the vessel wall, iii) vacuolization of the endothelial cells and presence of lipidic vacuoles and lipophages in the vessel wall, iv) disorganization and erosion of the endothelium.
Conclussions:The results confirm that an endothelial cell lesion occurs in the preeclampsia and suggest that umbilical endothelium can be a good model for the study of endothelial lesion in preeclampsia.
KEY WORDS
Hypertension; Pregnancy; Preeclampsia; Endothelium; Fibronectin; Morphology.
INTRODUCCIÓN
La preeclampsia (PE) es una de las complicaciones más importantes del embarazo y una de las principales causas de morbi-mortalidad materna y fetal. Su etiología sigue siendo desconocida, aunque distintos autores han propuesto hipótesis para explicarla(1).
Una de estas hipótesis se basa en una reducción de la perfusión placentaria debida a una implantación anómala. La isquemia placentaria conllevaría la producción de un agente/s responsable de la activación y/o lesión endotelial(2).
Otra de las hipótesis se fundamenta en el incremento de la relación plasmática entre lipoproteínas de muy baja densidad y la albúmina. Así, se ha demostrado un aumento de la actividad lipolítica en la PE y un acúmulo de trigliceridos en células endoteliales cuando son cultivadas in vitro en presencia de suero de gestantes afectas de PE. Asimismo, se ha puesto de manifiesto que la albúmina plasmática, o al menos alguna de sus isoformas, ejerce una acción protectora sobre las células endoteliales. Algunos autores han propuesto que la actividad protectora de la albúmina estaría disminuida en la PE, permitiendo evidenciar la toxicidad inducidad por las lipoproteínas de muy baja densidad(3,4).
La tercera hipótesis, sugiere que la etiología de la PE es una alteración inmunológica, que conllevaría a una reacción similar a la del rechazo del implante. En este caso, la activación de leucocitos, secreción de citoquinas y elastasa, y un incremento de los radicales libres, serían los responsables de la lesión endotelial(5,6).
Finalmente, también se ha sugerido una base genética de la PE, basándose en la tendencia familiar a desarrollarla. Se ha propuesto la existencia de un gen dominante de baja penetrancia probablemente dependiente del fenotipo fetal o una afectación multifactorial. En la PE, se han implicado genes de la cadena respiratoria mitocondrial y el gen del factor de necrosis tumoral (TNF)(7,8).
Todas estas hipótesis tienen un punto final común que explica los síntomas y signos de la PE: la activación y/o lesión de la célula endotelial. En este sentido, se han demostrado cambios morfológicos en el endotelio vascular de pacientes con PE(9-13). Hasta la actualidad, el estudio de la fisiopatología de la PE se ha basado en los resultados plasmáticos que reflejan una activación de la coagulación y un incremento de los marcadores de lesión endotelial(14-18). Varios autores han postulado la presencia de un factor plasmático en la PE que actuaría como responsable de la activación y posterior lesión de la célula endotelial. No obstante, este factor aún no ha podido ser identificado y su origen y mecanismo de acción siguen siendo desconocidos. Los estudios encaminados a demostrar su existencia se han realizado mediante el cultivo de células endoteliales normales expuestas in vitro al plasma/suero de pacientes con PE(2-4).
El objetivo de este trabajo fue realizar un estudio comparativo de la morfología del endotelio umbilical procedente de gestaciones complicadas con PE y sin complicaciones, con el fin de poder demostrar que las células del endotelio umbilical pueden ser un buen modelo para el estudio de la lesión endotelial en la PE.
MATERIAL Y MÉTODOS
Pacientes
La población control estaba constituida por 10 gestantes normotensas, sin antecedentes de enfermedad hipertensiva, diabetes o patología autoinmune. Las pacientes (n = 6) cumplían los criterios de PE severa según los criterios de Colegio Americano de Obstetras y Ginecólogos(19): presión arterial mayor o igual a 160/110 mm Hg a partir de las 20 semanas de gestación, proteinuria (> 3 mg/ml / 24h) y afectación multiorgánica. Los datos clínicos y de laboratorio analizados fueron: edad materna, paridad, edad gestacional al parto, presión arterial, proteinuria, forma de finalización del parto y peso de los recién nacidos.
Proceso de los cordones umbilicales
Los cordones umbilicales fueron pinzados y cortados desde la placenta, se lavaron con tampón fosfato para elimar los restos de sangre en el cordón, se sumergieron en tampón fosfato (4 ºC) y se remitieron al laboratorio con el mínimo intérvalo de tiempo. Los cordones se dividieron en dos porciones. Un fragmento de 2 cm se fijó por inmersión en formol al 10% en tampón fosfato para el estudio histológico convencional e inmunohistoquímica, y el otro fragmento de 2 cm se fijó en glutaraldehido al 2% para la realización de cortes semifinos y observación al microscopio electrónico de barrido.
Estudio morfológico
Los cordones umbilicales fijados en formol se incluyeron en parafina utilizando las técnicas convencionales, se realizaron cortes de 5 µm y se tiñeron con tricrómico de Mallory o de Von Gieson. Para el estudio inmunohistoquímico, los cortes de 5 µm se colocaron en portaobjetos preparados previamente con polylysina, se desparafinaron, se rehidrataron y se incubaron con tripsina al 0,1% durante 30 min. Tras 10 minutos de incubación con H2O2 al 3%, los cortes se incubaron, durante 1h a 37 ºC, con el anticuerpo monoclonal anti-fibronectina (mouse anti-human fibronectin antibody; FN-3E2 clone, dilución 1:400). Tras dos lavados, los cortes se incubaron con un anticuerpo secundario conjugado con biotina (goat anti-mouse, 30 minutos, temperatura ambiente, dilución 1:15). Posteriormente, los cortes se incubaron con estreptavidina conjugada con peroxidasa (peroxidase-conjugated streptavidin; 30 minutos, temperatura ambiente, dilución 1:15) y después con sustrato AEC durante 10 minutos. Los cortes se contrastaron con hematoxilina de Meyer (un minuto) y se montaron en gelatina de glicerol.
El procesado de las muestras para microscopía electrónica ha sido previamente descrita(20). Brevemente, los cordones umbilicales se fijaron durante 2h con glutaraldehido al 2% en tampón fosfato (pH 7.4; 0.1M). Tras diseccionar la vena, ésta se dividió en tres piezas, se postfijaron con tetróxido de osmio al 1% (1-2 h; 5 ºC) y se deshidrataron mediante cambios de 15-min en una serie gradual de etanol hasta el 100%. Dos de las piezas, de aproximadamente 0,5 cm, se incluyeron en resina de Spurr, y los cortes semifinos de 1 µm se tiñeron con azul de metileno al 2%. La pieza restante, de aproximadamente 1 cm, fue transferida a una mezcla gradual de amilacetato-etanol y se congeló en CO2 hasta llegar al punto crítico. Posteriormente, la vena se cortó longitudinalmente con el fin de exponer las células endoteliales y, finalmente, la muestra se montó y se cubrió con una película de oro para poder ser examinada en el microscopio de barrido (Jeol JSM 840; Cambridge Stereoscan 120 at 15 kV).
Reactivos
Todos los reactivos eran de Sigma (Madrid).
Análisis estadístico
Todos los resultados se expresan como media y rango. Se utilizó la prueba estadística U-Mann-Whitney para comparar los valores cuantitativos obtenidos en el grupo control (gestación sin complicaciones) y en el grupo de PE. Los valores de p < 0,01 se consideraron estadísticamente significativos.
RESULTADOS
Datos clínicos
La presión sanguínea sistólica y diastólica, y los niveles de proteinuria al diagnóstico fueron significativamente superiores en el grupo de gestantes con PE, como era predicible por los criterios diagnósticos. No se observaron diferencias en la edad materna ni en la presión sanguínea antes de las 20 semanas de gestación. El número de primíparas y de partos finalizados con cesárea fue superior en el grupo de gestantes afectas de PE, mientras que la edad gestacional en el momento del parto y el peso de los recién nacidos fueron inferiores en el grupo de PE (tabla 1).
Tabla 1 Datos clínicos | ||
| Normotensas | Preeclampsia | |
| (n = 10) | (n = 6) | |
| Edad materna, años | 29 (20-43) | 28 (25-32) |
| Presión sanguínea, mmHg | ||
| < 20 semanas | 115/65 | 116/71 |
| 3.er trimestre/diagnóstico | 108/62 | 170/108* |
| Proteinúria | | ++* |
| Edad gestacional al parto, semanas | 40 (38-42) | 31 (28-39)* |
| Peso recién nacido, kg | 3,4 (2,9-4,2) | 1,6 (0,9-2,9)* |
| Primigrávidas, % | 56 | 100* |
| Cesáreas, % | 13 | 75* |
| Media rango. *p < 0,01 | ||
Microscopía óptica
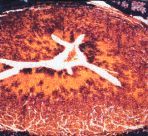
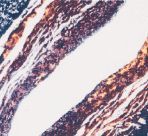
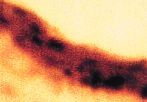
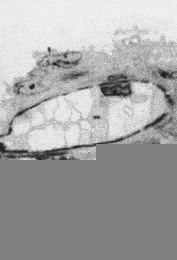
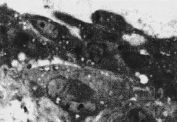
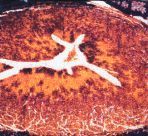
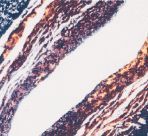
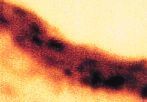
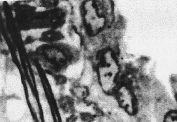
El aspecto de las arterias y vena umbilicales de cordones procedentes de gestaciones sin complicaciones (control) se muestra en las figuras 1A y 2A. En estas muestras, la íntima de las arterias y de la vena está constituida por una única capa de células endoteliales de forma más o menos alargada. Estas células presentan, en la superficie luminal, microvellosidades que se proyectaban hacia la luz del vaso. La lámina elástica está regularmente estructurada, y tiene forma sinuosa. En la vena, a nivel de la media puede observarse una segunda lámina elástica, más profunda, que aparecía esporádicamente rota. El núcleo de las células endoteliales es irregular, con invaginaciones, uno o dos nucleolos y un nucleoplasma finamente granular (Fig. 3A). Las fibras de colágeno se distribuyen irregularmente a lo largo de la pared vascular y la matriz extracelular de la zona subendotelial muestra una ligera positividad para la Fn (Figs. 1A, 2C y 2E).
A
BC
DFigura 1.Arteria umbilical procedente de gestación sin complicaciones (A, x40) y complicadas con preeclampsia (B y C x40; D x100). Tinción de Mallory (citoplasma: rojo-anaranjado; colágeno: violeta-azulado).
A
BC
DE
FGFigura 2.Vena umbilical procedente de gestaciones sin complicaciones (A, C y E) complicadas con preeclampsia (B, D, F, G). Tinción de Van Gieson (A y B x200) (núcleos: color negruzco; citoplasma: amarillo). Marcaje con antifibronectina (C y D x40; E y F x200; G x400).
En los cordones procedentes de gestaciones compliadas con PE, el diámetro de las arterias umbilicales no mostraba diferencias respecto a los controles, no obstante, se apreciaba una importante reducción del diámetro de la luz (tabla 2, Fig. 1B). Asimismo el tamaño de la vena umbilical era inferior en los cordones procedentes de gestaciones complicada con PE (tabla 2). El tejido conectivo, muestra un aspecto más denso y compacto que en los controles, observándose también un incremento del colágeno en las paredes de los vasos (Fig. 1B). En una de las muestras, destaca la presencia de espacios acelulares en la pared arterial (Figs. 1C y 1E). Las células endoteliales, presentan una forma globulosa con un incremento en el tamaño de los núcleos (Figs. 3B y 3E). Asimismo, el número y tamaño de las microvellosidades es superior al de los cordones control (Fig. 3C). En algunas zonas el endotelio aparece erosionado (falta de células endoteliales) o presentan signos de desorganización y lesión celular (protusiones, desestructuración celular, pérdida de adherencia) (Fig. 3G). Algunas células endoteliales presentan vacuolas citoplasmáticas (Fig. 3F) que, por su aspecto, parecen lipídicas. Asimismo, se aprecian células con un gran contenido lipídico (lipófagos) en la zona subendotelial (Fig. 3D). La positividad para la Fn, en el subendotelio, es mayor en los vasos de gestaciones con PE que en los controles (Fig. 2D), y aumenta en las zonas de erosión y desorganización del endotelio (Fig. 2F). También se observa reacción positiva en el interior de algunas células (Fig. 2G).
Tabla 2 Resultados morfométricos | ||
| Gestación sin complicaciones (n = 10) | Gestación con preeclampsia (n = 6) | |
| Diámetro arterial, mm | 2,1 (1,6-2,5) | 2,3 (1,5-2,7) |
| Diámetro luz arterial, mm | 1,2 (09,-1,6) | 0,4 (0,2-0,9)* |
| Diámetro de la vena, mm | 2,8 (2,5-3,2) | 1,9 (1,4-2,3)* |
| Diámetro luz de la vena, mm | 2,1 (1,5-2,6) | 1,4 (0,8-2,0)* |
| Media rango. *p < 0,01. | ||
A
BC
ED
F
GFigura 3.Vena umbilical procedente de gestación sin complicaciones (A) y complicadas con preeclampsia (B-G). Todas las imágenes x1.000.
Microscopía electrónica
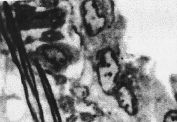
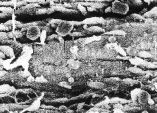
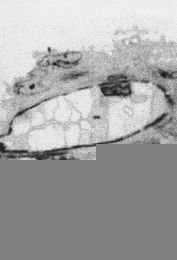
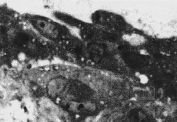
La observación al microscopio de barrido de la pared vascular en el grupo control muestra células endoteliales de forma alargada, bien organizadas en una única dirección y con una superficie relativamente rugosa. En algunas células, se observaron vesículas de secreción de forma redondeada (Fig. 4A). En las venas umbilicales de gestaciones con PE, la presencia de células con protusiones o vesículas era más frecuente, asimismo, el número y tamaño de estas vesículas era superior, dando al endotelio un aspecto rugoso y desorganizado (Fig. 4B). La orientación celular está menos definida, el endotelio aparece desorganizado y se pierde el aspecto de alineación (Fig. 4D). Era frecuente encontrar zonas erosionadas (desendotelización) y se observa un incremento de las estructuras fibrosas y de los coágulos (Figs. 4C, 4E y 4F). En algunas células, puede apreciarse una depresión superficial (Fig. 4D) y, en las paredes de los vasos, se detectaron vesículas, probablemente lipídicas, coincidiendo con las zonas de mayor erosión endotelial (Fig. 4E).
A
BC
DE
FFigura 4.Vena umbilical procedente de gestación sin complicaciones (A) y complicadas con preeclampsia (B-F). Vesículas de secreción (A, flecha). Depresión superficial (D, flecha). Vacuolas lipídicas (E, flecha).
DISCUSIÓN
Los componentes estructurales de los vasos umbilicales son de gran importancia para asegurar el correcto intercambio feto-materno. Las células endoteliales, dada su estratégica ubicación entre el flujo sanguíneo y la pared vascular presentan características morfológicas y antigénicas que reflejan la respuesta a factores microambientales, mostrando su especialización en diversas funciones. Los vasos umbilicales carecen de estructuras nerviosas, lo que sugiere un control no-neural de la circulación feto-placentaria(21). La ausencia de estructuras nerviosas, refuerza el papel de las células endoteliales en el control del flujo sanguíneo por mecanismos paracrinos. En este sentido, se ha demostrado un elevado contenido de sustancias vasoactivas en las células endoteliales de los vasos umbilicales(22).
Las alteraciones morfológicas observadas en el endotelio de los vasos umbilicales procedentes de gestaciones con PE son similares a las descritas en otros órganos(9-13) y a las observadas en los vasos umbilicales de gestantes con hipertensión gestacional sin proteinuria(23). No obstante, nuestros resultados muestran que el endotelio umbilical de gestaciones complicadas con PE está más afectado que en la hipertensión gestacional, como se demuestra por la mayor extensión de las zonas erosionadas y el elevado número de anomalías celulares. Las alteraciones morfológicas más significativas son: i) un mayor número de células con vesículas de secreción; ii) las vésiculas de secreción son de mayor tamaño y más numerosas que en los controles y son frecuentes las protusiones citoplasmáticas; ii) incremento de las fibras de colágeno y fibrina; iii) aumento de la fibronectina a nivel subendotelial e intracelular; iv) presencia de vesículas lipídicas extracelulares y lipófagos en la pared vascular, v) vacuolización de las células endoteliales; vi) desorganización y erosión del endotelio.
Las alteraciones morfológicas halladas en la placenta y arterias espirales de gestaciones con PE se han definido como «aterosis aguda» o hiperplasia aterosclerótica y son atribuibles a modificaciones en la reestructuración morfo-funcional normal de las arterias espirales durante el embarazo. Estas alteraciones se caracterizan por una infiltración, en la pared vascular lesionada, de células con un elevado contenido lipídico (lipófago)(10-12). En nuestro estudio también hemos hallado lesiones similares (Fig. 2), que no habían sido previamente descritas en vasos umbilicales.
El incremento de las vesículas de secreción y de las protusiones citoplasmáticas, sugiere una activación de la célula endotelial y, en cierto modo, el aumento de los depósitos extracelulares puede interpretarse como una consecuencia de esta activación. Así, la modulación morfo-funcional observada al comparar las características microscópicas de los cordones umbilicales procedentes de gestaciones con PE con los de gestaciones normales, fue confirmada por los hallazgos citoquímicos (incremento de las fibras de fibrina y colágeno) e inmunocitoquímicos (incremento de fibronectina). Las variaciones observadas en la cantidad de fibronectina glicoproteína de la matriz extracelular en la vena umbilical de gestaciones con PE , junto con los cambios fenotípicos de la célula endotelial, reflejan una estrecha relación entre la célula y las sustancias extracelulares. El acúmulo de estas proteínas de la matriz extracelular, especialmente en las zonas donde la erosión y descamación celular son más evidentes, puede ser debido, al menos en parte, a un incremento de la tensión mecánica ejercida sobre la pared vascular por la propia hipertensión(24). No obstante, el hallazgo de un mayor marcaje también a nivel intracelular refleja un incremento de la síntesis de esta proteína como respuesta a un estímulo microambiental anómalo. Este resultado coincide con el incremento de fibronectina plasmática en gestantes afectas de PE(11,16).
Algunos autores han sugerido que los productos de degradación de la fibronectina podrían contribuir a la lesión endotelial(25). Así, resulta interesante la propuesta de que la activación endotelial conduciría a un incremento de los depósitos extracelulares, pero que estos mismos acúmulos, podrían ocasionar la erosión del endotelio e inducir la descamación celular. Apoyando este resultado, se ha hallado un incremento de las células endoteliales circulantes en el embarazo normal, y un mayor número de estas células en las gestantes afectas de PE(11,16).
Varios autores han sugerido que la lesión endotelial en la PE tiene una base inmunológica. En este sentido, cabe destacar que las lesiones descritas en la PE son muy similares a las observadas cuando se produce el rechazo en un trasplante renal(9). La justificación de una base inmunológica en la PE se sustenta en la existencia de una alteración de la relación entre la madre y la unidad feto-placentaria. Se ha postulado que el mecanismo de acción sería la activación de complejos inmunológicos en la superficie del endotelio que conducirían a la lesión celular, al aumento de la permeabilidad, al incremento de los depósitos lipídicos y a la reorganización de los componentes extracelulares(10).
A nivel ultraestructural, otros autores han observado una reducción de la luz de los capilares en gestantes afectas de PE debido al incremento de volumen de las células endoteliales(10,11,13). Nuestros resultados también muestran una reducción en el diámetro de la vena y arterias umbilicales en cordones procedentes de gestaciones con PE. Se ha sugerido que el incremento de volumen citoplasmático y de los orgánulos celulares podría ser la causa de la lesión endotelial y su posterior descamación. Las anomalías observadas, especialmente en las mitocondrias, sugieren la existencia de una alteración metabólica sistémica en la PE, y son coincidientes con la demostración de alteraciones genéticas que afectaran a algunos de los genes de la cadena respiratoria mitocondrial(12,26).
En resumen, nuestros resultados confirman que los vasos umbilicales de gestaciones complicadas con PE muestran alteraciones morfológicas similares a las descritas en otros órganos de gestantes preeclámpticas. Este resultado permite especular que el factor circulante presente en el plasma de las gestantes con PE también puede afectar al endotelio umbilical. La importancia de esta demostración radica en que las células endoteliales procedentes de cordón umbilical es uno de los pocos tipos celulares fáciles de obtener y de estudiar in vitro mediante cultivos(27) y puede representar una fuente excelente de material feto-placentario para estudiar algunas patologías del embarazo(28), especialmente la fisiopatología de la PE.
AGRADECIMIENTOS
Los autores agradecen a Amparo Aguilar, Merce Montcusí, Dr. Jaume Folch y Dra. M.ª José Figueras su apoyo en la elaboración de este trabajo. Estos resultados corresponden parcialmente al Premio Nubiola de la Sociedad Catalana de Ginecología y Obstetricia en su convocatoria de 1997.
BIBLIOGRAFIA
1 Dekker M, Rodgers GA, Van Geijn HP. Endothelial dysfunction in preeclampsia. Part I: Primary prevention. therapeutic perspectives. J Perinat Med 1996;24:99-117.
2 Rodgers GM, Taylor RN, Roberts JM. Preeclampsia is associated with a serum factor cytotoxic to human endothelial cells. Am J Obstet Gynecol 1988;159:908-14.
3 Endresen MJ, Lorentzen B, Herniksen T. Increased lipolytic activity and high ratio of free fatty acids to albumin in sera from women with preeclampsia leads to triglyceride accumulation in cultured endothelial cells. Am J Obstet Gynecol 1992;167:440-7.
4 Arbogast BW, Leeper SC, Merrick RD, Olive KE, Taylor RN. Which plasma factors bring about disturbance of endothelial function in preeclampsia? Lancet 1994;343:340-1
5 Sibai BM. Immunologic aspects of preeclampsia. Clin Obstet Gynecol 1991;34:27-34.
6 Taylor RN. Immunobiology of preeclampsia. Am J Reprod Immunol 1997;37:78-86.
7 Arngrimsson R, Bjornsson S, Geirsson RT, Bjornsson H, Walker JJ, Snaedal G. Genetic and familial predisposition to eclampsia and preeclampsia in a defined population. Br J Obstet Gynaecol 1990;97:762-9.
8 Cooper DW, Brennecke SP, Wilton AN. Genetics in preeclampsia. Hypertens Preg 1993;12:1-5.
9 Petrucco OM, Thomson NM, Lawrence JR, Weldon MW. Immunofluorescent studies in renal biopsies in pre-eclampsia. Br Med J 1974;1:473-6.
10 Sheppard BL, Bonnar J. The ultrastructure of the arterial supply of the human placenta in pregnancy complicated by fetal growth retardation. Br J Obstet Gynaecol 1976;83:948-59.
11 Shanklin DR, Sibai BM. Ultrastructural aspects of preeclampsia. I. Placental bed and uterine boundary vessels. Am J Obstet Gynecol 1989;161:735-41.
12 Shanklin DR, Sibai BM. Ultrastructural aspects of preeclampsia. II. Mitochondrial changes. Am J Obstet Gynecol 1990;163:943-53.
13 Barton JR, Hiett AK, O''Connor WN, Nissen SE, Greene JW. Endomyocardial ultrastructural findings in preeclampsia. Am J Obstet Gynecol 1991;165:389-91.
14 Kobayashi H, Terao T. Preeclampsia as chronic disseminated vascular coagulation. Gyn Obstet Invest 1987;24:170-8.
15 Terao T, Maki M, Ikenoue T, Gotoh K, Murata M, Iwasaki H, Shibata J, Nakabayashi M, Muraoka M, Takeda Y. The relationship between clinical signs and hypercoagulable state in toxemia of pregnancy. Gyn Obstet Invest 1991;31:74-85.
16 Friedman SA, De Groot CJ, Taylor RN, Golditch BD, Roberts JM. Plasma cellular fibronectin as a measure of endothelial involvement in preeclampsia and intrauterine growth retardation. Am J Obstet Gynecol 1994;170:838-41.
17 Lyall F, Greer IA. Preeclampsia: A multiafected vascular disorder of pregnancy. J Hypertens 1994;12:1339-45.
18 Bellart J, Gilabert R, Fontcuberta J, Borrell M, Miralles RM, Cabero L. Coagulation and fibrinolysis parameters in normal and in hypertensive pregnancies. Hypertens Preg 1998;17:115-24.
19 National high pressure education program working group report on high blood pressure in pregnancy. Am J Obstet Gynecol 1990;163:1691-712.
20 Figueras MJ, Guarro J. Developmental morphology and fine structure of the ascoma of Chaetomium repens. Nova Hedwigia 1988;47:469-75.
21 Sexton AJ, Turmaine M, Cai WQ, Burnstock G. A study of the ultrastructure of developing human umbilical vessels. J Anat 1996;188:75-82.
22 Sexton AJ, Loesch A, Turmaine M, Miah S, Burnstock G. Electron-microscopic immunolabelling of vasoactive substances in human endothelial cells and their actions in early and late pregnancy. Cell Tissue Res 1996;284:167-75.
23 Pugnaloni A, Salvolini E, Lucarini G, Staffolani R, Cester N, Mazzanti L, Castaldini C, Tietz C, Biagini G, Romanini C. The human umbilical vein in normal, hypertensive and diabetic pregnancies: immunomorphological and ultrastructural evidence. Gyn Obstet Invest 1995;39:239-46.
24 Saouaf R, Takasaki I, Eastman E, Chobanian AV, Brechea P. Fibronectin biosynthesis in the rat aorta in vitro: changes dur to experimental hypertension. J Clin Invest 1991;88:1182-9.
25 De Jager CA, Shephard EG, Robson SC, Jasikiewicz K, Froese S, Anthony J, Kirsch RE. Degradation of fibronectin in association with vascular endothelial disruption in preeclampsia. J Lab Clin Med 1995;125:522-30.
26 Folgero T, Storbakk N, Torbergsen T, Oian P. Mutations in mitochondrial transfer ribonucleic acid genes in preeclampsia. Am J Obstet Gynecol 1996;174:1626-30.
27 Jaffe EA, Nachman RL, Becker CG, Minick CR. Culture of endothelial cells from umbilical veins. J Clin Invest 1973;52:2745-56.
28 Sobrevia L, Jarvis SM, Yudilevich DL. Adenosine transport in cultured human umbilical vein endothelial cells is reduced in diabetes. Am J Physiol 1994;267:c39-47.