ARTÍCULOS ORIGINALES
Obstetricia
Patrones cardiotocográficos y conductuales fetales en gestantes heroinómanas en relación con la ingesta de metadona
Fetal cardiotocographic and behavioral patterns in pregnant heroin addicts in relation to methadone intake
J. L. Trujillo
M. Álvarez1
F. J. Trujillo
J. I. Mederos
A. González1
J. Parache
Departamento de Obstetricia y Ginecología
Hospital Universitario de Canarias, Tenerife
1 Servicio de Fisiopatología Fetal. Departamento de Obstetricia
Hospital Maternal «La Paz». Madrid
Correspondencia:
Dr. José Luis Trujillo Carrillo
Departamento de Obstetricia y Ginecología
Hospital Universitario de Canarias
Ofra, s/n. La Laguna. Tenerife
Fecha de recepción: 1/9/98
Aceptado para publicación: 27/1/99
RESUMEN
El Plan de Mantenimiento con Metadona (PMM) se emplea desde hace años en embarazadas adictas, pues son conocidas las ventajas médicas y sociales de sustituir la heroína por metadona en gestantes. La pauta más aceptada es el mantenimiento de la dosis mínima necesaria hasta el final de la gestación. El feto está rodeado por unas concentraciones de metadona comparables a las séricas maternas y se sabe muy poco del mecanismo de acción de este producto sobre el mismo. En este estudio pretendemos evaluar el efecto de la metadona en el feto a término a través del análisis del registro cardiotocográfico basal y de algunos parámetros conductuales. Para ello hemos seleccionado 15 pacientes gestantes heroinómanas que no presentaban otra patología obstétrica o médica, en las que se practicaron registros basales y ecografías conductuales previos y posteriores a la ingesta de metadona. Se encontró una disminución significativa en la frecuencia de movimientos fetales y aceleraciones transitorias, ocurriendo esto precozmente tras la ingesta. Es por ello que la disminución de la reactividad fetal expresada en forma de registro cardiotocográfico no reactivo debe de ser interpretada cuidadosamente en este tipo de paciente para evitar conductas agresivas innecesarias.
PALABRAS CLAVE
Embarazo; Metadona; Registro basal; Movimientos respiratorios; Movimientos fetales; Tono fetal.
SUMMARY
Methadone maintenance plans (MMP) have been used for years in pregnant drug addicts because of the known medical and social benefits of replacing heroin with methadone in pregnant women. The most widely accepted guideline for use is to maintain the minimum required dose until the end of the pregnancy. A consequence of MMP is that the fetus is exposed to methadone concentrations similar to those found in maternal serum. We evaluated the effect of methadone on the term fetus by analyzing baseline cardiotocographic recordings and some behavioral parameters. A selection was made of 15 pregnant heroin addicts with no other obstetrical or medical pathology. Baseline recordings and behavioral echographs were recorded before and after methadone intake. A significant reduction in the frequency of fetal movements and transitory acceleration was observed soon after methadone intake. For this reason, reduced fetal activity in the form of a non-reactive cardiotocographic recording should be interpreted cautiously in order to avoid unnecessarily aggressive measures.
KEY WORDS
Pregnancy; Methadone; Baseline recording; Respiratory movements; Fetal movements; Fetal tone.
INTRODUCCIÓN
La adicción a opiáceos asociada al embarazo es un problema que afecta a un importante número de pacientes en los estratos socioculturales más bajos de las regiones urbanas. El Plan de Mantenimiento con Metadona (PMM) se emplea desde hace años en embarazadas adictas, pues son conocidos los beneficios de sustituir la heroína por metadona en gestantes, permaneciendo como principal opción terapéutica hasta la actualidad(1,2). Idealmente se debe captar a las pacientes desde etapas muy precoces de la gestación o incluso antes de la misma, lo que no es siempre fácil por motivos sociales y clínicos. Este tratamiento presenta otras ventajas de índole social como son el permitir el acceso de estas pacientes a un control prenatal adecuado conjunto por un obstetra y un equipo de atención al toxicómano (médico-psicólogo-asistente social), así como la suspensión del empleo de drogas que elimina la conducta ilegal. Además, la metadona previene las fluctuaciones de niveles de heroína en sangre, mejora la nutrición materna y facilita el acercamiento de estas pacientes a la rehabilitación psicosocial(3). Otras ventajas son las relativas a la mejora de la morbimortalidad perinatal al permitir controlar el síndrome de abstinencia neonatal. El síndrome de abstinencia neonatal que producen los opiáceos puede perdurar 4-6 meses tras el nacimiento(4), habiéndose descrito incluso la muerte súbita del lactante(5). El origen de este síndrome de abstinencia y de otras alteraciones conductuales es multifactorial (efectos farmacológicos, factores medioambientales e incluso genéticos). En cualquier caso, es indiscutible la conveniencia del PMM frente al uso de heroína y los riesgos que conlleva, puesto que se consigue un estado materno y neonatal más controlable y estable, y con menos complicaciones, aunque éstas pueden seguir existiendo(6).
En la embarazada la metadona se administra por vía oral. Pensando en el beneficio fetal, se recomienda ir reduciendo la dosis de metadona hasta lograr la menor dosis tolerada. Aunque en pacientes no embarazadas se reduce progresivamente hasta su extinción, en gestantes la pauta más aceptada es el mantenimiento de la dosis mínima necesaria hasta el final de la gestación para evitar tanto el síndrome de abstinencia materno como que se desencadene un parto prematuro o que la paciente vuelva a depender de la heroína(7).
Según los trabajos de Hope, et al.(7, 8), la metadona se puede encontrar en plasma materno, orina y líquido amniótico, de forma que el feto está rodeado por unas concentraciones comparables a las séricas maternas. El hígado fetal(9) puede ser de menor importancia que el del adulto a la hora de eliminar la droga, pero los metabolitos conjugados de la metadona persisten en el feto porque su paso por la placenta está limitado. La droga intacta se acumula en líquido amniótico y de ahí puede volver al feto o seguir eliminándose vía membranas fetales.
Se sabe muy poco del mecanismo de acción de la metadona sobre el feto y neonato. En modelos animales se han demostrado efectos sobre el cerebro, y por tanto, en el comportamiento(4). Este fármaco es un analgésico opiáceo sintético de vida media-larga, depresor del sistema nervioso central (SNC). Parece que la metadona intraútero retrasa el desarrollo de las neuronas estriadas colinérgicas(10). Además, en la rata produce hiperexcitabilidad del SNC(11) y disminuye el peso al nacimiento. También en modelos animales se ha visto que altera el receptores opioides centrales(12). Al parecer, en modelos placentarios in vitro, actúa mediante una «down regulation» de los receptores Kappa del trofoblasto(13,14).
En este estudio pretendemos evaluar el efecto de la metadona en el feto a término a través del análisis del registro cardiotocográfico basal y de algunos parámetros conductuales, antes y después de la ingesta del fármaco.
MATERIAL Y MÉTODO
Entre diciembre de 1996 y enero de 1998 hemos seleccionado prospectivamente para la realización de este estudio a un total de 15 pacientes gestantes heroinómanas, seis de ellas adictas alguna vez por vía parenteral (ADVP) y nueve sólo por vía aérea. Todas estaban incluidas en PMM en sus correspondientes Centros de Atención al Drogodependiente (CAD) y se sometieron a los protocolos de gestación de alto riesgo de gestantes heroinómanas seguidos en las consultas prenatales del Hospital Universitario de Canarias y del Hospital Maternal La Paz. La edad media de estas pacientes fue de veinticuatro años (rango diecinueve-treinta y cuatro años). La edad gestacional se pudo calcular certeramente en todos los casos mediante ecografía realizada en el primer trimestre de la gestación. La edad gestacional media en el momento del estudio fue de 38 semanas (rango entre 37 y 40 semanas). Cinco de las pacientes presentaban anticuerpos frente al Virus de la Inmunodeficiencia Humana (VIH), todas ellas se encontraban en estadio subclínico y fueron tratadas según ensayo ACTG-076 con Zidovudina. En todos los casos se pudo realizar un seguimiento prenatal completo desde el diagnóstico de la gestación en el primer trimestre hasta el parto. Todas las pacientes presentaban gestaciones únicas y el embarazo transcurrió en ausencia de patología médica-obstétrica de importancia. En todos los casos se obtuvo un resultado perinatal satisfactorio con test de Apgar superior a 7/7, peso del recién nacido superior a 2.500 g y ausencia de síndrome de abstinencia neonatal.
La administración de metadona se llevaba a cabo diariamente en los CAD, donde además se hacía un seguimiento de los aspectos toxicológicos y psico-sociales de la gestante por el equipo terapéutico (médico-psicólogo-asistente social). Se utilizaba fórmula líquida por vía oral y ni la paciente ni el familiar responsable conocían el producto y la dosis recibida. Se realizó en todos los casos una pauta de mantenimiento, esto es, partiendo de una dosis inicial calculada individualmente según el consumo actual, se reducía hasta lograr la menor dosis efectiva o hasta llegar a un mínimo de 20 mg/día, y una vez conseguido se mantenía esta dosificación hasta el momento del parto.
La evaluación cardiotocográfica fetal se realizó con un aparato Hewlett Packard Series 50IX, que dispone de actograma para la detección de movimientos fetales. La comprobación del estado conductual fetal se llevó a cabo con un ecógrafo Toshiba Sonolayer SSA-250A. La metódica seguida fue la siguiente: entre las 8:00 y 8:30 horas la paciente desayunaba; entre las 9:00 y 9:30 horas se practicaban el primer registro basal y ecografía conductual (premetadona); la ingesta de metadona se realizaba entre las 12:00 y 13:00 horas; la paciente almorzaba entre las 14:00 y 15:00 horas; entre las 15:00 y 16:00 horas se llevaba a cabo el segundo registro basal y ecografía conductual (postmetadona 1); y 3-4 horas después, es decir a las seis horas de la ingesta de la metadona, se completaba el estudio con el tercer registro basal y ecografía conductual (postmetadona 2). A todas las pacientes se les practicó una determinación de metabolitos en orina de cannabis, opiáceos, y cocaína en el momento de realizar el último control.
En el registro cardiotocográfico se analizaban durante 30 minutos las características de la frecuencia cardiaca fetal (FCF): basal, ascensos transitorios, desaceleraciones y variabilidad a corto plazo; en la línea del actograma se recogían los movimientos fetales y en el registro de la dinámica la existencia de contracciones y trazado sugestivo de movimientos fetales. El registro era informado como reactivo ante la existencia de un mínimo de cinco ascensos transitorios, oscilaciones superiores a cinco latidos por minutos y ausencia de desaceleraciones. La evaluación del patrón conductual se realizó mediante la observación ecográfica durante un período de 20 minutos del tono fetal, movimientos diafragmáticos y movimientos de extremidades. Los movimientos fetales de extremidades y diafragmáticos se puntuaron de 0 a 3 (0 = ausencia; 1 = presencia aislada en menos del 10% del tiempo de observación; 2 = presencia entre el 10% y el 50% del tiempo de observación; y 3 = presencia en más del 50% del tiempo de observación). También el tono fetal recibió una puntuación de 0 a 3 (0 = deflexión; 1 = flexión troncular y no de miembros; 2 = flexión troncular y miembros incompleta; 3 = flexión completa).
RESULTADOS
La dosis media administrada en las pacientes en el momento de ser sometidas a este estudio fue de 32 mg/día con un rango de 20 a 40 mg/día. En cuatro pacientes se detectó consumo de cannabis en las determinaciones urinarias de metabolitos.
En el control premetadona todos los registros basales menos uno fueron reactivos. Los patrones conductuales fueron: a) movimientos fetales: un punto en cinco ocasiones, dos puntos en seis pacientes y tres puntos en cuatro oportunidades; b) movimientos respiratorios: dos puntos en nueve ocasiones y tres puntos en seis pacientes; c) tono fetal: dos puntos en siete ocasiones y tres puntos en ocho pacientes.
En el control postmetadona 1 los registros basales fueron no reactivos en once ocasiones y reactivos en las cuatro restantes, se apreció pérdida relativa de la variabilidad de la FCF con respecto a la recogida en el registro premetadona en todas las pacientes. Los patrones conductuales fueron: a) movimientos fetales: cero puntos en seis ocasiones, un punto en ocho pacientes y dos puntos en una oportunidad; b) movimientos respiratorios: cero puntos en cinco ocasiones, un punto en tres oportunidades y dos puntos en siete pacientes; c) tono fetal: un punto en seis ocasiones y dos puntos en nueve pacientes.
En el control postmetadona 2 los registros basales fueron reactivos en las quince gestantes y se objetivó mejora de la variabilidad de la FCF respecto a la encontrada en el control postmetadona 1 en todas las pacientes. Los patrones conductuales fueron: a) movimientos fetales: un punto en una ocasión, dos puntos en trece pacientes y tres puntos en una oportunidad; b) movimientos respiratorios: un punto en una paciente, dos puntos en once oportunidades y tres puntos en tres ocasiones; c) tono fetal: dos puntos en nueve ocasiones y tres puntos en seis pacientes.
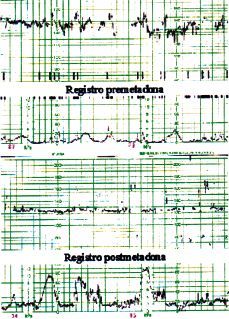
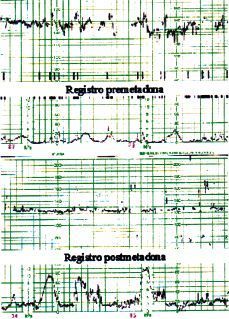
Los resultados obtenidos se pueden apreciar agrupados en cada paciente en la tabla 1. En la Figura 1 puede observarse el registro cardiotocográfico basal reactivo y el no reactivo realizado en la misma paciente cuatro horas después de la ingesta de metadona.
Tabla 1 Resultados obtenidos referidos a cada paciente | |||||||||||||||
| Caso | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 |
| Edad | 27 | 23 | 19 | 28 | 22 | 25 | 19 | 23 | 25 | 25 | 30 | 32 | 33 | 34 | 26 |
| EG | 38 | 38 | 40 | 39 | 40 | 39 | 40 | 40 | 39 | 38 | 39 | 37 | 37 | 37 | 38 |
| Metadona (mg/dia) | 20 | 40 | 35 | 40 | 35 | 25 | 30 | 35 | 25 | 35 | 30 | 40 | 40 | 40 | 20 |
| Mtb. en orina | C | C | N | N | N | N | N | C | N | N | N | N | C | N | N |
| REGISTRO BASAL | |||||||||||||||
| Premetadona | R | R | R | R | R | R | R | R | R | R | R | NR | R | R | R |
| Postmetadona 1 | NR | R | R | R | R | NR | NR | NR | NR | NR | NR | NR | NR | NR | NR |
| Postmetadona 2 | R | R | R | R | R | R | R | R | R | R | R | R | R | R | R |
| MOV. FETALES | |||||||||||||||
| Premetadona | 3 | 3 | 1 | 2 | 1 | 2 | 1 | 2 | 2 | 1 | 2 | 3 | 1 | 3 | 2 |
| Postmetadona 1 | 2 | 0 | 0 | 1 | 1 | 1 | 0 | 1 | 0 | 0 | 1 | 1 | 0 | 1 | 1 |
| Postmetadona 2 | 3 | 2 | 2 | 2 | 2 | 2 | 1 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 |
| MOV. RESPIRATORIOS | |||||||||||||||
| Premetadona | 3 | 2 | 2 | 2 | 2 | 3 | 2 | 3 | 3 | 2 | 2 | 3 | 2 | 2 | 3 |
| Postmetadona 1 | 2 | 0 | 2 | 0 | 1 | 2 | 0 | 2 | 2 | 2 | 0 | 1 | 1 | 0 | 2 |
| Postmetadona 2 | 3 | 2 | 2 | 2 | 2 | 2 | 3 | 1 | 3 | 2 | 2 | 2 | 2 | 2 | 2 |
| TONO FETAL | |||||||||||||||
| Premetadona2 | 2 | 3 | 2 | 2 | 2 | 3 | 3 | 3 | 2 | 2 | 2 | 3 | 3 | 3 | 3 |
| Postmetadona 1 | 1 | 2 | 2 | 1 | 1 | 1 | 2 | 2 | 2 | 1 | 1 | 2 | 2 | 2 | 2 |
| Postmetadona 2 | 3 | 2 | 2 | 2 | 3 | 2 | 2 | 3 | 2 | 2 | 3 | 2 | 2 | 3 | 3 |
| EG: Edad Gestacional. Mtb.: Metabolitos. MOV.: Movimientos. N: Negativo. C: Cannabis. R: Reactivo. NR: No Reactivo. | |||||||||||||||
Figura 1. Parte superior: registro basal correspondiente a la paciente nœm. 7, cumpliendo todos los criterios de reactividad. Parte inferior: registro a las cuatro horas de la ingesta de metadona correspondiente a la misma paciente núm. 7. Nótese la ausencia de ascensos transitorios y disminución de la variabilidad de la FCF, en este caso secundario a la ingesta de metadona y no como consecuencia de hipoxia fetal.
DISCUSION
Hemos encontrado escasos estudios que describan la influencia de la metadona sobre el comportamiento fetal. Archie(15) fue el primero en estudiar la reactividad fetal en relación con la dosis materna de metadona, encontrando una disminución significativa en la frecuencia de movimientos fetales y aceleraciones transitorias, ocurriendo esto muy precozmente, ya que la metadona por vía oral se absorbe rápidamente, sus niveles alcanzan un máximo a las cuatro horas(16) y atraviesa la barrera placentaria fácilmente(17). Wittmannen(18) estudió en siete pacientes la actividad fetal ecográfica y encontró también una disminución en los movimientos del cuerpo, movimientos respiratorios, así como períodos de inactividad absoluta, sobre todo en ingestas de dosis única frente a las dosis repartidas, que son las que aconseja. Levine(1) comunicó que la ingesta materna de metadona puede deprimir el estado de alerta fetal de forma que dificulta transitoriamente la interpretación de los registros cardiotocográficos y perfiles biofísicos en los que se refleja un estado de hipoactividad transitoria.
Eventualmente este efecto depresor de la metadona sobre la reactividad fetal podría verse influenciado por la toma de otras drogas, estados de malnutrición, y otras patologías que pueden concomitar en este tipo de pacientes. En este estudio hemos seleccionado a un grupo de heroinómanas que realizaron un adecuado control prenatal y en las que se descartó la coexistencia de otra patología trascendente o ingesta de drogas por determinación de metabolitos de consumo, de tal forma que, presumiblemente, se ha podido aislar el efecto de la metadona sobre la reactividad fetal estudiada en los registros cardiotocográficos convencionales y en los estados conductuales propuestos.
Es conocido que se precisa de una integridad no sólo física sino también funcional del SNC del feto para obtener un patrón cardiotocográfico reactivo normal como lo entendemos en la práctica clínica y que la metadona puede interferir en esta integridad funcional(15). Es por ello que la disminución de la reactividad fetal expresada en forma de registro cardiotocográfico no reactivo debe de ser interpretada cuidadosamente en este tipo de paciente para evitar conductas agresivas innecesarias. Como hemos podido comprobar en este estudio tras a las tres-cuatro horas de la ingesta de metadona, coincidiendo con la hipotética máxima concentración sérica, se produce una disminución de la reactividad fetal con expresión clínica en forma de registros cardiotocográficos no reactivos, disminución de la variabilidad de la FCF y de los indicadores de estado conductual que hemos considerado. Se trata de un efecto transitorio y no indicativo de sufrimiento fetal en los términos clásicos, como queda de manifiesto por la recuperación de estos mismos parámetros a las seis horas de la ingesta de la metadona y la constatación del estado perinatal normal en todos las pacientes incluidas en el estudio y como, además, queda corroborado por otros trabajos en los que se demuestra que la metadona no compromete explícitamente la función fetoplacentaria(19).
Creemos que en la práctica clínica habitual es necesario que el registro cardiotocográfico basal y los estudios inspirados en la observación de los estados conductuales fetales como el perfil biofísico se realicen al menos seis horas tras la ingesta de metadona para obtener un adecuado marco de la reactividad fetal real. Expresado de otra forma, proponemos que en estas pacientes los controles biofísicos se lleven a cabo en horario de tarde si la ingesta de la metadona se realiza por la mañana. También creemos que por este motivo serían de especial utilidad en pacientes en PMM la realización de ecografía-doppler o el test de oxitocina, cuya interpretación se ve menos influenciada por los efectos depresores de la metadona sobre el feto.
BIBLIOGRAFIA
01 Levine A, Rebarber A. Methadone maintenance treatment and the nonstress test. J Perinatol 1995;15:229-31.
02 Jarvis MA, Schnoll SH. Methadone treatment during pregnancy. J Psychoactive Drugs 1994;26:155-61.
03 Finnegan LP. Treatment issues for opioid-dependent women during the perinatal period. J Psychoactive Drugs 1991;23:191-201.
04 Hutchings DE, Zmitrovich A, Church S, Malowany D. Methadone during pregnancy: the search for a valid animal model. Ann Ist Super Sanita 1993;29: 439-44.
05 Kandall SR, Gaines J, Habel L, Davidson G, Jessop D. Relationship of maternal substance abuse to subsequent sudden infant death syndrome in offspring. J Pediatr 1993;123:120-6.
06 Vering A, Seeger J, Becker S, Halberstadt E, Bender HG. Heroinabusus und Methadon-Substitution in der Schwangerschaft. Geburtshilfe-Frauenheilkd 1992;52:144-7.
07 Doberczak TM, Kandall SR, Friedmann P. Relationship between maternal methadone dosage, maternal-neonatal methadone levels, and neonatal withdrawal. Obstet Gynecol 1993; 81:936-40.
08 Pierce TL, Hope W. Methadone levels in plasma, urine, and amniotic fluid of methadone-treated pregnant rats. Pharmacol Biochem Behav 1994;49:101-4.
09 Rurak DW, Wright MR, Axelson JE. Drug disposition and effects in the fetus. J Dev Physiol 1991;15:33-44.
10 Robinson SE, Guo H, Spencer RF. Prenatal exposure to methadone delays the development of striatal cholinergic neurons. Brain Res Dev Brain Res 1993;76:239-48.
11 Hutchings DE, Zmitrovich AC, Brake SC, Church SH, Malowany D. Prenatal administration of methadone in the rat increases offspring acoustic startle amplitude at age 3 weeks. Neurotoxicol Teratol 1993;15:157-64.
12 Darmani NA, Schnoll SH, Pandey U, Mart’n BR. Chronic prenatal methadone exposure alters central opioid mu-receptor affinity in both fetal and maternal brain. Neurotoxicol Teratol 1992;14:265-71.
13 Cemerikic B, Zamah R, Ahmed MS. Opioid tolerance in human placenta due to in vitro methadone administration. J Pharmacol Exp Ther 1995;273:987-94.
14 Ahmed MS, Cemerikic B, Mou S, Agbas A. Effects of methadone use during pregnancy on human placental opioid receptors. Membr Biochem 1993;10:91-8.
15 Archie CL, Lee MI, Sokol RJ, Norman G. The effect of methadone treatment on the reactivity of the nonstress test. Obstet Gynecol 1989;74:254-5.
16 Inturrisi CE, Verebely K. The levels of methadone in the plasma in methadone maintenence. Clin Pharmacol Ther 1972;5:633-7.
17 Inturrisi CE, Blinick C. The quantitation of methadone in human amniotic fluid. Res Commun Chem Pathol Pharmacol 1973;6:353-6.
18 Wittmann BK, Segal S. A comparison of the effects of single- and split-dose methadone administration on the fetus: ultrasound evaluation. Int J Addict 1991;26:213-8.
19 Hein PR, Schatorje JS, Frencken HJ, Segers MF, Thomas CM. The effect of chronic oral methadone treatment on monkey chorionic gonadotropin, estradiol, dehydroepiandrosterone sulfate, progesterone, prolactin and cortisol levels during pregnancy in the cynomolgus monkey (Macaca fascicularis). Eur J Obstet Gynecol Reprod Biol 1991;38:145-50.