(Actualizado en 2004)
INTRODUCCIÓN
Las enfermedades tiroideas son la segunda alteración endocrina en las mujeres en edad reproductiva, hecho que hace frecuente la asociación de gestación y de una disfunción tiroidea.
En este sentido sabemos que6,19:
Tanto el hipertiroidismo como el hipotiroidismo pueden tener su primera manifestación durante el embarazo.
El embarazo influye en la normal función del tiroides.
Las disfunciones tiroideas pueden afectar a la fertilidad de la mujer, el curso del embarazo establecido, la salud fetal y el estado materno y del recién nacido en el posparto.
Las funciones tiroideas materna y fetal están íntimamente ligadas.
Los cambios gravídicos pueden simular en ocasiones la sintomatología de las alteraciones tiroideas.
Cuadros gestacionales, como la hiperemesis gravídica o la mola hidatiforme pueden alterar también la función tiroidea. Debido a esta influencia recíproca entre gestación y enfermedad, es necesario una buena comunicación entre el endocrinólogo y el obstetra.
FISIOLOGÍA
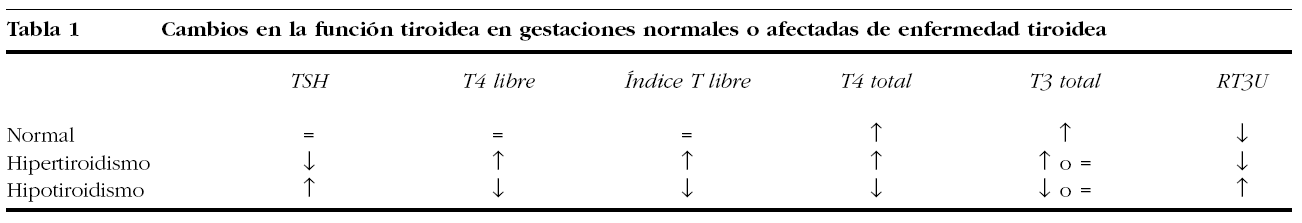
En la tabla 1 se pueden observar los cambios de la función tiroidea, tanto en gestaciones normales como en embarazos complicados con enfermedad tiroidea. Los requerimientos diarios de yodo en una mujer gestante se estiman en 200-300 μg/día16. Con respecto al paso trasplacentario de las diferentes hormonas tiroideas y de distintas medicaciones que se emplean en el tratamiento de las enfermedades tiroideas hay que señalar lo siguiente:
TSH materna: no atraviesa la placenta.
T4-T3 maternas: sólo pequeñas fracciones atraviesan la placenta.
TRH, yodo, TSI, TBII: cruzan la placenta.
Tioamidas (propiltiouracilo [PTU], metimazol): cruzan la placenta.
Bloqueadores beta adrenérgicos: cruzan la placenta.
El tiroides fetal comienza a concentrar yodo desde las semanas 10-1219 y tiene el control hipofisario mediante la TSH desde la semana 20 de gestación.
HIPOTIROIDISMO
Diagnóstico
El hipotiroidismo clínico se presenta en torno al 0,5% de todos los embarazos19. Se debe sospechar ante la presencia de los síntomas clásicos. La ausencia de bocio no debe ser causa para descartar la sospecha. Se estima que un tercio tiene los síntomas clásicos, otro tercio moderados y el restante es asintomático a pesar de existir una alteración funcional evidente15.
Los síntomas clásicos del hipotiroidismo consisten en una "reducción de la actividad metabólica". Por ello, se asocia astenia, estreñimiento, intolerancia al frío, calambres musculares, caída del cabello, piel seca, reflejos tendinosos con fase de reposo prolongada y síndrome del túnel carpiano.
En muchas ocasiones es difícil descubrir el cuadro debido al hipermetabolismo que supone el embarazo per se19.
La confirmación diagnóstica se realiza mediante analítica sérica:
Aumento de TSH con descenso de T4 y T3.
Los anticuerpos antimicrosomales y antitiroglobulina.
La determinación sérica de T3 no es útil en el diagnóstico de hipotiroidismo10.
La determinación de anticuerpos antitiroideos es útil para el diagnóstico de la enfermedad de Hashimoto y para predecir el hipotiroidismo neonatal y la tiroiditis posparto19. Si los anticuerpos antitiroideos están presentes en el primer trimestre, desarrollan hipotiroidismo el 40% de las pacientes6.
Todavía no hay datos que avalen la realización de un cribado gestacional para detectar el hipotiroidismo1. No obstante, algunos autores recomiendan el cribado en grupos de riesgo elevado15: tratamiento previo de hipertiroidismo; irradiación cervical previa a altas dosis; tiroiditis posparto previa; bocio; historia familiar de enfermedad tiroidea; tratamiento con amiodarona; sospecha de hipopituitarismo; diabetes mellitus tipo 1.
También podrían ser susceptibles de cribado grupos de riesgo moderado, tales como: cualquier endocrinopatía o cualquier enfermedad autoinmune, toma de medicaciones que interfieran la función tiroidea o la hiperlipidemia.
Diagnóstico diferencial
Tiroiditis de Hashimoto
Se caracteriza por la presencia de anticuerpos antiperoxidasa (en casi todos los pacientes) y anticuerpos antitiroglobulina (50-70% de los pacientes)19. Su prevalencia en mujeres en edad genésica es del 8-10%, y el 75-80% de los pacientes con tiroiditis de Hashimoto están eutiroideos19. Ante la presencia de una tiroiditis de Hashimoto con un nódulo dominante, se recomienda punción de la glándula para descartar un linfoma o un carcinoma tiroideo17.
Hipotiroidismo postratamiento ablativo
El hipotiroidismo secundario al tratamiento ablativo del hipertiroidismo, tanto con cirugía como con 131I, es la segunda causa de hipotiroidismo en mujeres en edad gestante.
Fármacos
Antitiroideos: tionamidas, yoduros, litio.
Inductores enzimáticos que aceleran el aclaramiento de tiroxina19: carbamazepina, fenitoína, rifampicina.
Amiodarona: inhibe la conversión de T4 en T3 y puede interferir en la acción de la T319.
Hidróxido de aluminio, colestiramina, sulfato ferroso y sucralfato: pueden alterar la absorción intestinal de levotiroxina19.
Déficit de yodo
Importante en zonas endémicas de déficit de yodo, como es España. Muchas gestantes son clínicamente eutiroideas pero presentan hipotiroidismo subclínico. El diagnóstico se realiza con la determinación de yodurias. Si la concentración de yodo en orina es > 5 μ/dl o la cantidad excretada > 100 μ/día, se puede descartar una deficiencia de yodo19.
Otras causas
Tiroiditis subaguda y supurativa, hipotiroidismo subclínico.
Riesgos maternos. Influencia del embarazo en la enfermedad
Existe un riesgo aumentado de coma mixomatoso que aunque muy raro presenta una mortalidad del 20%. Se debe iniciar el tratamiento ante la sospecha clínica, sin esperar a la confirmación analítica. El tratamiento consiste en la administración inmediata de hormona tiroidea. El inicio de la respuesta se suele retrasar 12-24 h.
Riesgos fetales. Influencia de la enfermedad en la gestación
El hipotiroidismo está asociado con un aumento de fetos con peso bajo al nacer, dado que éste incrementa las probabilidades de una preeclampsia, un DPPNI o un parto pretérmino. La hipotiroxinemia, especialmente en el primer trimestre, se asocia a déficit del desarrollo motor y cognitivo del recién nacido. Otros efectos negativos son el aumento de abortos espontáneos, el riesgo de pérdida del bienestar fetal, las malformaciones y los peores resultados perinatales16.
La presencia de anticuerpos antiperoxidasa predicen un riesgo incrementado de aborto y tiroiditis posparto4, más que el estado de la función tiroidea19.
El hipotiroidismo materno por déficit de yodo es el que más riesgo tiene de provocar cretinismo neonatal.
El hipotiroidismo congénito se presenta en 1/4.000-7.000 recién nacidos vivos6. Sólo el 5% presenta clínica al nacimiento, posiblemente por efecto del paso transplacentario de la hormona tiroidea materna. El cuadro es prevenible en los neonatos si se inicia el tratamiento de reposición de forma inmediata. Ésta es la razón por la que se realiza el cribado de esta metabolopatía19.
Tratamiento preconcepcional
La fertilidad está disminuida en las pacientes con hipotiroidismo. Suelen asociar cuadros de amenorrea e infertilidad. La esterilidad secundaria se suele deber a un aumento de la TRH que conlleva un aumento de la PRL19. La infertilidad secundaria se suele deber a la presencia de anticuerpos antitiroideos4. Por ello se recomienda la determinación de los anticuerpos antitiroideos en mujeres con historia de infertilidad independientemente de su función tiroidea19.
Lo ideal en el hipotiroidismo (tanto se conozca con anterioridad o se diagnostique en el transcurso de un estudio preconcepcional o de esterilidad) es lograr valores adecuados de reposición hormonal y luego intentar el embarazo. Está demostrado que las madres hipotiroideas (tanto clínicas como subclínicas) no tratadas tienen niños con desarrollo mental deficiente6. Como antes veíamos, no está claro si se deben aplicar estrategias de cribado poblacional. Algunos autores recomiendan su estudio en aquellas pacientes que realicen consulta preconcepcional, con el fin de poder tratarlas antes del embarazo6.
El tratamiento de elección en estas pacientes es la levotiroxina. Es un tratamiento seguro durante la gestación. Lo que pone en peligro a la madre y al embarazo es no cumplir el tratamiento. Se recomienda que toda paciente que haga reposición con un preparado distinto de levotiroxina, cambie a levotiroxina antes de iniciar el embarazo19.
El objetivo es normalizar la TSH4 a niveles < 2 μU/ml.
Tratamiento durante la gestación
Reposición hormonal con levotiroxina (100-200 μg/día). Las pacientes que se estén tratando con preparados distintos de levotiroxina, han de cambiar a esta última19.
Las dosis recomendadas son15:
A. Dosis inicial: 150 μg/día o 2 μg/kg peso actual/día.
B. Reajustes:
TSH elevada pero < 10 mU/ml: añadir 50 μg/día.
TSH 11-19 mU/ml: añadir 75 μg/día.
TSH ≥ 20 mU/ml: añadir 100 μg/día.
Se recomienda la ingesta por la mañana con el estómago vacío. En el primer trimestre, que las náuseas y vómitos son frecuentes, se administrará en las horas del día en que no estén presentes y asegure de esta forma un adecuado cumplimiento. Si la paciente toma suplementos de sulfato ferroso, la ingesta de los suplementos de hierro se demorará por lo menos 2 h respecto a la toma de levotiroxina15. La dosificación de levotiroxina se debe incrementar en el 80% de las gestantes hipotiroideas. El aumento de dosificación es más frecuente en el primer trimestre, con un incremento medio del 40-50% de la dosis2,8,15,19. Otros autores afirman que si el tratamiento de sustitución es de larga duración, no suele precisar incremento en la dosificación13 y que cuando la causa del hipotiroidismo es la ablación del tiroides, el 75% de las pacientes requieren aumento de dosis, frente al 47% de aquellas con hipotiroidismo secundario a una tiroiditis de Hashimoto10.
El objetivo es mantener los valores de T4 y T3 en el límite superior de la normalidad. Los valores se suelen normalizar en un período de 4 semanas. Si en este tiempo no se consigue normalizar la TSH, hay que incrementar la dosis10,19. Según otros autores, el objetivo sería la normalización de la TSH15.
Se deben hacer controles analíticos hormonales cada trimestre. Si es preciso, se pueden hacer controles más frecuentes. Si el inicio del tratamiento se realiza en la gestación, el control se efectuará cada 4 semanas. Una vez conseguida la normalización de la función tiroidea, los controles pasarán a hacerse con menor frecuencia15. En las pacientes con hipotiroidismo subclínico, se recomienda la suplementación con levotiroxina hasta la normalización de la TSH4.
En las pacientes con déficit de ingesta de yodo, la suplementación disminuye de forma significativa las muertes infantiles y previene el cretinismo con mejor desarrollo psicomotor12.
El control fetal anteparto no debe cambiar por la presencia de un hipotiroidismo materno, salvo que se presenten alteraciones asociadas (hipertensión, diabetes mellitus, etc.)15.
En caso de que se asocie bocio fetal con hipotiroidismo fetal, algunos autores postulan el uso de levotiroxina intraamniótica a dosis de 250 μg/semana. Es un tratamiento efectivo, especialmente en los casos secundarios a tratamiento con PTU18.
Tratamiento intraparto
Las pacientes con buen control no requieren medidas adicionales durante el parto.
Tratamiento posnatal
Las pacientes en tratamiento de reposición con levotiroxina que han requerido aumento de dosis durante la gestación, tras el parto han de volver a sus valores iniciales. Se ha de cuantificar la TSH a las 6-8 semanas del parto19. En el 5-10% de las mujeres tienen lugar reagudizaciones de hipotiroidismos subclínicos, aunque suelen ser más analíticas que clínicas. Ante la duda, durante el puerperio sí sería útil la determinación de anticuerpos antiperoxidasa y antitiroglobulina para el diagnóstico de hipotiroidismo.
HIPERTIROIDISMO
Diagnóstico
La asociación hipertiroidismo y embarazo se estima en el 0,2% de las gestaciones2,19. Otros autores refieren cifras en torno al 0,5%6. El cuadro clínico de la tirotoxicosis se caracteriza por una hiperactividad generalizada: nerviosismo, insomnio, temblor, taquicardia, palpitaciones, aumento del número de deposiciones, hipertensión arterial, aumento de la sudoración, intolerancia al calor, pérdida ponderal, miopatía proximal, linfadenopatía.
La enfermedad de Graves añade: exoftalmos y dermopatía (mixedema pretibial). Debemos sospechar un posible hipertiroidismo en aquellas gestantes que asocien pérdida o falta de ganancia ponderal, onicólisis y taquicardia en reposo (> 100 lat/min) que no disminuye con la maniobra de Valsalva6,19.
La confirmación diagnóstica nos la da el hallazgo de un aumento sérico de T4-T3 con descenso de TSH6,19. Valores de TSH < 0,05 μU/ml son diagnósticos de hipertiroidismo en ausencia de enfermedad hipofisaria19.
En las pocas ocasiones en que hay descenso de TSH con T4 normales, se debe determinar la T319.
El estudio inicial para confirmar un hipertiroidismo debe incluir las determinaciones de TSH y de T4 libre. En los casos en el límite de la normalidad se recomienda repetir la analítica en el plazo de 3-4 semanas, pues tanto la madre como el feto toleran bien esta situación19.
La determinación de anticuerpos no es necesaria para el diagnóstico, aunque sí aconsejable2. Otros autores recomiendan la determinación de TSI a las 28-30 semanas de gestación en todas las pacientes con enfermedad tiroidea activa o antecedente de enfermedad tiroidea autoinmune, porque puede ser útil en la predicción de la tirotoxicosis neonatal. Valores 3 veces por encima del rango alto de la normalidad son predictores de hipertiroidismo fetal19.
Diagnóstico diferencial
Si se ajusta clínicamente con enfermedad de Graves, ésta será la primera opción por confirmar, ya que es responsable del 90-95% de los casos de hipertiroidismo. Signos característicos son el bocio y el exoftalmos. La confirmación nos la dará la determinación de TSI. Los TSI están presentes en el 3% de las mujeres en edad genésica19.
La mitad de las gestantes con enfermedad trofoblástica gestacional tienen evidencia bioquímica de hipertiroidismo. Por eso, la enfermedad trofoblástica es una opción a descartar en toda paciente hipertiroidea.
Hiperemesis gravídica. El grado de estimulación tiroidea se correlaciona con la severidad de los vómitos, pero la normalización hormonal con antitiroideos no mejora el cuadro. Por ello no se recomienda el tratamiento en la mayoría de los casos. Si lo precisara, se puede optar por el metimazol vía rectal19.
Otras causas19: tirotoxicosis facticia, bocio multinodular tóxico, bocio nodular.
Hipertiroidismo subclínico. Tiene una prevalencia del 4%, la mitad por sobretratamiento de levotiroxina. Los efectos a largo plazo se desconocen, aunque se cree que pueden estar relacionados con fallo cardíaco y osteoporosis20. No se conocen los efectos en la gestación. No se recomienda tratamiento, tan sólo control6.
Riesgos maternos. Influencia del embarazo en la enfermedad
El hipertiroidismo tiene poca afectación de la fertilidad. La enfermedad no empeora con el embarazo. En los hipertiroidismos no tratados, los 2 problemas más serios que pueden aparecer son:
Insuficiencia cardíaca. Es la complicación más frecuente, que se intensifica por alteraciones del embarazo como preeclampsia, infecciones, anemia.
Crisis tirotóxica. Generalmente en gestaciones no controladas. Es un cuadro que presenta un claro riesgo vital para la madre, con una mortalidad del 20-25%.
Riesgos fetales. Influencia de la enfermedad en el embarazo
Los riesgos gestacionales aumentan cuando la enfermedad de Graves tiene más de 10 años de evolución o se ha instaurado antes de los 20 años de edad, o la tirotoxicosis gestacional acontece por encima de las 30 semanas de gestación, o los valores de anticuerpos antitiroideos son > 30% o más del límite superior en el parto14,18.
Efectos adversos sobre la gestación: aumento de la prematuridad, mortinatos, pérdida ponderal, trastornos hipertensivos del embarazo, desprendimiento prematuro de placenta normalmente inserta.
Efectos adversos sobre el feto: CIR, craneosinostosis fetal, exoftalmos, fallo cardíaco, hepatosplenomegalia, aumento de tirotoxicosis en el feto o en el neonato. Factores que pronostican una tirotoxicosis del producto son títulos altos de TSI (3-5 veces el límite superior de la normalidad)10,14,19.
La actividad de la enfermedad materna no se correlaciona necesariamente con la enfermedad fetal-neonatal19. El tratamiento materno con tionamidas puede enmascarar el cuadro neonatal. Los anticuerpos maternos se aclaran más lentamente que las tionamidas, dando lugar a una presentación tardía de la tirotoxicosis fetal. El tratamiento previo de la enfermedad de Graves con 131I o con cirugía, que logra el eutiroidismo materno, no libra del posible efecto en el feto si la paciente mantiene anticuerpos circulantes.
Tratamiento preconcepcional
Lo ideal es establecer el diagnóstico y el tratamiento antes de la gestación. Esto permite el uso de isótopos radiactivos en su diagnóstico y el tratamiento con 131I y/o cirugía con menor riesgo.
Los resultados gestacionales son mejores con tratamiento y normalización previos al embarazo que cuando se tratan inicialmente durante la gestación19.
Para las mujeres, el tratamiento previo con 131I no supone un mayor riesgo de presentar cáncer de tiroides, leucemia u otros tipos de cánceres.
Tras el tratamiento ablativo con 131I se aconseja posponer el embarazo hasta la normalización de la función tiroidea, que suele requerir entre 4 y 6 meses10. Se debe aconsejar sobre la necesidad de mantener el tratamiento antitiroideo durante el embarazo y de controles periódicos de los valores hormonales.
Tratamiento durante la gestación
Para el control fetal se recomienda ecografía, evaluación del crecimiento y el diagnóstico de bocio fetal. La aparición de un CIR o de una taquicardia fetal son indicadores de afectación fetal19.
Se indica tratamiento con antitiroideos en pacientes hipertiroideas con diagnóstico previo o realizado durante el embarazo.
Se mantiene el tratamiento previo en aquellas gestantes que estén eutiroideas a expensas del tratamiento. A las pacientes con síntomas adrenérgicos se les añade bloqueadores beta al tratamiento.
Los resultados gestacionales están en relación directa con el estado hormonal tiroideo. Las pacientes hipertiroideas no tratadas, o aquellas que permanecen hipertiroideas a pesar de tratamiento, tienen más complicaciones: parto pretérmino, mortalidad perinatal, fallo cardíaco materno, preeclampsia y CIR6,19.
Los controles que se deben plantear durante la gestación son:
Determinar TSH en la visita inicial en pacientes con tratamiento antitiroideo, para ajustar las dosis14.
Frecuencia del control gestacional adaptado a cada caso concreto (aparición o no de complicaciones).
Control de la función tiroidea en cada trimestre o, si es preciso, más frecuentemente.
La ganancia ponderal y el control de la taquicardia son 2 buenos marcadores de la respuesta terapéutica14.
Ecografía fetal seriada para control del crecimiento intrauterino (descartar CIR) y estudio del cuello fetal (descartar bocio fetal).
Control de la posible "crisis tirotóxica".
Se consideran criterios de hospitalización14:
Clínica severa.
Pacientes que no responden a los antitiroideos.
Pacientes con clínica manifiestamente diagnóstica que aparece por primera vez en la segunda mitad de la gestación.
Los objetivos del tratamiento del hipertiroidismo son:
Mantener la T4 en el límite alto de la normalidad con la cantidad mínima de fármaco, para minimizar la exposición fetal a las tionamidas.
Si se inicia el tratamiento durante la gestación, se recomienda determinar la T4 cada 2-4 semanas hasta conseguir valores deseados. En el 90% de las pacientes se objetivan mejoras en 2-4 semanas. La normalización se realiza en un tiempo medio de 7-8 semanas. El control se debe realizar con mediciones de T4, porque la TSH se mantiene suprimida durante semanas o meses. La primera determinación de TSH se realizará a los 2 meses del inicio del tratamiento. La supresión de TSH es un buen indicador de una respuesta correcta al tratamiento14,18. El uso de ß-miméticos está contraindicado porque pueden desencadenar una crisis tirotóxica11.
Tioamidas: propiltiouracilo y metimazol
Parecen igual de efectivas y seguras en el embarazo2. Ambas inhiben la síntesis de hormona tiroidea. Pero como el propiltiouracilo (PTU) también inhibe la conversión periférica de T4 en T3 se prefiere durante el embarazo2,6,7. Además, el metimazol tiene efectos secundarios como la aplasia cutis. Las tionamidas bloquean la producción de nueva hormona, así que su efecto no se detecta hasta que se consuma toda la hormona almacenada en el coloide tiroideo19.
Efectos secundarios aparecen en el 2-3% de las pacientes que toman tioamidas. Destacan la agranulocitosis (0,2%) que es una indicación para la suspensión del tratamiento, exantema cutáneo, prurito, granulocitopenia, náuseas y vómitos, diarrea. No se han observado efectos a largo plazo en los fetos que han estado expuestos a PTU intraútero.
Dosis de inicio
PTU: 100-150 mg/8 h19. Hay autores que recomiendan dosis de inicio más altas: 200 mg/8 h6.
Metimazol: 30-45 mg/día.
Ajustes de dosis
A la semana comienzan los efectos y puede que se pueda disminuir la dosis de PTU. En otras ocasiones hacen falta de 4-6 semanas.
El riesgo de tirotoxicosis materna es mayor que el que conlleva dosis altas de tionamidas (si se precisan se puede administrar hasta 200-300 mg/8 h)19. Se debe intentar conseguir la normalización cuanto antes7.
Las dosis se disminuyen entre un cuarto y un tercio cada 3-4 semanas.
El objetivo es administrar la mínima dosis necesaria, para controlar la tirotoxicosis materna sin desencadenar hipotiroidismo fetal o neonatal7,19. En alrededor del 30% de las pacientes, habrá que suprimir los antitiroideos hacia las semanas 32-36 de gestación14,19.
Vía administración
Vía oral. No existe vía parenteral. Si la paciente no tolera la vía oral, se podría preparar en forma de supositorio y administrar por vía rectal10.
Control de dosificación
Una vez que la paciente está eutiroidea, se deben realizar controles de T4 libre cada 3-4 semanas10.
Las determinaciones de TSH no son útiles porque permanecen suprimidas durante muchas semanas.
Hemograma al inicio del tratamiento y a todas las gestantes que desarrollen fiebre durante el tratamiento, para control de la agranulocitosis19. Algunos autores añaden la determinación de pruebas de función hepática10.
El 30% de las pacientes con enfermedad de Graves toleran la supresión de antitiroideos en el tercer trimestre sin que reaparezca la tirotoxicosis10.
Seguridad
No parece que estos fármacos sean teratógenos. Se estima que las pacientes hipertiroideas no tratadas tienen más malformaciones que las tratadas19.
Todas las tionamidas cruzan la placenta y se excretan en la leche, pero el metimazol lo hace en mayor proporción que el PTU19.
Se debe realizar un estudio fetal para descartar signos de hipotiroidismo fetal, bradicardias, bocio o CIR19.
La combinación de tionamidas con levotiroxina para asegurar el aporte hormonal al feto no está justificada2,14,19. Algunos autores estiman que con esta pauta se usan dosis excesivas de antitiroideos5.
Bloqueadores beta. Propranolol
Se utilizan para el tratamiento sintomático del efecto adrenérgico de las hormonas tiroideas, sobre todo la taquicardia, en pacientes con clínica exacerbada7.
La dosis empleada de propranolol suele ser de 20-40 mg/8-12 h, con una frecuencia cardíaca de 80-90 lat/min como objetivo19.
Tratamientos largos pueden tener efectos secundarios fetales, CIR, bradicardia fetal e hipoglucemia19.
Yoduro
Se usa generalmente en el preoperatorio (solución saturada de yoduro potásico; yoduro sódico) para bloquear la liberación de hormona por el tiroides. Su empleo durante 7-10 días parece seguro y algunas veces beneficioso en pacientes con tirotoxicosis severa10. El tratamiento no debe superar las 2 semanas. Su uso crónico afecta al feto induciendo bocio e hipotiroidismo7,19. En el caso de que se administre de forma accidental 131I a una gestante, se debe administrar yoduro para bloquear el tiroides y añadir tionamida. Para que el tratamiento sea eficaz, se debe instaurar en el margen de 7-10 días tras el accidente19.
Cirugía
Reservada para los pacientes que no responden al tratamiento médico o no lo toleran6. Si se ha de practicar, se prefiere realizarla en el segundo trimestre.
La cirugía no se debe recomendar sin estudio ecográfico completo y punción con aguja fina, para descartar malignidad.
Efectos secundarios del tratamiento son: hipotiroidismo, hipoparatiroidismo (1-2%) y la lesión del nervio laríngeo recurrente (1-2%). En general, se considera que tiene mayor riesgo que en las pacientes no gestantes19.
Yodo131
Está contraindicado durante el embarazo. Se debe contraindicar la gestación hasta 6 meses después del tratamiento con 131I14.
Consideraciones sobre el 131I
Algunos autores afirman que en exposiciones accidentales antes de la semana 10 de embarazo no se han publicado anormalidades fetales18, pues no ha comenzado su función hasta esas fechas10.
Si la exposición es posterior a la semana 10, se debe considerar la posibilidad de hipotiroidismo congénito. Se puede valorar una posible interrupción del embarazo2.
La lactancia está contraindicada hasta pasados 120 días del final del tratamiento.
En caso de exposición accidental al 131I, se puede intentar tratarlo con altas dosis de yodo con la intención de bloquear el tiroides18. Administrar PTU durante 10 días10.
Tratamiento intraparto
Durante el parto no existen riesgos especiales. Las exacerbaciones, incluida la crisis tirotóxica, son más frecuentes tras el parto.
Tratamiento posnatal
Cuando la causa del hipertiroidismo es autoinmune, el cuadro tiende a empeorar tras el parto. Si no está determinada la causa, el posparto es un buen momento para estudiar de forma adecuada a la paciente y dar un tratamiento definitivo. Se debe evaluar al recién nacido para descartar bocio e hipertiroidismo transitorio.
Lactancia
Propiltiouracilo
Los lactantes pueden lactar aunque se detecten pequeñas cantidades de PTU en leche materna.
Metimazol
Se considera seguro para los lactantes, pero está presente en una proporción mayor que el PTU. Algunos autores administran PTU de elección por su menor excreción en leche materna7,10,14. Se recomienda la ingesta de antitiroideos por parte materna tras amamantar14.
Tratamiento de la crisis tirotóxica
Es una verdadera emergencia médica. Ocurre en el 1% de los pacientes con hipertiroidismo y presenta una mortalidad del 25%.
Clínicamente, los pacientes suelen presentar fiebre, taquicardia desproporcionada para la fiebre, cambios mentales (agitación, convulsiones), vómitos, diarreas, arritmia cardíaca.
Se debe sospechar ante toda paciente con fiebre y estado mental alterado, se conozca o no su antecedente de hipertiroidismo4. Suelen presentar un antecedente de infección, cirugía o parto. El diagnóstico puede ser difícil. Por tanto, cuando se sospeche se debe realizar una determinación hormonal (T4, T3, TSH) e iniciar el tratamiento sin esperar la confirmación.
Tratamiento de la crisis tirotóxica en mujeres gestantes
Dosis de carga: PTU 600-800 mg oral o metimazol 60-100 mg vía rectal.
Dosis de mantenimiento: PTU 150-200 mg/4-6 h oral o metimazol 10-20 mg/8 h rectal.
Dexametasona 2 mg/6 h intravenosa (i.v.) o intramuscular (i.m.), y repetir 4 dosis.
Propranolol 20-80 mg/4-6 h oral o 1-2 mg/5 min i.v. hasta un máximo de 6 mg; entonces 1-10 mg/4 h i.v.
Si la paciente no tolera los bloqueadores beta por un broncospasmo: reserpina 1-5 mg/4-6 h i.m. o guanetidina 1 mg/kg/12 h oral o diltiazem 60 mg/6-8 h oral.
Fenobarbital 30-60 mg/6-8 h oral, como tratamiento de la agitación y para inducción enzimática y acelerar en lo posible la metabolización de la hormona tiroidea.
A las 2 h del PTU, cualquiera de las siguientes pautas: a) solución saturada de yoduro potásico 2-5 gotas/8 h; b) yoduro sódico 0,5-1,0 mg/8 h i.v.; c) solución de lugol 8 gotas/6 h; d) carbonato de litio 300 mg/6 h oral.
Tratamiento de mantenimiento de la crisis tirotóxica
Reposición de fluidos y electrolitos.
Antipiréticos: salicilatos, paracetamol, medidas físicas, compresas húmedas frías.
Aporte de calorías. Glucosa.
Tratamiento etiológico de la causa desencadenante. Si es el parto, intentar detenerlo. No dejarlo evolucionar si las indicaciones maternas son más importantes que las fetales.
Oxigenoterapia.
Digoxina para el fallo cardíaco congestivo.
TIROIDITIS POSPARTO
Diagnóstico
La tiroiditis posparto se presenta en el 5% de las mujeres que no tienen historia de enfermedad tiroidea2,13. El 10-20% de las tiroiditis no se recupera, así por cada 1.000 partos/año es de esperar un mínimo de 5 casos y un máximo de 20 casos de hipotiroidismo nuevos al año.
Existe una estrecha relación entre la presencia de anticuerpos antiperoxidasa y antitiroglobulina durante la gestación y la tiroiditis posparto. Un tercio desarrolla tiroiditis posparto. En ausencia de anticuerpos, es raro presentarla19. Si los resultados son positivos, se debe instruir a las pacientes para que consulten si presentan clínica de hiper o hipotiroidismo6,19.
La tiroiditis posparto no contraindica la lactancia materna7.
En la fase hipotiroidea, el síntoma que merece destacar es la depresión, que es 2 veces más frecuente que en las mujeres eutiroideas10.
Desde el punto de vista analítico, encontraremos valores bajos de TSH y altos de T4 libre en la fase hipertiroidea y bajos en la fase hipotiroidea, con anticuerpos antimicrosomales positivos19. Se determinarán: TSH, T4, anticuerpos antimicrosomales y antitiroglobulina. Cuanto más alto sea el título de anticuerpos, junto a TSH, más probable es desarrollar un hipotiroidismo permanente.
El riesgo de recurrencia en próximas gestaciones es del 70%17.
Puede ser que se precise usar 123I para el diagnóstico diferencial entre una tiroiditis posparto y una enfermedad de Graves posparto. Si la madre lacta, habrá que suspender 2 días la lactancia17.
Tratamiento
La fase hipertiroidea a menudo no requiere tratamiento. Si lo precisa, se basa en el tratamiento sintomático mediante bloqueadores beta6,10. El tratamiento con tionamidas no está indicado ni es eficaz porque no existe neosíntesis de hormona tiroidea10.
En ocasiones requiere tratamiento sustitutivo con levotiroxina. En estos casos, se recomienda reducir la dosis al año y evaluar si el cuadro es permanente o no. Las pacientes con clínica florida sin bocio son las que más probabilidad tienen de quedar hipotiroideas.
En próximas gestaciones se requiere control estrecho, porque tienen alto riesgo de recurrencia (10-25%), así como de quedarse hipotiroideas permanentemente6,10.
NÓDULO. NEOPLASIA DE TIROIDES
La presencia de un nódulo solitario precisa diagnóstico mediante punción para descartar una posible malignidad. La probabilidad de malignidad de un nódulo único se estima de un 5-10%10 a un 5-30%6.
Se debe determinar TSH y T4 libre para descartar un nódulo tóxico o presentación anómala de una tiroiditis de Hashimoto. Los estudios con radioisótopos están contraindicados durante la gestación19.
Si el nódulo tiene un diámetro > 5 mm, es detectable con seguridad mediante ecografía6. Un nódulo sólido > 2 cm, quístico > 4 cm, asociado a linfadenopatía cervical o que aumenta de tamaño, tienen indicación de punción6.
La gestación no altera el pronóstico del cáncer de la glándula tiroides. El tratamiento de elección es la cirugía. El 131I se pospone para el posparto.
Debido al buen pronóstico de las neoplasias bien diferenciadas (las más frecuentes), no se recomienda la interrupción de la gestación en estos casos19, salvo que haya evidencias de una enfermedad metastásica progresiva o diseminada10.
Los Protocolos Asistenciales en Ginecología y Obstetricia y los Protocolos de Procedimientos Diagnósticos y Terapéuticos de la Sociedad Española de Ginecología y Obstetricia pretenden contribuir al buen quehacer profesional de todos los ginecólogos, especialmente los más alejados de los grandes hospitales y clínicas universitarias. Presentan métodos y técnicas de atención clínica aceptadas y utilizadas por especialistas en cada tema. Estos protocolos no deben interpretarse de forma rígida ni excluyente, sino que deben servir de guía para la atención individualizada a las pacientes. No agotan todas las posibilidades ni pretenden sustituir a los protocolos ya existentes en departamentos y servicios hospitalarios.