El síndrome antifosfolipídico durante el embarazo está asociado a acontecimientos tromboembólicos, trombocitopenia, muerte fetal, crecimiento intrauterino retardado, preeclampsia grave de inicio temprano, parto pretérmino y aborto recurrente. En este artículo presentamos el caso de una preeclampsia severa en la que se realizó el diagnóstico de síndrome antifosfolipídico después del parto.
The antiphospholipid syndrome during pregnancy is associated with thromboembolic events, thrombocytopenia, fetal death, intrauterine growth retardation, early-onset severe preeclampsia, preterm birth and recurrent abortion. In this article, we present a case report of severe preeclampsia in which diagnosis of the antiphospholipid syndrome was made after delivery.
El síndrome antifosfolipídico (SAFL) es una enfermedad autoinmunitaria no inflamatoria. El término SAFL fue propuesto por primera vez en 1987 por Harris para definir a aquellos pacientes que presentaban historia de trombosis, a menudo asociada a trombocitopenia, y anticuerpos antifosfolipídicos (aAFL) positivos, aunque este síndrome se había descrito previamente por Hughes (1983) en pacientes afectados de lupus eritematoso sistémico1,2.
El SAFL es una de las causas más comunes de hipercoagulabilidad en la población general (1-5%), afecta 2–5 veces más frecuentemente a mujeres que a varones, y adquiere gran importancia durante el embarazo3. La mayoría de las características clínicas del SAFL pueden explicarse por la formación de trombos en cualquier vaso de la anatomía, independientemente del tamaño y la localización. La pérdida de las funciones de los distintos órganos es el resultado final de las múltiples trombosis que se producen en estos pacientes4.
A continuación presentamos el caso de una paciente afectada de un SAFL que debutó con una preeclampsia grave de inicio temprano en su segundo embarazo.
CASO CLÍNICOPaciente de 25 años secundigesta, nulípara, de 27 semanas, que acudió a nuestro servicio de urgencias por cefalea, visión borrosa, epigastralgia, náuseas y prurito en las manos, de 24h de evolución. En el curso de la gestación actual había ingresado 2 veces por amenaza de aborto y estaba siendo controlada de forma ambulatoria, con evolución normal del embarazo. Entre los antecedentes personales destacaban una interrupción legal del primer embarazo por feto polimalformado e hipotirodismo reciente en tratamiento con levotiroxina. Las constantes que presentaba en urgencias eran: una presión arterial (PA) de 160/90mmHg, una temperatura de 36,8°C y una frecuencia cardíaca de 85 latidos por minuto (lpm). En la exploración física llamaban la atención los edemas en facies, maléolos y muñecas, con una ganancia ponderal de 15kg. En la ecografía obstétrica se observó un feto varón vivo, con un retraso del crecimiento de 3 semanas respecto a la fecha de última regla, estructuras fetales aparentemente normales, placenta anterior normoinserta de grado II, líquido amniótico normal, Doppler de la arteria umbilical con flujo diastólico mínimo, índice de resistencia de la arteria cerebral media en el límite bajo y ductus venoso anterógrado. El hemograma, la coagulación, las pruebas de función hepática y el resto de parámetros de la bioquímica fueron normales. En el análisis sistemático y de sedimento de orina destacaba una proteinuria +++. Se diagnosticó a la paciente de preeclampsia grave e se la ingresó en la planta de maternidad para tratamiento antihipertensivo oral (metildopa), maduración pulmonar fetal (betametasona) y analgesia.
A las 18h del ingreso, la paciente presentó PA de 180/100mmHg, por lo que se decidió el traslado a la unidad de reanimación de anestesia (REA) para control y seguimiento de la PA con fármacos por vía intravenosa (labetalol a dosis altas, urapidilo y sulfato de magnesio), realización diaria de analítica completa (hemograma, coagulación, bioquímica completa y proteínas en orina de 24h) y control diario del bienestar fetal, con ecografía obstétrica, Doppler fetal y monitorización no estresante (MNS).
A las 72h del ingreso en REA la paciente presentó un empeoramiento general, con cefalea incoercible. Se realizó un Doppler fetal urgente donde se observó una ausencia de flujo diastólico en la arteria umbilical, un ductus venoso reverso, pulsatilidad en la vena umbilical y MNS arreactivo, con desaceleraciones espontáneas. Se realizó una cesárea urgente; se obtuvo un feto varón, de 620g y una puntuación en la prueba de Apgar de 4/8, que ingresó en la unidad de cuidados neonatales. La paciente reingresó en REA, donde persistía la tendencia hipertensiva y la clínica ocasional de cefalea, y llegó a precisar adición de nitroprusiato en perfusión continua. A las 36h de la cesárea se pudo retirar los fármacos por vía intravenosa y reiniciar el tratamiento oral con metildopa y antagonistas del calcio. La paciente fue trasladada a la planta de maternidad a los 2 días de la intervención.
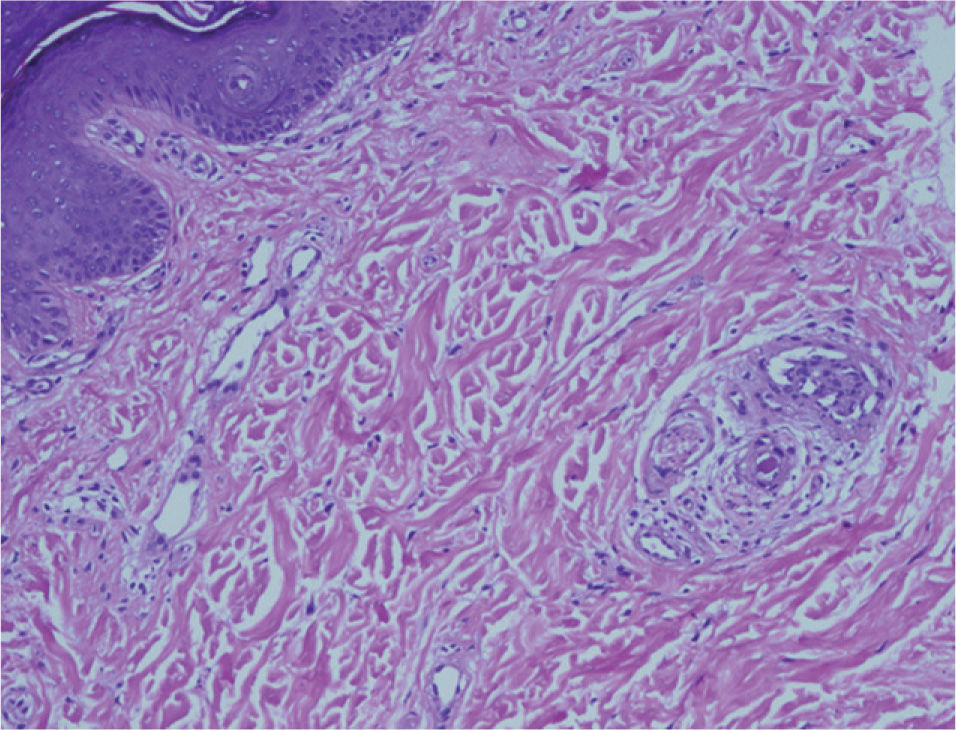
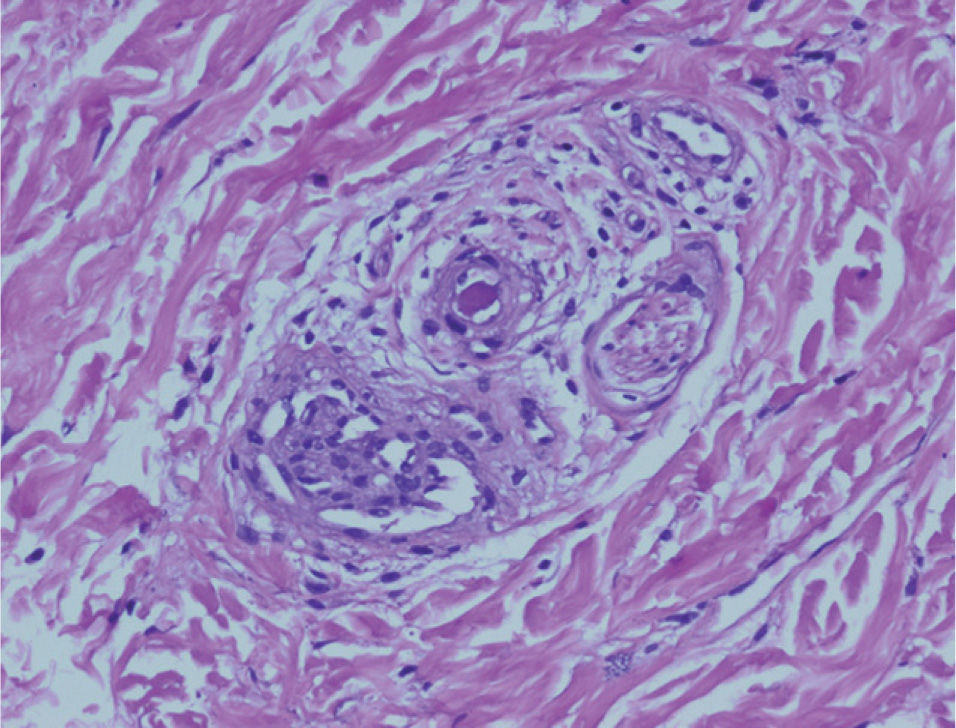
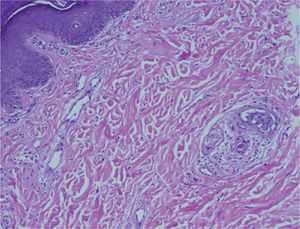
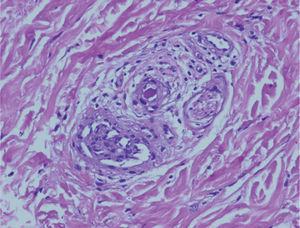
Veinticuatro horas más tarde, la paciente reingresó en REA por hipertensión mal controlada (PA 210/100mmHg) y visión borrosa del ojo izquierdo, con fotopsias. La analítica del ingreso presentaba una anemia leve postoperatoria y el resto de los parámetros se situaban dentro de la normalidad. Inicialmente se asoció un inhibidor de la enzima de conversión de la angiotensina (IECA) a la metildopa y al antagonista del calcio, que fueron insuficientes para controlar la PA, por lo que se inició perfusión de nitroprusiato y sulfato de magnesio. Se realizó un fondo de ojo que observó un desprendimiento exudativo en el polo posterior del ojo izquierdo, sin hemorragias. La evolución empeoró durante los siguientes días; aparecieron derrames pleurales bilaterales que precisaron colocación de drenajes torácicos, cuadro febril que fue tratado con tratamiento antibiótico de amplio espectro, nefropatía aguda médica, abdominalgia con hepatomegalia difusa, parestesias y disestesias en la cara, las manos y los pies, y PA de 160-140/90-80mmHg. A la exploración física se observaron lesiones cutáneas compatibles con livedo reticularis, telangiectasias ungueales y nódulos milimétricos en trayectos vasculares. Se solicitó una interconsulta al servicio de dermatología, que biopsió varias lesiones y solicitó una batería de anticuerpos. Ante la sospecha de un SAFL, se inició tratamiento empírico con corticoterapia, heparina de bajo peso molecular y ácido acetilsalicílico; a las 24h se obtuvo una mejoría evidente de su sintomatología, así como de sus lesiones dérmicas y su hipertensión, que permitió la retirada del tratamiento antihipertensivo. La histología de las biopsias cutáneas se informó como lesiones trombóticas compatibles con un SAFL, sin datos de vasculitis (figs. 1 y 2). El estudio inmunológico fue negativo para ANA, ADN y ENA, y positivo para anticardiolipina y anti-beta-2glucoproteína 1 (títulos altos), que se confirmaron 6 semanas más tarde.
Se diagnosticó a la paciente de un SAFL primario y fue dada de alta a los 25 días, con tratamiento con acenocumarol y terapia corticoidea. El recién nacido desarrolló una displasia broncopulmonar y un síndrome de abstinencia. En la actualidad, evoluciona favorablemente, con un peso cercano a los 2.000g.
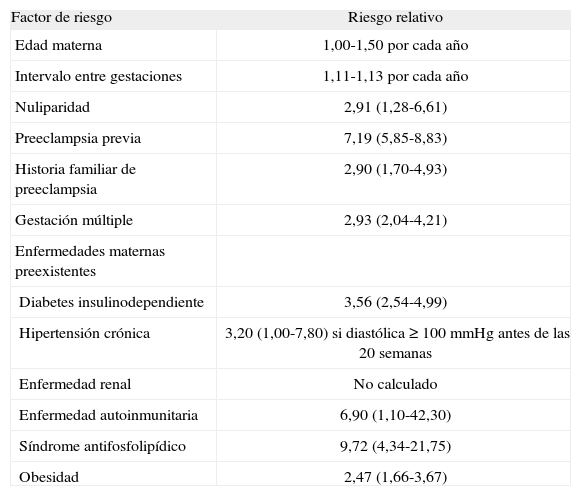
DISCUSIÓNLa preeclampsia es una de las complicaciones del embarazo con mayor repercusión maternofetal. Es una de las primeras causas de mortalidad materna y de morbilidad potencialmente grave, generalmente transitoria pero con riesgo de secuelas permanentes. Además, en la mayoría de los casos, se acompaña de malos resultados perinatales. La incidencia de preeclampsia es del 2-10%, dependiendo de la población estudiada5. La preeclampsia es una enfermedad endotelial sistémica, que se produce como consecuencia de las anomalías en la remodelación de los vasos uterinos, cuando una afección materna, vascular o inmunitaria, o una predisposición genética altera la invasión de las células trofoblásticas y los cambios fisiológicos de las arterias espirales, proceso que se inicia el primer trimestre del embarazo6. Los factores de riesgo más significantes para el desarrollo de preeclampsia (tabla 1) son la historia previa de preeclampsia y la presencia de aAFL5.
Factores de riesgo maternos para el desarrollo de preeclampsia
| Factor de riesgo | Riesgo relativo |
| Edad materna | 1,00-1,50 por cada año |
| Intervalo entre gestaciones | 1,11-1,13 por cada año |
| Nuliparidad | 2,91 (1,28-6,61) |
| Preeclampsia previa | 7,19 (5,85-8,83) |
| Historia familiar de preeclampsia | 2,90 (1,70-4,93) |
| Gestación múltiple | 2,93 (2,04-4,21) |
| Enfermedades maternas preexistentes | |
| Diabetes insulinodependiente | 3,56 (2,54-4,99) |
| Hipertensión crónica | 3,20 (1,00-7,80) si diastólica ≥ 100mmHg antes de las 20 semanas |
| Enfermedad renal | No calculado |
| Enfermedad autoinmunitaria | 6,90 (1,10-42,30) |
| Síndrome antifosfolipídico | 9,72 (4,34-21,75) |
| Obesidad | 2,47 (1,66-3,67) |
La prevalencia de aAFL en mujeres con abortos recurrentes oscila entre el 4,9 y el 59,1%7. Durante el segundo y tercer trimestres del embarazo el SAFL se caracteriza por una insuficiencia placentaria que se traduce en un crecimiento intrauterino retardado (15-30%) y en muerte fetal (hasta el 85% si los títulos de aAFL son altos)3,8. El SAFL se asocia, por tanto, a abortos recurrentes y a pérdidas fetales, pero además existe una fuerte correlación entre la presencia de aAFL y preeclampsia grave precoz (11,761%), abruptio placentae y parto pretérmino (540%)3,7,9,10.
Se han descrito varios mecanismos de acción de los aAFL para explicar las complicaciones gestacionales. Las trombosis de la vasculatura uteroplacentaria e infartos placentarios son el mecanismo primario más conocido de los aAFL; por una parte, interfieren en las vías de coagulación y fibrinólisis (aumento del factor VIIa y protrombina, disfunción del factor XIIa, disminución del activador del plasminógeno tipo urocinasa (uPA), del activador del plasminógeno tisular (tPA) y de los complejos plasmina/antiplasmina (PAP), e inhibición de la activación de las proteínas C y S)3,11,12 y, por otra parte, producen una activación de las células endoteliales que incrementan la expresión de moléculas de adhesión celular (VCAM-1, PECAM-1, E-selectina y Pselectina), aumentan la concentración del tromboxano y alteran el balance prostaciclina/tromboxano, promueven la síntesis de citocinas y aumentan la agregación y activación plaquetaria4,7,8,12. Estudios más recientes incluyen un daño directo de los aAFL a las células trofoblásticas, que producen una disminución de su proliferación, anomalías en la expresión de moléculas de adhesión (disminución de anexina V), alteraciones en la invasión trofoblástica, disminución de las membranas vasculosincitiales, generación de trombina en los espacios intervellosos (disfunción de la beta-2 glucoproteína 1) y alteración en la remodelación fisiológica de las arterias espirales en la decidua4,6,9–12. Además se produce una activación de la vía del complemento mediada por los aAFL, que amplificaría los efectos tóxicos de la trombosis, la hipoxia tisular y la inflamación de la placenta, e incrementaría el daño fetal11.
Los criterios diagnósticos del SAFL aceptados actualmente son los propuestos en la reunión de Sapporo y publicados en 1999. Para el diagnóstico se requieren al menos un criterio clínico y otro de laboratorio (tabla 2)4,7,8,10.
Consenso Internacional. Criteriosdiagnósticos del síndrome antifosfolipídico
|
Los aAFL son un grupo heterogéneo de autoanticuerpos que se unen a proteínas, fosfolípidos o un complejo proteína-fosfolípido. Se han descrito múltiples aAFL, pero los más definidos son el anticoagulante lúpico (aAL), descrito en los años cincuenta y el más específico para el diagnóstico de SAFL (prevalencia del 8,3% en la población), y el anticuerpo anticardiolipina (aAC) descubierto en los años ochenta y el más sensible (prevalencia del 15,5% en la población). A ellos hay que añadir el hallazgo en los años noventa del anticuerpo anti-beta-2-glucoproteína 1 (aAβ2GP1), que tiene una alta especificidad (98%) para SAFL2,4,10. El aAβ2GP1 no se incluye en los criterios preliminares para la clasificación del SAFL, pero este anticuerpo está fuertemente asociado a la trombosis y otras características del síndrome, por lo cual muchos autores recomiendan testar el aAβ2GP1 en pacientes con alta sospecha de SAFL si los aAL y aAC son negativos. En el futuro, la estandarización del aAβ2GP1 podría reemplazar a sus precesores3,10. Existen otros aAFL asociados al SAFL, pero esta asociación todavía no se ha confirmado (antifosfatidilinositol, antifosfatidilserina o antifosfatidiletanolamina).
El tratamiento ideal del SAFL durante el embarazo sería aquel que, por un lado, mejore los resultados maternofetales previniendo los abortos, la preeclampsia, la insuficiencia placentaria y el parto pretérmino, y por otro lado, reduzca el riesgo trombótico materno durante la gestación10. El tratamiento más consensuado para el manejo de las pacientes gestantes afectadas de SAFL parece ser la asociación de aspirina a dosis bajas y heparina de bajo peso molecular a dosis profilácticas, que obtiene una tasa de éxito del 7180% (recién nacidos vivos)3,4,7,10. La aspirina inhibe la síntesis plaquetaria de tromboxano y previene las 487 trombosis en la vasculatura placentaria y la heparina se une a los aAFL protegiendo a las células trofoblásticas y permitiendo la correcta implantación9,11,12. El tratamiento con aspirina debe iniciarse tan pronto como sea posible, incluso un mes antes de la concepción, y debe añadirse la heparina cuando detectemos embriocardio positivo en la ecografía11. La mejora de la supervivencia gestacional asociada al tratamiento con aspirina a dosis bajas y heparina no se ha acompañado de una disminución de la morbilidad gestacional, por eso continúa habiendo un 2030% de pérdidas fetales y son relativamente frecuentes la aparición de crecimiento intrauterino retardado (CIR), prematuridad y preeclampsia9,12.
En pacientes con SAFL tratadas y aAFL circulantes, un Doppler de las arterias uterinas anormal a las 24 semanas (definido por un índice de resistencia elevado o la persistencia de incisura protodiastólica o notch bilateral) se correlaciona con un riesgo elevado de desarrollar CIR y preeclampsia (alta especificidad y valor predictivo negativo). La existencia de notch bilateral a las 22–24 semanas tiene un buen nivel diagnóstico (razón de verosimilitud o likelihood ratio de 12,8) y pronóstico, por ello se ha propuesto como método de cribado de preeclampsia y CIR en mujeres con aAL1,6.
En estos casos refractarios al tratamiento inicial con aspirina a dosis bajas y heparina, se ha propuesto el uso de inmunoglobulinas por vía intravenosa como tratamiento de segunda línea, donde se han observado tasas de éxito del 80-90% y disminución de las complicaciones tardías obstétricas4,7,10.
A pesar de que son necesarios más estudios para evaluar los efectos del tratamiento en la circulación uteroplacentaria, continúa siendo importante confirmar lo antes posible el diagnóstico de un SAFL ante la mínima sospecha. Esto nos permitirá iniciar de forma temprana el tratamiento, para intentar mejorar los resultados maternofetales y poder aconsejar y controlar de forma más precisa a estas pacientes en futuros embarazos.