Conocer nuestros primeros resultados en la disección selectiva del ganglio centinela en el cáncer de vulva, en cuanto a tasa de detección del ganglio, casos de falsos negativos y su relación con la recidiva tumoral o no.
Material y métodosEstudio retrospectivo de los primeros 9 casos de ganglio centinela en carcinomas epidermoides vulvares, realizado entre junio de 2004 y diciembre de 2007.
ResultadosSe detectó el ganglio centinela en 8 de las 9 pacientes; la tasa de detección fue del 88,8%. No hubo ningún caso de falso negativo, por lo que el valor predictivo negativo de la técnica fue del 100%. Solamente una paciente con ganglio centinela negativo ha fallecido por cáncer de vulva; esta mujer estaba afectada por anemia de Fanconi.
ConclusionesLa técnica del ganglio centinela en los carcinomas epidermoides vulvares es factible y puede ser una alternativa a la linfadenectomía inguinofemoral convencional.
The aim was to analyse our first results in the sentinel lymph node procedure in vulvar cancer, as regards the detection rate, false negative cases and relation with cancer recurrence or not.
Material and methodsRetrospective study of first 9 cases of sentinel lymph node detection in vulvar squamous cell carcinoma, between June 2004 and December 2007.
ResultsWe identified the sentinel node in 8 out of 9 patients (88% detection rate). There were no false negative cases, giving a negative predictive value of 100%. Only one patient with a negative sentinel node died of vulvar cancer. She also had Fanconi anaemia.
ConclusionsSentinel lymph node detection in patients with squamous cell carcinoma of the vulva is feasible, and can be an alternative to conventional inguinofemoral lymphadenectomy.
El pronóstico de las pacientes con cáncer de vulva depende, en gran medida, de la afectación tumoral o no de los ganglios linfáticos inguinofemorales. Por tanto, a dichas pacientes se les debe realizar una linfadenectomía inguinal con fines díagnósticos y más dudosamente terapéuticos1. Este procedimiento conlleva una importante morbilidad, sobre todo en pacientes con edad avanzada e insuficiencia venosa. A largo plazo, se producen linfedema y celulitis crónica en las extremidades inferiores2. Por otra parte, la incidencia de metástasis ganglionares en los estádios I solamente es del 10%, por lo que teóricamente trataríamos en exceso a un número elevado de pacientes3.
De está manera aparece el concepto del ganglio centinela (GC), que es el primer ganglio linfático al que drena un tumor, por lo que su estádo nos informa sobre la afectación neoplásica o no del resto de los ganglios de ese territorio linfatico. Está técnica ya se ha aceptado en el manejo de las pacientes con cáncer de mama y en los melanomás cutáneos3,4. Por tanto, si el GC es negativo no realizaríamos a esa paciente una linfadenectomía inguinal, con lo que evitamos las complicaciones que acarrea está interventión. El primer autor que describió está técnica en el cáncer de vulva fue Levenback en 19945, y desde entonces los trabajos publicados son muy númerosos.
Para la detección del GC, la mayoría de los autores utilizan la técnica combinada, asociando un colorante vital (como el azul de metileno) a la linfogammagrafía medíante un isótopo radíactivo como el tecnecio 99 nanocoloide6,7. De está manera, se obtienen tasas de identificación del GC en el cáncer vulvar que alcanzan el 96-100%1,6.
No obstante, hoy día, la disección del GC en el caso de los carcinomás epidermoides vulvares no está aceptada como técnica estándar de tratamiento, esto es, omitiendo la linfadenectomía inguinal en caso de que el GC sea negativo1,6,7. Esto se debe a que no se conoce la seguridad del método a largo plazo, con el riesgo teórico de recidiva linfática inguinal. Por otra parte, el carcinoma de vulva es un tumor muy poco frecuente por lo que las series son muy pequeñas, y casi ningún centro puede reunir un número elevado de pacientes.
El objetivo de este trabajo es presentar nuestros primeros resultados en está novedosa técnica del GC en las neoplasias vulvares y contrastarlos con las series más extensas comunicadas por otros autores.
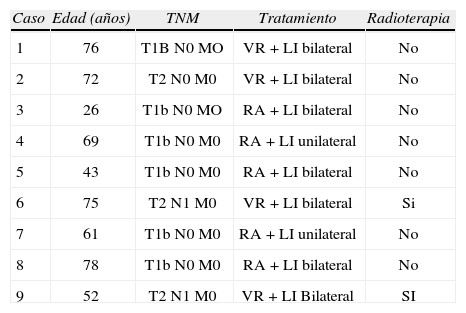
MATERIAL Y METODOSEntre junio de 2004 y diciembre de 2007 se realizó la técnica del GC a 9 pacientes con cáncer de vulva del tipo epidermoide y a una paciente con melanoma vulvar, aunque está última fue excluida del estudio. Las características clínicas de las pacientes y los tratamientos realizados se presentan en la tabla 1. Todas las pacientes tenían una biopsia previa de carcinoma epidermoide y un consentimiento informado firmado. Había 6 pacientes con tumores T1 y 3 mujeres con tumores T2 (casos 2, 6 y 9, que midieron 3,5, 5 y 4 cm, respectivamente). Hay que tener en cuenta que a cada paciente se le realizó la técnica quirúrgica adecuada para su caso, que en ningún momento se vio afectada por la disección del GC, por lo que en está fase de validación también hemos incluido a pacientes con tumores muy grandes.
Características clínicas y tratamiento quirúrgico de las pacientes
| Caso | Edad (años) | TNM | Tratamiento | Radioterapia |
| 1 | 76 | T1B N0 MO | VR + LI bilateral | No |
| 2 | 72 | T2 N0 M0 | VR + LI bilateral | No |
| 3 | 26 | T1b N0 MO | RA + LI bilateral | No |
| 4 | 69 | T1b N0 M0 | RA + LI unilateral | No |
| 5 | 43 | T1b N0 M0 | RA + LI bilateral | No |
| 6 | 75 | T2 N1 M0 | VR + LI bilateral | Si |
| 7 | 61 | T1b N0 M0 | RA + LI unilateral | No |
| 8 | 78 | T1b N0 M0 | RA + LI bilateral | No |
| 9 | 52 | T2 N1 M0 | VR + LI Bilateral | SI |
LI: linfadenectomía inguin2l; RA: resección amplia; VR: vulvectomía radical.
El mismo día de la intervención se administraron 4 inyecciones intradérmicas peritumorales de tecnecio 99 nanocoloide (Nanocol®), a razón de 0,3 mCi (11 MBq) diluidos en 0,15 ml cada una. Se realizó la linfogammagrafía prequirúrgica y se localizó el GC. Se trasladó a la paciente al quirófano y se le inyectaron 4 ml de azul de metileno peritumoral. Se másajeó la zona durante unos minutos y se realizó una incision en la piel de unos 3 cm por encima de la zona teórica de localización del GC. Para identificar el GC se usó una sonda isotópica manual (Europrobe®) y nos ayudamos con azul de metileno, que puede pigmentar el GC y los canales linfaticos aferentes. Al extraer el GC, la radíactividad de la zona estará por debajo del 10% de la radiactividad inicial.
Después de finalizar esta técnica del GC, se realizó a cada paciente la linfadenectomía inguinal indicada en cada caso, además del tratamiento de su lesión vulvar.
El GC se fijó en una solución de formol al 10% y se procesó en el servicio de anatomía patológica. A nivel macroscópico, se seccionó el GC en cortes de 2 mm de espesor y se fijó en parafina según la técnica estándar.
A nivel microscópico, se realizaron secciones de 4 micras teñidas con hematoxilina-eosina de cada bloque de parafina. Se observaron al microscopio óptico y, si las secciones eran negativas, se realizó la ultraestadificación. Se tomaron dos nuevas secciones de cada bloque de parafina, a intervalos de 200-400 micras. Estas secciones se tiñeron, una con hematoxilina-eosina y la otra mediante inmunohistoquímica, con anticuerpos monoclomles de amplio espectro contra las citoqueratinas (citoqueratina AE1/AE3, Dakocytomation, Carpinteria, California).
El resto de los ganglios linfáticos no centinelas se procesaron según la técnica habitual.
Revisamos retrospectivamente los datos clínicos de las pacientes, el tratamiento realizado, los resultados de la disección selectiva del GC y el estado clínico actual.
RESULTADOSLa tabla 1 muestra las características clínicas de las pacientes y el tratamiento quirúrgico realizado en cada caso. Si los ganglios linfáticos inguinales eran positivos se administraba a las pacientes radioterapia externa. La edad media de la pacientes fue de 61,3 años y el 66,6 % de ellas (6 pacientes) presentaban estadio T1BN0M0 (Ib de la FIGO). El tratamiento quirúrgico consistió en una vulvectomía radical modificada asociada a linfadenectomía inguinal bilateral (con 3 incisiones separadas) en 4 pacientes, y una extirpación amplia de la lesión (dejando 2 cm de márgenes sanos) asociada a linfadenectomía inguinal en 5 pacientes. De estas últimas, se hizo linfadenectomía unilateral en 2 casos porque las lesiones eran muy laterales.
El GC se detectó en 8 pacientes, lo que muestra una tasa de detección del 88,8 % (tabla 2). En todos estos casos, el radiotrazador detectó el GC, mientras que el colorante (azul de metileno) sólo detectó en 6 (66,6%) pacientes. El GC fue único en la mitad de las ocasiones y en el resto fueron 2 GC. No hubo ningún caso de GC falso negativo; 2 pacientes presentaron GC positivos y fueron detectados con la técnica de la hematoxilina-eosina. La ultraestadificación con tinción de citoqueratinas no aportó más GC positivos.
Ganglios centinela y evolucion clínica
| Caso | Deteccion | Linfadenectomia inguinal | Seguimiento (meses) | Estádo actual | ||||
| Colorante | RT | GC | (+) | Ganglios | (+) | |||
| 1 | No | Si | 2 | 0 | 9 | 0 | 51 | RC |
| Recidiva vulvar operada | ||||||||
| 2 | No | No | - | - | 4 | 0 | 48 | RC |
| Recidiva inguinal (RT-QT) | ||||||||
| Recidiva vulvar operada | ||||||||
| 3 | Si | Si | 1 | 0 | 6 | 0 | 31 | Fallecida |
| 4 | Si | Si | 2 | 0 | 5 | 0 | 33 | RC |
| 5 | Si | Si | 1 | 0 | 5 | 0 | 29 | RC |
| 6 | No | SI | 2 | 2 | 8 | 0 | 16 | Fallecida |
| 7 | Si | Si | 2 | 0 | 2 | 0 | 30 | RC |
| 8 | Si | Si | 2 | 0 | 7 | 0 | 18 | RC |
| 9 | Si | Si | 1 | 1 | 12 | 1 | 9 | RC |
GC: ganglio centinela; RC: remision completa; RT: radiotrazador; RT-QT: radioquimioterapia.
El seguimiento medio de las pacientes fue de 29,4 meses (rango 9–51 meses). Dentro del grupo de pacientes con GC negativo (6 casos), sólo una paciente falleció debido a recidiva tumoral. Se trataba de una mujer con anemia de Fanconi, que presentó cáncer de vulva a los 26 años. De las 2 pacientes con GC positivo, una falleció debido al cáncer de vulva y la otra está actualmente en remisión completa. La paciente con fallo en la detección del GC permanece libre de enfermedad, pero ha presentado una recidiva inguinal tratada con radioquimioterapia y otra recidiva vulvar tratada con extirpación amplia.
DISCUSIONDesde los primeros trabajos de Levenback et al5 en 1994 que describían la diseccion del GC en los carcinomas epidermoides vulvares, numerosos autores6,8–10 han publicado excelentes resultados en cuanto al rendimiento de la técnica y su relativa facil realización. El objetivo de la identificación del GC vulvar sería reducir la morbilidad asociada a la linfadenectomía inguinofemoral, consiguiendo una adecuada estádificacion quirúrgica11. En este sentido, la ultraestadificación del GC podría incluso mejorar la estadificación estándar al detectar micrometástasis, que con un procesado histopatológico normal del ganglio linfático no se podrían apreciar. Al igual que en cáncer de mama, la técnica del GC estária indicada en estádios tempraños, en los que existe una alta probabilidad de que el estudio ganglionar sea negativo. Se recomienda realizar la técnica en pacientes con T1 o T2 (< 4 cm) sin adenopatías inguinales sospechosas7. La tasa de detección del GC usando la técnica combinada (tecnecio 99 nanocoloide y azul de metileno) alcanza el 96-100%1,6,12. En nuestra serie fue del 88,8 %, ya que no detectamos el GC en una paciente de las 9 operadas. Más importante si cabe es el porcentaje de falsos negativos de la técnica. Serían pacientes con GC negativo sometidas a linfadenectomía inguinofemoral en las que está fuese positiva. Casi todos los autores presentan resultados con ningún falso negativo en sus series1,6,7. En nuestro trabajo ningúna paciente presentó un GC falso negativo. Por esto, el valor predictivo negativo de la técnica del GC en el cáncer de vulva sería del 100%.
Como se ha señalado antes, se debe realizar el GC en pacientes con tumores pequeños y sin adenopatías inguinales clínicamente sospechosas. Si el tumor es muy grande, puede haber un bloqueo de los canales linfáticos por el tumor, por lo que tendríamos un GC falso negativo7,13. Otra situación que podría resultar en un falso negativo sería en los carcinomás vulvares de la línea media, en los que el drenaje linfático es bilateral. La detección del GC soló en un lado de los dos puede deberse a un fallo de detección del otro GC, o a un bloqueo linfático contralateral, por lo que la estádificación sería inadecuada14,15.
El consenso científico recomienda, al igual que en el cáncer de mama, hacer una linfadenectomía si el GC es positivo, aunque sean nada más micrometástasis detectadas mediante la ultraestádificación con la tinción de citoqueratinas16,17. Hay trabajos en los que no se realizó linfadenectomía y hubo recurrencias tumorales en la zona inguinal. Nosotros no podemos aportar ningúna información al respecto porque realizamos la cirugía adecuada a cada caso, con independencia del resultado del GC, ya que estámos en la fase de estudio de la técnica.
Terada et al13 describieron una serie de 21 pacientes con tumores de vulva en estádio T1 a los que trataron medíante extirpación amplia de la lesión y técnica del GC. Si el GC era negativo no realizaron linfadenectomía inguinal. Ningúna paciente con GC negativo presentó recurrencias inguinales o a distancia, ni falleció por cáncer de vulva. El seguimiento fue de 3 años. Van der Zee et al18 han publicado un estudio multicentrico con 403 pacientes con cáncer de vulva (incluidos tumores de hasta 4 cm) tratados también con extirpación radical de la lesión y GC. La tasa de recurrencia inguinal en pacientes con GC negativo (2,3%) es identica a la que ocurre en pacientes con los mismos tumores tratados mediante linfadenectomía inguinofemoral bilateral. Tampoco ocurrieron recidivas inguinales en la serie de 63 pacientes de Johann et al19, aunque presentan una tasa de falsos negativos del GC del 2,2%. Por todo ello, todos estos autores recomiendan la técnica del GC en estadios precoces del cáncer de vulva, siempre que se realice en un centro con adecuada experiencia.
En nuestra serie dos pacientes fallecieron por cáncer de vulva. Una de ellas tuvo 2 GC positivos y la otra presentó un GC negativo (paciente número 3). Era una mujer de 26 anos que presentaba una anemia de Fanconi. Se trata de una enfermedad autosómica recesiva que se manifiesta en la infancia por un fallo progresivo de la médula ósea asociada a defectos congénitos. Además, tienen un riesgo elevado de desarrollar una leucemia mieloblástica aguda y tumores sólidos de cabeza y cuello, esófago, hígado y en las mujeres, de cérvix y vulva. La edad media de supervivencia de estos pacientes es de 20 años. Entendemos que este es un caso clínico especial, del que no se pueden extraer conclusiones para el conjunto general de pacientes con cáncer de vulva20.
Por otra parte, existe bastante discusión entre los diferentes autores con respecto al número de GC que debe realizar un grupo de trabajo para superar la curva de aprendizaje. En el melanoma de piel serían 30 casos21, en el cáncer de mama entre 20–30 casos22 y en el cáncer de vulva alrededor de 10 casos7,23, siempre y cuando fuesen centros habituados al manejo de la patología oncológica. En cualquier caso, aunque los resultados son prometedores la técnica del GC no es todavía un tratamiento estandar en el manejo del cáncer de vulva6,7,11.
Para concluir, diremos que a la vista de los trabajos publicados en la literatura cientifica y de los resultados de nuestro estudio, la disección del GC es un procedimiento adecuado en el manejo del cáncer de vulva inicial, lo que evita la morbilidad de la linfadenectomía inguinofemoral y consigue una adecuada estadificación del paciente. Por otra parte, la tecnica del GC no aumenta la tasa de recidiva inguinal de las pacientes. No obstante, no se recomienda su empleo como tratamiento estándar mientras las sociedades científicas no lo asuman en sus protocolos, aunque algunos autores ya lo están realizando en centros especializados.
CONFLICTO DE INTERESESLos autores declaran no tener ningún conflicto de intereses.