INTRODUCCION
La quimioterapia (QT) primaria es actualmente el tratamiento de primera elección en pacientes con cáncer mamario localmente avanzado y su uso se ha extendido progresivamente hacia estadios más tempranos de esta afección1-3. El objetivo de administrar este tratamiento es doble: por un lado, permite reducir el tamaño tumoral y realizar tratamientos conservadores en pacientes que hubiesen tenido forzosamente que someterse a una mastectomía por no haber recibido la terapia2,4. Por otro, la respuesta del tumor al tratamiento proporciona un valioso marcador pronóstico. Aunque el valor de la QT primaria para tratar carcinomas ductales infiltrantes (CDI) es bien conocido, su valor para tratar carcinomas lobulillares infiltrantes (CLI) es motivo de gran controversia5.
Presentamos un raro caso de carcinoma mamario bilateral sincrónico (CLI en la mama izquierda [MI] y CDI en la mama derecha [MD]) tratado con QT primaria. Ilustra muy claramente las diferencias entre ambos tumores y nos permite cuestionar la utilidad de la QT primaria como tratamiento de los CLI.
CASO CLINICO
Paciente de 45 años, sin antecedentes medicoquirúrgicos de interés, que acudió a nuestra consulta tras detectar la presencia de un nódulo sospechoso en su MD. Su madre presentó un cáncer de mama a los 54 años (falleció 1 año más tarde) y su padre falleció por un cáncer tiroideo a los 72 años de edad.
La exploración física mostró un nódulo único, de 7 cm, en el cuadrante superoexterno (CSE) de la MD. No se apreciaron signos de infiltración dérmica ni secreción por el pezón. No se palpaban adenopatías en la axila derecha (AD). La exploración de la MI mostró un área vagamente nodular, mal delimitada, que se extendía por ambos cuadrantes externos y alcanzaba un tamaño difícil de concretar, pero en cualquier caso superior a los 10 cm. La paciente había detectado esa alteración hacía varios años pero no había percibido cambios en ella, por lo que no la había considerado como un hallazgo alarmante. La exploración de la axila izquierda (AI) permitió palpar una adenopatía móvil, dura, de aproximadamente 1,5 cm.
Antes de realizar la biopsia de ambas mamas, se realizó una mamografía, una ecografía y una resonancia magnética bilateral (figs. 1-4). Tras obtener y analizar las imágenes, se procedió a una punción con aguja gruesa, tanto del nódulo en el CSE de la MD como del área de aumento de densidad en los cuadrantes externos de la MI. El nódulo de la MD se describió como CDI (fig. 5) y la biopsia de la MI informó de la presencia de áreas de CLI (fig. 6). Los receptores de estrógenos (RE) y de progesterona (RP) eran negativos en la MD y el tumor no sobreexpresaba la proteína Her2. El tumor de la MI presentaba RE (+), RP () y sobreexpresaba Her2. Se realizó un estudio de extensión que fue negativo para lesiones metastásicas.
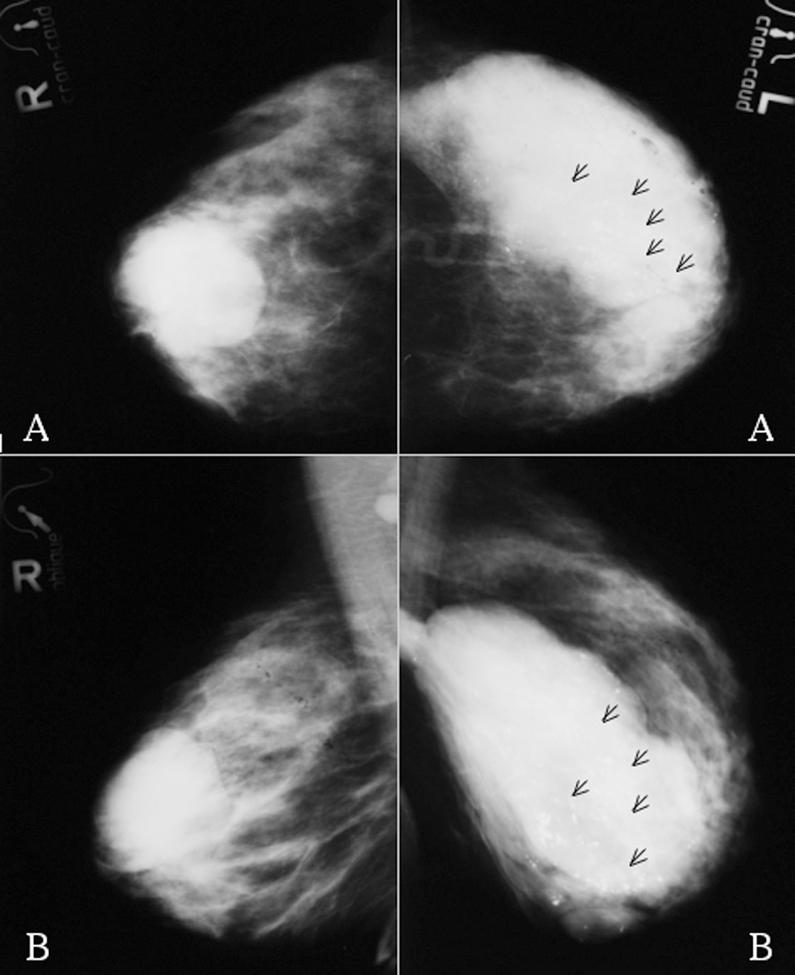
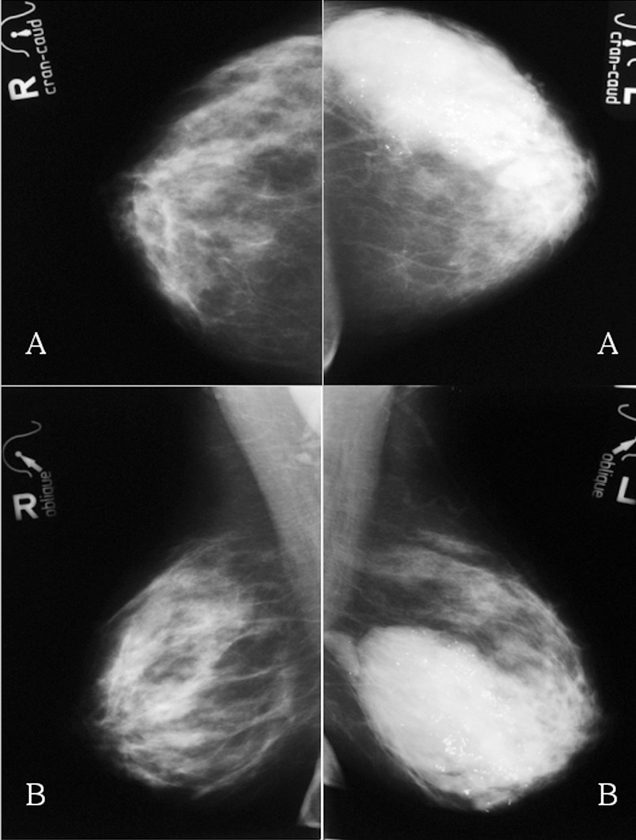
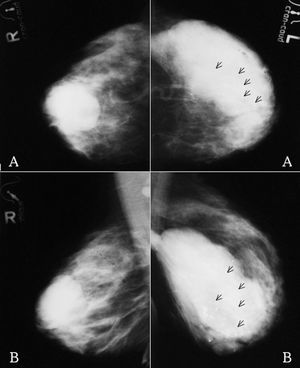
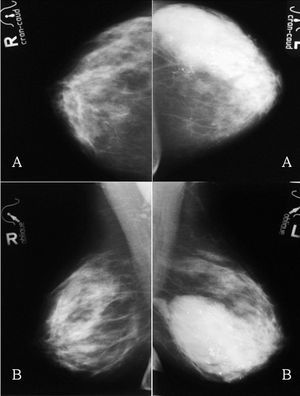
Figura 1. Mamografías bilaterales iniciales. A: proyección craneocaudal. B: proyección oblicua. Mama derecha: masa de 6 cm de diámetro con algunos márgenes especulados. Mama izquierda: masa polilobulada con márgenes redondeados y especulados, y numerosas microcalcificaciones (flechas negras).
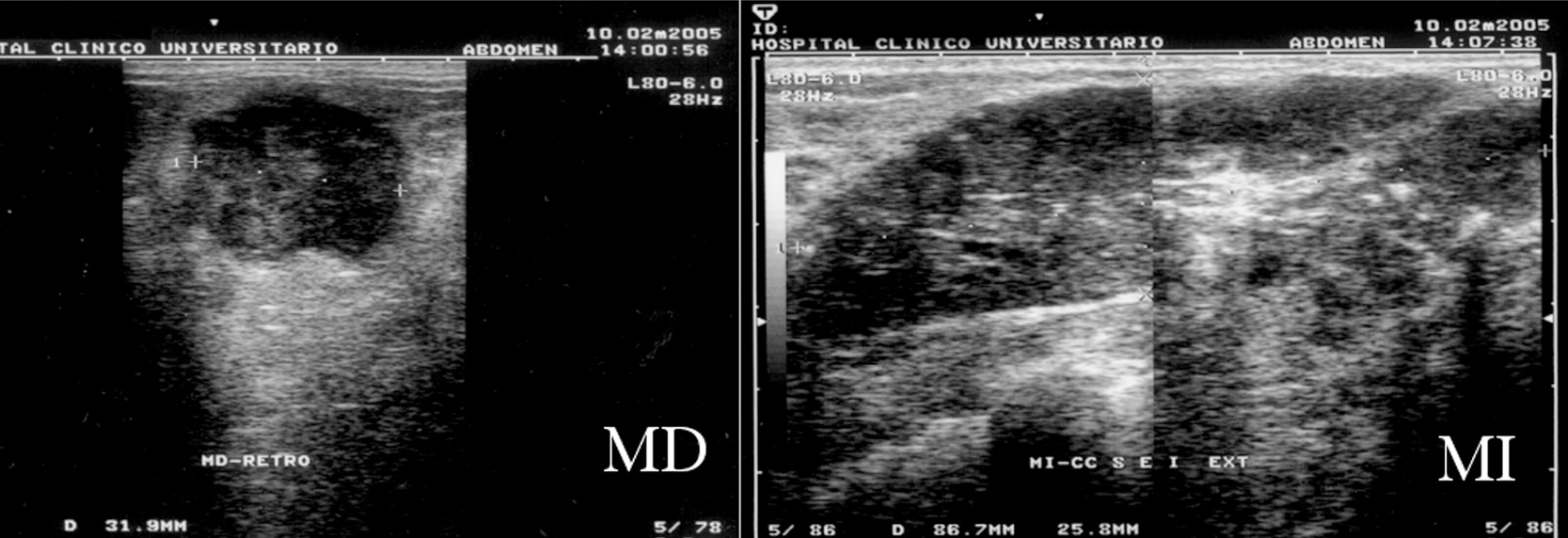
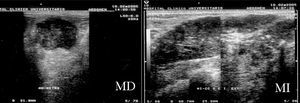
Figura 2. Ecografías bilaterales iniciales. Mama derecha (MD): nódulo sólido de 35 × 32 mm de contenido heterogéneo que ocupa el cuadrante superoexterno. Mama izquierda (MI): masa única multilobulada de 10 cm, parcialmente bien delimitada, muy heterogénea, con numerosas microcalcificaciones en su interior, que ocupa ambos cuadrantes externos de la mama izquierda.
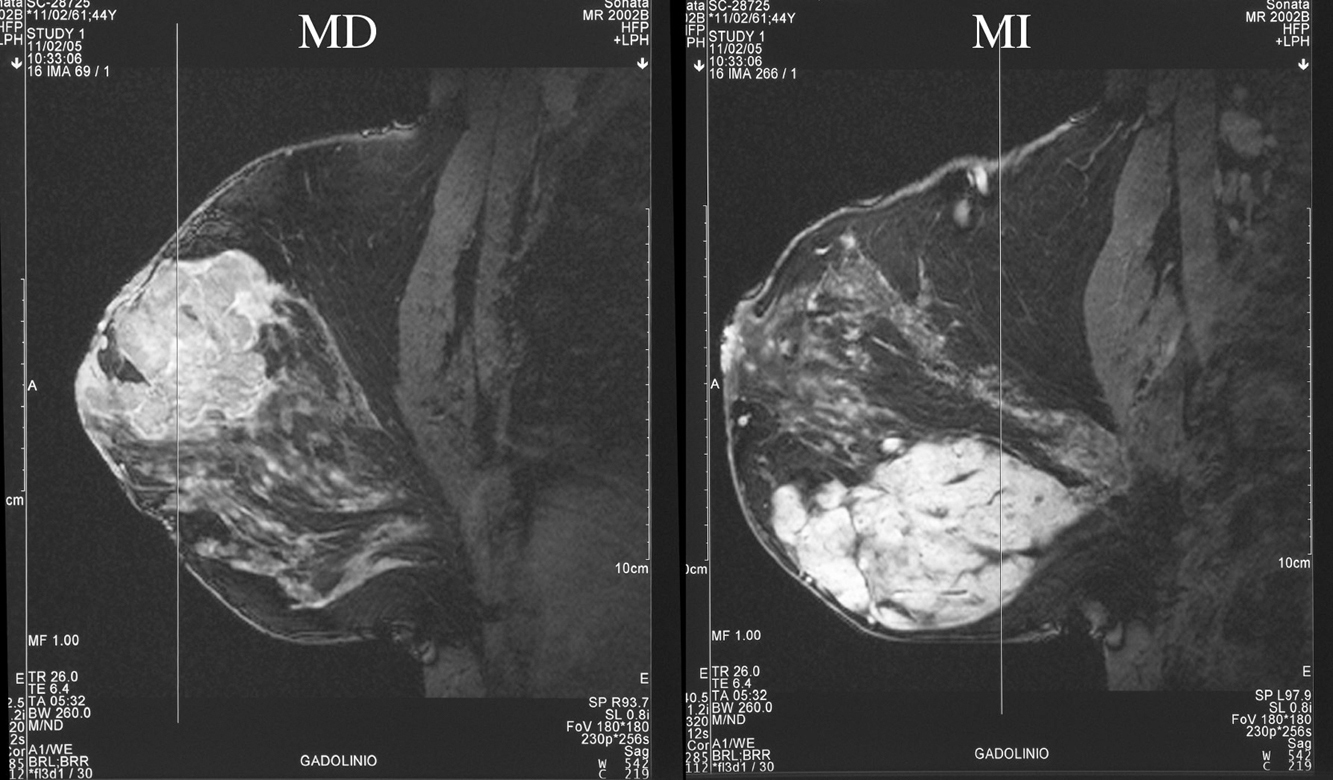
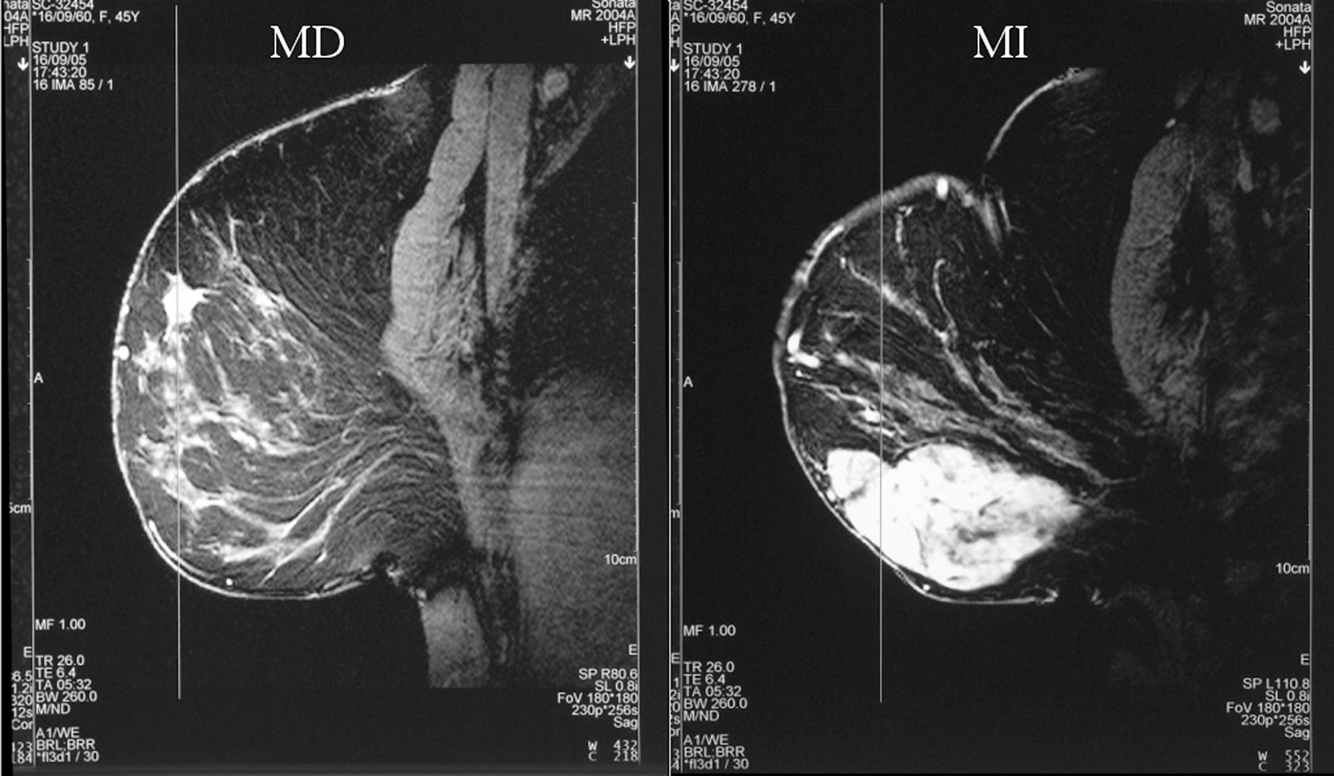
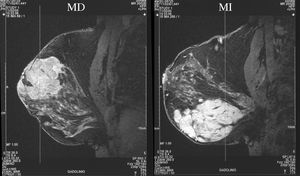
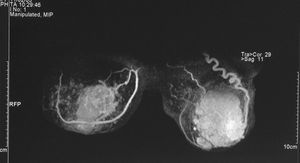
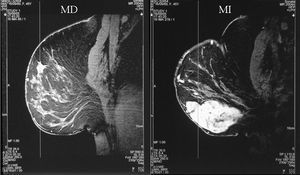
Figura 3. Resonancia magnética bilateral inicial. MD: mama derecha; MI: mama izquierda.
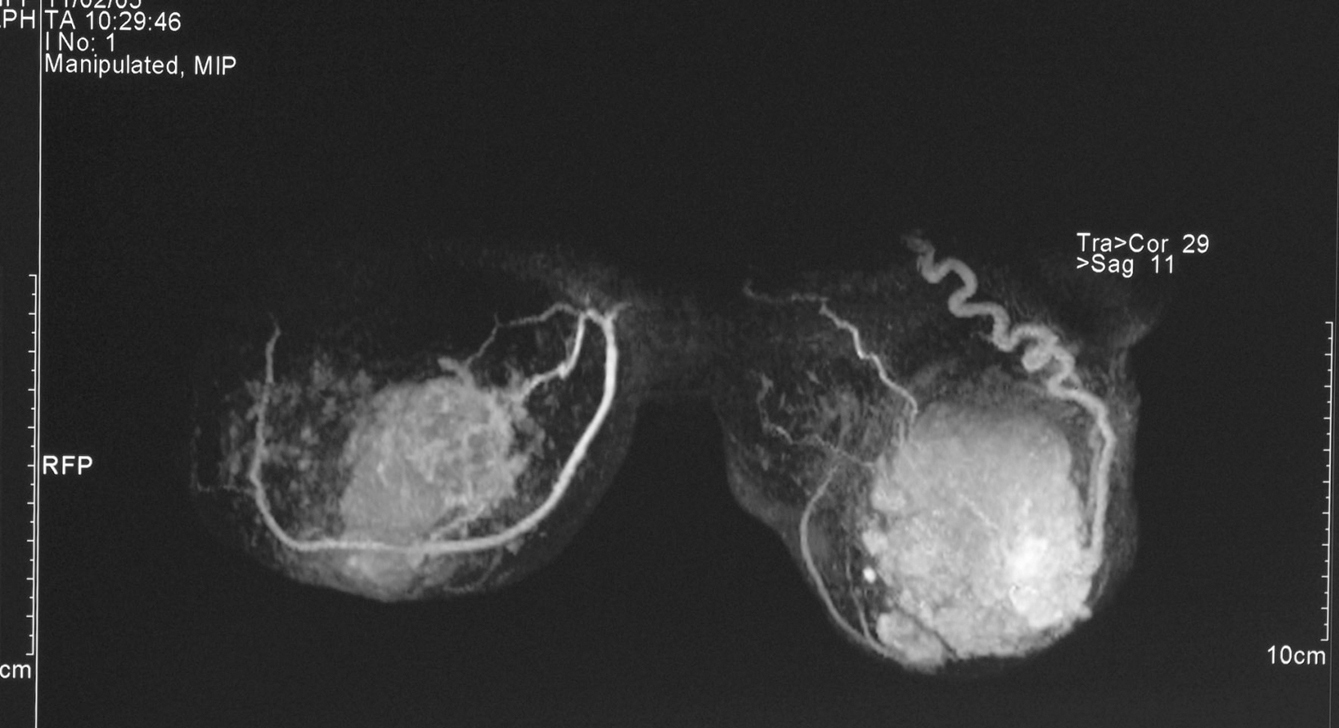
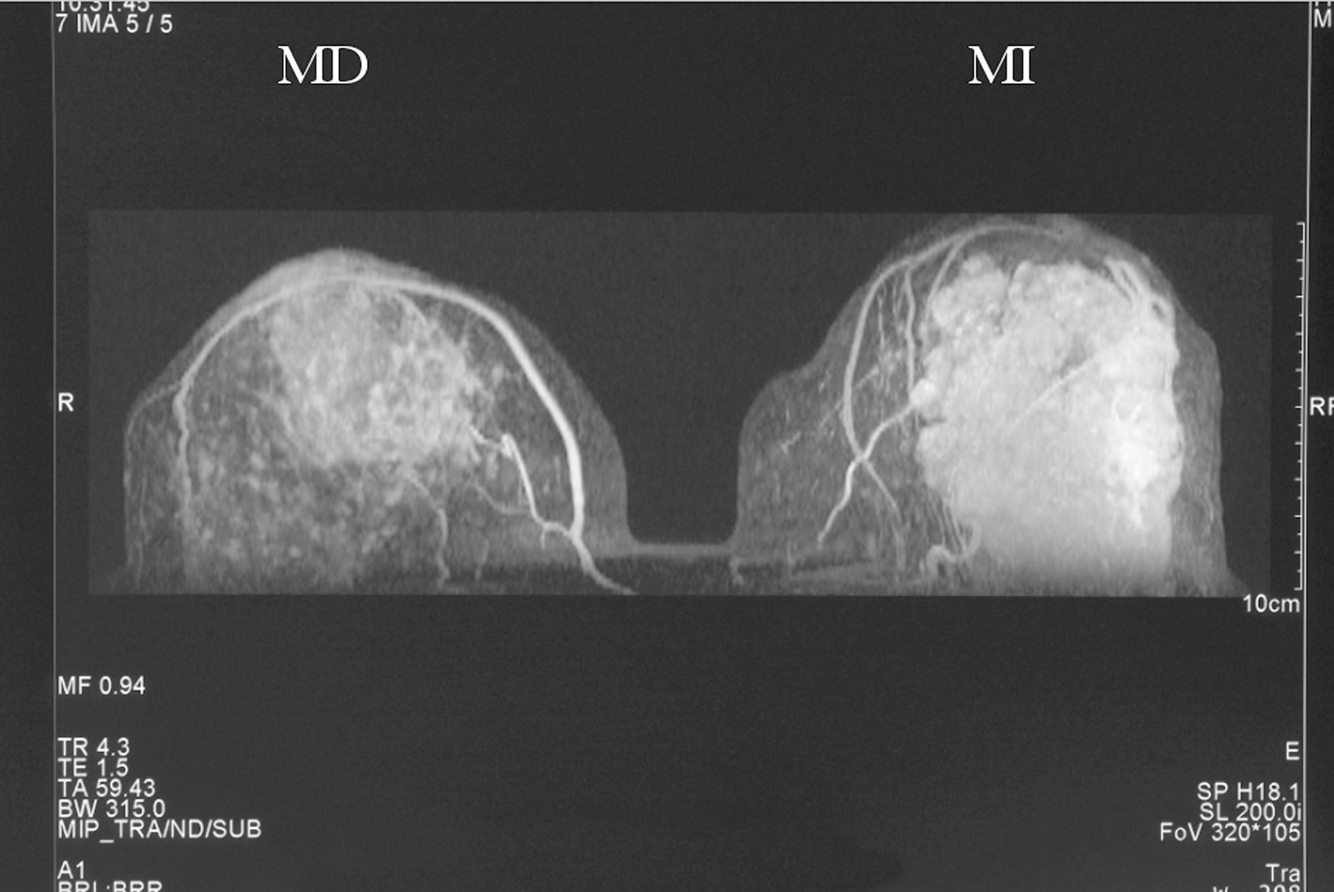
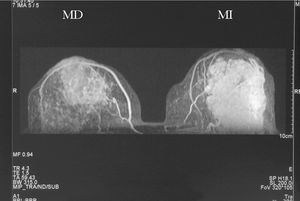
Figura 4. Resonancia magnética bilateral inicial; proyección en 3D. En la mama derecha se observa una masa irregular, de márgenes mal delimitados (1). En la mama izquierda se aprecia una masa polilobulada, algo más grande, que ocupa la totalidad de los cuadrantes externos (2).
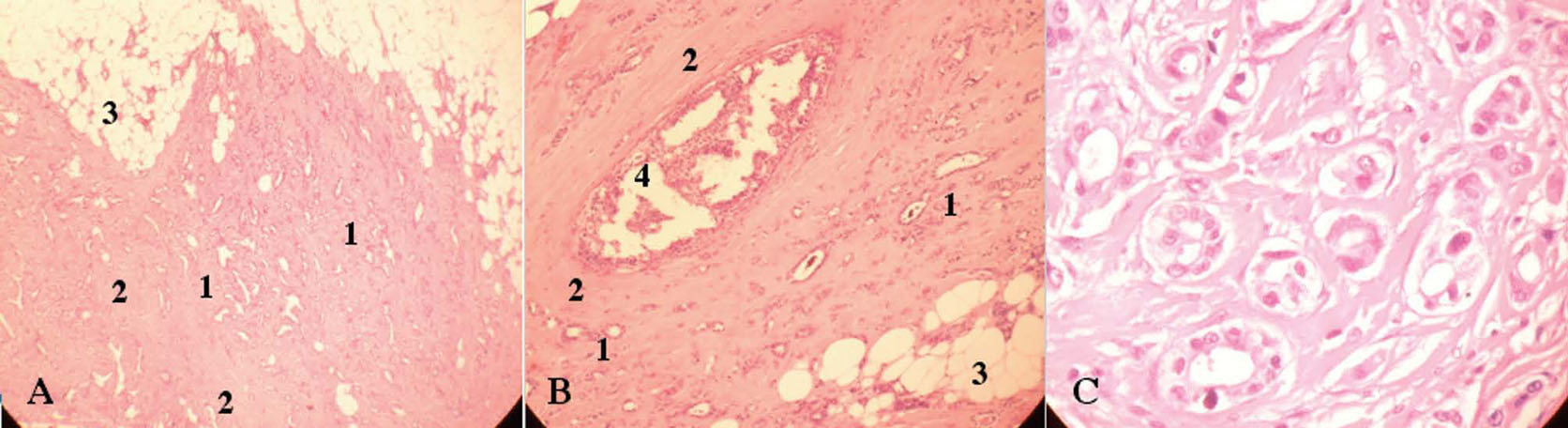
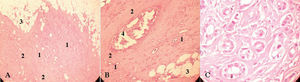
Figura 5. Anatomía patológica del carcinoma ductal infiltrante de la mama derecha. A: glándulas irregulares (1), dispuestas desordenadamente y rodeadas de un estroma desmoplásico prominente (2) que infiltran de forma difusa el estroma graso mamario (3). B: detalle a mayor aumento de los hallazgos descritos en A y gran ducto central dilatado (4) con proliferación cribiforme atípica de su epitelio (CDIS). C: glándulas tumorales de pequeño tamaño, de forma irregular y densamente dispuestas, revestidas por una sola capa de células pleomórficas, hipercromáticas, con nucléolos prominentes.
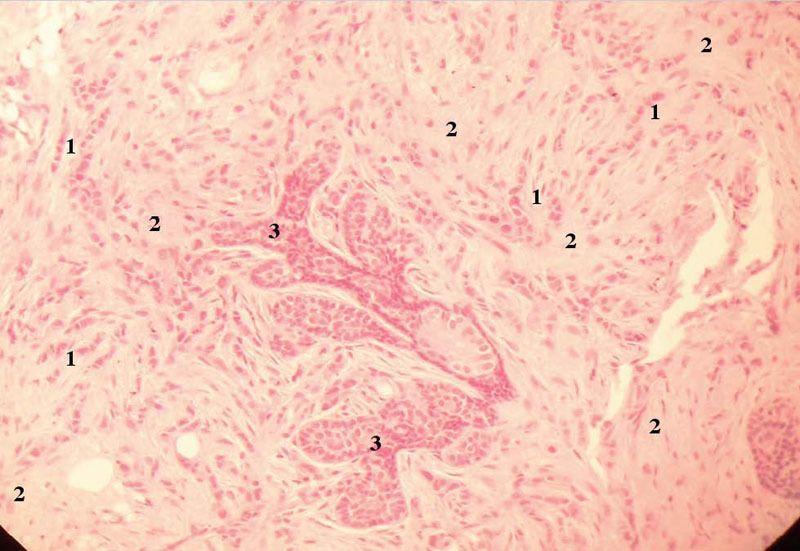
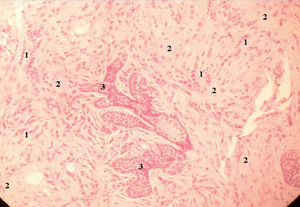
Figura 6. Anatomía patológica del carcinoma lobulillar infiltrante de la mama izquierda. Proliferación epitelial atípica en cordones, trabéculas e hileras (1), pero no en glándulas, con disposición característica en fila india. Las células, de pequeño tamaño (menores que en el carcinoma ductal infiltrante), se rodean de un estroma desmoplásico (2) y se distribuyen típicamente en torno de unidades ductolobulillares del parénquima (3).
La paciente fue informada de la naturaleza de sus lesiones y se le presentaron las distintas opciones terapéuticas. Dados los tamaños tumorales y el fuerte deseo de la paciente de someterse a una cirugía lo más conservadora posible, se decidió iniciar el tratamiento con QT primaria (adriamicina-taxol, 200 mg/m2) en 4 ciclos más CMF (60 mg/m2 en 4 ciclos).
Tras finalizar el tratamiento, la exploración física mostró desaparición del tumor de la MD y ausencia de respuesta en la MI. El estudio por imagen (mamografía y resonancia magnética) confirmó la impresión clínica: gran respuesta en la MD y ausencia de respuesta en la MI (las imágenes en la MI no se han modificado tras la QT) (figs. 7-9). Tras valorar cuidadosamente los hallazgos clínicorradiológicos, se decidió realizar una cuadrantectomía en el CSE de la MD y un vaciamiento axilar derecho de niveles I-II de Berg. Además, se practicó una mastectomía radical modificada de la MI. La anatomía patológica correspondiente a la MD fue informada de áreas de hiperplasia ductal y lobulillar, sin restos de neoplasia infiltrante. Los 16 ganglios linfáticos resecados en la AD estaban libres de infiltración. El estudio histológico de la MI y la AI mostró varios focos de CLI pleomórfico residual, con área de carcinoma lobulillar in situ de aproximadamente 10 cm. Los bordes quirúrgicos estaban libres de enfermedad. Una de 18 adenopatías resecadas estaba infiltrada por el tumor. Tras la correcta cicatrización de las heridas se procedió a administrar radioterapia (RT) sobre el lecho quirúrgico de la MD (50 Gy y sobreimpresión de electrones de 20 Gy sobre el lecho tumoral). La paciente está siendo sometida actualmente a tratamiento con tamoxifeno y herceptina.
Figura 7. Mamografías bilaterales tras quimioterapia primaria. A: proyección craneocaudal. B: proyección oblicua.
Figura 8. Resonancia magnética bilateral tras quimioterapia primaria. MD: mama derecha; MI: mama izquierda.
Figura 9. Resonancia magnética bilateral tras quimioterapia primaria en proyección 3D. MD: mama derecha; MI: mama izquierda.
DISCUSION
Los CLI suponen sólo el 10% de la totalidad de los cánceres de mama, aunque se ha sugerido que su incidencia puede estar aumentando6,7. Los CLI y los CDI son tumores biológica y clínicamente muy diferentes6. Comparar el pronóstico de estos tumores no es sencillo debido, entre otros factores, a la baja incidencia de los CLI y a las grandes variaciones en los criterios histológicos usados para su diagnóstico8,9. Aunque la QT primaria es el tratamiento de elección en casos con cáncer mamario localmente avanzado, son todavía pocas las pacientes con CLI sometidas a este tratamiento10-13. Se han señalado recientemente pobres respuestas de los CLI a la QT primaria pero no existen todavía estudios aleatorizados prospectivos que comparen la eficacia del tratamiento en función del tipo histológico13,14.
Los CLI representan un grupo muy amplio y heterogéneo de tumores15. Se clasifican en función de sus patrones de crecimiento (patrón clásico y variantes) y de sus características citológicas (tumores pleomórficos y no pleomórficos16,17). La mayoría de los tumores (clásicos, no pleomórficos) están formados por grupos homogéneos de células pequeñas y relativamente uniformes que invaden el estroma en «fila india», formando cordones18. Aunque estos tumores se presentan generalmente de forma uni o multifocal, algunos CLI invaden el estroma de forma difusa. Estos últimos son los más agresivos y se confunden fácilmente con los CDI17. Contrariamente a los CDI, los CLI no expresan E-caderina, proteína transmembrana que interviene en la adhesión celular, lo que ayuda a realizar el diagnóstico diferencial en los casos confusos19. Otros datos clínicos y biológicos facilitan el diagnóstico diferencial entre CDI y CLI: estos últimos tienden a diagnosticarse en pacientes de más edad, suelen ser de mayor tamaño, presentan en mayor medida RE o RP y fracciones de fase S más bajas, suelen ser diploides y no sobreexpresan Her2, p53 ni EGF20. Contrariamente a los CDI, el proceso de infiltración estromal por parte de los CLI no es tan destructivo para las estructuras anatómicas ni genera una reacción desmoplásica significativa, lo que contribuye a explicar que los CLI sean difíciles de palpar, de detectar tempranamente en las mamografías y de beneficiarse de cirugías conservadoras20-22. Por otra parte, los CLI tienden a presentarse, en mayor medida que los CDI, de forma multicéntrica o bilateral20,23. Finalmente, el patrón de metastatización de estos tumores es diferente del patrón de los CDI: tienden a metastatizar al peritoneo, el tracto gastrointestinal y los ovarios, mientras que los CDI tienden a metastatizar a los pulmones, la pleura, los nódulos linfáticos y el sistema nervioso central20,24. Las metástasis por CLI se caracterizan por crecimientos difusos de células neoplásicas que pueden permanecer silentes durante largos períodos pese a su extensión24.
El hecho de que los CLI se detecten, por regla general, en estadios más avanzados que los CDI muestra la importancia que la QT primaria podría tener en el tratamiento de estos tumores. Los dos beneficios más importantes de la QT primaria son la reducción del tamaño tumoral (que permite la realización de tratamientos conservadores en lugar de mastectomías) y la obtención de un marcador pronóstico (respuesta clínica o patológica completas1,25). En general, la eficacia de la QT primaria es menor en los casos de tumores de crecimiento lento o bien diferenciados (RE/RP positivos, índices de proliferación y grado histológico bajos1-3). En el caso de los CLI, se han comunicado tasas de respuesta muy bajas, mucho menores que las de los CDI, a la QT primaria6,13,14. Estas menores tasas de respuesta persisten tras ajustar variables como receptores hormonales o utilización de taxanos en el tratamiento1. Las pacientes con CLI presentan con mayor frecuencia enfermedad axilar residual tras la QT primaria13. Por último, el tamaño macroscópico de los CLI tras la QT primaria suele ser mayor que el de los CDI, probablemente debido al crecimiento difuso y multicéntrico de los primeros14.
Respecto al tratamiento quirúrgico, las pacientes con CLI son tratadas mediante mastectomía más frecuentemente (60-80%) que las pacientes con CDI (50-67%)6,13,14. Este dato es particularmente relevante ya que aumentar la tasa de tratamientos conservadores es justamente la razón más importante para administrar QT primaria1,26. El pronóstico de los CLI tratados mediante QT primaria es sujeto de controversia: mientras que algunos autores sostienen que el pronóstico es, pese a sus características biológicas más favorables, peor que el de los CDI27, otros no encuentran estas diferencias14. Finalmente, los estudios más recientes sugieren que el pronóstico de los CLI tratados con QT primaria es mejor que el de los CDI sometidos a ese mismo tratamiento, pese a presentar tasas de respuesta inferiores13,28. Se han propuesto algunos factores epidemiológicos para tratar de explicar estas diferencias: las mujeres con CLI suelen ser de más edad, han sido tratadas más frecuentemente con terapia hormonal sustitutiva y presentan en mayor medida RE y RP positivos8. No se puede descartar que las diferencias en la QT utilizada en unos y otros casos puedan explicar en alguna medida estos resultados.
En resumen, los CLI son neoplasias biológicamente muy diferentes de los CDI y no parecen beneficiarse de la QT primaria como éstas: su tasa de respuesta es demasiado baja como para tener valor pronóstico y en muy raras ocasiones se consigue evitar una mastectomía. Sin embargo, seguimos sin tener en cuenta el tipo histológico a la hora de decidir si administramos o no QT primaria5: las recomendaciones terapéuticas más importantes en la actualidad (Nacional Cancer Institute29 y Consenso de St. Gallen30), así como algunos instrumentos electrónicos muy utilizados para el cálculo del pronóstico de las pacientes (Adjuvant) no distinguen entre CDI y CLI. ¿Estamos extrapolando nuestra experiencia con la neoadyuvancia en los casos con CDI a los casos con CLI? Si esto fuese así, estaríamos exponiendo a estas últimas pacientes a terapias tan tóxicas como ineficaces. Tanto el caso que presentamos como las series revisadas sugieren que el CLI y el CDI son tumores biológicamente tan distintos que deberían ser manejados de forma diferente. Quizá ha llegado el momento de considerar la realización de un estudio aleatorizado y prospectivo para establecer claramente la utilidad de la QT primaria para tratar el CLI.
Correspondencia:
Dr. A. Millet Serrano.
Servicio de Obstetricia y Ginecología. Sección de Patología Mamaria.
Avda. Blasco Ibáñez, 17. 46003 Valencia. España.
Correo electrónico: amillets@amillets.com
Fecha de recepción: 12/4/2006.
Aceptado para su publicación: 12/7/2007.