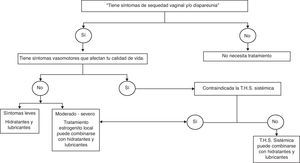
La atrofia vaginal, causada por el déficit estrogénico, es responsable de la aparición de síntomas que afectan la calidad de vida.
El tratamiento tendrá como objetivo restaurar la fisiología urogenital y aliviar los síntomas. Para síntomas como la sequedad vaginal o la dispareunia asociada con atrofia vaginal, la primera línea de tratamiento son los hidratantes (evidencia IA) y lubricantes vaginales (evidencia IIB). Si no proporcionan una adecuada mejora de los síntomas o ante síntomas moderados-intensos, se utilizarán estrógenos. Los estrógenos son los tratamientos más efectivos. En casos de solo atrofia vaginal, la elección será la terapia con estrógenos locales (TEL) (evidencia IA). En casos que coexistan con sintomatología vasomotora que afecte a la calidad de vida, la elección será la terapia hormonal sistémica (evidencia IA). Las dosis bajas de estrógenos son el tratamiento farmacológico hormonal de primera línea para la vaginitis atrófica.
Vaginal atrophy, caused by estrogen deficiency, leads to the development of symptoms that affect quality of life.
Treatment aims to restore the urogenital physiology and relieve symptoms. For symptoms such as vaginal dryness or dyspareunia associated with vaginal atrophy, the first line treatments are moisturizers (Evidence IA) and vaginal lubricants (Evidence IIB). If these treatments fail to provide sufficient improvement in symptoms or when the symptoms are moderate-to-intense, estrogen can be used. Estrogens are the most effective treatments. In patients with vaginal atrophy alone, the choice is local estrogen therapy (Evidence IA). In patients who also have vasomotor symptoms affecting quality of life, treatment consists of systemic hormone replacement therapy (Evidence IA). Low dose oestrogens are a first line pharmacological treatment for atrophic vaginitis.
La vagina es el órgano con mayor concentración de receptores estrogénicos del organismo, un indicador biológico accesible y sensible de los niveles séricos de dichas hormonas en la mujer1. La pérdida de la producción ovárica de estrógenos asociada con la transición menopáusica se refleja en la fisiología vaginal, produciendo una disfunción vulvovaginal que se concreta en: alteración de la maduración epitelial, con disminución del índice de células superficiales y, por tanto, de la producción de glucógeno; disminución de lactobacilos vaginales, al disminuir su sustrato; aumento del pH, al verse reducida la producción de ácido láctico bacteriano; disminución del aflujo vascular y consecuente reducción de las secreciones de la vagina (menos trasudado). Todo ello conduce al cortejo sintomático propio de la atrofia vaginal2.
La atrofia vaginal es responsable de la aparición de síntomas que afectan a la calidad de vida, como son la sequedad vaginal y/o dispareunia y afecta al 40% de las mujeres posmenopáusicas españolas3. La dispareunia afecta a un 10-15% de las mujeres sexualmente activas en la edad reproductiva y aumenta hasta un 45% en mujeres mayores de 50 años4.
Además, se produce pérdida de los pliegues rugosos vaginales y adelgazamiento de la mucosa, debido a la reducción del soporte de colágeno del epitelio vaginal, dado que la renovación de este disminuye al faltar los estrógenos. Estos cambios pueden ser importantes en la génesis del prolapso vaginal5.
El diagnóstico se sospecha basándose en la edad, los síntomas y la historia clínica y se confirma al realizar una exploración ginecológica6.
Este protocolo está realizado por un grupo de expertos de la Sociedad Española de Ginecología y Obstetricia (SEGO) con la intención de dar unas recomendaciones sobre la prevención y el tratamiento de la atrofia vaginal. Se han tenido en cuenta todos los documentos de posición de otras sociedades científicas, haciendo un repaso de todos los trabajos a doble ciego, metaanálisis y revisiones de la Cochraine aparecidos en Pubmed en los últimos 30 años.
Opciones de terapias no hormonalesLas opciones de tratamiento para los síntomas derivados de la atrofia vulvovaginal incluyen, además de un posible tratamiento hormonal, sistémico o local, modificaciones del estilo de vida, en caso de ser preciso, y tratamientos no hormonales, basados en la aplicación de hidratantes y lubricantes.
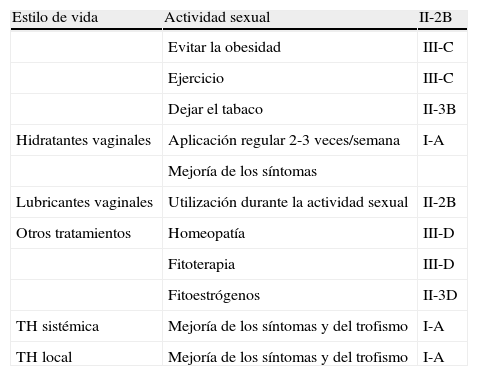
Modificación del estilo de vidaHay que tener en cuenta los factores de riesgo que aceleran la deprivación estrogénica, y aconsejar evitarlos. Entre ellos, el tabaco produce incremento en el metabolismo estrogénico y se asocia su consumo con mayor atrofia vaginal6. Aunque la evidencia en el efecto del cese del consumo de tabaco en la atrofia vaginal es controvertida, múltiples razones para el beneficio de la salud hacen que deba ser recomendado su cese7 (tabla 1).
Nivel de evidencia de los tratamientos para la atrofia vaginal
| Estilo de vida | Actividad sexual | II-2B |
| Evitar la obesidad | III-C | |
| Ejercicio | III-C | |
| Dejar el tabaco | II-3B | |
| Hidratantes vaginales | Aplicación regular 2-3 veces/semana | I-A |
| Mejoría de los síntomas | ||
| Lubricantes vaginales | Utilización durante la actividad sexual | II-2B |
| Otros tratamientos | Homeopatía | III-D |
| Fitoterapia | III-D | |
| Fitoestrógenos | II-3D | |
| TH sistémica | Mejoría de los síntomas y del trofismo | I-A |
| TH local | Mejoría de los síntomas y del trofismo | I-A |
El índice de masa corporal (IMC) > 27kg/m2 también se ha asociado con la presencia de sequedad vaginal. No realizar ejercicio físico implica un mayor riesgo de presentar síntomas vaginales en comparación con realizar ejercicio físico intenso8 (tabla 1).
Medidas mecánicasLas mujeres con actividad sexual tienen menos síntomas relacionados con la atrofia vaginal. El mayor número de relaciones sexuales se asocia a una mejor elasticidad tisular, mayor lubricación por incremento de la vascularización debido al estímulo mecánico y por tanto, una mejora en los síntomas con disminución de la coitalgia9 (tabla 1). No se ha establecido el tipo, frecuencia de la actividad sexual requerida para preservar la elasticidad vaginal y prevenir la dispareunia o la estenosis del introito.
Tratamiento no hormonalLa sequedad vaginal puede ser manejada con el uso regular de agentes hidratantes vaginales suplementando con lubricantes para su utilización durante la actividad sexual, lo que mejorará la coitalgia asociada a ella. Se recomiendan como primera línea terapéutica en mujeres con síntomas leves o moderados derivados de la atrofia vaginal.
Hidratantes vaginalesSu objetivo es el alivio de los síntomas, especialmente la sequedad vaginal. No cabe esperar con su uso un cambio en las características histológicas del tejido vaginal, salvo la hidratación del colágeno, es decir, no se producirá transformación madurativa del epitelio vaginal y, por tanto, su utilización no revierte los cambios atróficos relacionados con la deprivación estrogénica.
El uso regular de hidratantes vaginales proporciona alivio sintomático por cambios en el contenido de fluido del epitelio vaginal. En su composición se utilizan compuestos capaces de acumular agua, como el ácido hialurónico, sustancia con alto peso molecular y que tiene la propiedad de retener una gran cantidad de agua (unas 100 veces su peso), para después liberarla lentamente optimizando así el balance líquido. Esta sustancia, además, facilita la migración de células durante la inflamación y el proceso de reparación tisular teniendo así un papel en la conservación de la integridad del tejido. Los liposomas también están presentes en algunos preparados. Se trata de microesferas recubiertas de una capa lipídica que almacenan agua en su interior para luego liberarla lentamente, por lo que su efecto se prolonga en el tiempo. Los más utilizados son los geles policarbofílicos que se adhieren a las células epiteliales de la pared y mantienen 60 veces la retención epitelial de agua.
Los hidratantes deben ser utilizados una o más veces por semana. Existen informaciones sobre su eficacia, en las que son comparados con preparaciones de estrógenos locales, encontrando una mejora en la sequedad vaginal y restauración del pH vaginal similar para ambos. Por el contrario, los hidratantes no modifican el índice de maduración como lo hacen los estrógenos10 (tabla 1).
LubricantesAdemás del uso regular del hidratante, la utilización de un lubricante durante la relación sexual puede reducir la irritación causada por la fricción del tejido. Son productos solubles en agua, en base de aceite, glicerina o silicona11 (tabla 1).
La vaselina no es una buena opción, especialmente si se utilizan preservativos como prevención de infecciones de transmisión sexual o del embarazo, ya que daña el látex. En los últimos años se han desarrollado alternativas que no alteran las propiedades físicas del preservativo y que además respetan la viabilidad y motilidad de los espermatozoides debido a un pH y osmolaridad idénticos al semen y moco cervical.
Ante la gran disponibilidad de preparados, las mujeres deberán probar varios productos hasta encontrar el que mejor se adapte a sus necesidades.
Otros tratamientos alternativos y complementariosOfrecen datos de eficacia muy limitados y, en ocasiones, contradictorios.
La homeopatía no ha demostrado eficacia en estudios clínicos comparados con placebo. Se han utilizado algunas propiedades de determinadas plantas como aloe vera, caléndula, dong quai, uña de gato, borraja, manzanilla, lavanda o té verde, pero no existe suficiente evidencia científica para avalar su recomendación (tabla 1).
Las informaciones sobre el efecto vaginal de suplementos de fitoestrógenos por vía oral son controvertidas. Algunas publicaciones señalan que el consumo de una prolongada dieta rica en soja12 o los suplementos de isoflavonas13 tienen un efecto madurativo en el epitelio vaginal (aunque no se indica si ello se corresponde con mejora en los síntomas), mientras que en otros trabajos, el tratamiento con extractos de soja (genisteína) no produjo diferencias significativas en el índice de maduración vaginal en comparación con el placebo14.
La aplicación vaginal de fitoestrógenos precisa mayor investigación para obtener información sobre su efecto (tabla 1).
Tampoco se han mostrado diferencias significativas en el análisis citológico (índice de maduración vaginal) entre las mujeres tratadas con Cimicifuga racemosa o placebo15.
La vitamina D se encuentra implicada en la regulación del crecimiento y diferenciación del epitelio escamoso poliestratificado presente en la vagina16. En estudios en dosis orales o aplicación vaginal ha mostrado un aumento de la lubricación, aunque no se dispone de suficiente evidencia para su recomendación.
Terapia hormonal como tratamiento etiológico de la atrofia urogenital posmenopáusicaLa terapia hormonal (TH) es el tratamiento más efectivo para los síntomas moderados a intensos de la atrofia vulvovaginal17.
El uso de terapias hormonales para prevenir o tratar desde un punto de vista etiológico la sintomatología local que surge en la posmenopausia viene justificado ya que el trofismo del aparato urogenital femenino depende estrechamente de los estrógenos.
Terapia hormonal sistémicaLa administración de estrógenos exógenos ha demostrado restaurar el pH vaginal, engrosar y revascularizar el epitelio, y aumentar la lubricación vaginal. Como resultado, la terapia hormonal (TH) sistémica es capaz de aliviar los síntomas relacionados a la atrofia vaginal, que incluyen sequedad, irritación, prurito, quemazón y dispareunia, entre otros (tabla 1). Existen diversas publicaciones de gran calidad científica que refrendan la indicación de la TH sistémica en el tratamiento de la atrofia vaginal, pero la mayoría de los datos disponibles al respecto son antiguos. Un metaanálisis de 58 estudios de 1998 encuentra que, entre los diferentes preparados sistémicos, solo aquellos que contienen estriol parecen ser menos efectivos18. Sin embargo, existen escasas publicaciones sobre la eficacia a largo plazo de la TH sistémica a este nivel. El estudio Women's Health Initiative (WHI) encontró que el 74% de las pacientes seguían encontrando mejoría sintomática tras un año de TH sistémica19. El hecho de que hasta un 26% de las usuarias de terapia hormonal sistémica seguirán experimentando sintomatología de atrofia urogenital es razón suficiente para justificar el no recomendar de inicio la TH sistémica en mujeres con síntomas vaginales exclusivamente, y el que en muchas mujeres se requiera inicialmente la combinación de estrógenos sistémicos y locales, especialmente cuando se emplea la TH sistémica a dosis bajas5.
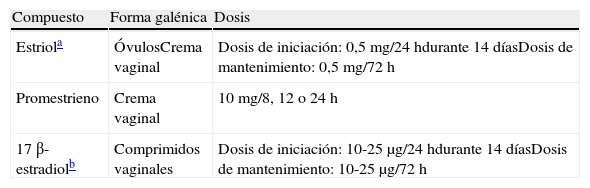
Terapia estrogénica localLa terapia local no solo obvia la mayoría de los efectos adversos de la terapia sistémica, sino que es probablemente más eficaz en el tratamiento de la sintomatología vulvovaginal (tabla 1)17. Las bajas dosis de TH local pueden mejorar además la satisfacción sexual, ya que mejoran la lubricación e incrementan el flujo sanguíneo y la sensibilidad vaginal. Existen diferentes principios activos y formas galénicas disponibles en nuestro país para la administración de estrogenoterapia local (tabla 2).
Estrógenos para uso tópico comercializados en España
| Compuesto | Forma galénica | Dosis |
| Estriola | ÓvulosCrema vaginal | Dosis de iniciación: 0,5 mg/24 hdurante 14 díasDosis de mantenimiento: 0,5 mg/72 h |
| Promestrieno | Crema vaginal | 10 mg/8, 12 o 24 h |
| 17 β-estradiolb | Comprimidos vaginales | Dosis de iniciación: 10-25μg/24 hdurante 14 díasDosis de mantenimiento: 10-25μg/72 h |
Varios parámetros subjetivos han sido usados para cuantificar el efecto de la TH local, como la mejoría sintomática o de la apariencia del grosor vaginal. Igualmente, se han realizado mediciones objetivas de los descensos del pH vaginal, del incremento en la dotación lactobacilar o de las variaciones en la citología a favor de las células superficiales. Una revisión de Cochrane de 20066,20 identificó 37 ensayos clínicos, incluyendo 19 con comparaciones aleatorizadas de preparados estrogénicos administrados intravaginalmente en 4.162 mujeres posmenopáusicas durante al menos 3 meses. Los análisis comparativos de estos ensayos se ven limitados por variaciones en la metodología, en la medida de los resultados, por los reducidos tamaños muestrales y por su sustancial heterogeneidad en las pautas posológicas. A pesar de ello, en conjunto puede afirmarse que las cremas, los pesarios, las tabletas y los anillos vaginales de estradiol fueron igualmente eficaces en el alivio de los síntomas de la atrofia vaginal, y significativamente mejores que placebo y que geles no hormonales en los síntomas moderados-severos.
Aunque la eficacia de todos ellos parece similar, cada preparado hormonal tópico en concreto presenta ciertas diferencias. Por ejemplo, las tabletas vaginales causan menos secreción vaginal que los óvulos y cremas, lo que puede ser preferible en algunas mujeres. De este modo, la experiencia clínica del profesional combinada con la preferencia personal de las pacientes determinará la elección final del producto.
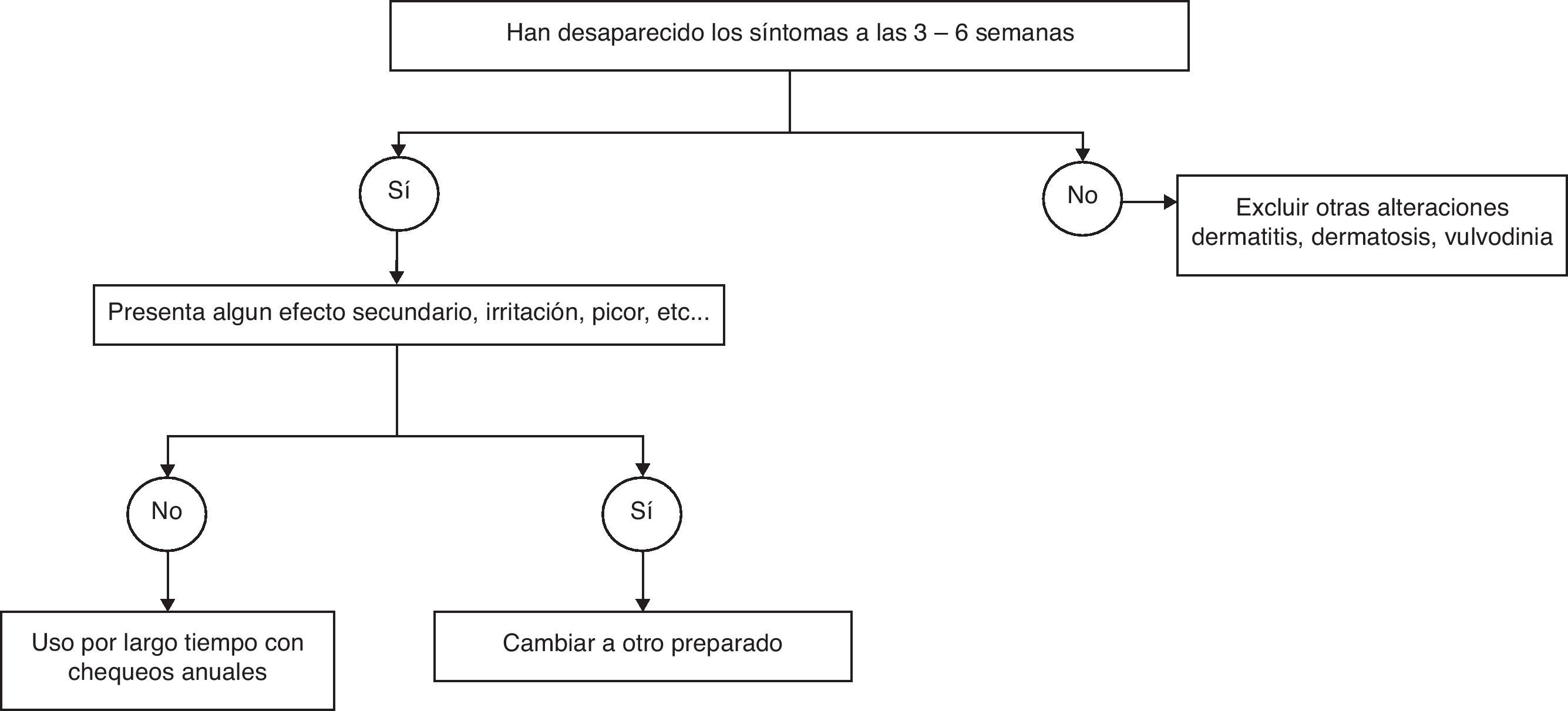
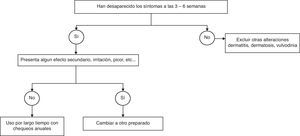
Generalmente, las pacientes obtendrán un alivio sustancial de sus síntomas después de unas 3 semanas de tratamiento, si bien en algunas mujeres se pueden requerir de 4 a 6 semanas antes de apreciar una mejoría adecuada. Alrededor del 80-90% de las mujeres logrará una mejoría subjetiva, y el fracaso del tratamiento obliga a una reevaluación para excluir otras condiciones subyacentes, como dermatitis/dermatosis5.
Efectos adversos de la terapia hormonal local: seguridad y tolerabilidadLos efectos adversos graves son poco comunes17. Los estrógenos son fácilmente absorbidos en la pared vaginal y sus efectos no serán exclusivamente locales a menos que se usen formulaciones farmacéuticas o principios activos que presenten una absorción reducida. Sin embargo, como se necesitan habitualmente solo dosis bajas para tratar los síntomas vaginales, los efectos sistémicos son muy limitados a pesar de la absorción de los estrógenos. De hecho, las concentraciones séricas no se elevan de modo significativo o, si lo hacen, permanecen en los rangos normales para la posmenopausia. En consonancia con lo anterior, no existe evidencia de incremento de episodios tromboembólicos o de aumento de metástasis o recidiva en supervivientes de cáncer mamario en usuarias de TH local5.
Para determinar la seguridad de la TH vaginal se han empleado la medición de los valores séricos de estradiol y hormona foliculoestimulante (FSH), el grosor endometrial ecográfico, la biopsia endometrial y la presencia de sangrado tras administración de gestágenos. La revisión Cochrane de 200620 analizó, además de la eficacia, 14 ensayos clínicos sobre seguridad con estos tratamientos. En ella, un estudio mostró efectos adversos significativos del tipo de sangrado uterino, dolor mamario y perineal solo para la crema de estrógenos conjugados equinos (la cual no está disponible en España) y no para otros preparados, con lo cual la tolerabilidad es excelente. Sin embargo, todos los preparados pueden asociarse a efectos adversos menores, del tipo de la irritación o prurito vaginal o el aumento de la secreción vaginal.
Numerosos estudios clínicos y la citada revisión Cochrane han evaluado la necesidad del uso concurrente de gestágenos en mujeres en tratamiento con estrógenos vaginales. En todos ellos, la incidencia de hiperplasia endometrial observada es muy baja y similar a la de la población posmenopáusica no tratada, siendo ligeramente más elevada solo para la crema de estrógenos conjugados equinos (no disponibles en España). Una revisión de estrógenos tópicos de 200921 concluyó que ningún estudio evidencia proliferación endometrial tras 6-24 meses de uso, de manera que la literatura médica proporciona información consistente respecto a la seguridad de los preparados estrogénicos vaginales de baja dosis y no apoya el uso concomitante de gestágenos sistémicos para la protección endometrial. Esta evidencia ha sido apoyada en las guías de práctica clínica recientes de la International Menopause Society (IMS)5 y de la North American Menopause Society (NAMS)17.
Hechos clínicos importantes que cabe reseñar son que parece haber un vínculo entre la dosis y el tipo de estrógenos usados y la respuesta endometrial, de modo que los clínicos debieran prescribir la menor dosis efectiva y advertir a las pacientes de no exceder la frecuencia recomendada de administración del producto elegido, si bien una paciente ocasional pudiera requerir un uso más frecuente para obtener una respuesta satisfactoria. Así, Ulrich et al.22, en 2010, estudiaron el endometrio de 336 pacientes similares con dosis de 10 μg de estradiol en comprimidos vaginales, durante 12 meses, y constataron la ausencia de estimulación endometrial mediante ecografía y biopsia. Hausmann et al.23 estudiaron en 2010 la farmacocinética de los comprimidos de ultrabaja dosis de 10 μg de 17 β-estradiol en las colpitis atróficas llegando a la conclusión de que con la utilización de estas dosis se produce un 50% menos de absorción sistémica que con las de 25 μg. Con ninguna de las 2 dosis, tanto bajas como ultrabajas, hubo efecto acumulativo, por lo que se señala la preferencia de usar la ultrabaja dosis, es decir, 10 μg.
Por otra parte, hay escasa evidencia para comprobar la seguridad más allá de un año de uso para cualquier producto vaginal. En la actualidad, no hay motivos para que las mujeres con atrofia vaginal sintomática no utilicen terapia estrogénica local de baja dosis por el tiempo que sea necesario según la presencia de síntomas5. Sin embargo, en pacientes de alto riesgo para carcinoma endometrial o que presenten sangrados, es necesario un seguimiento más exhaustivo17, además de investigar en detalle a aquellas pacientes que presenten cualquier tipo de sangrado vaginal para descartar enfermedad endometrial24. No hay datos suficientes para recomendar una valoración endometrial en pacientes que empleen TH local y se encuentren asintomáticas.
Terapia hormonal local tras cánceres sensibles a las hormonasLa mayoría de los cánceres mamarios y ginecológicos son sensibles a las hormonas, de modo que una cuestión importante es la seguridad del uso de TH local en pacientes oncológicas (carcinoma mamario dependiente de estrógenos, ovárico, endometrial y adenocarcinoma de cérvix). Los cánceres de células escamosas del cuello uterino no responden a las hormonas, pero la radioterapia local puede reducir el número de receptores de estrógenos y disminuir, en consecuencia, la respuesta a TH tópica5.
No existen estudios que permitan hacer recomendaciones basadas en evidencias al respecto. Únicamente existe un ensayo sobre 1.472 mujeres con cáncer de mama, el 23,2% de las cuales había usado algún estrógeno vaginal, aunque solo el 4,7% era debido a síntomas vaginales25. No se observó un aumento en la recurrencia tumoral después de un seguimiento promedio de 5,5 años, pero el diseño de este estudio no permite confirmar una ausencia absoluta de riesgo. Los inhibidores de aromatasa tienden a causar síntomas de deficiencia estrogénica más intensos que el tamoxifeno y, por lo tanto, tienen un mayor impacto sobre la función sexual, si bien, al no bloquear el receptor estrogénico, la eficacia de la TH local se verá menos comprometida que en las pacientes que emplean tamoxifeno. Biglia et al.26, mediante un ensayo, compararon los estrógenos en sangre en 3 grupos de pacientes, uno tratado con comprimidos vaginales de 10 μg de estradiol, otro con 25mg de crema de estriol y los compararon con un tercero con 2,5 g de crema hidratante de policarbofilo, concluyendo que no existían diferencias significativas de la tasa de estrógenos en sangre ni en el grosor endometrial entre los 3 grupos; al mismo tiempo solo mejoraba la sintomatología local y normalizaba el pH vaginal en las tratadas con estrógenos locales. Kendal et al.27 realizaron un estudio de mujeres con cáncer de mama en tratamiento con comprimidos vaginales de 25 μg de estradiol y observaron que la supresión estrogénica conseguida por los inhibidores de la aromatasa se revertía con dicho tratamiento, por lo que en opinión de estos autores están formalmente contraindicados.
En el caso de los carcinomas endometriales podría existir preocupación por un posible aumento del riesgo de recidiva en la cúpula vaginal por la TH local, pero no existen datos al respecto. Sobre el carcinoma ovárico, no hay información que sugiera un riesgo aumentado de recurrencia con la terapia estrogénica local5.
Tras cualquier cáncer ginecológico puede ser apropiado discutir el riesgo relativo del uso de estrógenos con el equipo de oncólogos y también con la paciente. Para las mujeres con cáncer mamario dependiente de estrógenos son preferibles de inicio las terapias no hormonales, pero cuando estas no son efectivas, pueden utilizarse estrógenos vaginales en la mínima dosis efectiva y tras el consentimiento informado de la paciente17.
Revisión crítica del posicionamiento de las diferentes sociedades científicasLas sociedades internacionales que agrupan a un mayor número de especialistas en climaterio5,17 coinciden en que los objetivos del tratamiento de la vaginitis atrófica son el alivio de los síntomas, revertir o reducir al mínimo los cambios fisiológicos, y la mejora de la calidad de vida de la paciente.
Tratamientos no hormonalesLos hidratantes y lubricantes vaginales son para la mayoría de las sociedades internacionales y locales los tratamientos no hormonales de primera línea para la sequedad vaginal. Suelen destinarse a mujeres que no desean o no pueden emplear hormonas y a mujeres con un grado mínimo de cambios fisiológicos o síntomas. Sin embargo, a pesar de su amplio uso, se carece de datos de eficacia de gran parte de las preparaciones de venta libre utilizados para el tratamiento de la vaginitis atrófica.
La vitamina E suele administrarse en cápsulas de gel. Estas cápsulas pueden ser perforadas y el gel se coloca en la vagina –se recomienda el uso de protectores higiénicos pues la vitamina E mancha la ropa. Los geles policarbofílicos son de los mejores hidratantes vaginales, generalmente se colocan en la vagina hasta tres veces por semana. Actúa como un bioadhesivo y produce una película húmeda que se adhiere a la superficie vaginal. Estos geles han demostrado restaurar el pH vaginal y mejorar la sintomatología de modo semejante a los preparados a base de estrógenos28.
Actualmente también están disponibles una amplia variedad de lubricantes hidrofílicos pero la mayoría de ellos carecen de estudios de calidad suficiente. Otro tipo de lubricantes son los que están constituidos a base de silicona. Estos productos suelen durar más tiempo que los hidrofílicos al no absorberse en la piel29. Otros productos no hormonales que recogen el posicionamiento de la IMS son la pilocarpina oral, los anestésicos tópicos, dong quay y cápsulas de lactobacilos.
Consideraciones sobre el uso de estos productos de venta libre que se deben tener en cuenta son el hecho de que algunas mujeres pueden presentar sensibilidad o alergia a los componentes de las cremas hidratantes o lubricantes. Estas cremas pueden contener aditivos, colorantes, perfumes, bactericidas o espermicidas que pueden aumentar la irritación de la mucosa vaginal atrófica. Los irritantes vaginales y vulvares que con frecuencia se emplean o forman parte de estos compuestos son la benzocaína, la clorhexidina, algunos conservantes (parabenos y propilenglicol) y los condones de látex. Ciertos productos de amplio uso como los aceites minerales y la vaselina pueden interferir con la eficacia del preservativo y alterar el equilibrio natural de la microbiota vaginal, por lo que deben ser evitados30.
Tratamiento hormonalLocalLas dosis bajas de estrógenos son el tratamiento farmacológico hormonal de primera línea para la vaginitis atrófica. Los posicionamientos publicados por la NAMS y la IMS5,17, siguiendo criterios de medicina basada en la evidencia, hacen recomendaciones específicas sobre el uso de los estrógenos locales en el tratamiento de la atrofia vaginal.
Los estrógenos revierten los cambios anatómicos propios de la atrofia, disminuyen el pH y la sequedad vaginal, revascularizan en el epitelio, e incrementan las secreciones vaginales y el número de células superficiales en la citología. Los datos disponibles de ensayos clínicos aleatorizados y controlados con placebo demuestran que las dosis bajas de estrógenos aplicadas por vía vaginal son eficaces y bien toleradas, con bajos perfiles de efectos secundarios, y que el uso de progestágenos no está indicado cuando baja dosis de estrógeno se administra localmente para el tratamiento de la vaginitis atrófica11.
La preferencia de las pacientes es muy importante en el momento de seleccionar la forma galénica del tratamiento. La discusión de los pros y los contras de cada producto y la consideración de los síntomas de la paciente, el estilo de vida y las necesidades individuales facilitarán una elección óptima y contribuirá a una mayor adherencia al tratamiento. La duración del tratamiento es variable, pero se debe continuar, siempre y cuando los síntomas dolorosos que afectan a la calidad de vida estén presentes.
SistémicoEntre las indicaciones para la TH se incluye la sintomatología urogenital y múltiples estudios y metaanálisis han demostrado su elevada eficacia. Sin embargo, hay que tener en cuenta los efectos secundarios y que el empleo de TH sistémica no resuelve los síntomas de atrofia en el 100% de las mujeres (datos del estudio WHI señalan que el 74% de las mujeres con TH oral mejoran la sintomatología de atrofia genital)19, por lo que en algunos casos la asociación con tratamiento tópico puede mejorar la satisfacción de las pacientes al inicio de la terapia31.
Recomendaciones finalesLa atrofia vaginal, causada por el déficit estrogénico, es responsable de la aparición de síntomas que afectan a la calidad de vida, como la sequedad vaginal y/o dispareunia, y afecta al 40% de las mujeres posmenopáusicas españolas.
El diagnóstico es sencillo y se basa en la anamnesis junto con la exploración visual. Sin embargo, una de las grandes barreras diagnósticas es que los profesionales de la salud no preguntan por estos síntomas, por lo que recomendamos preguntar específicamente por ellos.
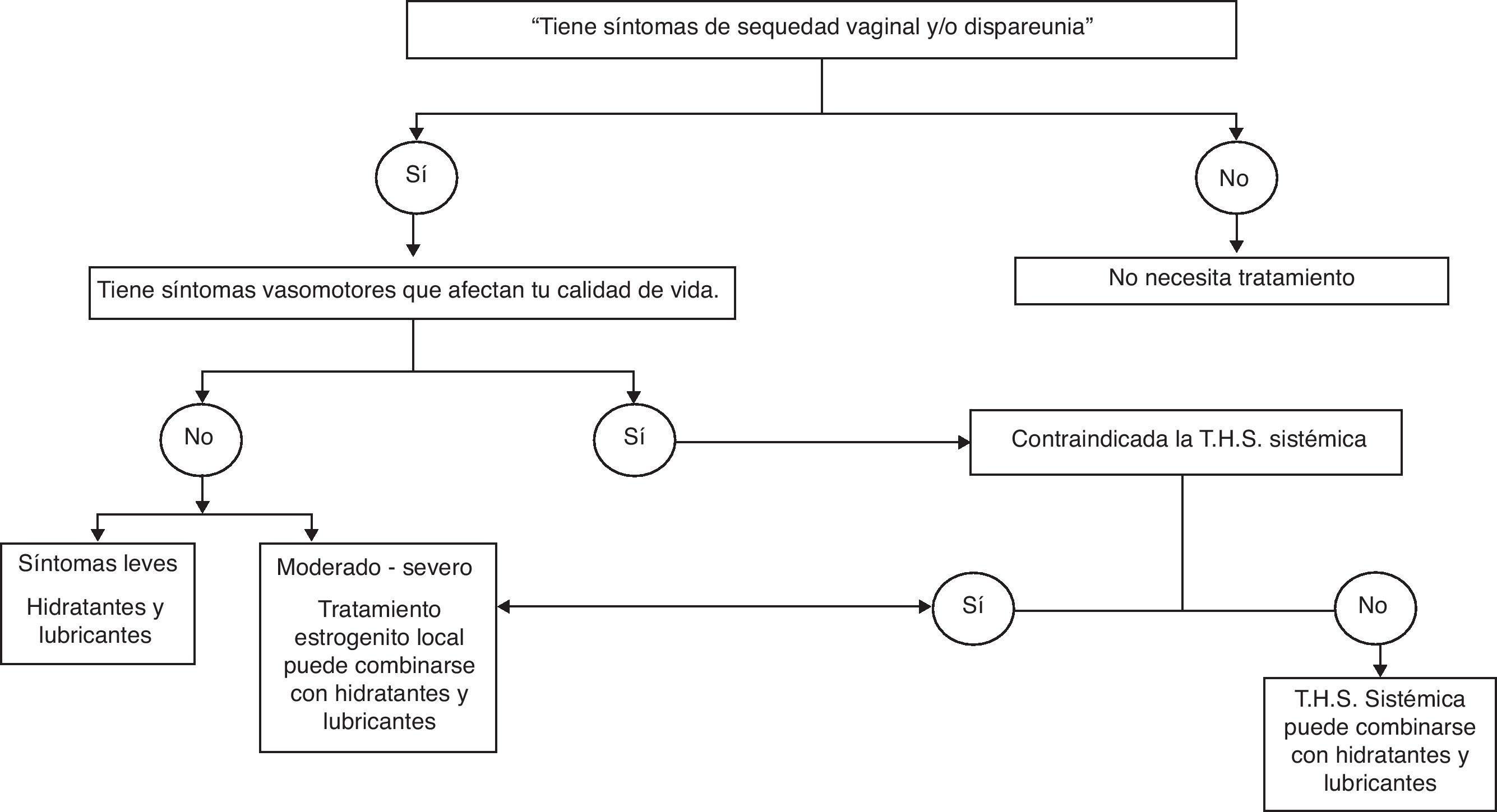
El tratamiento tendrá como objetivo restaurar la fisiología urogenital y aliviar los síntomas. Para síntomas como la sequedad vaginal o dispareunia asociada con atrofia vaginal, la primera línea de tratamiento son los hidratantes (evidencia IA) y lubricantes vaginales (evidencia IIB). Si no proporcionan una adecuada mejoría de los síntomas o ante síntomas moderados-intensos, se utilizarán estrógenos. Los estrógenos son el tratamiento más efectivo. En casos de solo atrofia vaginal, la elección será la terapia con estrógenos locales (TEL) (evidencia IA). En los casos en que coexistan con sintomatología vasomotora que afecte a la calidad de vida, la elección será la TH sistémica (evidencia IA) (fig. 1). Los tratamientos estrogénicos locales o sistémicos pueden combinarse con hidratantes y lubricantes.
Todos los estrógenos tópicos (tabletas de estradiol, óvulos y cremas de estriol y promestrieno) han demostrado ser eficaces y seguros (evidencia IA). Ninguno de estos tratamientos necesita que se añadan gestágenos para la protección endometrial, aunque no existen datos a más de un año. Los ensayos clínicos en mujeres posmenopáusicas han demostrado que la prescripción de estrogenoterapia local con bajas dosis es eficaz y bien tolerada, al tiempo que produce una mínima absorción sistémica. Entre los preparados disponibles en España, existen presentaciones en dosis bajas, una en dosis ultrabaja, de estrógenos, conteniendo esta 10 μg de 17 β-estradiol en comprimidos vaginales, que ha demostrado la misma efectividad con menor absorción sistémica (tabla 2).
La atrofia vaginal es una consecuencia frecuente del tratamiento de muchos cánceres ginecológicos. El uso de estrógenos locales en estos casos es discutido. La preferencia será utilizar tratamientos no hormonales y, si fuera necesario y tras informar a la paciente y obtener su consentimiento, podría justificarse el uso de estrógenos locales en la menor dosis efectiva.
La mejoría tras el tratamiento estrogénico se observa a las 3-6 semanas de comenzar el tratamiento en el 80-90% de las pacientes, pudiéndose mantener el tratamiento por largo plazo, siempre que se mantengan los beneficios (fig. 2).
FinanciaciónEste estudio fue financiado por ISDIN.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
Esta revisión ha sido solicitada, supervisada y aceptada por la Sociedad Española de Ginecología y Obstetricia (SEGO). Recomendaciones con evidencias IA son los estrógenos locales e hidratantes vaginales y la terapia hormonal sistémica cuando existan síntomas vasomotores. Los lubricantes vaginales tienen una evidencia IIB.