Presentamos el caso de una mujer de 79 años, con antecedentes de un supuesto fibroma ovárico, que comienza con un cuadro de dolor en fosa ilíaca izquierda y leucocitosis, siendo diagnosticada de diverticulitis. Durante el estudio, incidentalmente se descubre una masa en la pared abdominal anterior que resultó ser una recidiva de un tumor de células de la granulosa.
Realizamos una revisión bibliográfica de esta patología centrándonos, fundamentalmente, en sus aspectos clínicos y terapéuticos.
Se trata de una neoplasia muy poco frecuente, sobre la que hay pocos estudios, que se caracteriza por su larga historia natural y su tendencia a recurrir años después del diagnóstico.
We present the case of a 79-year-old woman who was misdiagnosed with an ovarian fibroma 5years previously. The patient presented with pain in the right iliac fossa with leukocytosis and was diagnosed with diverticulitis. A mass was incidentally found in the anterior abdominal wall, which was later confirmed as metastasis from a granulosa cell tumor of the ovary.
We provide a literature review, focussing on the clinical findings and treatment of this tumor. Few reports have been published of this uncommon entity, characterized by a long natural history and tendency to recur years after the initial diagnosis.
Los tumores de los cordones sexuales y del estroma gonadal suponen el 5-8% de las neoplasias ováricas primarias1. Los tumores de las células de la granulosa-estromales constituyen el subtipo más frecuente de éstos (70%) y, a su vez, se clasifican en: tumores de las células de la granulosa (TCG), tecomas y fibromas2 (tabla 1). Estos TCG se dividen en el tipo juvenil (5%) y el del adulto (95%), que suele aparecer en la quinta década de la vida (periodo perimenopáusico o posmenopáusico temprano). Ambos tipos se diferencian por sus características clinicopatológicas3.
Clasificación de tumores de células granulosa-estromales
| A | Tumor de células de la granulosa |
| I. Tipo adulto | |
| II. Tipo juvenil | |
| B | Tumores en el grupo tecoma-fibroma |
| I. Tecoma | |
| A. Típico | |
| B. Luteinizado | |
| II. Fibroma-fibrosarcoma | |
| A. Fibroma | |
| B. Fibroma celular | |
| C. Fibrosarcoma | |
| III. Tumores estromales con elementos de los cordones sexuales | |
| IV. Tumor estromal esclerosante | |
| V. Tumor estromal en anillo de sello | |
| VI. No clasificado | |
Los TCG pueden ser sólidos, quísticos o de composición mixta, con frecuentes áreas de hemorragia. El tamaño tumoral varía desde lesiones microscópicas (10-15%) a grandes masas tumorales, con una media de 12cm4. Se componen de células de la granulosa, células de la teca y fibroblastos en una proporción variable, pero predominando el primer grupo, y en algunos casos, pueden producir esteroides.
Se caracterizan por un bajo potencial maligno, una alta tasa de supervivencia, una lenta progresión y recurrencias tardías, que se producen hasta 40 años después del diagnóstico inicial, en una media de 4 a 6 años, siendo más frecuentes en la variedad de TCG del adulto2,5.
Dos tercios de las pacientes afectadas por este tipo de tumor presentan sangrado vaginal anormal. La alteración endometrial típica que se asocia a los TCG es la hiperplasia simple. Asimismo, se ha evidenciado una asociación de esta neoplasia con el cáncer de mama4.
Presentamos el caso de una mujer de 79 años con una recidiva de TCG en la pared abdominal, que tiene lugar 5 años después de la escisión quirúrgica tumoral. Debido a la rareza de este tumor, realizamos una revisión bibliográfica sobre sus características clínicas y manejo.
Caso clínicoMujer de 79 años, secundípara, entre cuyos antecedentes personales destaca obesidad, una cesárea, e histerectomía con doble anexectomía por un tumor ovárico hace 5 años. Tras revisar su historia clínica, descubrimos que se trataba de una lesión quística en el ovario derecho, con el diagnóstico anatomopatológico de fibroma celular. Dos meses después de aquella cirugía, volvió a ser intervenida por un síndrome adherencial.
En el actual episodio, la paciente acudió a urgencias por un cuadro de dolor abdominal de 6 días de evolución, febrícula y discreta leucocitosis. Mediante una ecografía se confirmó el diagnóstico de sospecha de diverticulitis y se evidenció, de forma incidental, una masa en pared abdominal anterior. Se le administró un tratamiento médico para su cuadro agudo de diverticulitis, que evolucionó favorablemente, y se inició el estudio de la tumoración.
En la exploración clínica presentaba buen estado general y constantes normales. A la palpación abdominal destacaba un dolor en fosa ilíaca izquierda, sin signos de defensa ni peritonismo. No se palpaban masas, aunque era difícil de valorar por la obesidad.
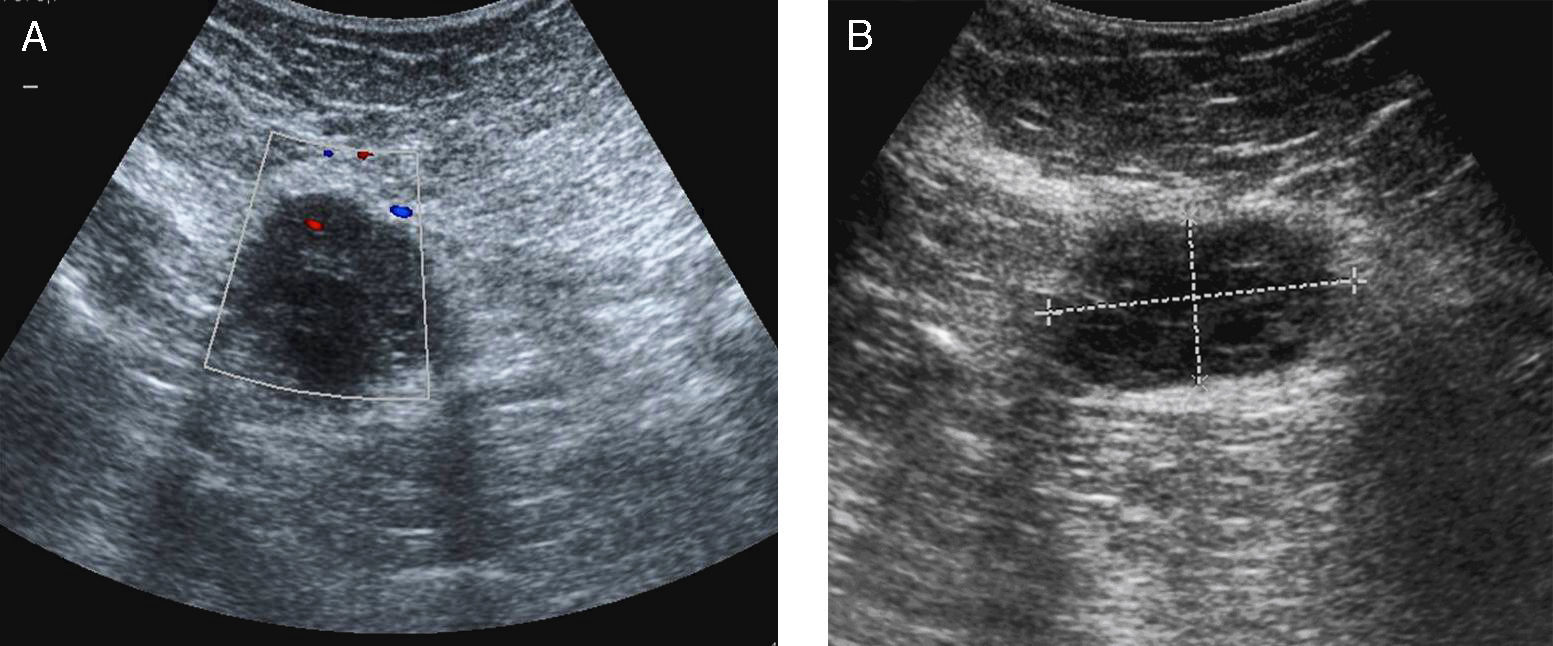
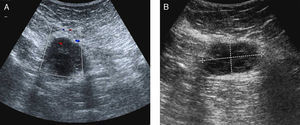
Entre las pruebas complementarias, se realizó una ecografía abdominal donde se visualizaron hallazgos radiológicos compatibles con una afectación inflamatoria diverticular aguda del colon sigmoides. Asimismo, en el hipo-mesogastrio se observó una formación nodular sólido-quística de 45 x 30mm de aparente localización extraperitoneal y escasa vascularización (fig. 1a y b).
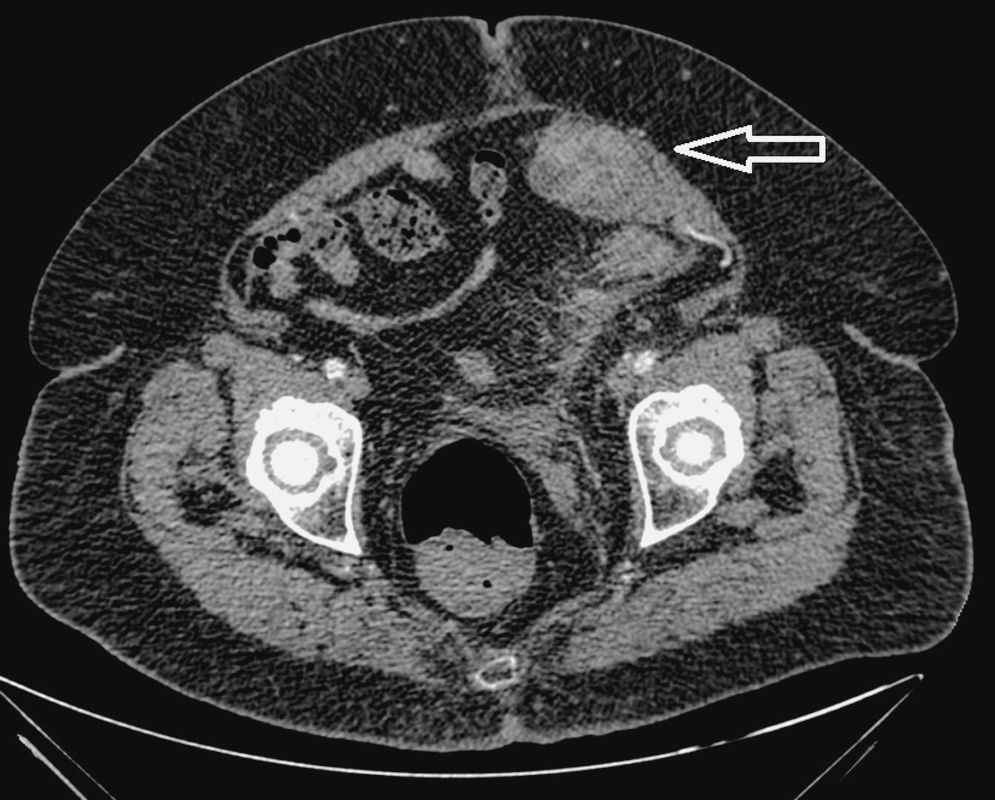
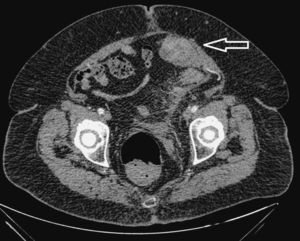
Debido a la dificultad en la valoración de este hallazgo por la obesidad de la paciente, se completó el estudio con una TC abdomino-pélvica sin contraste por vía intravenosa. En ésta se identificó la imagen nodular de localización extraperitoneal y profunda al músculo recto anterior izquierdo, al que comprime y desplaza, sin visualizar un claro plano de clivaje entre ambas estructuras. La lesión tenía un tamaño aproximado de 45 x 36 x 35mm, con unos bordes lobulados y una densidad homogénea de partes blandas, que tras la administración de contraste presentó una captación irregular, poniendo en evidencia áreas sólidas y quísticas con múltiples tabiques en su interior (fig. 2).
Teniendo en cuenta los antecedentes quirúrgicos sobre esta región, se planteó el diagnóstico diferencial de una fibromatosis mesentérica (tumor desmoide) de la musculatura abdominal anterior o, menos probablemente, un tumor primario (fibrosarcoma, rabdomiosarcoma) o metastásico.
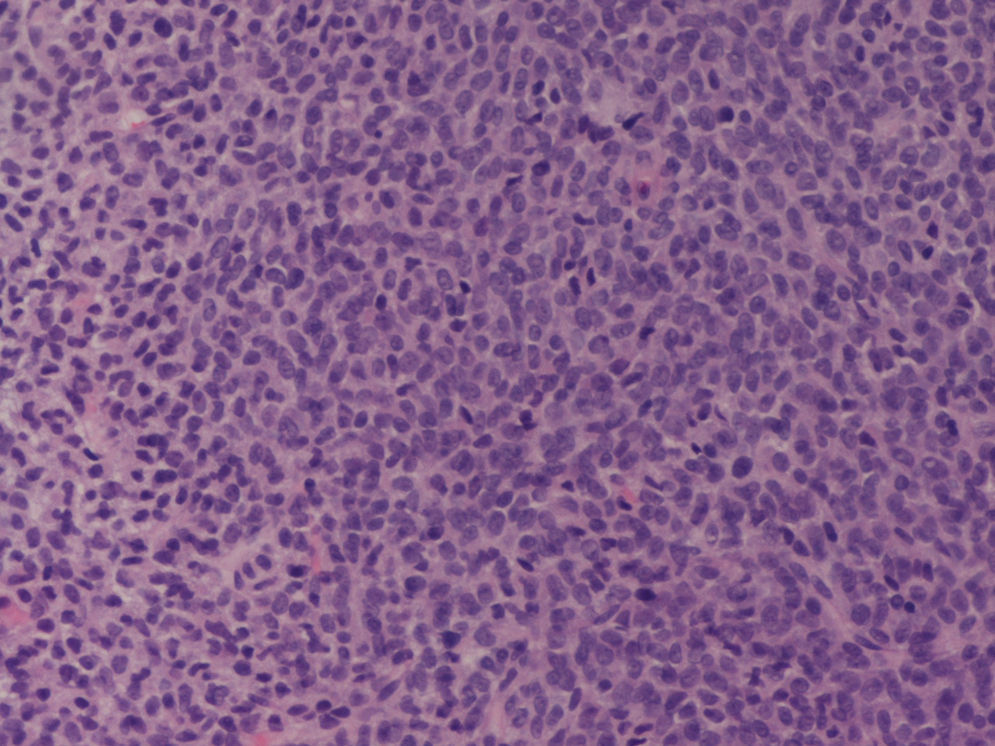
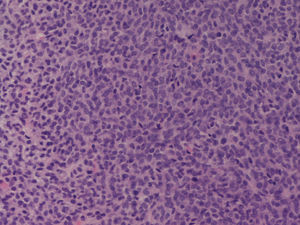
Con este diagnóstico de presunción, se le realizó una biopsia de la tumoración abdominal con aguja de 14 G y guía ecográfica. El estudio anatomopatológico de la muestra identificó una proliferación monomorfa, difusa y relativamente densa, de células de pequeño tamaño y de baja agresividad histológica que se disponían formando nódulos o lobulaciones separadas por finos tractos fibrosos, sin evidencia de atipia significativa ni necrosis y con ocasionales figuras de mitosis, todo ello compatible con un tumor del grupo «estroma y cordones sexuales», concretamente, con un tumor de células de la granulosa (fig. 3).
A la paciente se realiza una exéresis completa de la masa abdominal, siendo el diagnóstico de la pieza extraída acorde con el de la biopsia, presentando los bordes quirúrgicos libres. Ante la discrepancia entre el diagnóstico del tumor ovárico que le fue extirpado hace 5 años y la tumoración abdominal actual, fueron revisadas ambas muestras, y se concluyó que la masa anexial, que fue clasificada previamente como fibroma celular de 8 x 6cm, se trataba en realidad de un tumor de células de la granulosa de tipo difuso. Revisamos los marcadores tumorales que presentó la paciente antes de la anexectomía y encontramos que el CEA, CA19.9 y CA 12.5 se hallaban dentro de los límites de la normalidad.
La evolución de la paciente fue favorable, siendo dada de alta. En la actualidad, persiste asintomática sin signos de recidiva tumoral locorregional o a distancia y no desea ser sometida a más tratamientos.
DiscusiónLos TCG del adulto son tumores ováricos muy poco frecuentes y constituyen aproximadamente el 2-5% de todas las neoplasias ováricas malignas. Debido a su escasa prevalencia, así como a su curso indolente, el manejo clínico, los factores pronósticos, el tratamiento y los controles de seguimiento no están bien establecidos6.
En contraste con el cáncer de ovario de origen epitelial, la mayoría de las pacientes con estos tumores son diagnosticadas en estadios tempranos y, generalmente, son considerados como de bajo grado de malignidad.
Los síntomas de presentación más frecuentes del tumor de células de la granulosa son el sangrado uterino anormal y el dolor secundarios al tamaño tumoral. Debido a la acción estrogénica, además de una hiperplasia endometrial o un carcinoma endometrial, en pacientes en edad reproductiva suelen cursar con irregularidades menstruales, amenorrea, menorragia o sangrado intermenstrual y, en las posmenopáusicas, igualmente suelen producir sangrados uterinos anormales7. En caso de edad avanzada, los síntomas más frecuentes son: molestias abdominales, aumento del perímetro abdominal y pérdida de peso.
La extensión de los TCG es fundamentalmente local, aunque también pueden diseminar por vía hematógena o linfática, pudiendo aparecer metástasis años después del diagnóstico inicial. Éstas son más frecuentes en pulmón, hígado, bazo y cerebro, siendo mucho más raras en otras localizaciones, como la mama o el hueso8–10.
Las técnicas de imagen que ayudan al diagnóstico inicial del tumor y a la detección de metástasis incluyen la ecografía y la TC, que ponen de manifiesto el tumor como una masa ovárica de aspecto sólido, quístico o mixto, bien circunscrita y generalmente unilateral. Son frecuentes los componentes hemorrágicos y un aumento de la vascularización intratumoral.
Se han descrito numerosos patrones histológicos de estos tumores11. Dentro del grupo de los bien diferenciados, el patrón microfolicular es el más frecuente, caracterizado por los «cuerpos de Call-Exner», que son estructuras con forma de roseta y contenido eosinófilo. En nuestro caso, el tumor primario fue clasificado inicialmente como fibroma celular (perteneciente al grupo de los tumores de células de la granulosa-estromales), debido a la ausencia de cuerpos de Call-Exner, a la presencia de un patrón reticulínico y a un índice de mitosis acorde. Los fibromas celulares (10% de todos los fibromas) son densamente celulares e, histológicamente, son muy parecidos a los TCG de tipo difuso, con los que hay que hacer el diagnóstico diferencial12.
Se han estudiado numerosas sustancias que podrían utilizarse como marcadores para el diagnóstico o seguimiento de la enfermedad. El estradiol se encuentra entre los más importantes y es el causante de la clínica de hiperestrogenismo que presentan algunas pacientes. Sin embargo, no se ha demostrado lo suficientemente sensible como para ser usado como marcador tumoral4,13. Otras sustancias valoradas han sido la testosterona o sus precursores, la inhibina4, la proteína reguladora de folículos y la sustancia inhibidora mülleriana, aunque su importancia clínica está aún por determinar14.
El sistema de estadificación utilizado para los TCG es el mismo que para los tumores epiteliales (FIGO); sin embargo, el significado pronóstico de algunos aspectos, como la citología positiva en el lavado peritoneal o la invasión de la superficie ovárica, no están bien definidos para los TCG.
La cirugía es el eje principal del tratamiento de las pacientes con un TCG, tanto en los tumores primarios como en los casos de recidiva. Si la paciente es joven o con deseo gestacional y la enfermedad parece confinada a un ovario, se realizaría una salpingo-ooforectomía unilateral. En pacientes posmenopáusicas o con deseos genésicos cumplidos, se realizará un histerectomía con doble anexectomía15. En todos los casos debe realizarse, a continuación, una omentectomía y tomar múltiples biopsias del peritoneo diafragmático, de las gotieras, del fondo de saco de Douglas, de la serosa intestinal, así como un muestreo o linfadenectomía de los ganglios pélvicos y para-aórticos. Es recomendable, en caso de conservar el útero, realizar una biopsia endometrial, para descartar un posible carcinoma.
La quimioterapia adyuvante sólo se recomienda en estadios precoces con factores de riesgo o en estadios avanzados, ya que parece aumentar la supervivencia libre de enfermedad y la supervivencia libre de recaída, al igual que la radioterapia.
Las recurrencias pélvicas o abdominales son susceptibles, como en nuestro caso, de una resección quirúrgica. La quimioterapia también se acepta en estos casos, especialmente cuando la cirugía de la recidiva resulta subóptima. En cualquier caso, el pronóstico es pobre, lo que sugiere la necesidad de nuevas opciones terapéuticas más efectivas4.
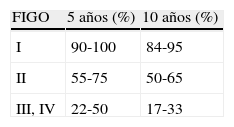
Es importante destacar que, al igual que en nuestro caso, muy raramente se lleva a cabo una completa estadificación en el momento del diagnóstico. Cuando ésta sí que se ha realizado correctamente, se ha visto que, en el estadio I de enfermedad, la mayoría de estudios muestran un rango de supervivencia mayor al 90%, siendo el riesgo de recurrencia para el estadio IA del 9%. El estadio II conlleva una supervivencia a los 5 años del 55 al 75%, siendo ésta del 22 al 30% para los casos de estadio III y IV (tabla 2). Un 70% de las pacientes con recurrencia del TCG fallecen por esta causa4.
La edad igual o inferior a 50 años y, principalmente, el estadio inicial en el momento del diagnóstico son los dos únicos factores pronósticos significativos que mejoran la supervivencia.
Como los TCG tienen tendencia a la recurrencia tardía, es aconsejable el seguimiento de estas pacientes indefinidamente, mediante ecografía, TC o marcadores tumorales.
ConclusiónEl TCG es una neoplasia poco común, que se caracteriza por su dilatada historia natural, una clínica insidiosa y su tendencia a recurrir tras largos periodos libres de enfermedad. Por estos motivos, las tasas de muerte a corto plazo no muestran el verdadero potencial maligno de esta neoplasia, siendo necesario un seguimiento indefinido de las pacientes.
El tratamiento inicial de elección es la cirugía, bien conservadora o radical. En estadios avanzados, enfermedad metastásica o recurrente, puede asociarse quimioterapia, radioterapia u hormonoterapia. Aunque, en la mayoría de los casos, el pronóstico es excelente, factores como un estadio avanzado de la FIGO o una edad mayor de 50 años disminuyen la supervivencia.
La relativa infrecuencia de estos tumores, que impide la realización de ensayos clínicos aleatorizados, y su comportamiento biológico variable limitan nuestro conocimiento de la enfermedad. Sin embargo, el estudio de la patogénesis molecular de la enfermedad podría potenciar el desarrollo de nuevas opciones terapéuticas.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.