El cáncer de mama es la enfermedad maligna no dermatológica más frecuente en las mujeres de todo el mundo. Su incidencia se ha ido incrementando; cada año se diagnostican en el mundo 1.151.000 casos nuevos casos. En la actualidad, puede considerarse un problema sanitario de características epidémicas, ya que se estima que 1-2 mujeres de cada 10 desarrollará cáncer de mama a lo largo de su vida. Además, es la primera causa de muerte entre las mujeres en el mundo. En los últimos años, se han realizado multitud de trabajos encaminados a aclarar las causas últimas de esta enfermedad. En esta revisión de la bibliografía científica, presentamos el estado actual de los factores de riesgo del cáncer de mama, así como su influencia en el desarrollo de la enfermedad.
Breast cancer is one of the most common malignancies among women. Its incidence is increasing, with 1,151,000 new cases diagnosed every year. Nowadays, it could be considered an epidemic disease because it is estimated that 1-2 women in every 10 will develop this cancer during their lives. Moreover, it is the first cause of death among women worldwide. A lot of work has been carried investigating the causes of breast cancer in the last few years. We have carried out a review of the scientific literature concerning the current situation of risk factors for breast cancer, and their influence in the development of the illness.
El cáncer de mama es la enfermedad maligna no dermatológica más frecuente en las mujeres de todo el mundo1,2. Su incidencia se ha ido incrementando en todos los países occidentales; cada año se diagnostican en el mundo 1.151.000 casos nuevos casos3,4. En la actualidad, puede considerarse un problema sanitario de características epidémicas, ya que se estima que 1–2 mujeres de cada 10 desarrollará cáncer de mama a lo largo de su vida, dato que no ha variado en los últimos 15 años5-9. Además, es la primera causa de muerte entre las mujeres en el mundo10.
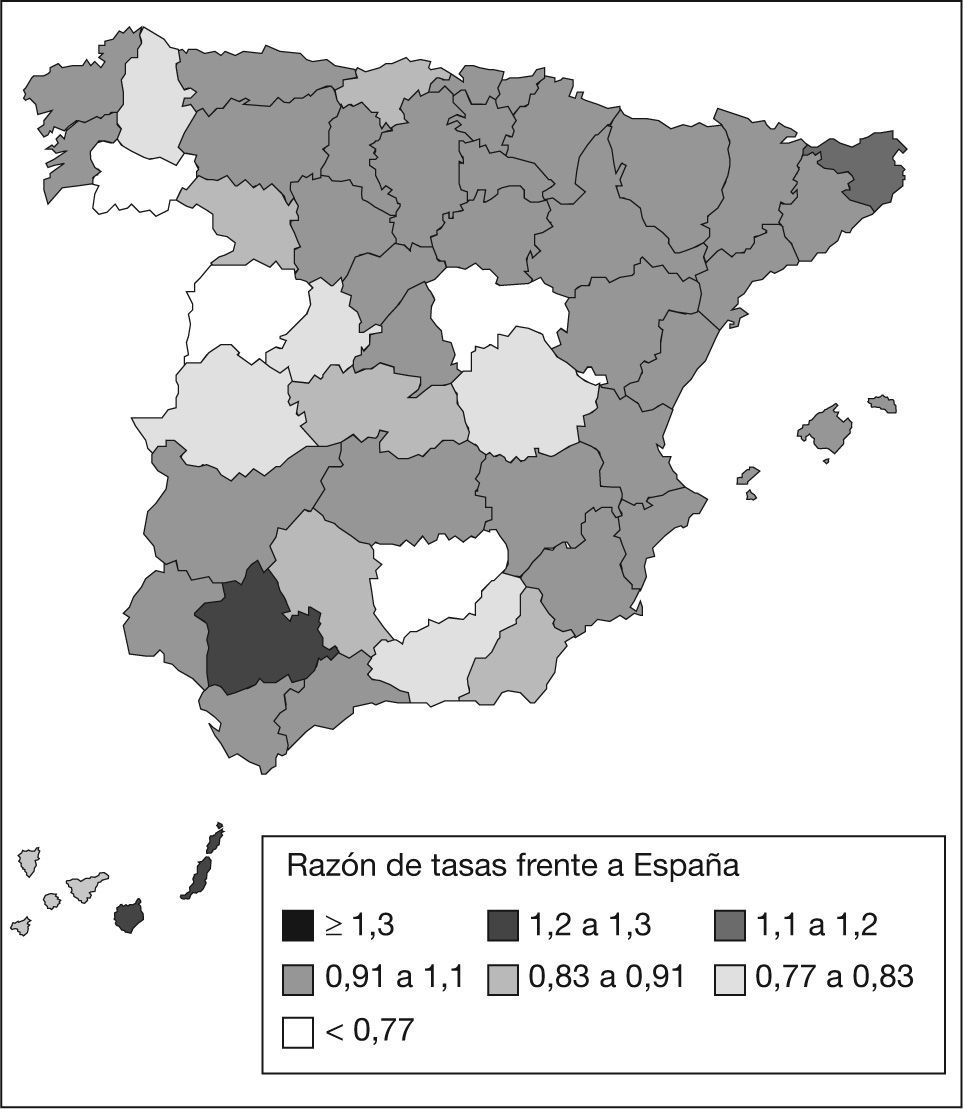
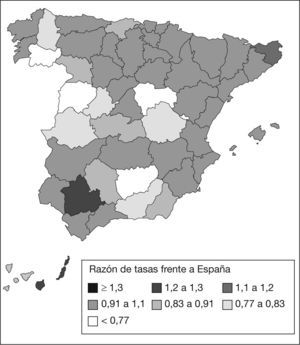
En España, la incidencia asciende a 16.000 nuevos casos anuales2-4,11. Esto supone casi un 10% del total de diagnósticos de cáncer en nuestro país. Con respecto a la tasa de mortalidad española por esta causa, está en torno a 15,9 muertes por 100.000 habitantes/año12-14 (fig. 1). Esta mortalidad ha ido creciendo, dato que se correlaciona con las estadísticas del ámbito mundial.
Con respecto a la supervivencia de estas pacientes, los datos indican que la supervivencia global al año del diagnóstico del cáncer de mama asciende al 95,4% y disminuye al 80,3% a los 5 años15.
En los últimos años, hemos asistido a un aumento en el volumen de estudios, ensayos clínicos y publicaciones relacionados con la etiología, biología molecular, diagnóstico y tratamiento del cáncer de mama, lo cual implica un aumento de las expectativas de comprender mejor la historia natural y el comportamiento clínico de la enfermedad que, esperemos, acabe redundando en una caída de las tasas de mortalidad por esta afección.
ETIOLOGÍA DEL CÁNCER DE MAMA HUMANOEl cáncer de mama ha sido objeto de infinidad de estudios acerca de los posibles factores de riesgo, tanto endógenos como exógenos, que influyen en su aparición. Actualmente, se desconoce la causa que lo desencadena, pero cada día se sabe más acerca de la multitud de factores que influyen en su formación. Son pocos los factores de riesgo que tienen una prevalencia más alta del 10-15%, aunque se ha visto que algunos de ellos, pese a tener una prevalencia baja, se asocian fuertemente a la aparición de este tipo de cáncer16. Además, hay que tener en cuenta que sólo el 30% de los cánceres pueden atribuirse a factores de riesgo conocidos17.
En la práctica habitual, intentar determinar el riesgo individual de cada paciente de presentar cáncer de mama puede ser algo muy útil, de modo que se pueda planificar un control mamario adecuado18.
Los factores de riesgo más importantes se pueden dividir en: factores ambientales, factores hormonales, factores genéticos y lesiones mamarias precursoras.
Factores ambientalesAlimentaciónSe han observado variaciones en la incidencia del cáncer de mama en países cuyas costumbres alimentarias son diferentes. Además, se ha comprobado que mujeres nativas de países con baja incidencia, como China y Japón, al emigrar a países de alta incidencia, como EE. UU. y Canadá, aumentaron significativamente su incidencia, aproximándose a la del país de adopción. Esto se debe, probablemente, a que estas mujeres adoptaron el estilo de vida y alimentación del país donde se trasladaron19.
La estatura elevada y el índice de masa corporal (IMC), ambos ligados a una buena alimentación, apoyan la hipótesis de la relación entre cáncer de mama y dieta. La primera, porque se sabe que un aporte de proteínas temprano aumenta la secreción de hormona del crecimiento, la cual induce la síntesis hepática de factor de crecimiento similar a la insulina tipo 1 (IGF-1), que es un factor de crecimiento para las células tumorales. Con respecto al IMC, las mujeres obesas tienen un riesgo 50% mayor de padecer cáncer de mama; esto se debe a la mayor expresión de aromatasa en el tejido adiposo que provoca la formación de altas concentraciones de estrona, estrógeno extragonadal que favorece la aparición de la afección20.
También se ha estudiado el papel protector de la dieta en la aparición del cáncer de mama, de modo que una dieta rica en productos vegetales, con fruta fresca y baja en calorías, así como el aumento en la práctica de ejercicio físico, ha llevado a una reducción de la incidencia de cáncer en estas pacientes, probablemente debido a un descenso del IMC21,22.
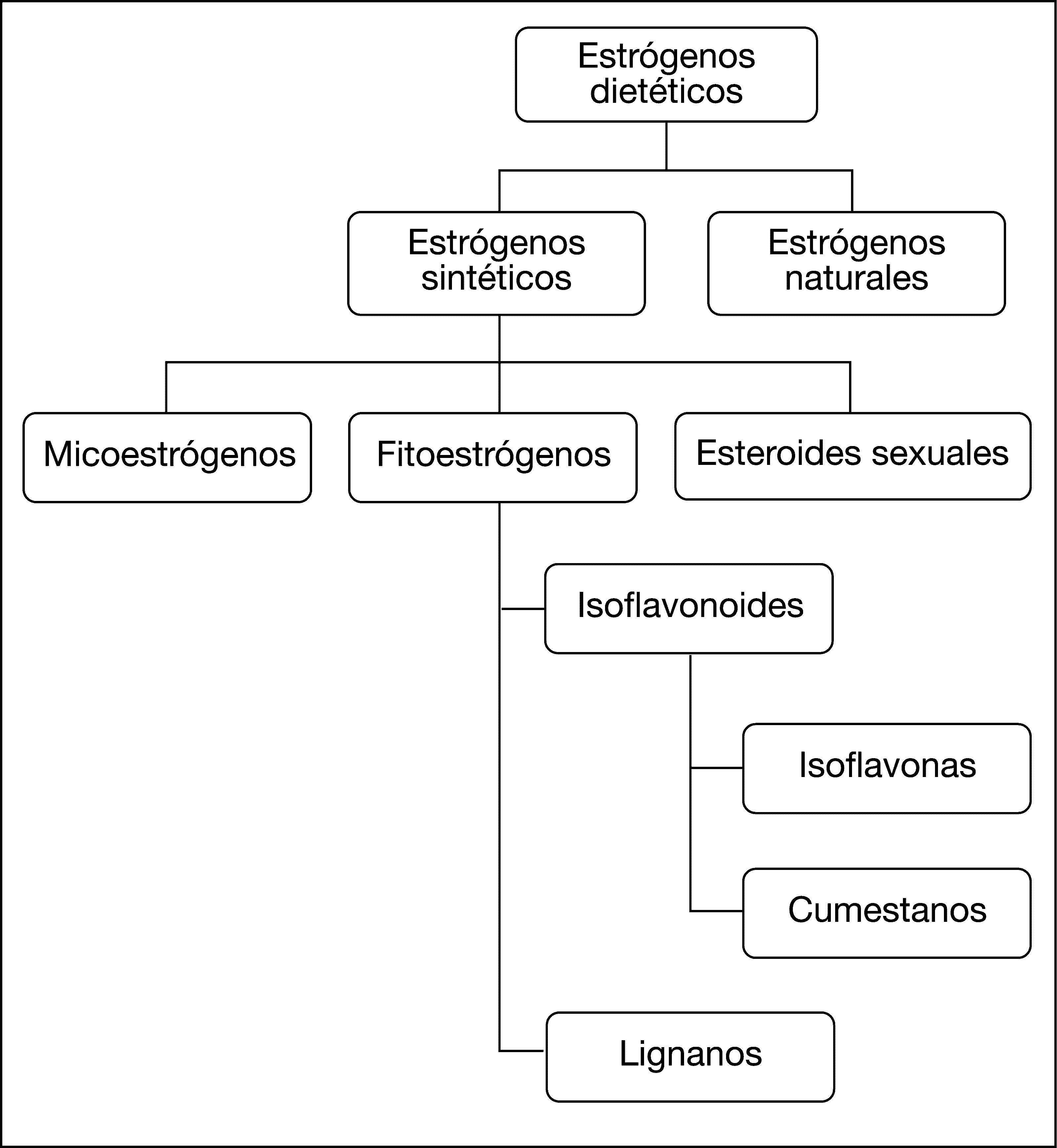
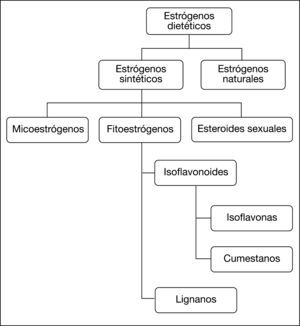
De los datos expuestos anteriormente, se desprende que cada macronutriente ingerido tiene un papel. Con respecto a las proteínas, ya se ha expuesto su papel en el crecimiento que aboca finalmente a la formación de IGF-1. Fuera del papel en el crecimiento, se ha demostrado que el consumo de carne también influye en el riesgo, probablemente por otras vías23. Además, hay que tener en cuenta que el consumo de carne roja, frita o asada, contiene aminas heterocíclicas que se liberan a altas temperaturas, que son potentes mutágenos y carcinógenos en animales de experimentación24. Esto hace que la carne sea un probable promotor de la carcinogénesis mamaria, aumentando el riesgo de carcinoma ductal infiltrante hasta 4 veces, mientras que se observó una asociación negativa con el resto de tipos de cáncer mamario25. Los lípidos son los que aportan más calorías a la dieta (9 Kcal/g), casi el doble que las proteínas y glúcidos, y contribuyen al aumento del IMC. Además, se ha observado que el consumo de ácidos grasos saturados aumenta el riesgo hasta 3,3 veces26. Sin embargo, el consumo de ácidos grasos monoinsaturados, como los del aceite de oliva, se asocia a una disminución del riesgo que es hasta del 21% en las categorías de consumo más elevadas. Con respecto a los ácidos grasos poliinsaturados, como los que contiene el pescado azul, se ha visto que no parecen aumentar el riesgo de cáncer mamario27. De hecho, ya hay muchos estudios que sugieren el efecto protector de algunos de estos, como los ácidos omega-328,29, ya que no sólo aportan una citotoxicidad directa sobre las células tumorales, sino que además se ha comprobado que son potenciadores del efecto quimioterápico de algunas sustancias, como el paclitaxel30 o el trastuzumab, en este último caso mediante la regulación de la expresión de la proteína HER231. Con respecto a los glúcidos, no se ha observado una asociación clara, aunque pueden tener cierto papel potenciador del riesgo en determinadas circunstancias, como en mujeres posmenopáusicas con algún factor de riesgo añadido, como la terapia hormonal sustitutiva32,33. Por otra parte, se ha llegado a la conclusión de que las dietas ricas en fibra previenen la aparición del cáncer de mama, bien por el menor aporte calórico o por la eliminación vía fecal de los estrógenos conjugados en el hígado34. Los alimentos susceptibles de reducir el riesgo por su alto contenido en fibra, y los que más se han estudiado, son los cereales y las legumbres. De estas últimas, destaca la soja, legumbre un tanto especial, ya que contienen fitoestrógenos. Los fitoestrógenos presentan una analogía estructural con los estrógenos de los mamíferos (fig. 2) y, a pesar de ello, parecen estar asociados a una reducción del riesgo que se añadiría al de la fibra19.
Esto se ha demostrado con multitud de estudios en mujeres asiáticas consumidoras de productos derivados de la soja35-37. El mecanismo de acción parece estar relacionado con el receptor nuclear estrogénico beta, por el que los fitoestrógenos tienen mucha afinidad. Al unirse a él, actuarían como antagonistas estrogénicos; además, también actúan como inhibidores de la aromatasa y de la topoisomerasa, deteniendo la proliferación de las células malignas19.
Otros alimentos que se deben tener en cuenta son las frutas y verduras que, aunque tienen poca fibra, destacan por su alto contenido en vitaminas, y de estas, las que reducen más el riesgo son las antioxidantes A, C y E; producen regulación de la diferenciación y proliferación de las células epiteliales y además son potentes inductores de la apoptosis38-41. Por último, otros alimentos que parecen reducir el riesgo de presentar cáncer de mama son la leche y derivados, aves, patatas, café y té42-44.
Es importante mencionar que, a la vez que la mayoría de los trabajos parecen indicar una relación entre la dieta y el riesgo de cáncer mama, algunos trabajos actuales sugieren que falta evidencia científica para realizar esta afirmación44.
Sin embargo, la mayoría de los autores está de acuerdo en que de todos los factores de riesgo para al cáncer de mama, los relacionados con la dieta adquieren una gran relevancia debido a que se pueden modificar. Por ello es necesaria la educación al respecto durante la infancia, para llevar una dieta saludable en ese período y en la vida adulta.
Masa corporalSe ha comprobado que el IMC se relaciona negativamente con el riesgo de cáncer de mama en la mujer premenopáusica45,46. Además, también hay evidencia de que esta relación es mucho más intensa y positiva en las mujeres posmenopáusicas, aunque hay muchos autores que abogan por un aumento del riesgo claro y significativo en ambos grupos junto con una menor supervivencia una vez realizado el diagnóstico47. Esto se puede deber a la función endocrina de esta grasa en cada etapa de la vida. Conviene recordar la mayor expresión de aromatasa en el tejido adiposo que provoca la formación de estrona, que predispone al cáncer de mama48.
Además, la distinta distribución de grasa corporal que se observa en cada rango de edad también influye, de modo que se ha observado relación positiva entre el peso a los 30 años de edad y el riesgo de cáncer de mama, así como la ganancia ponderal desde los 18 años hasta la menopausia49,50. En cambio, la pérdida de peso antes de la menopausia se relaciona con un descenso del riesgo51,52.
Actividad físicaLos estudios realizados hasta hace varios años mostraban información contradictoria, pero ya en las primeras publicaciones de este siglo se ha observado una reducción del riesgo relacionada con la realización de actividad física de ocio, iniciada en la adolescencia. De ahí en adelante, es decir en los últimos 5 años, se ha afianzado la idea de que la realización de actividad física reduce significativamente el riesgo de cáncer de mama53. Además, también hay autores que defienden que la realización de ejercicio moderado, andando de 3 a 5h a la semana, aumenta la supervivencia considerablemente en pacientes ya diagnosticadas de cáncer de mama54.
Los mecanismos de acción por los que este beneficio se produce son varios. En primer lugar, tenemos el gasto de energía que el ejercicio supone, evitando el sobrepeso y la obesidad que, como ya hemos afirmado, aumentan el riesgo. Además, el ejercicio tiene un papel específico sobre la resistencia a la insulina, facilitando el transporte de glucosa al músculo y su utilización19,55. El mecanismo íntimo sería mediante el uso del IGF-1 circulante a través de su unión a las proteínas transportadoras, las IGFBP56 (proteínas de unión de factores de crecimiento tipo insulina). Por ello, el biomarcador más relacionado con el cáncer de mama a este respecto es el IGF-1 circulante, que está significativamente aumentado en pacientes con cáncer de mama y se asocia a un incremento del riesgo de presentarlo en pacientes no diagnosticadas, ya que este polipéptido se comporta como un potente inductor del crecimiento y la diferenciación celular (fig. 3).
Sin embargo, la IGFBP-1, IGFBP-2, IGFBP-3, la leptina y el péptido C no parecen tener esta relación tan clara, ya que los datos de los distintos estudios son muy discordantes, si bien es cierto que, para algunos autores, el aumento de IGFBP-3 podría reducir el riesgo, esta sería la principal de las proteínas transportadoras antes citadas57-60.
EstrésNo se dispone de una evidencia clara que relacione el estrés con la aparición de cáncer de mama. Disponemos de diversos trabajos que abogan por un incremento del riesgo en aquellas pacientes sometidas a estrés psicológico. bien por acontecimientos desagradables ocurridos en su vida. o bien por estrés en el trabajo diario61-63. Son menos los trabajos que defienden la no influencia del estrés en el riesgo64,65; algunos de estos autores, se retractan en estudios posteriores, reconociendo la influencia del estrés en el incremento del riesgo66. Además, hay algún trabajo reciente que concluye que una historia de estrés crónico disminuye significativamente la incidencia de cáncer de mama, sobre todo en las mujeres posmenopáusicas con tratamiento hormonal sustitutivo. El mecanismo de actuación sería mediante la disminución de la actividad ovárica a causa del estrés que conllevaría una reducción de los estrógenos circulantes67,68. Sin embargo, bibliografía científica más reciente alude al hecho de que una vez instaurada la afección, su progresión sí se ve favorecida por hechos traumáticos o estresantes en la vida de la paciente debido a una afectación de los ejes hipotálamo-hipofisario y corticosuprarrenal69,70.
TabacoLa relación del tabaquismo con el cáncer de mama parece tener es una base fisiopatológica en los polimorfismos genéticos individuales, que hacen que cada persona tenga una susceptibilidad diferente del efecto del tabaco en su organismo. En lo referente al carcinoma mamario, la base parece estar en las modificaciones genéticas que afectan a la actividad de las enzimas de fase I y II, encargadas de la eliminación de carcinógenos, y de modo menos importante, en alteraciones hormonales secundarias19. Hay diferentes estudios, tanto a favor71-75 como en contra, de este incremento del riesgo76-78. Aunque sí parecen más numerosos y más convincentes los que encuentran una relación significativa entre el consumo de larga duración y grandes cantidades de tabaco, el comienzo del hábito en edad temprana y antes del primer embarazo a término, y las fumadoras pasivas, con el incremento del riesgo de presentar carcinoma mamario. En cualquier caso, se requieren más estudios que afiancen estos conocimientos y arrojen más luz sobre el efecto del tabaco en relación con el cáncer de mama.
AlcoholLa asociación entre el consumo de alcohol y el incremento del riesgo de presentar cáncer de mama es clara y firme79-83. Esta relación se asocia a un incremento de los estrógenos circulantes84. Aproximadamente, un consumo > 20g de alcohol al día incrementa el riesgo en un 30%, a un ritmo del 7% cada 10g de alcohol consumido al día85, cosa que no ocurre cuando estas pacientes consumen una cantidad cercana a 400μg de vitamina B9 al día, que puede atenuar el riesgo causado por el consumo de alcohol86. Esta vitamina se encuentra en las verduras, la levadura de cerveza y el hígado19.
La asociación encontrada parece aumentar cuando el consumo de alcohol comienza en edad temprana87, cuando el consumo se realiza de modo moderado durante largos períodos88, en mujeres con tratamiento hormonal sustitutivo posmenopáusico89,90 y en pacientes con genotipo de metabolizador rápido para la enzima alcohol deshidrogenasa 391. Además, se ha encontrado una estrecha relación con la aparición de cánceres de mama que expresan receptores de estrógenos y progesterona positivos92,93. También se ha observado que los tumores que aparecen en mujeres alcohólicas lo hacen en estadios más avanzados94.
Radiaciones y campos electromagnéticosSe conoce que la exposición a radiaciones ionizantes aumenta, de modo moderado, el riesgo de cáncer de mama y más aún en pacientes con susceptibilidad genética95,96. Estas radiaciones pueden provenir de múltiples fuentes, como son las armas nucleares, campañas de cribado de enfermedades que requieran el uso de técnicas radiológicas, irradiaciones usadas en el tratamiento de otras enfermedades oncológicas97, etc.
También tiene interés el efecto de las radiaciones cósmicas (fig. 4), de modo que hay una docena de estudios y algún metaanálisis que avalan la afirmación de que en mujeres sobreexpuestas a radiación solar ultravioleta aumenta el riesgo de presentar cáncer de mama98,99, como ocurre con profesionales de la aviación o población que habita en determinadas latitudes.
Existe evidencia de que tanto los campos electromagnéticos, como las radiaciones no ionizantes, incrementan el riesgo de tener cáncer de mama. El mecanismo más probable por el que se produce es la alteración de la glándula pineal, que acarrea un desajuste de la secreción de melatonina, que tiene un importante papel en la regulación inmunológica antitumoral, aumentando el riesgo cuando esta se mantiene suprimida100. La exposición doméstica no es suficiente para provocar estos efectos, pero en determinados ambientes, como en centrales eléctricas, estaciones de radio o cercanía a torres de alta tensión eléctrica, el riesgo de presentar cáncer de mama está aumentado101,102.
Otros factoresAdemás de los factores ya expuestos, existen otros que se han intentado asociar al incremento del riesgo como son, entre otros: el exceso de hierro libre que, con su acción oxidativa, potenciaría el efecto carcinogénico de otros agentes103 y la falta de sueño podría también incrementar ligeramente el riesgo, sobre todo en mujeres con una media diaria de sueño < 6h104.
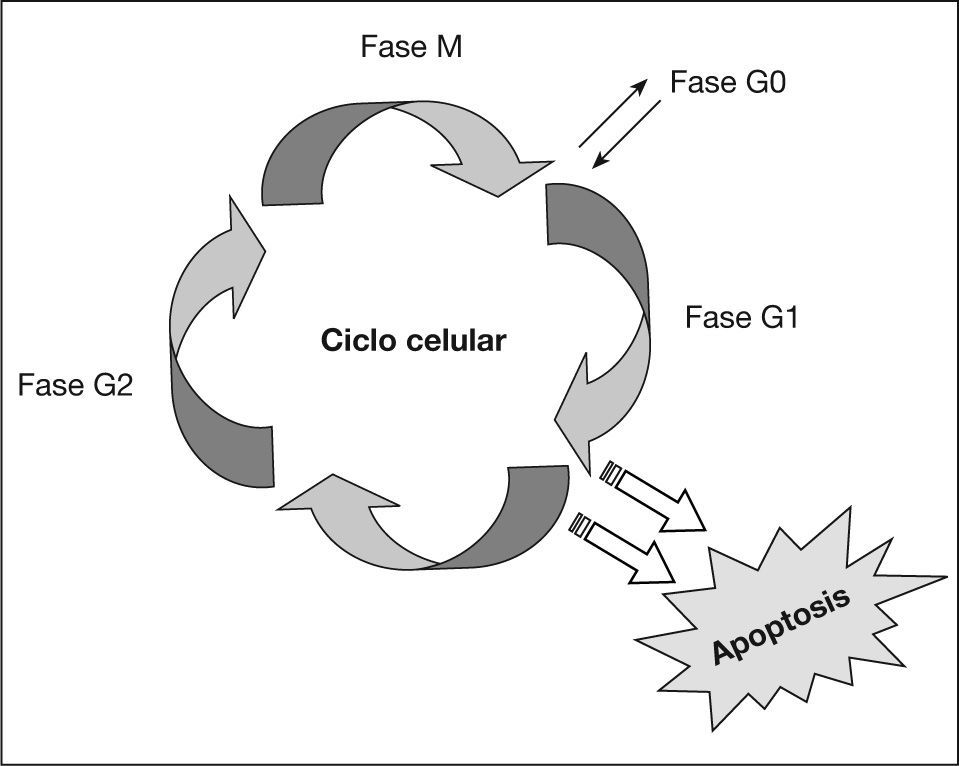
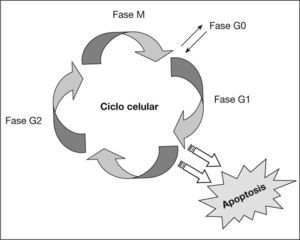
Factores hormonalesLas hormonas, especialmente los estrógenos, se han relacionado con el desarrollo del carcinoma de mama en multitud de publicaciones científicas en los últimos 25 años105. Su papel se ha atribuido a su capacidad de estimular la proliferación celular, favoreciendo la estimulación de células G0 y reduciendo la duración de la fase G1 y del ciclo celular (fig. 5) en su conjunto106,107.
El aumento en la proliferación celular puede favorecer la acumulación de errores genéticos producidos al azar que, finalmente, podrían dar como resultado el desarrollo de una neoplasia108-110. Además, gracias al desarrollo de la biología molecular en los últimos años, se ha correlacionado más firmemente el aumento del riesgo de presentar cáncer de mama con el polimorfismo genético de varias enzimas implicadas en el metabolismo estrogénico111.
Existen una serie de evidencias epidemiológicas que apoyan el papel de los estrógenos endógenos y exógenos en el desarrollo del cáncer de mama. Así, una aproximación convincente al papel que parecen desempeñar los estrógenos en el cáncer de mama está basada en el hecho que la incidencia de esta neoplasia es, al menos, 100 veces más elevada en las mujeres que en los varones, y que la proporción de esta diferencia desciende sustancialmente tras la edad de la menopausia112,113.
Hormonas endógenasLa exposición a estrógenos endógenos aumenta el riesgo de presentar cáncer de mama; en este sentido, se puede afirmar que el número total de ciclos ovulatorios y, por tanto, la exposición que ello conlleva a elevados niveles estrogénicos, es un factor reconocido que contribuye al aumento de riesgo51,105,108. Ello explicaría el mayor riesgo de cáncer mamario asociado a una menarquia temprana, a una menopausia tardía, nuliparidad y obesidad111,114.
Además, también se ha argumentado que la continua división y proliferación celular resultante de los múltiples ciclos ovulatorios, principalmente entre la menarquia y el primer embarazo, incrementaría la susceptibilidad del tejido mamario a determinados factores carcinogénicos del medio ambiente. De modo que, en mujeres que tienen su primer embarazo después de los 30 años de edad, el riesgo de cáncer de mama es casi el doble que las que lo tienen a los 20 años115. Aunque, como norma general, se puede afirmar que a mayor vida menstrual, mayor incidencia de cáncer de mama116.
Se ha publicado recientemente un metaanálisis en relación con la exposición intrauterina fetal a las hormonas circulantes y su posterior riesgo de presentar cáncer de mama y parece que existe un riesgo ligeramente incrementado en mujeres que tenían un alto peso y tamaño neonatal al nacer. Se ha observado un descenso del cáncer en hijas de mujeres con gestaciones gemelares y con preeclampsia o eclampsia. No se ha visto relación con la edad gestacional o la exposición a dietilestilbestrol117.
Por otra parte, cabe señalar la existencia de una asociación positiva entre los estrógenos endógenos y el riesgo de cáncer mamario en mujeres posmenopáusicas, y esta asociación se ha visto también con la testosterona circulante y no con la progesterona118,119. En mujeres premenopáusicas, los datos son más dispares, y aunque la relación positiva parece demostrada para los estrógenos y sus metabolitos, los datos son más dudosos para los andrógenos y la progesterona51,120. Otras hormonas con posible relación son las hormonas de crecimiento117, la prolactina121, el IGF-1 y melatonina120.
Por último, cabe señalar el papel protector de la lactancia materna, probablemente relacionado con el ambiente hormonal en este período. Se calcula un descenso del riesgo relativo de presentar cáncer de mama del 12% por cada 12 meses de lactancia materna; además, a esto habría que sumarle el descenso del riesgo añadido por la paridad122.
Hormonas exógenasSe han publicado numerosos estudios sobre la posible relación entre la administración de estrógenos y progestágenos exógenos, bien como anticonceptivos orales o como terapia sustitutoria en la menopausia, y el riesgo de cáncer mamario. Sin embargo, los resultados de esas investigaciones son conflictivos y deben interpretarse cautelosamente debido a los cambios en las dosis de hormonas en el tiempo y en los métodos de administración empleados123,124; normalmente son mayores los beneficios que el riesgo potencial125.
Existen más de 50 estudios importantes, incluidos metaanálisis, revisiones y ensayos clínicos, que relacionan anticoncepción hormonal y cáncer de mama, y de los que se desprende que, en caso de que existiese un aumento del riesgo, este sería mínimo, incluso en mujeres que llevan más de 10 años con el consumo de anticonceptivos orales. Estas pacientes con un mínimo aumento del riesgo, y con un muy bajo riesgo global, suelen estar por debajo de los 45 años de edad; además, existen ligeras variaciones según el tipo histológico120,126,127.
Antes del estudio americano Women's Health Initiative (WHI), el uso de terapia hormonal sustitutiva parecía claramente beneficioso, aunque ya desde antes de su publicación algunos autores apuntaban varios de los resultados que se observarían algunos años después en el WHI. Tras este, el uso combinado de estrógenos y progesterona en la menopausia parecía provocar 1,26 veces más cáncer de mama en las mujeres que lo tomaban respecto a las que no lo tomaban, con un seguimiento a 5,2 años, tras los cuales el estudio se tuvo que parar porque se consideró que los riesgos (cáncer de mama entre otros) superaban a los beneficios128. Los estudios más recientes confirman que la administración de estrógenos y progestágenos juntos, por vía oral, como terapia sustitutoria en la perimenopausia aumentan este riesgo, cosa que no parece ocurrir cuando la vía es transdérmica, con el uso de estrógenos solos o usando tibolona, aunque estos datos ofrecen menor solidez129.
Por último, se ha relacionado la administración de inductores de la ovulación con un ligero aumento en el riesgo de cáncer de mama de alrededor del 1,42, y un aumento del riesgo relativo de presentar cáncer en cualquier localización del 1,36130.
Factores genéticosLa agregación familiar del cáncer de mama es bien conocida, de modo que una mujer con antecedentes familiares de cáncer de mama eleva mucho el riesgo de presentarlo; este riesgo es mayor cuanto más cercano es el familiar (tabla 1), más numerosos los casos en la familia y más temprana la edad de aparición131,132.
La mayoría de las mujeres con historia familiar de cáncer de mama, y que lo padecen, no tienen la enfermedad transmitida familiarmente; lo más frecuente es la presencia de alteraciones genéticas que predisponen al cáncer. La mayoría de los casos son esporádicos y sólo un 5-10% son atribuibles a un gen de herencia autosómica dominante con penetrancia incompleta.
Los dos genes que más se relacionan con la herencia familiar del cáncer mamario son el BRCA1 y el BRCA2, aunque cada vez se van descubriendo más genes que predisponen a esta patología oncológica, como la reciente incorporación del gen HMMR133.
El gen BRCA1 se encuentra en el cromosoma 17q21, con un patrón de herencia autosómica dominante y está asociado al 50% de los cánceres de mama hereditarios. Una mujer con una mutación en este gen tiene un riesgo de presentar cáncer mamario que oscila entre el 50 y el 87%, y además se asocia a un riesgo de presentar cáncer de ovario del 25-60%. Además, también incrementa el riesgo de cáncer de colon y próstata en varones134,135.
El gen BRCA2 se localiza en el cromosoma 13q12-13, es el causante del otro 40% de los cánceres mamarios hereditarios y se asocia a cáncer de ovario en alrededor de un 20% de ocasiones136,137; también tiene herencia de patrón autosómico dominante.
Se han identificados unas 1.000 mutaciones distintas de estos dos genes, de modo que se estima que 1 persona de cada 420 en la población general podría ser portadora de una alteración en un gen BRCA18. Además, recientes estudios demuestran una relación significativa entre la edad temprana al diagnóstico y la frecuencia de mutaciones en los genes BRCA, lo que además se asocia también a receptores hormonales y HER2/neu negativos138.
Otros genes implicados en el restante 10% son el p53, ATM, PTEN/MMAC, MSH2, STK11 y otros139-141.
Lesiones precursorasExisten varias clasificaciones que indican el riesgo de presentar cáncer de mama en mujeres que tienen diversas lesiones que, en principio, son benignas o no invasivas142, y aunque pueden variar entre los distintos autores, la mayoría coincide en las patologías inocuas y las de mayor riesgo143,144; la clasificación presentada en la tabla 2 puede ser válida.
Riesgo de cáncer de mama según el tipo de lesión precursora
| Riesgo relativo | Lesiones |
| 1 | Adenosis no esclerosante, ectasia ductal, fibroadenoma simple, fibrosis, mastitis, macromastia gestacional, quistes, hiperplasia leve sin atipias, metaplasia apocrina simple, metaplasia escamosa |
| 1-2 | Fibroadenoma complejo, hiperplasia moderada o grave sin atipia, adenosis esclerosante, papiloma solitario sin atipia |
| 4-5 | Hiperplasia ductal atípica |
| Hiperplasia lobulillar atípica | |
| 8-10 | Carcinoma ductal in situ |
| Carcinoma lobulillar in situ |
Además, conviene reseñar que la probabilidad de que una hiperplasia atípica se convierta en carcinoma invasivo también varía en función de la edad del primer embarazo, de modo que en una mujer cuyo primer embarazo sucede antes de los 20 años el riesgo relativo de transformación es de 1,6, mientras que si la paciente tiene más de 20 años de edad al embarazo, o es nulípara, varía entre 4,5 y 4,9, como reflejaba el cuadro anterior145.
Otra característica reseñable es que, a pesar de los riesgos relativos de cada lesión, es fundamental el diagnóstico correcto y el seguimiento exhaustivo, ya que la edad de aparición de este tipo de lesiones en la población general es, tan sólo, de 5 años antes que la de los cánceres infiltrantes, y se desconoce de modo específico cuáles son los mecanismos de progresión de una a otra146.
CONCLUSIONESSe han encontrado numerosísimos factores que influyen, en mayor o menor medida, en la formación del cáncer de mama, lo que hace pensar, evidentemente, en una etiología plurifactorial; sin embargo, queda por determinar si existe algún punto de confluencia de estos factores sobre el que podamos incidir para evitar tanto su formación como su progresión, y que en un futuro pueda darnos la clave de cómo tratar o evitar de modo definitivo esta afección. Por esto, son necesarios más estudios, y con una evidencia científica sólida, que ahonden en esta área, para progresar en el estudio de la etiología del cáncer de mama.