El síndrome metabólico (SM) se define por una constelación de múltiples factores de riesgo de enfermedad cardiovascular (ECV), entre los que se incluye la obesidad abdominal, la dislipemia aterogénica, la hipertensión y el aumento de la glucosa en ayunas. Este síndrome se considera como un importante problema de salud pública, ya que está asociado a un incremento de 5 veces en la prevalencia de diabetes tipo 2 y de 2-3 veces en la de ECV.
La resistencia a la insulina, o disminución de la sensibilidad a la insulina en la captación y el metabolismo de la glucosa en los tejidos periféricos, tiene una gran importancia en el desarrollo del SM. En el campo de la ginecología y la obstetricia, hay varias entidades clínicas en las que puede existir resistencia a la insulina con hiperinsulinemia compensatoria y, por consiguiente, ser más frecuente la presencia del SM: síndrome de ovarios poliquísticos, hiperandrogenismo, posmenopausia, disfunción sexual femenina, riesgo de recurrencia de cáncer de mama, hiperglucemia gestacional e hipertensión inducida por el embarazo. En este trabajo, se revisa la implicación del SM en estos frecuentes cuadros de nuestra especialidad.
Metabolic syndrome is defined by the constellation of multiple cardiovascular risk factors that include abdominal obesity, atherogenic dyslipidemia, hypertension and increased fasting glucose levels. This syndrome is an important public health problem, since it is associated with a 5-fold increase in the prevalence of diabetes type 2 and a 2-3-fold increase in that of cardiovascular disease.
Insulin-resistance, or reduced insulin sensitivity in the uptake and metabolism of glucose in peripheral tissues, plays a major role in the development of metabolic syndrome. In obstetrics and gynecology, insulin resistance with compensatory hyperinsulinism can occur in several entities, in which the presence of metabolic syndrome is therefore more frequent. These entities include polycystic ovary syndrome, hyperandrogenism, postmenopausal status, female sexual dysfunction, risk of recurrence of breast cancer, gestational hyperglycemia and pregnancy-induced hypertension. In this review, the involvement of metabolic syndrome in these frequent gynecological and obstetric conditions is discussed.
El síndrome metabólico (SM), conocido también como síndrome plurimetabólico, síndrome de resistencia a la insulina o síndrome X, es la confluencia de múltiples factores de riesgo de ECV, que se diagnostica con la presencia de más de 3 de los criterios de la ATP III1 (National Cholesterol Education Program Adult Treatment Panel III) (tabla 1). Se aprecia que hace énfasis en la obesidad abdominal, la dislipemia aterogénica, la hipertensión y el aumento de la glucosa en ayunas.
Definiciones del síndrome metabólico propuestas por la OMS, el EGIR y el ATP-III
| OMS, 1999 | EGIR, 1999 | ATP-III, 2001 |
| Diabetes o alteración de la tolerancia | RI* o hiperinsulinemia | |
| a la glucosa o RI* | (únicamente a las personas no diabéticas) | |
| Dos o más de los factores siguientes: | Dos o más de los factores siguientes: | Tres o más de los factores siguientes: |
| 1. Obesidad: IMC > 30 o CCC > 0,9 en | 1. Obesidad central: PC ≥ 94 cm en los varones | 1. Obesidad central: PC > 102 cm |
| los varones o > 0,85 en las mujeres | o ≥ 80 cm en las mujeres | en los varones o > 88 cm en las mujeres |
| 2. Dislipemia: triglicéridos > 1,7 mmol/l | 2. Dislipemia: triglicéridos > 2,0 mmol/l | 2. Hipertrigliceridemia: tricligéridos |
| o cHDL < 0,9 en los varones | o cHDL < 1,0 | ≥ 1,7 mmol/l |
| o < 1,0 en las mujeres | ||
| 3. Hipertensión: presión arterial | 3. Hipertensión: presión arterial | 3. Disminución del cHDL: < 1,0 mmol/l |
| > 140/90 mmHg o tratamiento | ≥ 140/90 mmHg, tratamiento | en los varones o < 1,3 mmol/l |
| con fármacos | con fármacos o ambos | en las mujeres |
| 4. Micoralbuminuria: excreción | 4. Glucemia en ayunas ≥ 6,1 mmol/l | 4. Hipertensión: presión arterial |
| de albúmina ≥ 20 μg/min | ≥ 130/85 mmHg o tratamiento | |
| con fármacos | ||
| 5. Glucemia en ayunas ≥ 6,1 mmol/l |
ATP-III: Adult Treatment Panel III; CCC: coeficiente entre el perímetro de la cintura y el perímetro de la cadera; cHDL: colesterol unido a lipoproteínas de alta densidad; EGIR: European Group for the Study of Insuline Resistance; IMC: índice de masa corporal; OMS: Organización Mundial de la Salud; PC: perímetro de cintura; RI: resistencia a la insulina. *Definida como el cuartil superior de la concentración de insulina en ayunas en personas no diabéticas.
Para su diagnóstico, otros organismos internacionales incorporan modificaciones particulares. Así, la Organización Mundial de la Salud (OMS) incluye como criterio necesario la diabetes, la tolerancia anormal a la glucosa o la resistencia a la insulina (RI), y añade el índice cintura-cadera y la microalbuminuria. El grupo europeo EGIR2 (European Group for the Study of Insulin Resistance), sin embargo, varía las cifras de triglicéridos > 180 mg/dl, incluye el perímetro abdominal (> 94 cm en varones y > 80 cm en mujeres) y agrega también la resistencia a la insulina (RI) o hiperinsulinemia en ayunas superior al percentil 75. En la tabla 1, extraída de Zimmet et al3, se resumen los distintos criterios diagnósticos de estos 3 grupos.
Recientemente, la Internacional Diabetes Federation (IDF)4 ha propuesto una modificación de los criterios diagnósticos tradicionales del SM del Adult Treatment Panel III (ATP III). Los nuevos criterios introducidos por la IDF (tabla 2) son: PC ≥ 94 cm en varones y ≥ 80 cm en mujeres, y glucemia ≥ 100 mg/dl. En 2005, la American Heart Association, junto con el Nacional Heart, Lund and Blood Institute5, en un documento sobre SM, no optan por una determinada elección de parámetros definitorios.
Definición del síndrome metabólico propuesta por la International Diabetes Federation
| Obesidad centralPerímetro de la cinturaa: con especificidad respecto a los distintos grupos étnicos | |
| Más dos cualesquiera de los factores siguientes | |
| Aumento de los triglicéridos | ≥ 1,7 mmol/l (150 mg/dl) o tratamiento específico de esta alteración lipídica |
| Disminución del cHDL | < 1,03 mmol/l (40 mg/dl) en los varones |
| < 1,29 mmol/l (50 mg/dl) en las mujeres | |
| o tratamiento específico de esta alteración lipídica | |
| Aumento de la presión arterial | Sistólica: ≥ 130 mmHg |
| o bien diastólica: ≥ 85 mmHg | |
| o bien tratamiento de hipertensión diagnosticada previamente | |
| Incremento de la glucemiab | Glucemia en ayunas > 5,6 mmol/l (100 mg/dl) |
| o bien diabetes mellitus tipo 2 previamente diagnosticada | |
| Si la glucemia en ayunas es > 5,6 mmol/l o > 100 mg/dl, se recomienda | |
| la realización de una PTGO, aunque no es necesaria par definir la presencia del síndrome | |
cHDL: colesterol unido a lipoproteínas de alta densidad; PTGO: prueba de tolerancia a la glucosa administrada por vía oral.
Si el índice de masa corporal es > 30, se puede asumir la presencia de obesidad central y no es necesario medir el perímetro de la cintura.
En la práctica clínica también es aceptable la demostración de la alteración de la tolerancia a la glucosa, pero en todos los estudios epidemiológicos relativos a la prevalencia del síndrome metabólico se deben utilizar únicamente la glucemia en ayunas y la presencia de una diabetes previamente diagnosticada para evaluar este criterio. Las cifras de prevalencia que también incorporan los resultados de la glucemia a las 2 h se pueden añadir como un hallazgo complementario.
En nuestro medio, en la población española, Meriño-Ibarra et al6 señalan que estos nuevos criterios mejoran 3 veces la sensibilidad diagnóstica de RI y, por tanto, parecen ser más útiles para detectar RI en nuestro medio.
El SM se está convirtiendo en un importante problema de salud pública en todo el mundo7, ya que se considera como un elemento fundamental en la epidemia actual de diabetes y ECV, toda vez que el SM está asociado a un incremento de 5 veces en la prevalencia de diabetes mellitus tipo 2 (DM2) y de 2–3 veces en la de ECV.
La prevalencia del SM en EE. UU., en un estudio realizado en 8.814 varones y mujeres mayores de 20 años, es del 6,7% de los participantes entre 20 y 29 años, y aumenta al 43,5% en las mujeres en la década de los 60 años. Este estudio confirma que el aumento del SM se registra con la edad. La prevalencia en España oscila entre el 19,3% (criterios OMS) y el 15,5% (criterios EGIR).
La RI tiene una gran importancia en el desarrollo del SM, hasta tal punto que se afirma que el SM es la expresión clínica de la RI. La RI, o disminución de la sensibilidad a la insulina en la captación y el metabolismo de la glucosa en los tejidos periféricos (fundamentalmente, tejido adiposo, hígado, sistema osteomuscular), lo que produce, en consecuencia, un aumento de la síntesis y la secreción de la insulina por las células beta del páncreas, tiene efectos adversos per se:
- -
Proliferación de las células espumosas y depósito de lípidos en la pared vascular.
- -
Aumento de la presión arterial.
- -
Aumento de la producción del factor plasminógeno activador inhibidor tipo 1 (PAI-1), fibrinógeno, factor VII y de proteína C reactiva (PCR).
- -
Aumento de la lipólisis en el tejido adiposo. En efecto, la RI aumenta la actividad de la lipasa, enzima responsable de la lipólisis en el adipocito, produciendo aumento de los ácidos grasos libres.
- -
Alteraciones en el metabolismo lipoproteico, ya que la lipasa hepática (que aumenta con la RI) produce un aumento de los triglicéridos, del colesterol unido a lipoproteínas de baja densidad (cLDL) y del colesterol, y una disminución del colesterol unido a lipoproteínas alta densidad (cHDL).
- -
Aumento de peso por deterioro en la termogénesis.
En consecuencia, y por todos estos efectos adversos descritos, la RI produce un aumento del riesgo cardiovascular y del desarrollo de DM2.
La causa del desarrollo de la RI es multifactorial; están implicados factores genéticos, envejecimiento, sedentarismo, obesidad, dieta hipercalórica rica en grasa y carbohidratos, y tabaquismo. Otros factores relacionados con la RI y el SM son:
- -
Hiperuricemia, gota.
- -
Hipercoagulabilidad y defectos de la fibrinólisis.
- -
Hiperleptinemia o resistencia a la leptina.
- -
Otros: homocisteína (tiene un papel controvertido), leucocitosis, elevación de la velocidad de se
- -
dimentación globular, PAI-1 elevado, hígado graso no alcohólico, litiasis biliar, acantosis nigricans y osteoporosis.
Todas estas alteraciones no aparecen al mismo tiempo, ni tampoco usualmente todas; se van instaurando progresivamente con los años. La obesidad desempeña un papel importante en el SM y en el ulterior desarrollo de complicaciones8 (fig. 1).
Papel de la obesidad en el síndrome metabólico. AGL: ácidos grasos libres; cHDL: colesterol unido a lipoproteínas de alta densidad; HTA: hipertensión arterial. Fuente: Braguinsky8.
Debe quedar claro que la RI precede en años al diagnóstico de DM2 y que, como se indicará a continuación, está asociada a otras afecciones, algunas de ellas de alta prevalencia. Es importante diferenciar la RI del SM, ya que la primera es una condición fisiopatológica que indica una menor resistencia, por parte de los órganos periféricos, a la acción de la insulina, lo que deriva en una hiperinsulinemia, mientras que el SM es la agrupación de distintos factores de riesgo cardiovascular y de DM2 en una única entidad.
En el campo de la ginecología, hay varias entidades clínicas en las que puede existir RI con hiperinsulinemia compensatoria y, por consiguiente, es más frecuente la presencia del SM:
- -
Síndrome de ovarios poliquísticos.
- -
Hiperandrogenismo.
- -
Posmenopausia.
- -
Disfunción sexual.
- -
Cáncer de mama.
También, y dentro de la obstetricia, la hiperglucemia gestacional podría considerarse como predictora de riesgo aumentado de síndrome metabólico, así como la hipertensión inducida por el embarazo.
SÍNDROME METABÓLICO Y SÍNDROME DE OVARIO POLIQUÍSTICOEl síndrome de ovario poliquístico (SOP), disfunción ovárica considerada como la forma más frecuente de anovulación crónica, se diagnostica al menos en un 25% de todas las mujeres con amenorrea secundaria y aparece casi en la mitad de las que presentan oligomenorrea, hirsutismo o ambos. El SOP también se ha asociado con un 75% de los casos de infertilidad anovulatoria.
Actualmente, además de por esterilidad, su importancia radica en el hecho de constituir una endocrinopatía con numerosas secuelas multisistémicas que pueden comprometer la salud general de la mujer; así:
- -
Casi el 35-40% de las mujeres con SOP tiene una alteración del metabolismo de los hidratos de carbono9, en la mayoría asociado a RI, y el 7-10% tiene DM2.
- -
Además, las pacientes con SOP presentan un incremento en la presentación de dislipemias y ECV, así como una aparición de éstas a más temprana edad.
El SOP se caracteriza clínicamente por mostrarse de forma variada, desde su aparición con mínimos signos de hiperandrogenismo en mujeres delgadas y menstruaciones regulares, hasta la presentación más severa en mujeres obesas, muy hirsutas, con opsomenorreas o baches amenorreicos. La anovulación y el exceso de andrógenos justifican la esterilidad o infertilidad en mujeres con SOP.
En cuanto a los criterios diagnósticos del SOP, se establecen los siguientes:
- 1.
Oligomenorrea y/o anovulación.
- 2.
Signos bioquímicos o clínicos de hiperandrogenismo:
- -
Signos bioquímicos: aumento de andrógenos circulantes, en especial testosterona libre, fracción de testosterona libre (> 1%), androstendiona o dehidroepiandrostendiona-sulfato (DHEA-S) y disminución de los valores de proteína transportadora de andrógenos (SHBG).
- -
Signos clínicos: hirsutismo, acné, alteraciones de la libido, involución mamaria, alopecia.
- -
- 3.
Morfología de ovarios poliquísticos, detectada por ecografía, realizada en fase folicular temprana (3.°-5.° día del ciclo): presencia de 12 o más folículos en cada ovario, de 2–9 mm de diámetro y/o incremento del volumen ovárico, calculándose éste con la fórmula: 0,5 × diámetro longitudinal × diámetro anteroposterior × diámetro transversal.
El diagnóstico de SOP se realizará si se verifican 2 o más de estos criterios, junto con la exclusión de patologías que pueden presentar una clínica similar: hiperplasia adrenal congénita, tumores secretores de andrógenos, síndrome de Cushing, patología tiroidea, hiperprolactinemia e hipogonadismo hipogonadotropo.
Es evidente que, en los últimos 25 años, el SOP se ha llegado a considerar como un importante desorden metabólico. Al respecto, hay autores10 que se hacen la siguiente pregunta: «el SOP es un trastorno metabólico de la reproducción?». Una notable proporción de mujeres con SOP manifiestan RI, con mayor frecuencia entre las que presentan sobrepeso de tipo androide o clínica de androgenización. Paralelamente, la conjunción de estos dos trastornos se ha mostrado como una situación que dificulta el desarrollo folicular en los ciclos de estimulación de la ovulación y se ha relacionado con el aborto y la diabetes gestacional. La RI tiene tal importancia en el contexto del SOP que hoy día11 se sabe que desempeña un importante papel no sólo en la patogénesis de ese síndrome, sino también en las secuelas a largo plazo12.
Son 3 factores en muchas ocasiones presentes en las pacientes con SOP los que con mayor frecuencia se asocian a riesgo de ECV13:
- -
Resistencia a la insulina.
- -
Hiperandrogenismo.
- -
Dislipemia.
Además, y dado que la RI da cuenta de un fenotipo metabólico de riesgo de diabetes y ECV, fenotipo que puede estar presente de forma muy temprana (desde la adolescencia), existe una creciente preocupación en que el diagnóstico de RI en la adolescencia o en la edad fértil de la mujer pueda incrementar el riesgo de presentar ECV y DM2. De hecho, Coviello et al14 indican en su estudio que las chicas adolescentes con SOP tienen una alta prevalencia de SM en comparación con la población adolescente general, y encuentran que la hiperandrogenemia es un factor de riesgo de SM independientemente de la obesidad y de la RI.
Por otra parte, al ser especialmente relevante el enlace entre la disfunción ovárica que ocasiona la anovulación crónica y las alteraciones en la secreción de insulina, se pueden ampliar los datos de sospecha de presencia de RI en aquellas pacientes que presenten:
- -
Anovulación e hiperandrogenismo.
- -
Antecedentes familiares de DM2.
- -
Antecedentes personales de diabetes gestacional.
- -
Obesidad (índice de masa corporal [IMC] > 29,9 kg/m2).
- -
Distribución grasa tipo androide (perímetro cintura > 88 cm)
- -
Intolerancia a la glucosa o glucemia anormal en ayunas.
- -
Hipertrigliceridemia (< 150 mg/dl).
- -
Hipertensión arterial (> 140/90 mmHg).
- -
Adolescentes con anovulación persistente.
En cuanto a los métodos de diagnóstico de RI, se han descrito los siguientes12:1. Diagnóstico clínico:
- -
Antecedentes personales y familiares de DM2, hipertensión arterial, patología coronaria, diabetes gestacional, bajo peso para la edad gestacional en el nacimiento y haber tenido hijos con macrosomía.
La obesidad androide o central y la presencia de acantosis nigricans, definida como hiperpigmentación hiperplásica de la piel de predominio en la región posterior del cuello con pliegues cutáneos. 2. Laboratorio:
- -
Relación glucosa/insulina15 en ayunas < 4,5.
- -
Valor de insulina en ayunas > 15 mU/ml.
- -
Prueba de sobrecarga oral de glucosa.
- -
HOMA-IR (homeostatic model assessment): insulina basal (μU/ml) x glucosa basal (mg)/405 = 2–3 (rango de normalidad).
- -
Índice de sensibilidad = insulina basal/91 x 0,05551 = 1 (por debajo indica RI). Reserva funcional de células beta (HOMA β cell) = 360 x insulina basal/glucosa basal (mg) - 63 = 100% en condiciones normales.
La técnica del clamp o pinza euglucémica hiperinsulinémica se considera el patrón de oro para cuantificar la sensibilidad a la insulina; mide la cantidad de glucosa que hay que administrar para mantener constante la glucemia frente a dosis de insulina crecientes. La dificultad de desarrollarla en la clínica (es un método complejo, prolongado y costoso, sólo útil en protocolos de estudios con un número limitado de pacientes) ha movido la aparición de otras de mayor sencillez. De ellas, el índice HOMA, propuesto en 1985 por Matthews et al16, es un método sencillo basado en un modelo matemático, que proporciona una medida semicuantitativa de la sensibilidad a la insulina. Ese índice es ampliamente utilizado y fue validado con la técnica del clamp por Bonora et al17. Su rango de normalidad se fija entre 2 y 3 y, aunque no exista consenso para establecer el límite con el que empezar un tratamiento, en nuestro medio venimos usando el valor de 3,2.
En un estudio retrospectivo institucional de revisión18 de 106 mujeres con SOP, se halla un 43% de prevalencia de SM, con unas diferencias altamente significativas en comparación con mujeres sin SOP (el 45 frente al 6%, respectivamente, en grupos de edad entre los 20 y los 29 años; y del 53 frente al 14%, en edades comprendidas entre los 30 y los 39 años). Estas altas tasas de SM en pacientes con SOP ocurrieron independientemente del peso corporal; 91% de las mujeres con SOP tuvieron al menos una anomalía metabólica en la presentación inicial del cuadro. De los componentes metabólicos individuales del SM, el más prevalente en mujeres con SOP fue una disminución de los valores séricos del cHDL (68%) seguida de obesidad (67%) e hipertensión (45%). Los mayores predictores de SM en mujeres con SOP fueron la elevación de la testosterona sérica libre y la reducción de los valores séricos de la globulina ligada a la hormona sexual.
Otros estudios19,20 han reportado una similar prevalencia de SM en casos de SOP, con rangos entre 46-47%, y hallaron, además, que el 64% de las mujeres con SOP concomitante con SM tenían disminuidos los valores séricos de cHDL. En un estudio de casos y controles de 86 mujeres jóvenes, de edades comprendidas entre los 18 y los 22 años, Vural et al21 informaron de una prevalencia del 11% de SM en mujeres con SOP, y un 86% de esas jóvenes presentaban una dislipidemia. Talbott et al22 encontraron que mujeres de edad media con SOP tuvieron 4,4 veces más probabilidades de presentar también un SM en comparación con un grupo control de mujeres de similar edad. Estas mujeres también mostraron una alta prevalencia de calcificación arterial coronaria (el 46 frente al 31%) y de calcificación aórtica (el 69 frente al 55%) en comparación con el grupo control.
En conclusión, la prevalencia de SM en mujeres con SOP es alta entre todos los grupos de edad23. Esta prevalencia incrementada aparece independientemente del peso corporal. La dislipemia, en particular la disminución del cHDL, es el hallazgo más frecuente encontrado en el grupo de SOP. En consecuencia, es obligado que, en las mujeres con SOP, se haga un cribado de SM y de otros factores de riesgo cardiovascular.
A pesar de que las altas de SM en pacientes con SOP son independientes del peso corporal, también es cierto, como ya se ha referido, que uno de los componentes metabólicos individuales del SM más prevalentes en mujeres con SOP es la obesidad (67%). De aquí que hay algún autor24 que preconiza que, en pacientes con sobrepeso y obesas con SOP, se haga sistemáticamente cribado de SM:
- -
Si este cribado es positivo: tratamiento.
- -
Si es negativo: repetir el cribado cada 2–3 años.
En una paciente a la que se le diagnostica un SOP y además presenta una RI, la pauta de tratamiento será la siguiente.
TRATAMIENTO DE LA RESISTENCIA A LA INSULINA- 1.
La primera medida debe ser la recomendación de un cambio en los hábitos dietéticos y el estilo de vida (dieta y actividad física), que reduce los factores de riesgo cardiovascular, más la investigación y el tratamiento de otros factores de riesgo cardiovascular (hipertensión, dislipemia o diabetes).
- 2.
Ante la persistencia de valores de HOMA superiores a 3,2 pasados 6 meses de dieta y ejercicio, será indicación para tratamiento farmacológico con metformina.
Propiedades. Se considera que existen razones para su uso, no sólo en pacientes con SM, sino también ante la presencia de obesidad, esterilidad, oligomenorreas o hirsutismo. La metformina es una biguanida utilizada desde hace más de 40 años en el tratamiento de la DM2. Aumenta la sensibilidad periférica y hepática de la insulina, mejora el perfil glucémico en ayunas y posprandial, y carece de riesgo significativo de producir acidosis láctica, que se había notificado anteriormente con otra biguanida25. Tiene una biodisponibilidad oral del 50-60%, no se une a proteínas plasmáticas ni se biotransforma, su vida media es de 3 h y su excreción es renal.
Su mecanismo de acción se centra fundamentalmente en la detención hepática de la neoglucogénesis26, pero su efecto hipoglucemiante se limita a las pacientes con hiperglucemia. También se ha observado una mejora de la sensibilidad a la insulina, una disminución de la absorción intestinal de glucosa y un aumento de su captación y utilización periférica, junto a una disminución del colesterol sérico, de los triglicéridos, del PAI-1 y de la presión arterial. Lord et al27, en pacientes con SOP tratadas con metformina, no encuentran efectos clínicos significativos en la reducción de la grasa visceral, pero sí informan de efectos beneficiosos sobre los lípidos. Es así que diversos autores28 recomiendan el uso de clorhidrato de metformina en asociación a la terapia clásica en las pacientes con SOP, en aras de obtener mejores y más rápidos resultados en cuanto al logro de un adecuado control metabólico.
A diferencia de otros antidiabéticos orales, la metformina no modifica la secreción de insulina por el páncreas. Tampoco se le conoce efecto estimulante sobre las células germinales o el estroma ovárico, aunque con su empleo se han conseguido ciclos regulares y ovulatorios, incluso en mujeres resistentes al clomifeno y menores tasas de hiperrespuesta en ciclos FIV/ICSI (fecundación in vitro/inyección intracitoplasmática de espermatozoides).
Stadtmauer et al29, en un estudio retrospectivo, refieren que el empleo de metformina puede mejorar la calidad ovocitaria en mujeres con SOP que realizan tratamientos de FIV por una reducción del hiperinsulinismo. El tratamiento con metformina en pacientes con SOP se ha asociado también con una disminución del hirsutismo y el acné, junto con una mejoría o normalización de la presión arterial, y con una regulación del ciclo menstrual30,31. En este sentido, Meyer et al32 sugieren que anticonceptivos orales en preparados a dosis bajas pueden ser preferibles en mujeres con SOP si es precisa la contracepción, y se puede considerar la metformina para el manejo sintomático del cuadro, particularmente en mujeres con SM adicional y factores de riesgo cardiovascular.
Dosis y mantenimiento. Aunque no está establecida una dosis óptima para su uso, en la mayoría de los estudios con pacientes que tienen SOP se emplean entre 1.500 y 2.000 mg diarios. En nuestro país sólo existe la presentación de 850 mg por comprimido y recomendamos comenzar con esta dosis, fraccionada en 2 tomas con las comidas, para evitar los frecuentes efectos gastrointestinales que se presentan con ella (náuseas, vómitos y dolor abdominal). Esta dosis puede mantenerse durante 14 días en las pacientes con pobre tolerancia al fármaco, pero conviene incrementarla a 1.700 mg/día durante el tiempo que juzguemos necesario su tratamiento. En las revisiones se atenderá a posibles efectos secundarios y se medirán el HOMA, el perfil lipídico, las enzimas hepáticas, la presión arterial, la fórmula menstrual y el IMC. Su uso está contraindicado en pacientes con insuficiencia renal, disfunción hepática, insuficiencia cardíaca congestiva, acidosis metabólica aguda o crónica, alcoholismo y deshidratación.
Metformina y embarazo. Un aspecto controvertido en el empleo de metformina fue la decisión de continuarla cuando se ha conseguido un embarazo, en ocasiones sin la ayuda de otro tratamiento. En un estudio prospectivo con 40 mujeres gestantes no diabéticas con SOP, Glueck et al33 observaron un 26% de abortos tempranos en las tratadas con metformina durante la concepción y la gestación frente a un 62% de abortos en las mujeres sin tratamiento (p < 0,0001). Asimismo, se evidenció un menor riesgo de desarrollar diabetes gestacional en las pacientes tratadas con metformina durante la gestación (4%) frente a gestaciones previas de las mismas pacientes sin este tratamiento (26%). No se objetivaron teratogenicidad, retraso del crecimiento intrauterino, efectos secundarios maternos o fetales ni alteraciones del desarrollo ponderal, motor o social en los niños de las pacientes tratadas hasta los 18 meses34.
La Food and Drug Administration le ha asignado la categoría B, lo que indica que la seguridad en la mujer gestante no se ha establecido definitivamente, pero no existe evidencia experimental de su teratogenicidad. Se aconseja, por tanto, la continuación del tratamiento durante los primeros meses de la gestación con el propósito de proteger frente a un aborto: la metformina puede rectificar el estado de hipercoagulabilidad (aumento del PAI-I) que se presenta con el exceso de insulina. Además de la reducción del riesgo de abortos precoces, otros beneficios potenciales asociados al uso de metformina durante el embarazo son la reducción de la hiperinsulinemia, la prevención del riesgo de diabetes gestacional y la disminución de obesidad y ganancia ponderal excesiva durante el embarazo. Por ello, y a falta de otras alternativas, se debería recomendar el tratamiento con metformina no sólo como inductor de la ovulación, sino también durante el embarazo en las pacientes con SOP35.
Tratamiento con tiazolidinedionas36 173Los representantes (troglitazona, rosiglitazona, pioglitazona) de esta nueva clase de antidiabéticos orales son agonistas selectivos de los receptores nucleares PPAR-y (receptores de la activación de pe- roxisomas gamma), que se expresan principalmente en el tejido adiposo. Ejercen su acción insulinsensibilizante a través de 2 mecanismos: directamente, promoviendo la captación y almacenamiento de ácidos grasos en el tejido adiposo, e indirectamente, incrementando la expresión de adiponectina, una adipocitocina con un efecto insulinsensitivo. La mayoría de los estudios clínicos37–39 que evalúan los efectos de las tiazolidinedionas en el SOP han demostrado que estos fármacos mejoran la resistencia a la insulina (disminución de la insulinemia en ayunas, aumento de la SHBG), la tolerancia a la glucosa y la hiperandrogenemia, teniendo también influencias positivas sobre la ovulación.
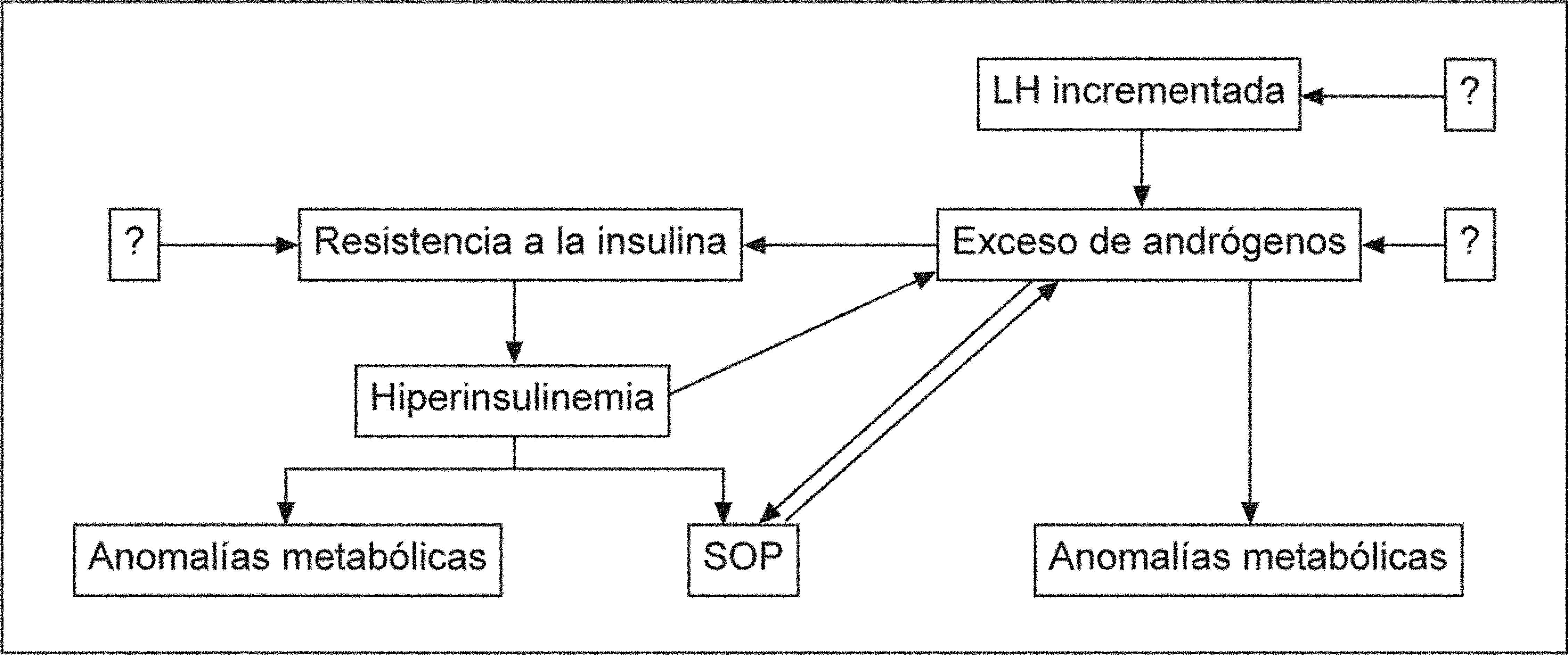
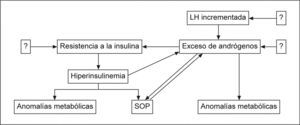
HIPERANDROGENISMO Y SÍNDROME METABÓLICIOEl hiperandrogenismo es una característica cardinal del SOP y es directamente responsable de algunos síntomas y, posiblemente, de algunas alteraciones metabólicas presentes en esas mujeres. El círculo vicioso entre la resistencia a la insulina y el exceso de andrógenos puede explicar y sustentar muchas de las anomalías endocrinas, reproductivas y metabólicas halladas con frecuencia en estas pacientes afectadas de SOP. Moghetti40 (2006) (fig. 2) explica el hipotético papel del exceso de andrógenos en la patogénesis del SOP.
Papel del exceso de andrógenos en la patogénesis del SOP. LH: hormona luteinizante; SOP: síndrome del ovario poliquístico. Fuente: Moghetti40.
En el tratamiento del hiperandrogenismo hay 2 estrategias claramente definidas: reducción de los andrógenos séricos libres e inhibición de la acción androgénica en los tejidos diana. Se usan 2 fármacos que, aunque no son antiandrógenos puros, actúan en los receptores androgénicos, el acetato de ciproterona y la espironolactona, con los que se cuenta con suficiente experiencia. El acetato de ciproterona, derivado de la 17-α-hidroxiprogesterona, es un progestágeno muy potente que también actúa como un antiandrógeno en los órganos diana. La espironolactona es un antagonista de la aldosterona que compite con los andrógenos por el receptor androgénico en el folículo pilosebáceo e inhibe la interacción de la dehidrotestosterona con su receptor androgénico intracelular. Hay otro preparado, éste sí antiandrógeno puro, la flutamida, que, aunque generalmente es bien tolerado, ocasionalmente puede ocasionar toxicidad hepática.
Hay diversos estudios41,42 que muestran que estos fármacos, en las pacientes con SOP, pueden reducir la grasa visceral, mejorar el perfil lipídico y, quizá, atenuar la RI y mejorar las tasas de ovulación. Si la hipótesis del papel desempeñado por la RI y el exceso de andrógenos en la patogénesis del SOP es cierta, se debe considerar la combinación terapéutica de agentes sensibilizadores de la insulina y antiandrógenos42.
SÍNDROME METABÓLICO EN LA MENOPAUSIALa prevalencia de SM se incrementa con la menopausia; este hecho tiene una explicación: en parte, por la aparente aceleración del riesgo de ECV después de la menopausia. El período de transición pre a posmenopausia está asociado con la aparición de algunas características del SM, como43:
1.Incremento del peso, que se traduce en un aumento del perímetro abdominal. La acumulación de grasa con una distribución central (intraabdominal) surge como un factor de riesgo cardiovascular, independiente de la obesidad total, como se describe en el estudio de Framingham44. Mesch et al45 señalan que la frecuencia de aparición del SM se incrementó durante la fase de la transición del estado de menopausia a la posmenopausia, y el aumento de la obesidad abdominal fue el hallazgo más frecuentemente observado.
- 2.
Un cambio hacia un perfil lipídico más aterogénico, con incremento de la LDL y de los valores de triglicéridos y una disminución de la HDL46.
- 3.
Un incremento de la glucosa y de los valores de insulina.
- 4.
En cuanto a si la menopausia está asociada a un incremento de la RI, los datos que aporta la literatura científica son contradictorios. Así, Lindheim et al47 muestran una reducción de sensibilidad a la insulina (y, por tanto, alta RI) en mujeres posmenopáusicas en comparación con mujeres premenopáusicas con similar IMC, mientras que Toth et al48 no hallan diferencias.
La aparición de todos estos factores de riesgo puede ser una consecuencia directa resultante del fallo ovárico o, alternativamente, como resultado indirecto de los efectos metabólicos ocasionados por una redistribución central de la grasa corporal asociada a la deficiencia estrogénica.
La posmenopausia está asociada a un incremento de riesgo de SM de hasta un 60%. No está claro si la transición a la menopausia incrementa los factores de riesgo cardiovascular en todas las mujeres o solamente en aquellas que desarrollan características propias del SM. En lo que sí coinciden todos los autores es en el hecho de que, a fin de prevenir el riesgo de ECV, el SM debe evaluarse durante el tiempo de la transición menopáusica45 y tratar de forma agresiva a la mujer posmenopáusica que desarrolla criterios de SM. Todas las guías prácticas de manejo, en estos casos, sugieren una combinación de:
- -
Modificaciones en el estilo de vida (pérdida de peso y realización de ejercicio físico)49. Al respecto, se ha demostrado que una modesta pérdida de peso puede mejorar la adiposidad visceral y la RI. Por otra parte, la realización de ejercicio aeróbico origina una pérdida de grasa abdominal.
- -
Terapia médica. Hasta hace poco, la terapia hormonal sustitutiva (THS) fue una opción para el tratamiento del SM en la mujer posmenopáusica, debido a que mejora algunas de las anomalías detectadas en el SM50. Sin embargo, con los datos aportados por el estudio WHI, que demuestran un incremento de riesgo de ECV en mujeres usuarias de la THS, se concluye que la THS no debe recomendarse para tratamiento preventivo de la ECV51. No obstante, Green et al52, en el HERITAGE Family Study, concluyen afirmando que las mujeres posmenopáusicas que recibieron THS tienden a tener valores más bajos de grasa abdominal visceral, un más favorable perfil lipídico y una significativa reducción del riesgo de SM en comparación con mujeres que no recibieronTHS. Cooper et al53 estudiaron si la RI asociada con THS tenía alguna influencia sobre los marcadores de inflamación y adiposidad, y hallaron que el tratamiento con THS durante un año incrementaba la PCR, pero no alteraba la interleucina 6, la adiponectina o la leptina. El cambio en la PCR, sin embargo, no estaba relacionado con la disminución de la glucosa disponible con la THS.
Los datos epidemiológicos de disfunción sexual femenina (DSF) indican que entre el 11 y el 45% de las mujeres presenta alguna disfunción sexual; los trastornos de la excitación, la anorgasmia y la dispareunia son los comunicados con más frecuencia. Además, se pone de relevancia que el riesgo aumenta con la edad, pero sobre todo tras la menopausia y ante la presencia de depresiones o enfermedades somáticas.
Esposito et al54 han investigado la prevalencia de la disfunción sexual en la mujer premenopáusica con SM y la han comparado con un grupo de población general femenina. La función sexual fue investigada mediante el índice de función sexual femenina (FSFI)55 y los criterios diagnósticos de SM fueron los recomendados por el Adult Treatment Panel1.En su estudio, encuentran que las mujeres con SM tienen una prevalencia aumentada de disfunciones sexuales en comparación con el grupo de mujeres sin SM. No obstante, señalan que dada la complejidad de la respuesta sexual femenina y los limitados modelos experimentales disponibles, son necesarias más investigaciones en esta área a fin de objetivar la significación clínica y las posibles implicaciones de estos hallazgos. En otro estudio56, el mismo grupo, además de encontrar una reducción en el FSFI en el grupo de mujeres con SM, encuentran también que este grupo de mujeres tienen unos valores circulantes de PCR más elevados que en el grupo de mujeres sin SM. Estos datos ya sugieren una base orgánica para la DSF, lo que lleva a pensar que datos de la eficacia del tratamiento del SM con efectos positivos sobre la DSF están por llegar.
Síndrome metabólico y cáncer de mamaDiversos estudios han mostrado que mecanismos hormonales, metabólicos e inflamatorios pueden afectar a la progresión del cáncer de mama. Pasanisi et al57 investigaron el valor pronóstico del SM en 110 mujeres posmenopáusicas con cáncer de mama. El porcentaje adverso ajustado de recurrencia del cáncer de mama por la presencia del SM fue 3,0 (intervalo de confianza [IC] del 95%, 1,2-7,1). Combinando el SM y la testosterona sérica, el índice ajustado adverso de recurrencia entre las mujeres con SM y valores de testosterona elevados (> 0,40 ng/ml) fue de 6,7 (IC del 95%, 2,3-19,8) en comparación con las mujeres sin SM y valores de testosterona ≤ 0,40 ng/ml. Estos resultados sugieren que el SM puede ser un importante factor pronóstico para el cáncer de mama.
Por otra parte, se sabe que los estados de hiperinsulinemia con RI están frecuentemente asociados a anomalías proliferativas titulares. Sinagra et al58 hallaron que la prevalencia de algunos elementos constituyentes del SM, como la DM2, la hipertensión y la dislipemia, fue alta en un grupo de mujeres afectadas de cáncer de mama frente a pacientes con patología mamaria benigna y pacientes sin ninguna patología mamaria. Concluyeron afirmando que estos hallazgos están de acuerdo con la hipótesis de la interrelación existente entre el hiperinsulinismo/RI con el desarrollo de anomalías relacionadas con el cáncer de mama.
Síndrome metabólico y embarazoEl embarazo es un SM transitorio que predispone a disfunción epitelial59. En el embarazo normal, hay un gasto cardíaco aumentado, tendencia a la hipercoagulabilidad, aumento de marcadores de inflamación y, después de la semana 20, RI y dislipidemia.
Todos estos factores son proaterogénicos y se encuentran más acentuados en la paciente que desarrolla hipertensión. Este SM persiste en el posparto y se evidencia como persistencia de un IMC aumentado, aumento de la presión arterial y los triglicéridos, y disminución de las HDL.
La disfunción placentaria, que se puede poner de manifiesto en los desórdenes hipertensivos del embarazo, ocurre más frecuentemente en la mujer con obesidad, hipertensión crónica, diabetes mellitus y dislipemia, cuadros todos ellos propios del SM. Sin embargo, la relación existente entre el SM y el futuro riesgo de disfunción placentaria o muerte fetal permanece desconocida. A este respecto, en un estudio retrospectivo, Ray et al60 señalan que las mujeres que exhiben aspectos del SM antes del embarazo tienen un elevado riesgo de disfunción placentaria e, incluso, de muerte fetal.
Rodie et al61 señalan que complicaciones del embarazo, particularmente la preeclampsia y la restricción del crecimiento fetal intrauterino, se han asociado a una futura ECV materna, hasta tal punto que se preguntan si la preeclampsia y la ECV no son sino un auténtico SM del embarazo. Aún más, Barden et al62 describen que factores presentes en el SM en pacientes no gestantes, como la relativa elevación de la presión arterial, el aumento en el índice de masa corporal y de los lípidos podrían ser importantes factores sensibilizantes que contribuyan a la patogénesis de preeclampsia en esas pacientes una vez que quedan gestantes.
Después de un embarazo afectado por preeclampsia y antes que se haga evidente una ECV, hay evidencia de disfunción endotelial subclínica. Forest et al63 hallaron que la prevalencia de SM está incrementada de 3 a 5 veces en las mujeres con una historia de hipertensión inducida por el embarazo en su primera gestación. En este mismo sentido, Chambers et al64 encontraron que 15 a 25 años después de presentar preeclampsia se encuentran valores aumentados de moléculas de adhesión vascular y evidencia de RI.
Por todo ello, es preciso un manejo óptimo de la puérpera hipertensa, que incluye, entre otras medidas, disminuir los factores relacionados con el SM. Para ello, será fundamental que la puérpera hipertensa modifique su estilo de vida, mediante:
- -
Fomento de la realización de actividad física.
- -
Control del peso.
- -
Dieta rica en vegetales (antioxidantes), disminución de grasas y de la ingesta de sal, eliminar por completo el consumo de alcohol.
Con estas medidas, se pretende disminuir los factores nocivos para el endotelio y así intentar retrasar la aparición de enfermedades debidas directamente a su disfunción65.
Por otra parte, la diabetes gestacional (DG) podría considerarse como predictora de riesgo aumentado de SM66. Si además se presenta con obesidad pregestacional, el riesgo se eleva notablemente. La DG afecta a un 6-8% de las mujeres embarazadas; su presencia se ha relacionado con un incremento de la morbimortalidad fetal, fundamentalmente en relación con la macrosomía. En diversos estudios67,68 se ha descrito la DG como un factor predictivo de diabetes mellitus y presencia de factores de riesgo vascular a corto, medio y largo plazo para la mujer tras el parto; se han publicado cifras de evolución a diabetes desde el 6 hasta el 70%, en función del tiempo transcurrido y los factores de riesgo existentes, y estas mujeres también eran más proclives a desarrollar SM. Según Noussitou et al69, en una cuarta parte de las gestantes con DG, las anomalías metabólicas preceden a la aparición de intolerancia a la glucosa. Donde el cribado de DG no está implantado, los clínicos deben ser advertidos de los riesgos metabólicos presentes en cada una de las gestantes que presentan obesidad, hipertensión y dislipidemia, todas ellas alteraciones asociadas a la DG y a la posibilidad de desarrollo posterior de un SM.