INTRODUCCIÓN
Los tumores de Sertoli-Leydig constituyen un grupo de neoformaciones caracterizadas por presentar una organización morfológica, en ocasiones también funcional, de tipo masculino, en cuyo caso se pueden acompañar de signos clínicos de hirsutismo o fenómenos de franca virilización1.
Se trata de una variedad de tumor muy poco frecuente (constituye el 0,5-1% de todas las neoplasias ováricas), casi siempre unilateral. Aparece generalmente en mujeres jóvenes, con una media de edad de 25 años, y es raro que se observe antes de la pubertad o después de la menopausia, aunque su aparición ha sido descrita en mujeres de 3 a 74 años. Se presenta en mujeres en edad reproductiva en un 78% de los casos, y en algunas ocasiones ha sido descubierto durante una gestación2,3.
Se trata generalmente de un tumor benigno que deriva de la estroma ovárica, con una estructura histológica que recuerda a las células de Sertoli y Leydig testiculares, es un tumor secretor de andrógenos. Su aspecto microscópico es similar al de otros tumores del mesénquima o secretores de hormonas. El tamaño puede variar dentro de límites muy amplios (con una media de 10 cm) y no posee ningún tipo de significación pronóstica.
El tumor de células de Sertoli-Leydig reproduce en su estructura diversos aspectos del desarrollo testicular embrionario. Microscópicamente se distinguen diversas formas según el grado de diferenciación de los elementos constitutivos (bien diferenciados, diferenciación intermedia, pobremente diferenciados o sarcomatoideos, patrón retiforme y con elementos heterólogos)4. Mientras que los tumores bien diferenciados suelen tener una apariencia sólida, los tumores con diferenciación intermedia o pobre y aquellos con patrón retiforme o con elementos heterólogos pueden presentarse como una masa quística multilocular5. Estos distintos tipos histológicos, además, pueden hallarse en el mismo tumor.
Estudios recientes señalan que la falta de estrógenos en el ovario adulto induce la transdiferenciación de los folículos en estructuras similares a los túmulos seminíferos del testículo. Estos datos sugieren un posible papel de los esteroides en la patogenia de estos tumores1.
En cuanto a la clínica de los tumores, destaca la aparición de síntomas masculinizantes en aproximadamente la mitad de las pacientes, como amenorrea secundaria, atrofia mamaria, hirsutismo, agravamiento de la voz y clitoromegalia. Sólo en un 30% de los casos existen síntomas virilizantes4. En un 50% de los casos no hay manifestaciones endocrinas1. Es frecuente, pues, que tan sólo la elevación de los valores séricos de andrógenos den la pista de que se trata de un tumor de esta clase6,7.
El diagnóstico del tumor es anatomopatológico e inmunocitoquímico3.
El tratamiento y el pronóstico dependen de la edad, el estadio y el grado de diferenciación, y presentan una supervivencia del 92-100%.
Se analiza un caso de un tumor ovárico de células de Sertoli-Leydig en una mujer posmenopáusica.
CASO CLÍNICO
Se trató de una mujer de 55 años diagnosticada por primera vez en 2001, a los 54 años, de hirsutismo de reciente aparición (3 años después de la menopausia) y rápidamente progresivo.
Tuvo la menarquia a los 12 años, 2 gestaciones a término con partos eutócicos, y la menopausia se produjo a los 51 años. No tenía enfermedades sistémicas de interés ni hábitos tóxicos. Como antecedentes quirúrgicos, fue sometida a apendicectomía. Como antecedentes familiares solamente destaca un tío con diabetes mellitus tipo II.
El servicio de endocrinología remitió a la paciente a nuestro servicio por un aumento de la pilosidad en la cara en septiembre de 2001. A la exploración física, no había datos llamativos de virilismo, caída del cabello ni atrofia mamaria. La valoración de hirsutismo según la escala modificada de Ferriman-Gallwey dio una puntación de 4 por el exceso de pilosidad en el labio superior y la barbilla.
Realizado el estudio analítico, se observó: concentraciones de gonadotropinas hipofisarias y estradiol en rango de menopausia; prolactina en valores normales, y unas cifras de testoterona fuera de rango que quintuplicaban las cifras normales (5,7 ng/ml).
En junio de 2001, ante el aumento de la pilosidad facial, se realizó un test de valoración suprarrenal para criba de hiperandrogenismo de causa suprarrenal. La prueba de Nuvacthen/17-OHPg en nuestra paciente resultó ser de 5 ng/ml, con lo que se descartó el origen suprarrenal. Se realizó también la prueba para el hiperandrogenismo funcional ovárico, que estableció el diagnóstico de hiperandrogenismo de origen ovárico. Como complemento de las pruebas funcionales, se realizó previamente a la intervención quirúrgica un tratamiento médico con análogos de la gonadoliberina (nafarelina 200 μg/día intranasal) con la finalidad de descartar la influencia hipofisaria en la función ovárica. Tras el tratamiento médico, persistieron las elevadas concentraciones séricas de testosterona, de 8,3 ng/ml.
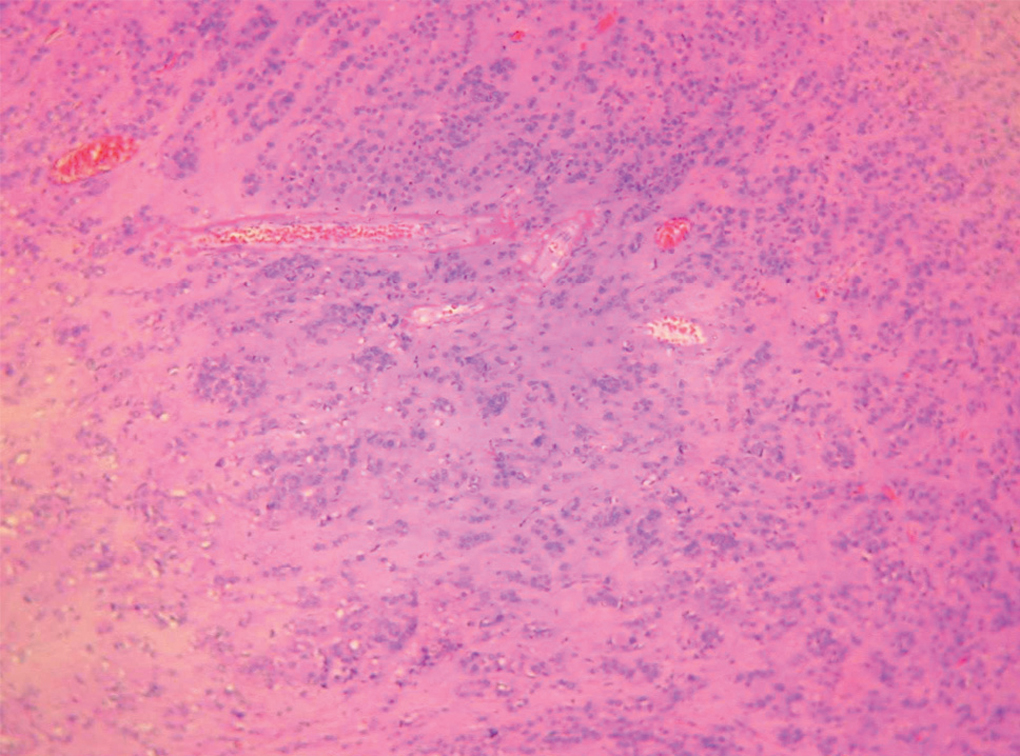
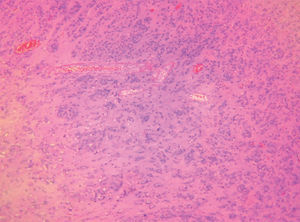
Figura 1.Imagen macroscópica del ovario. La apariencia macroscópica es la de un ovario atrófico de características normales en una mujer posmenopáusica.
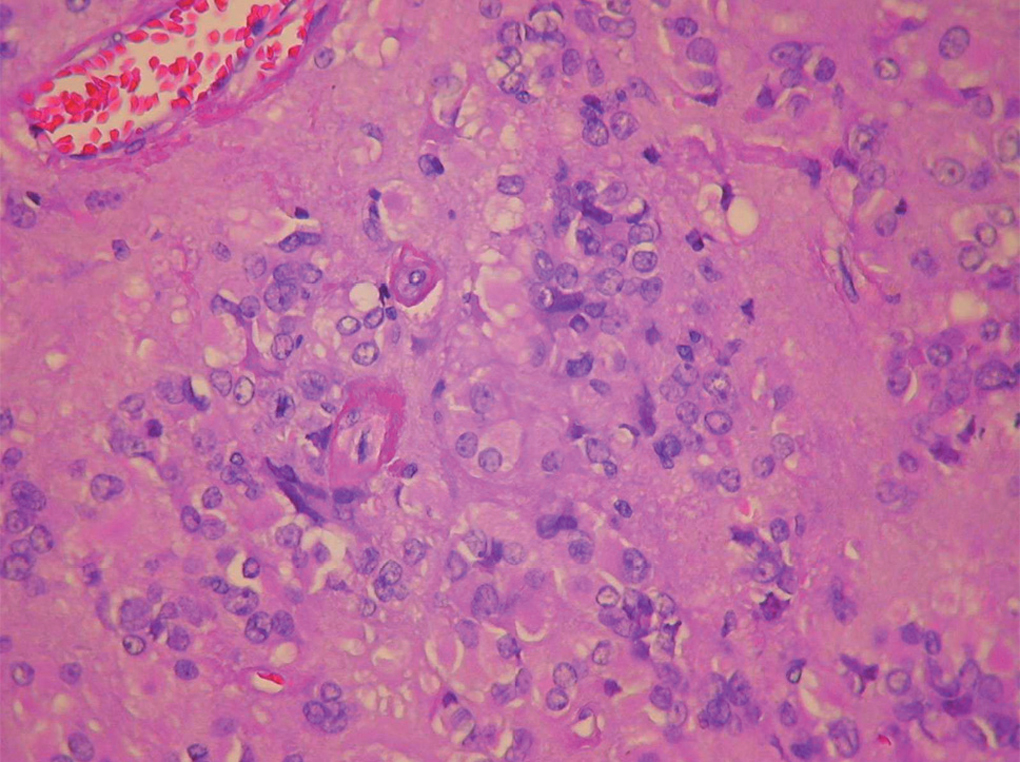
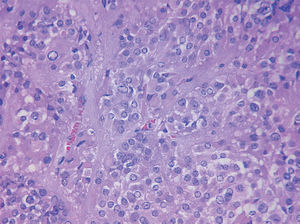
Figura 2.Imagen microscópica del tumor. Se observa celularidad compartimentalizada por bandas de estroma y cambio fibrinoide perivascular.
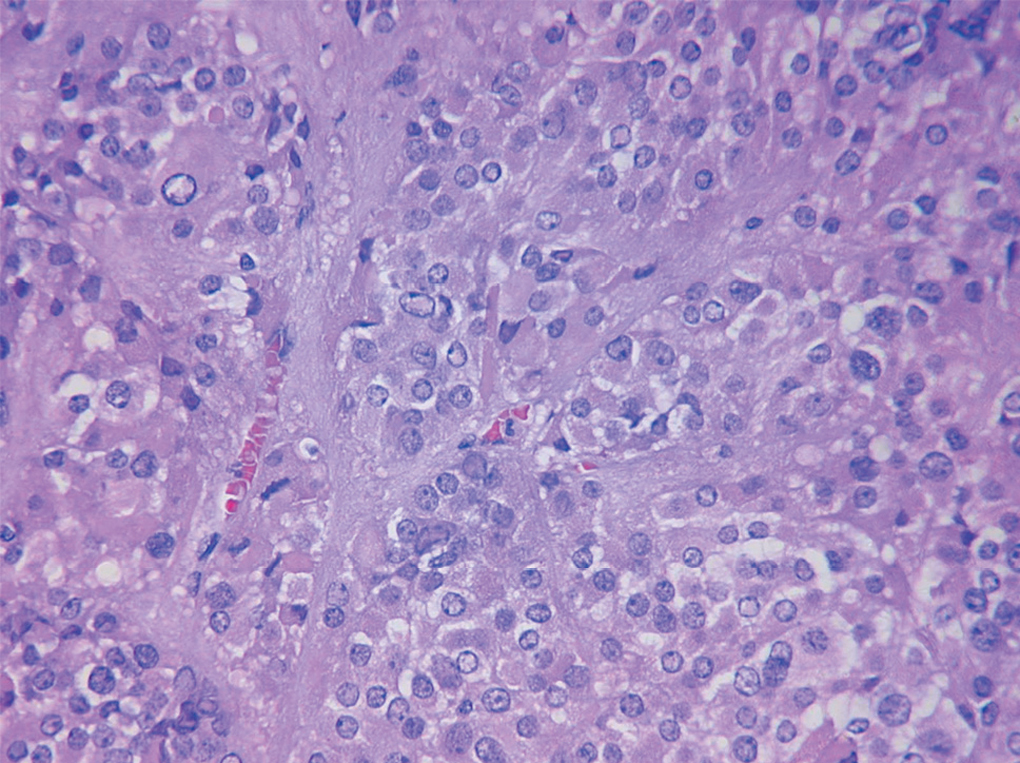
Figura 3.Imagen microscópica del tumor. Detalle del cambio fibrinoide perivascular y de la celularidad tumoral.
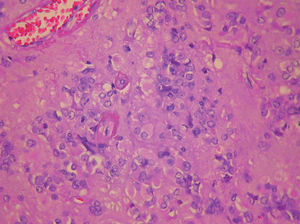
Figura 4.Imagen microscópica del tumor. Cristaloide de Reinke en el centro del campo.
Se optó por realizar estudios de imágenes para localizar la fuente anormal de andrógenos. En la tomografía computarizada abdominopélvica no se obtuvo hallazgos significativos. Se evidenciaron ambas suprarrenales de tamaño y morfología normales, sin evidencia de nódulos. La morfología uterina fue normal, y se observó que los ovarios eran de aproximadamente 2,1 cm el izquierdo y 2,3 cm el derecho, con disposición normal. La ecografía ginecológica evidenció: un útero en anteversoflexión de 8,4 x 2,8 x 5,2 cm, con pequeño mioma de 1,4 cm en la pared posterior; línea endometrial fina, de 3 mm de grosor; el ovario derecho era de 2 x 2,4 cm, sin alteraciones, y el ovario izquierdo, de 2,3 cm x 1,2 cm, sin alteraciones.
Inicialmente se decidió un tratamiento cosmético.
En marzo de 2001, la pilosidad facial aumentó de forma espectacular, pasando a una puntación de 8 en la escala modificada de Ferriman-Gallewey. Se aconsejó láser facial como tratamiento cosmético y se ampliaron los estudios funcionales (test Nuvacthen/17OH pg y prueba de hiperandrogenismo funcional ovárico).
Una nueva batería analítica el 22 de febrero de 2002 mostró una testosterona total de 6,6 ng/ml. En la exploración física se apreció un inicio de calvicie en áreas temporales y vértex, y también un aumento considerable de la vellosidad en el abdomen infraumbilical y las nalgas; la puntación de la escala de Ferriman ascendió a 16. Se consideró el diagnóstico de hiperandrogenismo de origen ovárico con técnicas de imagen negativas, que no indicaron malignidad por su evolución. Se planteó valorar el origen ovárico mediante biopsia, pero se optó finalmente por una histerectomía con doble anexectomía asistida por laparoscopia, por el antecedente del mioma uterino y por no tenerse una localización clara del tumor por las técnicas de imagen.
El 18 de septiembre de 2002 se realizó una histerectomía vaginal asistida por laparoscopia más doble anexectomía. La anatomía patológica de la intervención informó de tumor de células esteroideas de ovario derecho concordante con tumor de células de Leydig benigno, útero con endometrio atrófico y adenomiosis, con cérvix, ovario izquierdo y trompas uterinas sin lesiones relevantes.
Tras la intervención se realizó una nueva batería analítica el 15 de enero de 2003, en la que destacó la normalización de las cifras de testosterona total sérica, con 0,5 ng/ml.
En noviembre de 2003 la paciente refirió un aumento del pelo en el cuero cabelludo. La puntación de Ferriman-Gallwey se redujo a 0. Se consideró éxito total y se dio el alta a la paciente.
DISCUSIÓN
Ante la aparición de un hirsutismo debemos hacer un diagnóstico correcto de su posible etiología, ya que las causas pueden ser varias8.
Este caso clínico muestra muchos aspectos relevantes en la clínica y el diagnóstico de los tumores ováricos de células de Sertoli-Leydig. Destaca su aparición después de la menopausia9, hecho que es bastante infrecuente en este tipo de tumores.
Independientemente de la edad de aparición, la evolución rápida de la clínica de virilización suele estar asociada a un tumor productor de andrógenos. La causa más frecuente de tumor ovárico virilizante es el tumor de células de Sertoli-Leydig2.
En la gran mayoría de los casos, los tumores ováricos funcionales son palpables. En aproximadamente el 95% de las pacientes sintomáticas se puede palpar una masa anexial4. Sin embargo, se sabe que tumores ováricos muy pequeños (generalmente localizados en el hilio ovárico) pueden secretar testosterona3. Este es nuestro caso, ya que ni la tomografía computarizada abdominopélvica ni la ecografía ginecológica fueron capaces de diagnosticar la presencia de la tumoración. Ocasionalmente, se halla virilización con un tumor no funcional, que es estimulado por la secreción de andrógenos del tejido circundante de la estroma.
Cuando se sospecha un tumor productor de andrógenos y no se palpa una masa anexial, se debe realizar estudios por imagen de la suprarrenal y los ovarios. El estudio por imagen de la suprarrenal es una técnica sensible para la detección de tumores pequeños que producen síndrome de Cushing y, también, adenomas virilizantes. Se prefiere la tomografía computarizada a la resonancia magnética y la ecografía por su mayor resolución en las imágenes de la suprarrenal. En nuestro caso, tras la tomografía computarizada, no se encontró ninguna alteración relevante en las suprarrenales. El método de elección para el estudio de los ovarios es la ecografía transvaginal, pero en la de nuestro caso no fue posible detectar el tumor.
En una paciente en la que no se palpa una masa, el dilema en el diagnóstico reside en cuándo empezar a explorar. Podemos recurrir a los test funcionales:
Test de Nuvacthen/17-OHPg que mide la 17-OH-progesterona a la hora de administrar 250 μg de corticotropina intravenosa en ayunas. En caso de hiperandrogenismo de causa suprarrenal, la 7-OH-progesterona es > 10 ng/ml.
Prueba para el hiperandrogenismo funcional ovárico, que consta de la determinación basal de folitropina, lutropina, 17-OHPg, testosterona, androstendiona y sulfato de deshidroepiandrosterona. Se frena la suprarrenal con dexametasona a 0,5 μg/6 h durante 2 días. Teniendo frenada la suprarrenal con dexametasona, se realiza un estímulo con gonadoliberina. Si la 17-OHPg se incrementa por encima de 2,5 ng/ml, el origen es ovárico.
Tratamiento médico con análogos de la gonadoliberina: la posmenopausia asocia una hiperinsulinemia que puede estimular una hipertecosis ovárica y ésta, en ocasiones, puede parecer un tumor ovárico. En estas pacientes se puede evitar la cirugía con tratamiento con un agonista de la gonadoliberina, porque la actividad esteroidogénica inducida por la insulina en el ovario todavía depende de la lutropina. Nuestra paciente, tras varios meses de tratamiento con nafarelina, siguió presentando altas concentraciones séricas de testosterona.
Se sabe que en muchas ocasiones las pruebas de supresión y estimulación hormonal conducen erróneamente a la ooforectomía en presencia de un adenoma virilizante suprarrenal. Además, los métodos de estimulación y supresión suprarrenal no permiten aislar en algunos casos las funciones ovárica y suprarrenal3. Éste no es nuestro caso, pues nuestra paciente presentó un patrón característico de respuesta a las pruebas de supresión-estimulación que indicó un hiperandrogenismo de origen ovárico.
El tratamiento y el pronóstico de estos tumores dependen de la edad, el estadio y el grado de diferenciación. En mujeres menopáusicas, como es nuestro caso, el tratamiento de elección es la histerectomía con doble anexectomía. Esto es lo que se hizo en nuestro caso. Tras el tratamiento quirúrgico, los valores séricos de testosterona decrecen rápidamente, pero los signos de virilización remiten más lentamente. Esto es lo sucedido en nuestro caso pues, aunque la testosterona sérica se había normalizado 3 meses después de la intervención, los signos clínicos de hiperandrogenismo comenzaron a remitir casi un año después.
El presente estudio muestra un caso particular de tumor ovárico de células de Sertoli-Leydig de aparición en la posmenopausia con una excelente evolución tras el tratamiento quirúrgico, pues tanto las cifras de testosterona sérica como los signos clínicos de hiperandrogenismo se normalizaron.
Correspondencia:
Dr. J.F. Pardo Hernández.
Servicio de Obstetricia y Ginecología. Hospital Universitario Dr. Peset.
Gaspar Aguilar, 90. 46017 Valencia. España.
Correo electrónico: jf@jfpardo.com
Fecha de recepción: 22/10/04
Aceptado para su publicación: 3/11/05