INTRODUCCIÓN
Los tumores de células de Sertoli-Leydig son neoplasias muy raras ya que constituyen menos del 0,5% de todos los tumores ováricos1. De ellos sólo un 20% presenta componente heterólogo, y con mucha menor frecuencia tienen un origen mixto (tumores de células de Sertoli-Leydig y de células de la granulosa).
Los tumores de células de Sertoli-Leydig se denominan también androblastomas2 por la virilización que ocasionan en las pacientes, aunque habrá que tener en cuenta que la producción elevada de andrógenos también puede tener un origen suprarrenal3.
Los tumores con origen en los cordones sexuales y de la estroma gonadal se representan en la tabla 1.
A diferencia del tumor de células de la granulosa, en el que el componente celular es de origen propiamente ovárico y producirían estrógenos (en el de tipo adulto), en el de Sertoli-Leydig evocan un origen testicular y producirían andrógenos. En el ginandroblastoma coexisten los 2 tipos celulares, y la producción hormonal es mixta4-6.
A continuación se describe un caso de síndrome de virilización secundaria a un tumor mixto de células de Sertoli-Leydig/granulosa juvenil con componente heterólogo cartilaginoso en una paciente adolescente que fue tratada con anexectomía unilateral.
La rareza del resultado del estudio anatomopatológico conlleva una revisión del tema basado en la evidencia disponible en la bibliografía.
CASO CLÍNICO
Mujer adolescente de 15 años de edad, con antecedentes de intervención quirúrgica por neuroblastoma pulmonar a los 4 años y tratamiento quimioterapéutico. Acude a nuestra consulta de ginecología por presentar un cuadro de dolor abdominal, hirsutismo y amenorrea de un año de evolución.
En los antecedentes ginecoobstétricos destacan ser nuligesta y presentar la menarquia a los 11 años de edad. La fórmula menstrual hasta hace un año era normal. El peso, la talla y el desarrollo mamario eran acordes con su edad. A la exploración presentaba signos de notable virilización (hirsutismo, cambio de timbre de voz, leve hipertrofia de clítoris). Se palpaba tumoración abdominopélvica que sobrepasaba el nivel umbilical.
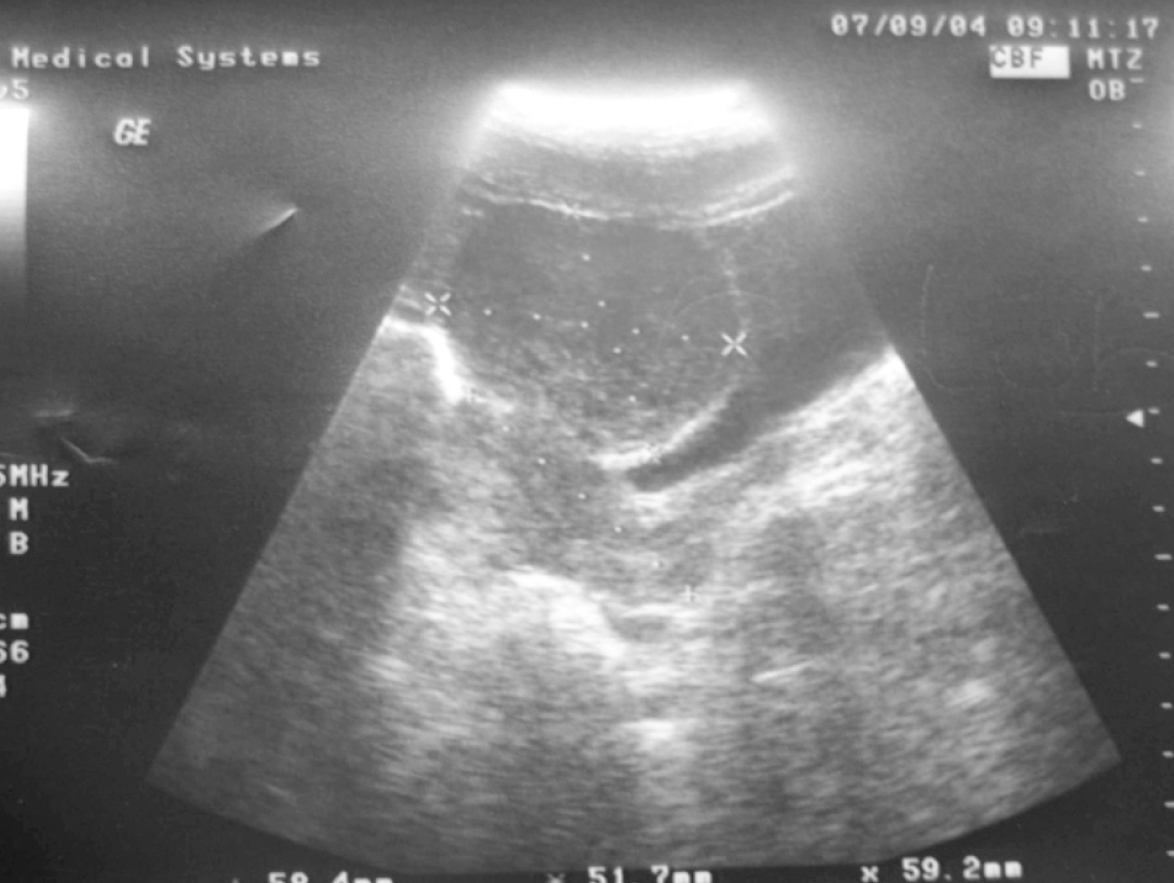
En la ecografía abdominal se observaba el útero y el anejo derecho normales. El anejo izquierdo estaba aumentado de tamaño con unas medidas de 15 x 11 x 7 cm, y presentaba un ecogenicidad mixta (sólido-quística) con estudio Doppler color normal (fig. 1).
Figura 1.Imagen ecográfica.
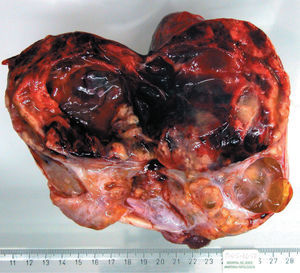
Figura 2.Aspecto macroscópico.
En la tomografía computarizada (TC) abdominal presentaba una imagen ocupante de espacio de 13 cm de diámetro máximo en el fondo de saco de Douglas, con características mixtas, sólidas o quísticas, heterogéneas en su distribución, compatible con una masa anexial izquierda. No presentaba hallazgos locorregionales pélvicos asociados. Se observaron imágenes de características residuales basales en el pulmón derecho, secundarias a una intervención de neuroblastoma pulmonar en la infancia.
El estudio analítico general era normal. Los marcadores tumorales (CEA, CA 19.9, CA 125, gonadotropina coriónica beta [BHCG] y alfafetoproteína) eran todos negativos.
En la analítica hormonal, sólo destacaba un aumento importante de testosterona (3,43 ng/ml). El resto de hormonas sexuales y suprarrenales estaban dentro de los valores normales.
Con el diagnóstico de tumor ovárico virilizante, se interviene a la paciente quirúrgicamente, practicándosele una laparotomía media suprainfraumbilical. Como hallazgos intraoperatorios se encontró una gran tumoración ovárica izquierda con múltiples adherencias a epiplón y sigma, sin presencia de líquido ascítico libre; el resto de los órganos intraabdominales eran normales; a la palpación, las glándulas suprarrenales eran de tamaño normal. Se procedió a liberar las adherencias descritas y se practicó una anexectomía izquierda.
El estudio peroperatorio anatomopatológico de la pieza es informado como tumoración compleja, difiriéndose el diagnóstico al estudio con parafina.
ESTUDIO ANATOMOPATOLÓGICO
Descripción macroscópica
Tumoración compleja (fig. 2) de 16 × 10 × 7 cm, de dimensiones máximas que muestra una superficie grisácea y homogénea, ligeramente surcada en la superficie por una fina trama vascular y a cuya apertura se observa una cavidad quística central de 6 cm de dimensión máxima, en cuya pared se observa un área sólida de 8 cm de tonalidad pardusca-grisácea y consistencia blanda, que a los cortes seriados muestra aspecto hemorrágico. Asimismo, en conjunción con las zonas anteriormente descritas, se observa un área poliquística con quistes de paredes homogéneas que albergan un fluido amarillento seroso cuya evacuación permite apreciar diversas excrecencias papilares, la mayor de 4 cm de diámetro máximo.
Descripción microscópica
El estudio de la pieza quirúrgica reveló la ausencia de disrupción capsular e invasión de ésta por la neoplasia. La trompa de Falopio estaba libre de neoplasia.
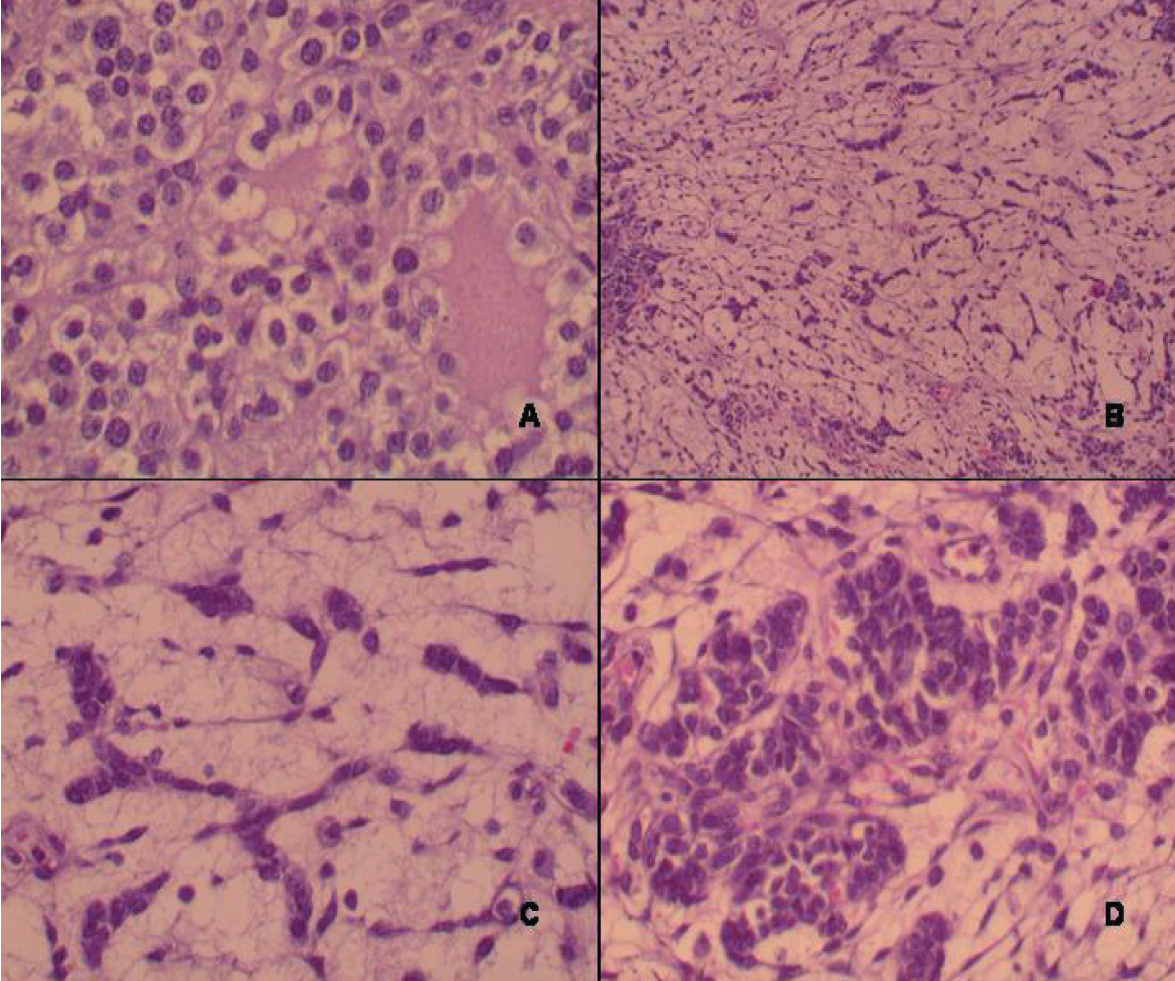
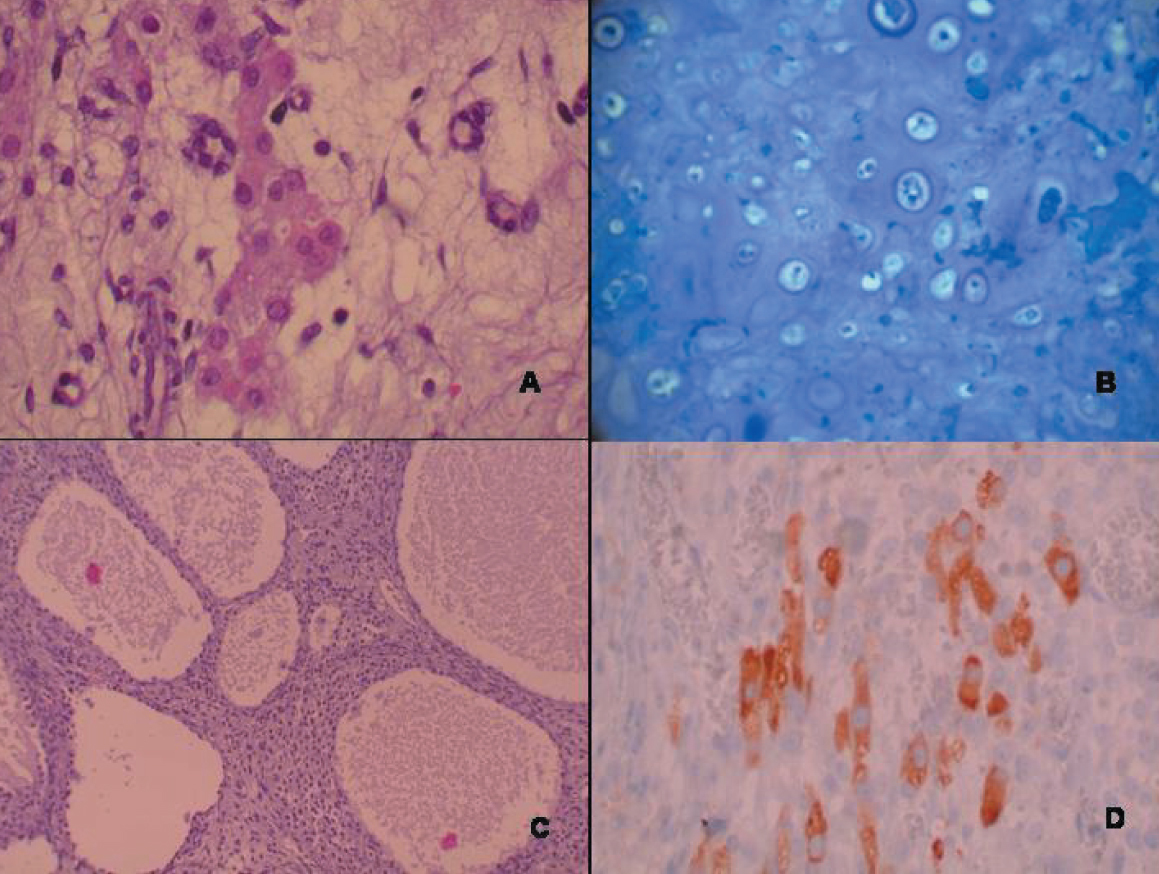
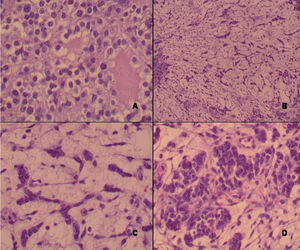
El estudio histológico mostró un parénquima predominantemente edematoso con la presencia de células fusiformes del tipo estroma gonadal sin atipia. Sobre este fondo se identificaron numerosas hileras y cordones de células pequeñas con núcleo hipercromático y discreta atipia, que recordaban a los cordones sexuales primitivos (células de Sertoli con diferenciación intermedia) (fig. 3), así como nódulos relativamente bien delimitados de células poligonales vacuoladas con núcleo paracentral, sin atipia, que se disponían en torno a luces constituyendo macrofolículos, cuyo contenido fluido mostraba un tono rosado-eosinofílico. Dichas células presentaban plegaduras nucleares evidentes de modo focal (células de la granulosa). El estudio exhaustivo de la pieza quirúrgica demostró asimismo la presencia de células rojizas poligonales, ligeramente estrelladas en ocasiones, que recordaban a los hepatocitos, con citoplasma granular y gran tamaño (células de Leydig) agrupadas o sueltas entre los cordones celulares anteriormente descritos (fig. 4). La región poliquística macroscópicamente descrita se correspondía en la histología con la presencia de múltiples cavidades quísticas, sin revestimiento epitelial, con contenido fluido seroso transparente en escasa cuantía. En torno a ellas se podía observar un componente fusocelular con patrón seudosarcomatoide, cuyas células mostraban una atipia nuclear de grado moderado (componente poco diferenciado). Por último, se observaron muy escasos focos de componente heterólogo de tipo condroide inmaduro. El estudio inmunohistoquímico de la neoplasia demostró inmunopositividad para inhibina, tanto en los cordones de diferenciación intermedia como en el componente de tumor juvenil de la granulosa. Se observó inmunopositividad heterogénea para citoqueratinas y vimentina en el componente de células de Sertoli y en la estroma. La negatividad para alfafetoproteína permitió hacer el diagnóstico diferencial entre las células de Leydig (negativas) y hepatocitos heterólogos (generalmente positivos), mostrando las primeras una clara inmunopositividad para vimentina y alfa-inhibina.
Figura 3.A) Células de la granulosa juvenil (x40). B) Cordones de células de Sertoli con diferenciación intermedia (x10). C) Cordones celulares (detalle) (x40). D) Áreas escasamente diferenciadas (x40).
Figura 4.A) Células de Leydig (x40). B) Cartílago inmaduro (x40). C) Áreas quísticas (x10). D) Inmunotinción positiva para inhibina (x40).
Si bien el elemento heterólogo más frecuente en este tipo de tumores es el epitelial (generalmente mucinoso), hay casos como el nuestro en que éste es de origen mesenquimal (cartílago), que presentan un peor pronóstico, según refiere la bibliografía. Por otro lado, hay que hacer hincapié en el hecho de que tales elementos heterólogos acompañan a las neoplasias de grados intermedio y alto pero no a las de bajo grado.
El diagnóstico definitivo podría establecerse como ginandroblastoma, si bien habría que hacer algunas observaciones. El ginandroblastoma es una neoplasia de aparición excepcional que, según la última clasificación de tumores ováricos de la OMS, se define como un tumor compuesto por un tejido bien diferenciado de células de Sertoli y de células de la granulosa (este último constituye al menos el 10% de la lesión). Se trata de neoplasias de comportamiento benigno cuya presentación clínica bien pudiera corresponder con la de nuestro caso. Asimismo, la definición de sus componentes muestra gran analogía con las del tumor de células de Sertoli-Leydig que nos ocupa, si bien el componente de células de Sertoli es principalmente de bajo grado, lo cual contrasta con el predominio de áreas de grados alto e intermedio de nuestro caso. Del mismo modo, la presencia de elementos heterólogos de tipo mesenquimal, aunque infrecuentes en el tumor de células de Sertoli-Leydig, es excepcional en los casos de ginandroblastoma.
Se trataría pues de un tumor de células de los cordones sexuales-estroma de tipo mixto con elementos heterólogos que, catalogado de un modo u otro, constituye una neoplasia del todo infrecuente.
CURSO CLÍNICO
Tras la intervención la paciente evoluciona favorablemente, con un curso postoperatorio normal. En el tercer día de postoperatorio los valores de testosterona habían bajado a 0,445 ng/ml. Es dada de alta en el quinto día postoperatorio.
La paciente es evaluada por el comité de oncología ginecológica y, a pesar de ser estudiada como pT1A, las áreas indiferenciadas con componente heterólogo del tumor le confieren peor pronóstico con mayor probabilidad de recidiva. Pero teniendo en cuenta los deseos de la paciente de preservar la fertilidad, se le explican las diferentes opciones terapéuticas, que van desde la observación a la administración de radioterapia o quimioterapia adyuvante, cuya eficacia aún no ha sido demostrada. Tras esta información la paciente y sus padres eligieron la opción de realizar revisiones periódicas sin recibir tratamiento adyuvante.
Tras 9 meses de control periódico ha experimentado una gran mejoría en el estado de virilización (hirsutismo y timbre de voz), recuperando las menstruaciones normales a los 2 meses tras la intervención. Por el momento, no hay evidencias de recurrencia de la enfermedad.
DISCUSIÓN
Los tumores virilizantes fueron descritos a principios del siglo xx como una entidad aislada, en mujeres en su mayoría en edad reproductiva, casi siempre unilaterales.
Fue Meyer, en 1930, quien les dio el nombre de arrenoblastomas y los clasificó en bien diferenciados, moderadamente diferenciados y mal diferenciados4. En 1949 este nombre fue sustituido por androblastoma. Desde 1958, se denominan tumores de células de Sertoli y Leydig. En la actualidad, se utilizan indistintamente este último o androblastoma2,7. Asimismo, fue Meyer, en 1930, el primero en describir el ginandroblastoma4,8.
Ante un cuadro de virilización, hay que confirmar que el origen se encuentra en el ovario o en la glándula suprarrenal. Entre las causas no neoplásicas de androgenización están las formas graves de poliquistosis ovárica, hipertecosis estromal, hiperplasia suprarrenal congénita del adulto, síndrome de Cushing y los andrógenos exógenos. Los valores de testosterona son los que más se elevan en las neoplasias ováricas (más de 2,5 veces sobre su valor normal), a diferencia de la deshidroepiandrosterona [DHEA]-S, la cual se encuentra muy elevada en los tumores virilizantes de las glándulas suprarrenales. Otra característica de toda neoplasia funcional es que causa virilización progresiva de instauración rápida, usualmente en meses9,10.
Cuando son pequeños, no visibles por los métodos de estudio por imagen, es necesaria la cateterización venosa selectiva para descubrir la fuente de andrógenos. El tumor de células de Sertoli-Leydig es poco frecuente, y supone menos del 0,5% de los tumores ováricos. La edad media de las pacientes es de 25 años y las formas de presentación más frecuente son el hirsutismo y el aumento de volumen abdominal10,11.
En el ginandroblastoma4,5, al ser un tumor mixto que contiene células de Sertoli-Leydig y de la granulosa, la producción hormonal suele ser mixta, detectándose en el estudio analítico una elevación de andrógenos y de estrógenos al mismo tiempo, lo que clínicamente puede determinar la aparición de un curioso caso en el que se entremezclan, en grado variable y no siempre constante, signos de virilización y de feminización8,12. En el caso que nos ocupa, sólo se detectó un aumento de testosterona y unos valores de estrógenos dentro de la normalidad, lo cual no es excluyente del diagnóstico de ginandroblastoma, ya que éste va ligado a los hallazgos anatomopatológicos y no a la clínica.
En el 98% de los casos, la neoplasia es unilateral1,9 y con un tamaño medio de 13 cm de diámetro máximo, y de componente quístico y sólido. Frente a la sospecha de malignidad y de un tumor productor de hormonas, la forma de abordarlo debe ser la laparotomía, aunque hay publicaciones que citan la laparoscopia11. No hay evidencia actual sobre qué técnica es la más adecuada, pero en casos bien seleccionados de mujeres jóvenes y con deseo de fertilidad la vía laparoscópica podría ser una alternativa.
El 80% de estos tumores se presenta en estadio IA (FIGO), la mayoría con la cápsula íntegra y son moderadamente diferenciados. Además, el hecho de ser mujeres jóvenes y en edad fértil conduce a una actitud conservadora, considerándose suficiente la realización de una anexectomía simple13. Sin embargo, la rotura de la cápsula, una peor diferenciación o un estadio más alto ensombrecen notablemente el pronóstico.
Los tumores se clasifican en grados histológicos, de acuerdo con su diferenciación, en bien diferenciados, moderadamente diferenciados o de diferenciación intermedia y poco diferenciados.
Además, se consideran los siguientes indicadores de peor pronóstico: a) el componente heterólogo (que aparece en el 20%), la mayoría de epitelio gástrico o intestinal y, menos frecuentes, los focos de carcinoide14 o elementos estromales, como el cartílago y el músculo, las células hepatoides, el hueso y el neuroblastoma, y b) patrón retiforme (similar a la rete testis).
El grado de diferenciación y el estadio del tumor son más importantes para el pronóstico que la presencia o no de tejido heterólogo15. En la serie de 207 tumores de Young y Scully sólo 29 tumores fueron clínicamente malignos. Ninguno de los 27 bien diferenciados, y sólo 4 de 100 de diferenciación moderada fueron malignos1.
La lista de diagnósticos diferenciales en los tumores bien diferenciados incluye: carcinoma endometrioide, tumor de Krukenberg, tumor carcinoide, tumor de células lipídicas, luteoma y carcinoma de células claras. En los menos diferenciados se incluye: tumor de la granulosa, sarcoma estromal endometrial, sarcomas ováricos, tumor mixto mesodérmico mulleriano, teratomas y tumores mucinosos quísticos.
En casos de duda diagnóstica se puede recurrir a la microscopia electrónica buscando cristales de Charcot-Bottcher en las células de Sertoli y cristaloides de Reinke en las células de Leydig16.
La inmunohistoquímica ayuda a confirmar el diagnóstico, ya que la alfa-inhibina es positiva tanto en las células de Sertoli como en las de Leydig17.
En general, los tumores de Sertoli-Leydig se consideran neoplasias de bajo potencial de malignidad1,14. Debido a la edad de las pacientes y que en el 97,5% de los casos se diagnostican en estadio I, el tratamiento quirúrgico de elección es conservador en la mayoría de las pacientes. En el caso del ginandroblastoma la supervivencia es todavía mayor, ya que suelen ser tumores de bajo grado en el componente de células de Sertoli. Sin embargo, en el caso que presentamos, en el componente de células de Sertoli predominan áreas de grado alto e intermedio. Asimismo, la presencia de elementos heterólogos de tipo mesenquimal empeora el pronóstico y es lo que hace este caso tan particular.
La supervivencia a los 5 años oscila entre un 70 y un 90%. La evolución favorable se constata por la normalización de los valores hormonales, el retorno de los ciclos menstruales y la desaparición paulatina de rasgos virilizantes.
En los casos de mujeres posmenopáusicas se aconseja la histerectomía con anexectomía bilateral18.
Dada la rareza de los tumores de Sertoli-Leydig, y más aún de los ginandroblastomas, así como los infrecuentes hallazgos de enfermedad avanzada o recurrente, hay poca experiencia en los tratamientos quimioterapéuticos, y menos aún con la radioterapia. Se tiene constancia de un caso de recurrencia fulminante en una paciente embarazada19. En caso de lesiones avanzadas o recurrentes (inusuales) se aconseja un régimen de quimioterapia basado en platino (VAC) y en la combinación de bleomicina-vinblastina18,20.
Correspondencia:
Dra. G. Reina Vinardell.
Servicio de Obstetricia y Ginecología. Hospital del SAS de Jerez de la Frontera. Ctra. Circunvalación, s/n. Jerez de la Frontera. Cádiz. España.
Correo electrónico: grv@ono.com
Fecha de recepción: 8/11/05.
Aceptado para su publicación: 14/2/06.