La vacunación integral en la embarazada contempla la inmunización antes, durante o después de la gestación, y pretende proteger a la madre y al recién nacido. Se deben ponderar, de forma individualizada, los riesgos de padecer determinadas enfermedades frente a los potenciales beneficios y riesgos de la vacunación. En el contexto de enfermedades emergentes como la tos ferina, la actualización de las recomendaciones es de especial relevancia.
En el presente trabajo se describen las principales estrategias de vacunación en la embarazada consensuadas por diversos organismos expertos en vacunas. Se revisan las vacunas indicadas durante el embarazo, y aquellas que se deberían considerar en el posparto inmediato o previamente a la gestación. Finalmente, se detallan las vacunas a valorar antes de realizar un viaje durante la gestación.
Comprehensive vaccination in pregnancy is related to immunization before, during or after gestation, and aims to protect the mother and the newborn. The risks to which every pregnant woman is exposed and the potential benefits of vaccination must be evaluated on an individual basis. In the context of emerging infectious diseases such as pertussis, the need to update traditional recommendations is particularly important.
This article describes the main vaccination strategies during pregnancy agreed by different expert institutions. The vaccines indicated during pregnancy, and those that should be considered in the immediate postpartum or prior to pregnancy are reviewed. Finally, the vaccines to be considered during pregnancy before international travel are discussed.
La inmunización antes, durante, o después del embarazo es una forma singular de inmunización del adulto, ya que puede proteger a la madre y también al futuro hijo. La lógica y creciente preocupación por controlar y minimizar cualquier riesgo durante el embarazo hace que la vacunación en la mujer gestante sea siempre objeto de preocupación.
Existen limitaciones éticas derivadas del tipo de estudios necesarios para obtener información sobre el riesgo potencial de afectación fetal. Por este motivo, las normas generales de vacunación para la mujer embarazada se basan, además de en la experimentación animal, en riesgos teóricos extrapolados de los conocimientos actuales sobre los efectos de las vacunas en diferentes colectivos y en estudios observacionales de vacunación inadvertida durante la gestación.
Las indicaciones de vacunación en la gestante dependen de la repercusión que cada enfermedad pueda tener a 3 niveles: 1) sobre la salud de la propia embarazada; 2) sobre la organogénesis y crecimiento del feto intraútero; y 3) sobre la susceptibilidad del recién nacido frente determinadas enfermedades. Los recién nacidos habitualmente no son capaces de crear respuestas inmunes protectoras hasta que pasan algunas semanas o meses de vida. En consecuencia, existe un espacio de tiempo en que el recién nacido es extremadamente vulnerable a enfermedades actualmente prevenibles mediante la vacunación. Por lo tanto, la inmunización de la futura madre no solo consigue proteger a la vacunada, sino que a través del paso de anticuerpos de forma pasiva al feto puede proteger al recién nacido hasta que sea posible la inmunización activa de este, con el inicio de su calendario vacunal1.
Las recomendaciones actuales de vacunación durante el embarazo deben ser individualizadas, ponderando en cada caso los riesgos de enfermedad frente a los beneficios y potenciales riesgos de la vacunación.
En la presente revisión se expondrán las normas generales consensuadas por diversos organismos y comités expertos en vacunas, y se revisarán las indicaciones especiales durante el embarazo de las vacunas disponibles actualmente en España.
Normas generalesLos beneficios de vacunar a una mujer embarazada a menudo son superiores a los riesgos potenciales cuando la posibilidad de exposición a la enfermedad es alta, cuando contraer la enfermedad supone un riesgo para el feto o para la madre y cuando es poco probable que la vacuna cause efectos adversos.
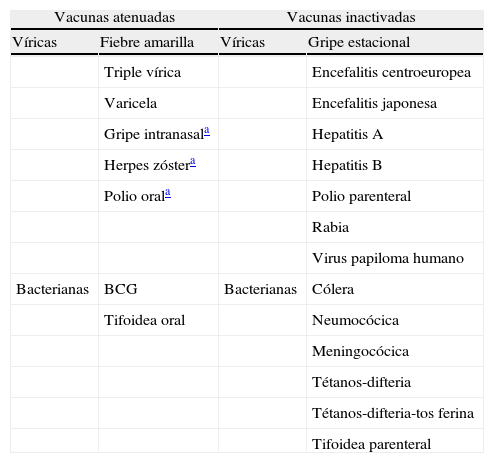
Según su composición existen 2 tipos de vacunas: las vivas o atenuadas y las inactivadas (tabla 1). Las primeras contienen microorganismos vivos atenuados, virus o bacterias, con capacidad replicativa. Las inactivadas pueden estar compuestas por virus o bacterias enteros modificados, o más comúnmente fracciones de estos obtenidas mediante tecnologías muy diversas2.
Tipo de vacunas según su composición
| Vacunas atenuadas | Vacunas inactivadas | ||
| Víricas | Fiebre amarilla | Víricas | Gripe estacional |
| Triple vírica | Encefalitis centroeuropea | ||
| Varicela | Encefalitis japonesa | ||
| Gripe intranasala | Hepatitis A | ||
| Herpes zóstera | Hepatitis B | ||
| Polio orala | Polio parenteral | ||
| Rabia | |||
| Virus papiloma humano | |||
| Bacterianas | BCG | Bacterianas | Cólera |
| Tifoidea oral | Neumocócica | ||
| Meningocócica | |||
| Tétanos-difteria | |||
| Tétanos-difteria-tos ferina | |||
| Tifoidea parenteral | |||
La administración de vacunas atenuadas durante la gestación puede suponer un riesgo para el feto, al menos teórico, por la posibilidad de transmisión del agente vacunal al feto. Por este motivo, de forma general las vacunas atenuadas están contraindicadas durante la gestación.
Por el contrario, no existe evidencia de riesgo de efectos adversos al vacunar a una mujer embarazada con vacunas inactivadas. Su administración debe considerarse individualmente, sopesando los riesgos y los beneficios de la vacunación.
Por otro lado, la evidencia muestra que es seguro para la madre y para el lactante recibir vacunas en el posparto, incluso durante la lactancia materna, con la excepción de la vacuna de la fiebre amarilla3.
Vacunas que deberían, o pueden ser administradas durante la gestaciónSiguiendo las recomendaciones del Advisory Comitee on Immunization Practices (ACIP) de los Centers for Disease Control and Prevention (CDC) de EE. UU.4–6, en una mujer embarazada cabría plantearse la administración de diferentes vacunas (tabla 2):
- •
Indicación universal: difteria-tétanos (Td) aunque se prefiere la difteria-tétanos-tos ferina acelular del adulto (dTpa) y la gripe estacional (inactivada).
- •
Indicación selectiva en caso de presentar situaciones de riesgo asociadas, como podrían ser: hepatitis A y B o vacunas neumocóccica y meningocóccica.
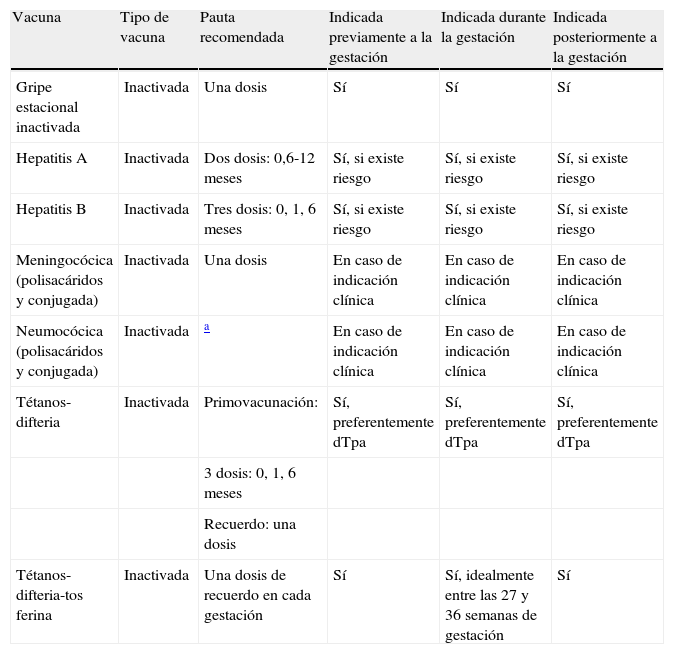
Vacunas a considerar durante el embarazo, incluidas en el calendario de vacunación
| Vacuna | Tipo de vacuna | Pauta recomendada | Indicada previamente a la gestación | Indicada durante la gestación | Indicada posteriormente a la gestación |
| Gripe estacional inactivada | Inactivada | Una dosis | Sí | Sí | Sí |
| Hepatitis A | Inactivada | Dos dosis: 0,6-12 meses | Sí, si existe riesgo | Sí, si existe riesgo | Sí, si existe riesgo |
| Hepatitis B | Inactivada | Tres dosis: 0, 1, 6 meses | Sí, si existe riesgo | Sí, si existe riesgo | Sí, si existe riesgo |
| Meningocócica (polisacáridos y conjugada) | Inactivada | Una dosis | En caso de indicación clínica | En caso de indicación clínica | En caso de indicación clínica |
| Neumocócica (polisacáridos y conjugada) | Inactivada | a | En caso de indicación clínica | En caso de indicación clínica | En caso de indicación clínica |
| Tétanos-difteria | Inactivada | Primovacunación: | Sí, preferentemente dTpa | Sí, preferentemente dTpa | Sí, preferentemente dTpa |
| 3 dosis: 0, 1, 6 meses | |||||
| Recuerdo: una dosis | |||||
| Tétanos-difteria-tos ferina | Inactivada | Una dosis de recuerdo en cada gestación | Sí | Sí, idealmente entre las 27 y 36 semanas de gestación | Sí |
Adaptada de: Guidelines for vaccinating pregnant women5.
Las gestantes en el segundo y tercer trimestre del embarazo tienen un mayor riesgo de complicaciones, incluido el ingreso hospitalario, derivadas de la infección por el virus de la gripe que los demás adultos de la misma edad y condición7. Por este motivo, los CDC ya recomendaron en 1997 la vacunación antigripal en embarazadas de segundo o tercer trimestre durante la temporada gripal (octubre-marzo); en 2004 se amplió esta indicación a las embarazadas de primer trimestre8. Asimismo, en el año 2005 la OMS se manifestó a favor de la vacunación frente a la gripe en las embarazadas durante la temporada gripal, no solo por las posibles complicaciones durante la gestación, sino también con el objetivo de proteger al recién nacido en los primeros meses de vida9. En España, actualmente, el Ministerio de Sanidad, Servicios Sociales e Igualdad (MSSSI) recomienda la vacunación antigripal en todas las embarazadas con independencia de la edad gestacional10.
Durante las temporadas interpandémicas se ha observado un aumento de los ingresos hospitalarios y un uso incrementado de recursos de salud relacionados con el virus de la gripe en las gestantes11. La morbilidad se incrementa al aumentar la edad gestacional, alcanzando las cifras más elevadas en el tercer trimestre del embarazo12. Los estudios realizados acerca de la morbimortalidad de la gripe pandémica muestran que las complicaciones derivadas de esta infección en el subgrupo de las embarazadas son mayores que en el resto de la población. Así lo demuestran estudios publicados tras las pandemias de 1918, 1957 y 200913,14.
Existe evidencia de la transferencia de anticuerpos vacunales maternos que protegen el recién nacido durante los primeros meses de vida en madres inmunizadas durante la gestación15.
Hasta la fecha no se ha publicado ningún estudio que demuestre riesgos para el feto o complicaciones maternas asociadas a la vacunación antigripal. Por otro lado, sí se han publicado trabajos que demuestran la inocuidad de la vacuna y un menor número de complicaciones respiratorias en los recién nacidos16,17.
A pesar de la evidencia disponible y de los beneficios de esta intervención en gestantes las coberturas vacunales existentes son muy bajas; la mayoría de estudios señalan coberturas que no superan el 10%. Esto es debido a miedos infundados tanto por parte de la embarazada como del obstetra, así como a falta de información y sensibilización al respecto. Predomina la errónea idea de «mejor no administrar ninguna vacuna durante el embarazo». Un estudio publicado en Cataluña en 2009 mostró que la cobertura de vacunación con vacuna estacional trivalente era inferior al 5%18. Sin embargo, en Estados Unidos las estimaciones de vacunación en mujeres embarazadas durante la temporada gripal 2010-2011 y 2011-2012 mostraban una cobertura entre el 38-49% y del 47%, respectivamente19.
Tétanos-difteria-tos ferinaLa tos ferina es una causa importante de mortalidad infantil a nivel mundial, y actualmente es un problema de salud pública emergente. En los últimos años se ha detectado un aumento en el número de casos de tos ferina que se asocia a distintos motivos20, uno de los cuales es la disminución de la cobertura vacunal en los adultos, ya que la duración de la protección que depara la vacunación es limitada, del orden de 4-12 años21.
La tos ferina es una enfermedad altamente contagiosa, siendo los adolescentes y los adultos la principal fuente de transmisión a los niños no vacunados. Los lactantes menores de 6 meses es el grupo en que la infección presenta una mayor gravedad, e incluso puede producir la muerte. Existe un período de tiempo entre el nacimiento y el inicio de la pauta de vacunación en que el niño no está protegido de forma activa.
Se describen 4 posibles estrategias, no excluyentes entre sí, para prevenir la tos ferina en los recién nacidos: 1) inmunización de todos los adolescentes y adultos; 2) inmunización de los contactos próximos (vacunación de la madre, padre, convivientes, personal sanitario, en el contexto de estrategia nido [cocooning strategy]); c) inmunización de las mujeres en edad fértil y embarazadas; y d) inmunización de los recién nacidos22.
En octubre de 2011 la ACIP aconsejó la vacunación con dTpa a las mujeres embarazadas a partir de la semana 20 de gestación, independientemente de cuándo hubieran recibido la última dosis de vacuna Td6. En diciembre de 2012 el mismo organismo publicó recomendaciones provisionales en las cuales indicaban que se debería revacunar a la mujer en cada gestación23 y en enero 2013 actualizó, en el calendario de vacunación para el adulto, la recomendación de vacunar en cada gestación, estableciendo el momento temporal ideal entre las 27 y 36 semanas de gestación. Esta recomendación pretende aumentar la probabilidad que la madre y el recién nacido presenten una protección óptima en los primeros meses de vida del niño24, considerando que el mayor paso de anticuerpos vía transplacentaria se produce en el tercer trimestre de la gestación. Diversos países, organismos y sociedades científicas han incorporado la estrategia de vacunación en la embarazada, entre ellos el American College of Obstetricians and Gynecologists (ACOG)25. El Reino Unido ha recomendado temporalmente la vacunación contra tos ferina en todas las embarazadas entre la semana 28 y 38 de la gestación26. En España no existen todavía recomendaciones de los organismos competentes, aunque sí de varias Sociedades Científicas22. En Cataluña está prevista la introducción de la vacunación frente a tos ferina durante la gestación, a principios de 2014.
La vacunación de las madres durante el embarazo puede prevenir casos de tos ferina, hospitalizaciones y muertes del lactante, comparada con la vacunación posparto, cuya protección «llega tarde»27,28.
Respecto a seguridad, los datos disponibles de mujeres que han recibido la vacuna durante la gestación no sugieren cambios en los patrones de efectos adversos relacionados con la vacuna29,30.
Tétanos y difteriaSegún recomendaciones del MSSSI las personas correctamente vacunadas en la infancia (5 dosis antes de los 14-16 años) no precisan recibir ninguna vacuna Td hasta los 65 años31. En Cataluña se recomienda administrar una dosis a los 40 años y otra a los 6532. En el caso de las embarazadas debería ser administrada una dosis de dTpa, independientemente de la fecha de la última dosis de Td6. En la situación de vacunación antitetánica incompleta se debe completar evitando, si es posible, el primer trimestre del embarazo. Aunque no existen indicios de que los toxoides tetánico y diftérico sean teratógenos, parece razonable esperar hasta el segundo trimestre para la administración de la vacuna Td, por un «principio de precaución» y con el objetivo de minimizar un potencial efecto adverso de la vacuna4.
La recomendación se hace principalmente para prevenir el tétanos neonatal, si bien la madre incorrectamente vacunada también está expuesta a la enfermedad31. En España no disponemos actualmente de vacuna del tétanos monovalente, por lo que se administra conjuntamente con la de la difteria. Los riesgos de infección por tétanos tanto para la madre como para el feto ocurren principalmente por el manejo durante el parto y la posible contaminación del cordón umbilical33. Numerosos estudios han demostrado que la vacunación de la madre durante el embarazo reduce la incidencia de tétanos neonatal, por lo que se debiera promover esta vacuna en las situaciones indicadas anteriormente34.
Hepatitis BLa gestación no es una contraindicación para la vacunación frente a la hepatitis B, las vacunas disponibles contienen HBsAg que no puede provocar la infección ni de la madre ni del feto. El virus de la hepatitis B se transmite principalmente por contacto sexual, a través de la exposición parenteral a sangre, hemoderivados y otros fluidos orgánicos u órganos infectados, o verticalmente de la madre al hijo. Si la embarazada es portadora crónica de la hepatitis B se debe de proteger al hijo con vacunación e inmunoglobulina específica en el momento del nacimiento.
Se debe considerar de forma individualizada la vacunación de una mujer embarazada seronegativa en caso de pertenecer a alguno de los grupos de riesgo de hepatitis B35, como son mujeres que por su ocupación (profesionales de la salud o fuerzas de seguridad), enfermedad de base (receptoras habituales de hemoderivados, infectadas por el VIH o pacientes en insuficiencia renal), estilos de vida (por ejemplo, actividad sexual con diferentes parejas o usuarias de drogas por vía parenteral) o circunstancias ambientales (convivientes y contactos sexuales de personas con infección aguda o crónica de virus) están expuestas frecuentemente a sangre o fluidos corporales que pueden contener el virus de la hepatitis B.
Hepatitis ALa vacuna de la hepatitis A es una vacuna inactivada y por lo tanto no está contraindicada durante el embarazo, a pesar de que su seguridad no ha sido específicamente evaluada en mujeres gestantes36. A la hora de recomendarla se debe valorar el riesgo de infección versus los riesgos de la vacuna37.
La vía de adquisición del virus de la hepatitis A es oral-fecal y por contacto directo persona-persona. En casos de riesgo elevado de exposición al virus, como viaje a zona endémica, usuarias de drogas por vía parenteral, prácticas sexuales oro-anales, enfermedades hepáticas crónicas, o riesgo ocupacional se debe recomendar la vacuna independientemente del trimestre de embarazo.
Antineumocócica (polisacárida y conjugada)Actualmente las vacunas antineumocócicas obtenidas a partir de antígenos polisacáridos capsulares conjugados con determinadas proteínas están reemplazando a aquellas únicamente constituidas por polisacáridos capsulares. Las vacunas conjugadas son más inmunógenas, ya que inducen respuesta celular y deparan protección prolongada.
La vacuna antineumocócica 23-valente es una vacuna polisacárida, de la cual no se han reportado consecuencias adversas en recién nacidos cuyas madres la habían recibido durante la gestación. En estudios recientes ha demostrado ser segura e inmunogénica, incluso en pacientes inmunodeprimidas embarazadas, proporcionando títulos aceptables de anticuerpos tanto en las vacunadas como en el recién nacido38. Se debería valorar la vacunación de la mujer embarazada en caso de pertenecer a alguno de los grupos de riesgo, como padecimiento de ciertas enfermedades crónicas, esplenectomizadas, inmunodepresión o infección por el VIH.
A nivel general las vacunas antineumocócicas conjugadas se consideran seguras en los distintos grupos de riesgo, incluyendo los inmunocomprometidos, aunque no hay información específica sobre la seguridad de PCV10 y PCV13 durante el embarazo. Los estudios experimentales en animales no muestran efectos adversos directos o indirectos de estas vacunas respecto a la toxicidad reproductiva39.
Vacuna meningocócica (polisacárida y conjugada)La vacuna polisacárida que protege contra los serotipos ACW135Y es una vacuna considerada segura e inmunogénica durante el embarazo40,41. En caso de alto riesgo de exposición se debe vacunar a la mujer embarazada independientemente del trimestre de gestación, considerándose las principales indicaciones: situación de epidemia, esplenectomía y deficiencias de componentes del complemento42.
Se dispone de menos información de seguridad en relación con las vacunas conjugadas, de notables ventajas respecto a las polisacáridas. Se debe considerar su administración en caso de alto riesgo de infección. No obstante, según la OMS, con la excepción de posibles reacciones alérgicas graves de hipersensibilidad a alguno de los componentes de la vacuna, no existen contraindicaciones para su uso, incluyendo el embarazo, de forma que ambas vacunas (la de polisacáridos y la conjugada) son eficaces y seguras durante la gestación43. Posteriormente se expondrán las indicaciones en caso de viaje a zonas endémicas.
Vacunas a considerar en el posparto inmediato (o previamente a la gestación)Idealmente todas las mujeres en edad fértil deberían estar ya protegidas frente a los virus teratogénicos de la rubéola y varicela.
Triple víricaLa vacuna triple vírica está contraindicada en mujeres embarazadas por los riesgos teóricos de las vacunas vivas previamente descritos. Se debe recomendar que las mujeres que deseen quedarse embarazadas se vacunen por lo menos un mes antes de la concepción, para minimizar cualquier potencial riesgo. En el caso de que por desconocimiento de la gestación se hubiera recibido alguna dosis, no sería razón para interrumpir el embarazo.
La rubéola es una enfermedad febril exantemática que es benigna en los niños, aunque en el caso de que la infección se produzca durante la primera mitad de la gestación, y especialmente durante el primer trimestre, puede ocasionar el síndrome de la rubéola congénita. La infección de la rubéola en la embarazada sigue siendo una realidad en Europa. En España un estudio realizado en mujeres embarazadas inmigrantes versus españolas mostró que más del 95% de las autóctonas presentaban anticuerpos frente a rubéola, siendo este porcentaje inferior en las extranjeras, de apenas un 90% en algunos grupos44. Por ello se debe informar a la población en general y a estos colectivos en particular sobre la importancia de la vacunación contra la rubéola.
Varias publicaciones señalan la necesidad de realizar un cribado serológico frente a rubéola en las mujeres embarazadas4,45 para proceder a una vacunación de las mujeres susceptibles en el posparto inmediato4. De esta manera se protegerían a sí mismas y para futuras gestaciones. Se debe incidir especialmente en aquellas que no hayan sido vacunadas en la infancia (mujeres nacidas en España sin antecedentes fiables de vacunación, y mujeres que procedan de países con programas de vacunación sistemática deficitarios que no certifiquen la vacunación) para evitar daños en el feto en una futura gestación.
No hay evidencia que demuestre que el padecimiento de sarampión durante el embarazo aumente el riesgo de malformaciones congénitas, aunque la enfermedad suele ser más grave en la paciente embarazada y hay mayor riesgo de aborto y prematuridad46.
La parotiditis en la mujer gestante no se ha asociado con anomalías fetales ni con prematuridad en el recién nacido, aunque sí se ha relacionado con mayor riesgo de aborto si la infección ocurre en el primer trimestre47.
VaricelaLa vacuna de la varicela, por idénticos motivos que la triple vírica, está contraindicada durante la gestación. La recomendación de evitar el embarazo hasta pasado un mes de la vacunación también se hace extensible a esta vacuna.
La varicela en las mujeres embarazadas puede ser considerada como una enfermedad grave por 2 razones: en primer lugar, porque una mujer gestante que se infecte por el virus presenta más riesgo de encefalitis y neumonía, y en segundo lugar porque el virus varicela-zóster se puede transmitir al feto produciendo el síndrome de la varicela congénita (con graves anomalías físicas asociadas) en 1 de cada 100 recién nacidos de una madre infectada durante la gestación48,49. Si la infección se produce al final de la gestación, con manifestaciones clínicas maternas entre 5 días antes y 2 días después del parto, un 17-31% de los recién nacidos sufrirá varicela generalizada y casi una tercera parte puede morir a causa de la infección50. Por ello, ante la exposición de la gestante susceptible a un caso de varicela se debe administrar inmunoglobulina humana hiperinmune, o en su defecto inmunoglobulina humana polivalente. Por otra parte, igual que en la rubéola, en el caso de mujeres susceptibles a varicela se debería proceder a su vacunación en el posparto inmediato.
Virus papiloma humanoLa vacuna del virus del papiloma humano (HPV) es una vacuna inactivada, pero no está recomendada durante la gestación, por no haberse estudiado suficientemente su seguridad en el colectivo de embarazadas. Si alguna embarazada recibiera inadvertidamente una dosis se deben posponer las restantes hasta la finalización del embarazo y no sería necesario realizar ninguna otra intervención51.
Herpes zósterEn España no está todavía disponible esta vacuna. Se trata de una vacuna viva, contraindicada durante la gestación.
Bacilo Calmette GuerinLa vacunación del BCG contra la tuberculosis no está recomendada sistemáticamente en el territorio español. Se trata de una vacuna con bacilos atenuados, contraindicada en el embarazo52.
Gripe estacional intranasalEn España aún no está disponible esta vacuna. Se trata de una vacuna viva, contraindicada durante la gestación.
Vacunas a considerar antes de realizar un viaje durante la gestaciónVarias enfermedades prevenibles mediante la vacunación (tabla 3), poco frecuentes en España, están presentes en otros países. Una mujer embarazada con intención de realizar un viaje internacional debería consultar previamente a un centro de vacunación internacional y consejos a viajeros53.
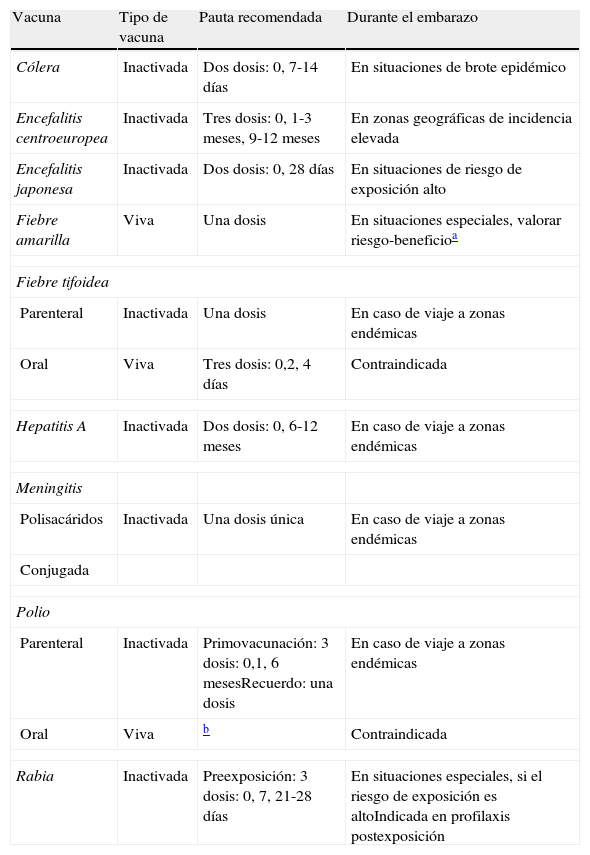
Vacunas del viajero a considerar durante el embarazo
| Vacuna | Tipo de vacuna | Pauta recomendada | Durante el embarazo |
| Cólera | Inactivada | Dos dosis: 0, 7-14 días | En situaciones de brote epidémico |
| Encefalitis centroeuropea | Inactivada | Tres dosis: 0, 1-3 meses, 9-12 meses | En zonas geográficas de incidencia elevada |
| Encefalitis japonesa | Inactivada | Dos dosis: 0, 28 días | En situaciones de riesgo de exposición alto |
| Fiebre amarilla | Viva | Una dosis | En situaciones especiales, valorar riesgo-beneficioa |
| Fiebre tifoidea | |||
| Parenteral | Inactivada | Una dosis | En caso de viaje a zonas endémicas |
| Oral | Viva | Tres dosis: 0,2, 4 días | Contraindicada |
| Hepatitis A | Inactivada | Dos dosis: 0, 6-12 meses | En caso de viaje a zonas endémicas |
| Meningitis | |||
| Polisacáridos | Inactivada | Una dosis única | En caso de viaje a zonas endémicas |
| Conjugada | |||
| Polio | |||
| Parenteral | Inactivada | Primovacunación: 3 dosis: 0,1, 6 mesesRecuerdo: una dosis | En caso de viaje a zonas endémicas |
| Oral | Viva | b | Contraindicada |
| Rabia | Inactivada | Preexposición: 3 dosis: 0, 7, 21-28 días | En situaciones especiales, si el riesgo de exposición es altoIndicada en profilaxis postexposición |
La vacuna oral disponible contra el cólera es una vacuna con cepas inactivadas, por lo tanto no está formalmente contraindicada durante el embarazo. Los estudios realizados muestran un buen perfil de seguridad cuando se ha administrado durante la gestación54. Actualmente es una vacuna poco recomendada por la mayoría de centros de atención al viajero por el bajo riesgo al que se exponen los turistas y la eficacia relativa de la vacuna. En algunos países (Suiza, Canadá) la vacuna está indicada, además, para la prevención de la diarrea del viajero.
En caso de elevado riesgo de exposición, como puede ser un viaje a un país/región en situación de brote epidémico por cólera, debería valorarse detenidamente su administración, siendo las embarazadas un grupo vulnerable para presentar enfermedad grave53.
Encefalitis centroeuropeaLas 2 vacunas disponibles contra la encefalitis centroeuropea contienen virus inactivados. Según las recomendaciones de la OMS se debería indicar la vacuna a mujeres que residen en áreas con incidencia elevada (>5 casos/100.000 habitantes año). En áreas donde la incidencia es moderada o baja se debe hacer una valoración del riesgo-beneficio, considerando si la mujer embarazada participa en actividades al aire libre u otras circunstancias que aumenten el riesgo de infección. De la misma forma se debería actuar en caso de viaje a zona endémica de una gestante procedente de un área no endémica55.
Encefalitis japonesaLa vacuna de virus vivos contra la encefalitis japonesa ha dejado de fabricarse, con lo cual no está disponible en nuestro país. El perfil de seguridad de la nueva vacuna inactivada es muy superior al de la vacuna viva56. No se dispone de datos en embarazadas sobre la vacuna de virus inactivados contra la encefalitis japonesa, por este motivo solamente debe administrarse durante la gestación cuando se considere que exista un riesgo elevado de exposición, en caso de viaje a zonas de alto riesgo57.
Fiebre amarillaLa vacuna de la fiebre amarilla contiene virus vivos. Por lo tanto es una vacuna que únicamente se debe administrar en caso de no poder evitar el viaje a alguno de los países donde la enfermedad es endémica. En estos casos se considera que los beneficios de la vacunación superan los potenciales riesgos de esta enfermedad en una mujer embarazada.
Estudios recientes realizados en embarazadas que recibieron inadvertidamente la vacuna en los primeros estadios de la gestación no han encontrado ninguna relación entre la vacuna y una mayor tasa de malformaciones fetales que en el resto de la población3,58, si bien el tamaño muestral de estos estudios podría cuestionar los resultados obtenidos.
Lo que sí sugieren los estudios realizados hasta la fecha es que la inmunogenicidad de la vacuna puede ser limitada en mujeres embarazadas, debido al cierto estado de inmunosupresión provocado por el embarazo. Por este motivo, según disponibilidad, se ha sugerido examinar la respuesta serológica posvacunal3,59.
Después de la gestación no se recomienda la vacunación en caso de lactancia materna a niños menores de 9-12 meses, por la potencial transmisión al niño del agente vacunal3.
Aunque no existen datos específicos disponibles, una mujer en edad fértil debería esperar un mínimo de 4 semanas para la concepción después de la administración de la vacuna.
Fiebre tifoideaExisten 2 vacunas contra la fiebre tifoidea: una de polisacáridos capsulares purificados (antígeno Vi) de administración parenteral y otra oral, que contiene una cepa mutante atenuada de Salmonella typhi (Ty21a).
No se dispone de estudios en mujeres embarazadas. Teóricamente la vacuna oral, que contiene una cepa atenuada, está contraindicada. Respecto a la vacuna parenteral habría que considerar de forma individualizada su administración a mujeres con posibilidad de exposición a la bacteria en zonas endémicas, o en situaciones de epidemia. A la hora de tomar una decisión conviene tener en cuenta que los últimos estudios señalan que la eficacia de la vacuna para prevenir la enfermedad en adultos es de alrededor del 60%60.
Meningitis ACYW135Tal como se ha expuesto anteriormente, los estudios realizados no han mostrado efectos adversos de las vacunas antimeningocócicas tetravalentes, de manera que en situaciones especiales es recomendable administrarla, como en el caso de viajeras a países del cinturón subsahariano en temporada de meningitis de la estación seca (diciembre-junio) o peregrinación a la Meca61.
Polio (parenteral)Respecto a la vacuna de la polio parenteral (Salk) se recomienda una dosis de recuerdo a las mujeres gestantes que potencialmente se van a exponer al virus salvaje de la poliomielitis. Hoy en día esta recomendación se debería limitar a mujeres que tengan que viajar a los países considerados endémicos: Nigeria, Afganistán, Pakistán, además de otros países con casos de la enfermedad62.
RabiaLas vacunas de la rabia disponibles en España son vacunas inactivadas, obtenidas a partir de cepas de virus rábicos propagados en cultivos celulares. Los estudios hasta la fecha no han demostrado asociación alguna entre la vacuna y malformaciones congénitas, y es también una vacuna que se debe administrar si el riesgo de exposición es alto o si se ha producido un contacto con secreciones de animales potencialmente rabiosos63.
Entendiendo que la rabia es una enfermedad letal, no existen contraindicaciones para la profilaxis postexposición. Su administración en la mujer embarazada debe considerarse después de un contacto (mordeduras, arañazos con solución de continuidad de la piel) con un animal potencialmente rabioso64. Asimismo, se debe considerar su uso preexposición en mujeres que tengan riesgo de exposición al virus en laboratorio o a animales potencialmente infectados65.
Conflicto de interesesJ.M. Bayas ha recibido honorarios profesionales por conferencias y participación en grupos de trabajo financiados por GlaxoSmithKline (GSK), Sanofi Pasteur MSD, Esteve, Novartis y Pfizer. Ha participado como investigador principal en ensayos clínicos promovidos por GSK y Sanofi Pasteur MSD.