INTRODUCCION
El cáncer de cérvix es la manifestación más importante de la infección genital por el virus del papiloma humano (VPH) y es una de las principales causas de mortalidad por cáncer entre las mujeres. Actualmente, es el segundo cáncer más frecuente entre las mujeres en todo el mundo y el primero en los países en vías de desarrollo, con una incidencia global estimada de 470.000 nuevos casos cada año y una mortalidad aproximada de 273.000 muertes anuales1,2. Más del 80% de los casos se producen en los países en vías de desarrollo. En dichos países, menos del 50% de las mujeres con cáncer de cérvix sobreviven más de 5 años, mientras que la supervivencia a los 5 años en los países desarrollados es aproximadamente del 66%. Dado que dicha neoplasia afecta a mujeres jóvenes, con un pico de edad entre los 45 y 50 años, es la principal causa de «años de vida perdidos» entre mujeres del sur de Asia, Latinoamérica y África subsahariana, lo que comporta una reducción en la esperanza de vida superior a la producida por el sida, la tuberculosis o la patología materna en Latinoamérica y en Europa3.
VPH EN LA ETIOPATOGENIA DEL CANCER DE CÉRVIX
Hace más de 100 años ya se establecieron relaciones epidemiológicas entre el cáncer de cérvix y las conductas sexuales de riesgo. Durante varias décadas se intentó relacionar sin éxito la mayoría de los agentes responsables de las enfermedades de transmisión sexual con dicha neoplasia. A principios de los ochenta se descubrió la asociación entre el VPH y el cáncer de cérvix4. En los últimos años, múltiples investigaciones clínicas, epidemiológicas, virológicas y de biología molecular han demostrado que el principal agente etiopatogénico de las lesiones precursoras y del cáncer de cuello uterino es el VPH5,6. La naturaleza causal de la asociación entre el VPH y el cáncer de cérvix se basa en: a) los resultados de múltiples estudios epidemiológicos realizados en distintas poblaciones y con diferentes diseños, que demuestran de forma coherente que las infecciones por ciertos tipos virales son el principal factor de riesgo para el desarrollo de cáncer cervical; b) la detección regular de ADN de VPH de alto riesgo en las células cancerosas (en un 99,7% en una serie internacional de cánceres de cuello uterino con una reacción en cadena de la polimerasa [PCR] de alta sensibilidad y en el 100% de los casos confirmados por una revisión histológica experta7) y en las lesiones precursoras (en más del 90%); c) la demostración de la expresión de las proteínas oncogénicas virales de los tipos de alto riesgo producidas por los genes E6 y E7 del VPH en el tejido neoplásico, pero no en el tejido sano; d) la capacidad transformadora de estos oncogenes por bloqueo efectivo de las proteínas reguladoras del ciclo celular (p53, pRb), y e) la expresión mantenida de E6 y E7 como requisito indispensable para mantener el fenotipo maligno de las células cancerosas.
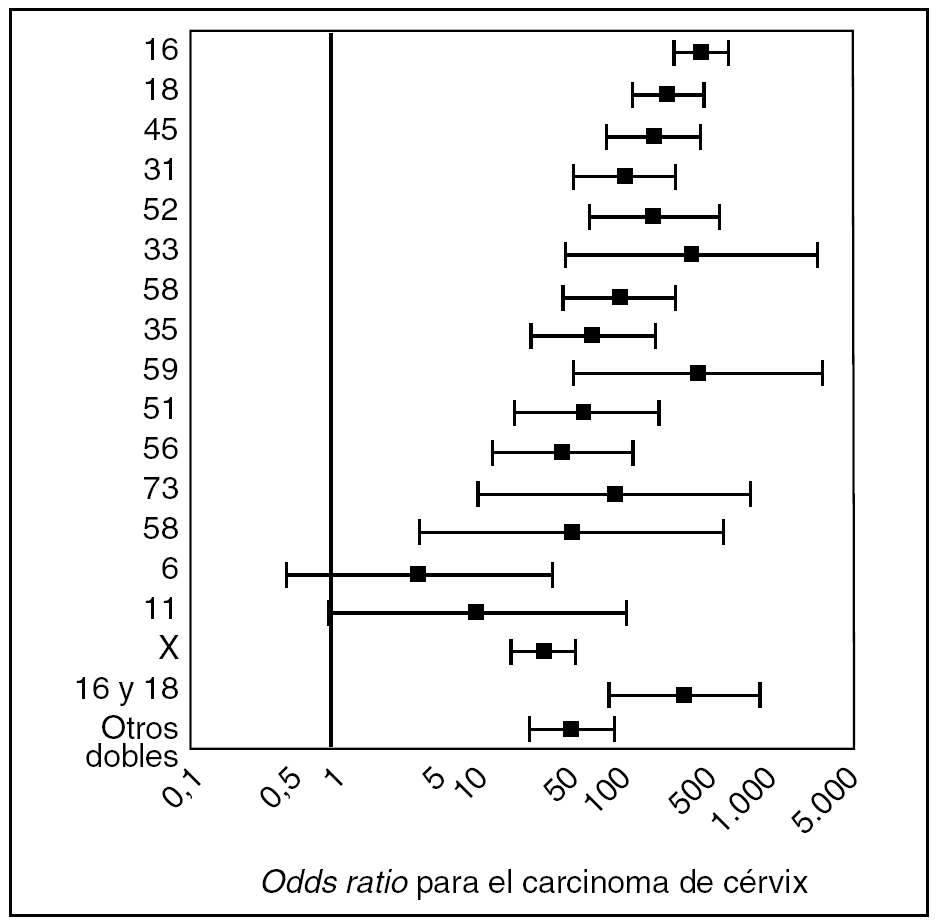
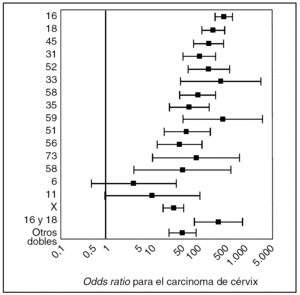
En la actualidad se han catalogado más de 120 genotipos diferentes de VPH, de los cuales aproximadamente 40 pueden infectar el tracto anogenital y otras áreas mucosas del cuerpo8. Datos procedentes de 11 estudios de casos y controles, que exploraron la asociación entre la infección por el VPH y el cáncer de cérvix, realizados en diferentes países, han identificado 15 tipos virales como de alto riesgo oncogénico (VPH-AR) (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 68, 73 y 82); 3 tipos se han clasificado como de probable alto riesgo (26, 53 y 66), y 12 tipos se han catalogado como de bajo riesgo (VPH-BR) (6, 11, 40, 42, 43, 44, 54, 61, 70, 72, 81 y CP6108)9. En la figura 1 se resume el grado de asociación entre la detección de genotipos de VPH específicos y riesgo de cáncer de cérvix para los 13 tipos de VPH de alto riesgo más importantes, y los tipos de VPH de bajo riesgo 6 y 11.
Figura 1. Estimaciones de riesgo para cáncer de cérvix según el genotipo de VPH (Modificado de Muñoz et al9.)
Los VPH de alto riesgo más comunes son el 16, detectable en aproximadamente el 60% de todos los cánceres y el 18, presente en cerca del 10%8-13, aunque la distribución de frecuencias para tipos diferentes del 16 varía notablemente en función de las poblaciones analizadas. El exceso de riesgo (odds ratio) de cáncer de cérvix asociado con VPH-AR estimado en estudios de casos y controles es superior a 15011. Esto significa que el riesgo de desarrollar cáncer de cuello de útero en una mujer infectada por VPH-AR es 150, superior al de las mujeres no infectadas por VPH-AR.
La infección por el VPH-BR puede causar lesiones subclínicas o clínicas, como los condilomas o verrugas genitales, que pueden afectar a todo el tracto genital (vulva, vagina y cérvix), al área anorrectal, la uretra y el tracto aéreo superior (papilomatosis laringea). Los tipos virales 6 y 11 son responsables del 90% de todas las verrugas anogenitales. Las infecciones clínicas por el VPH-BR causan una considerable morbilidad y unos elevados costes sanitarios derivados de su diagnóstico, seguimiento y tratamiento14.
La infección cervical por algún tipo de VPH es relativamente común en las mujeres sexualmente activas (se estima que afecta al 80% de las mujeres durante su vida)15, por lo que constituye la infección de transmisión sexual más frecuente en todo el mundo16-18. Sin embargo, la mayoría de estas infecciones son subclínicas y transitorias, y en el 70-90% de las mujeres infectadas se produce un aclaramiento espontáneo en los 12-30 meses siguientes19,20.
Están descritos factores de riesgo para la adquisición del VPH de la mujer (edad al primer coito, alto número de compañeros sexuales) y/o los asociados con su pareja sexual (pareja con conducta de alto riesgo, incluido un elevado número de parejas sexuales y frecuentes contactos con mujeres que ejercen la prostitución). La circuncisión y el uso del preservativo pueden reducir el riesgo de transmisión21. La mayoría de dichas infecciones se produce por tipos de alto riesgo oncogénico y son asintomáticas y transitorias. La historia natural de la infección por el VPH muestra que la mayoría de las mujeres jóvenes con contagio tras el inicio de las relaciones sexuales experimenta una resolución espontánea, con aclaramiento total del virus en el transcurso de 24 meses. Únicamente los casos con persistencia del VPH pueden iniciar una transformación en el epitelio cervical (etapa preinvasiva, caracterizada por la presencia de lesiones intraepiteliales) que, con el transcurso de los años, puede desembocar en un carcinoma invasivo. Se conocen factores asociados al riesgo de persistencia y/o progresión: utilización de anticonceptivos orales durante varios años, tabaquismo y alta paridad22. La carga viral por célula podría ser también un factor determinante, así como la coexistencia de otras enfermedades de transmisión sexual, como Chlamydia trachomatis, herpes simple 2 y, en especial, la coinfección por el virus de la inmunodeficiencia humana (VIH)22.
En definitiva, puede afirmarse que el cáncer de cuello uterino es una complicación muy poco habitual de una infección viral muy frecuente y no resuelta que se transmite por vía sexual.
BASES MOLECULARES DE LA TRANSFORMACION NEOPLASICA INDUCIDA POR EL VPH
Los VPH son virus epiteliotrópicos que infectan las células basales del epitelio y aprovechan su capacidad de proliferación para replicarse. Tras la infección, pueden permanecer en forma episomal, en estado latente, o bien replicarse expresando sus genes de forma secuencial; en primer lugar, los genes tempranos (E1-E8) en las capas basales y, posteriormente, en capas superficiales del epitelio diferenciado, expresan sus proteínas tardías (L1 y L2), que formarán la cápside y permitirán el ensamblaje de las nuevas partículas virales23. En determinadas circunstancias y tras un período de persistencia de la infección, generalmente largo, el ADN viral que se encuentra en forma episomal se integra en el genoma celular e interfiere con las proteínas que regulan el ciclo celular (p53 y Rb), lo que provoca alteraciones en el crecimiento normal y la diferenciación del epitelio que, asociadas a errores genéticos (clastogénesis), pueden conducir a la transformación tumoral24,25.
Las células epiteliales infectadas activan mecanismos de defensa celular, uno de los cuales consiste en la revisión de la secuencia de ADN antes de su división. Cuando la célula localiza el ADN viral, intenta reparar el error y, dado que este ADN es excesivamente grande como para ser eliminado, p53 y Rb dirigen a la célula infectada a una «muerte celular programada» o apoptosis, evitando así que ésta sirva de propagadora de la infección. Los tipos de VPH oncogénicos se protegen de este mecanismo celular y son capaces de sintetizar unas proteínas (E6 y E7) que bloquean a p53 y Rb, con lo que evitan la muerte celular por apoptosis y permiten la replicación viral. Por ello, los genes E6 y E7 se consideran oncogenes virales.
INFECCION POR EL VPH E INMUNIDAD
Cualquier infección viral requiere la presencia de un receptor celular que permita la internalización de las partículas virales. Esta circunstancia supone la principal barrera de entrada y explica la naturaleza especie-específica, e incluso órgano-específica, de las infecciones virales. Algunos virus utilizan los complejos mayores de histocompatibilidad (MHC I y II) como receptor para su internalización, y otros utilizan moléculas de superficie celular (CD4, receptores de quimocinas, factores de crecimiento, β2-microglobulina, etc.)26. Los VPH no tienen receptor celular específico, sino una molécula de superficie muy conservada con funciones celulares vitales, lo que imposibilitaría su utilización como diana para el bloqueo de la infección. A diferencia de lo que ocurre con otros virus, no parece que los receptores de superficie estén implicados en la especificidad de tejido y especie ni en el tropismo de los VPH27.
Tanto el reconocimiento de la infección por la célula huésped como el tropismo específico de cada subtipo viral van a determinar los efectos citopáticos en los tejidos específicos28; de este modo, se distinguen infecciones latentes que no muestran sus efectos durante largos períodos de tiempo, e infecciones activas con efectos citopáticos prácticamente inmediatos. En función de estos parámetros se puede calificar el nivel antigénico o inmunogénico de cada virus, lo cual es fundamental para la elaboración de vacunas profilácticas o terapéuticas.
INMUNIDAD CELULAR E INMUNIDAD HUMORAL FRENTE A VPH
La inmunidad celular está representada principalmente por las células T, que actúan en el tejido local mediante íntimo contacto célula a célula. La respuesta humoral está mediada por las células B bajo la inducción de las células T-helper, mediante la producción de anticuerpos. Las células T reconocen antígenos asociados a moléculas de la superficie celular (HLA), mientras que los anticuerpos lo hacen tanto frente a antígenos de superficie como frente a antígenos solubles, en este último caso con mayor especificidad. Los receptores de las células T reconocen secuencias específicas de pequeños péptidos presentados por el MHC, mientras que los anticuerpos reconocen estructuras esféricas, tridimensionales, con una conformación determinada. Si bien la presentación adecuada del antígeno es esencial para la inducción de la respuesta inmunológica, la cinética de la unión antígeno-anticuerpo, su cantidad y distribución serán los factores que determinen el grado de respuesta inmunológica.
En términos generales, tras la primera infección de las células del epitelio cervical por el VPH, se desencadena una respuesta inespecífica acompañada de un proceso inflamatorio, quimioatracción de neutrófilos, activación de macrófagos, intervención de células natural killer (NK), de anticuerpos naturales, e incluso del sistema del complemento, que formarán una primera barrera defensiva de inmunidad inespecífica. La prolongación de la respuesta en el tiempo y la protección frente a futuras infecciones requiere mecanismos de inmunidad específica.
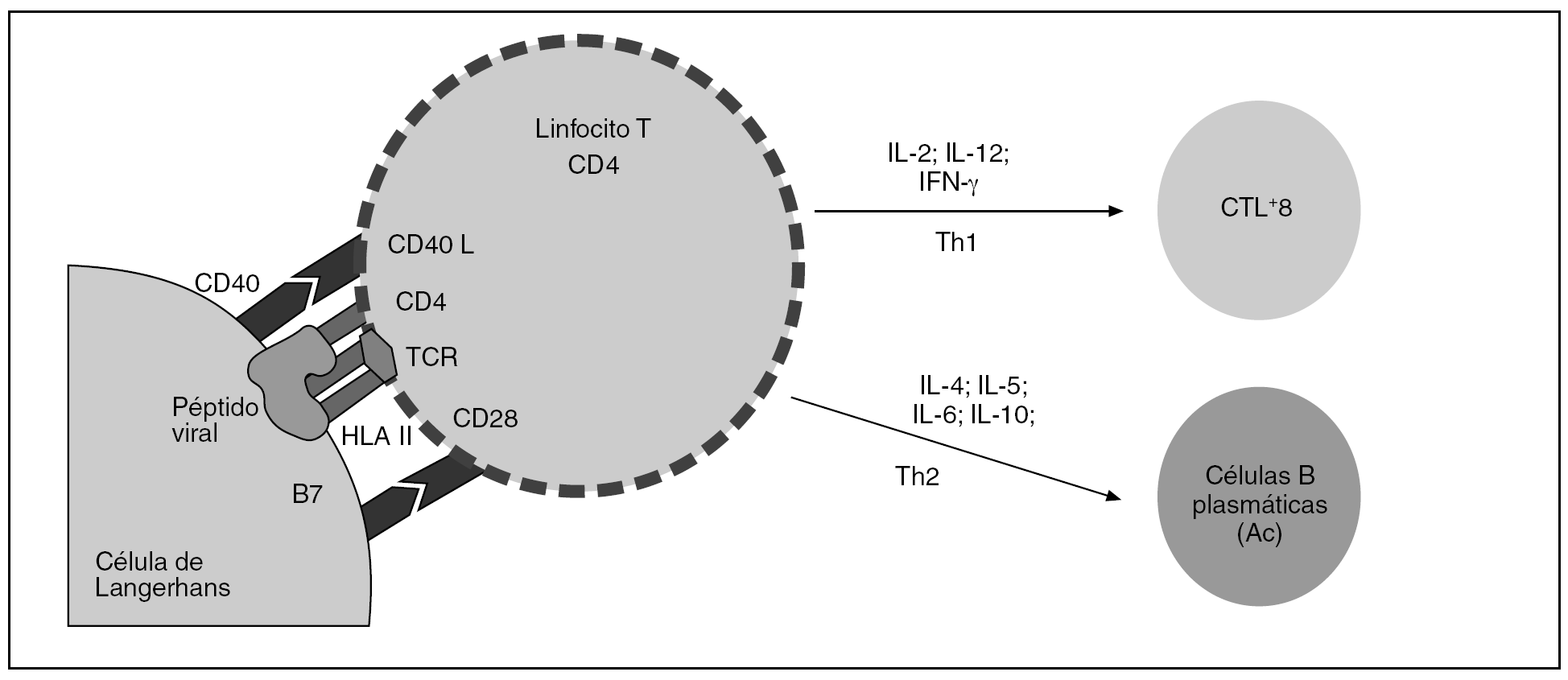
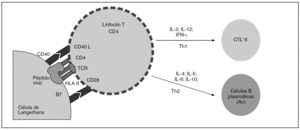
En el epitelio cervical hay células específicas con capacidad de actuar como presentadoras de antígenos y, aunque algunos queratinocitos desarrollan esta capacidad, son las células reticulares de Langerhans las verdaderas especialistas en la presentación antigénica. Estas células fagocitan las partículas virales para digerirlas en endosomas y comenzar un proceso de activación, que incluye la presentación en superficie del antígeno junto con HLA de las células presentadoras. Estas células activadas serán reconocidas por los linfocitos T CD4+, en el caso de que se reconozcan todas y cada una de las moléculas en su entorno adecuado y, tras ello, evolucionarán hacia linfocitos helper (Th) en el contexto local de expresión de ciertas interleucinas (IL). Dependiendo del tipo de IL, se promoverá la diferenciación hacia una vía Th1 que inducirá la activación y la proliferación de los linfocitos T CD8+ citotóxicos de la inmunidad específica (CTL+8), o bien se promoverá la vía Th2, que inducirá la activación y la expansión de linfocitos B, los cuales evolucionarán diferenciándose hacia células plasmáticas productoras de anticuerpos frente a las proteínas virales, base de la inmunidad inespecífica que podríamos identificar como profiláctica (fig. 2).
Figura 2.La activación de los linfocitos T CD4 requiere el reconocimiento de las moléculas de superficie que expone la célula presentadora. El péptido viral, junto con el HLA de clase II, será reconocido en el contexto del TCR y CD4, pero hace falta un mecanismo de «seguridad» que controle el proceso de activación; por ello, es necesario que otras moléculas, como CD40 y B7, presentes en la superficie de la célula presentadora, sean reconocidas por sus receptores (respectivamente, CD 40 ligando y CD28) para que la activación tenga lugar. El linfocito T CD4 activado se convertirá en linfocito T-helper de tipo 1 o de tipo 2, en función de una serie de factores tisulares locales, fundamentalmente la vía de entrada del antígeno, el mecanismo de procesamiento y la presencia de diferentes interleucinas. La vía Th1 inducirá la maduración de los linfocitos T CD8+ hacia células citotóxicas efectoras.
Los CTL+8 tienen la capacidad de actuar frente a la infección viral establecida, mientras que las células B plasmáticas producen anticuerpos que actúan frente a los antígenos virales de origen externo expuestos durante ésta y las sucesivas infecciones por el VPH.
PERSISTENCIA DE LA INFECCION VIRAL
Muchos virus son capaces de mantener infecciones a largo plazo sin efectos citopáticos aunque con producción de viriones, bien de forma crónica o bien con reactivaciones intermitentes productivas. El patrón de infección, crónica o latente, y la aparición de brotes con efectos citopáticos dependen en gran medida de las condiciones celulares del huésped. La persistencia de la infección viral requiere la evasión de la detección y la eliminación de las células infectadas por el sistema inmune. Estos procesos de evasión pueden producirse por diferentes vías: a) si el virus presenta antígenos de superficie muy variable, la síntesis de un exceso de anticuerpos, no neutralizantes, puede interferir con los que sí tienen esa capacidad de neutralización; b) depleción de la expresión de moléculas del MHC; c) disminución del número de células de Langerhans con la consiguiente reducción de la capacidad de presentación antigénica (evidenciado en condilomas), y d) disminución de la actividad de las células NK (comprobada en lesiones pretumorales y tumorales).
Hay 2 consideraciones fundamentales en el diseño de las vacunas antitumorales: la selección de antígenos y el procedimiento mediante el cual esos antígenos estimulan la respuesta inmune. Por definición, las vacunas deben ser seguras, efectivas y potentes, de modo que requieran pocas dosis de inmunización; además, deben ser estables y fáciles de manipular. Muchas de las vacunas utilizadas actualmente basan su estrategia en la utilización de virus atenuados; la incorporación de nuevas técnicas de biología molecular y los avances en el campo de los cultivos celulares ha permitido el desarrollo de nuevos tipos de vacunas en los que se aplica la técnica de selección antigénica y la fabricación de partículas quiméricas, entre otras, para lograr respuestas dirigidas.
VACUNAS PROFILACTICAS CONTRA EL VPH
Como hemos descrito previamente, la evidencia científica acumulada en los últimos 15 años permite afirmar que el cáncer de cuello uterino es el resultado final de una infección persistente y no resuelta por ciertos tipos de VPH. El hecho de que el VPH sea la causa necesaria del cáncer de cuello uterino implica que la vacunación contra los genotipos más frecuentes de VPH sea una estrategia que cabe considerar en la prevención primaria del cáncer de cérvix.
ESTUDIOS PRECLINICOS
La prevención primaria del cáncer de cérvix uterino puede llevarse a cabo mediante vacunas profilácticas que impidan la infección por el VPH y su patología asociada. Para diseñar una vacuna profiláctica, los antígenos diana deben ser los de la cápside, ya que éstos son los únicos accesibles a la respuesta clásica de anticuerpos neutralizantes (respuesta humoral). Inicialmente, los trabajos de Christensen y Kreider demostraron que los anticuerpos contra las proteínas de la cápside L1 neutralizaban el VPH11 en ratones. Unos años más tarde, Zhou et al29 demostraron que las proteínas de la cápside del VPH16, cuando se expresaban en un sistema recombinante, formaban partículas similares a virus o seudovirales denominadas VLP (virus like particles). Dichas partículas están desprovistas de ADN y se sintetizan mediante autoensamblaje de proteínas del antígeno mayor de la cápside L130. Las VLP se fabrican mediante ingeniería genética y son estructuralmente idénticas a los virus nativos, pero carecen de capacidad infectiva. La proteína estructural menor L2 puede ensamblarse con la L1 y formar una VLP incluso más estable. Las semejanzas antigénicas con los viriones auténticos del papiloma explican que las VLP induzcan una potente respuesta humoral con anticuerpos neutralizantes.
Los primeros estudios experimentales con vacunas VLP L1 en modelos animales (perros, vacas y conejos) demostraron la formación de anticuerpos circulantes neutralizantes, inmunogenicidad duradera y protección especie-específica. La inducción de IgG neutralizantes depende de los epítopos conformacionales sobre VLP intactos, ya que la utilización de proteínas L1 desnaturalizadas son incapaces de generar dichos anticuerpos.
ENSAYOS CLINICOS
La primera generación de vacunas VLP evaluadas en ensayos clínicos utilizaron sistemas de producción basados en levaduras. Estudios iniciales (en fase I) realizados en voluntarios sanos demostraron que la inyección de 20-100 µg de L1 VLP en 3 dosis durante 6 meses generaba títulos altos de anticuerpos anti-L1. Además de la seguridad de la vacuna, se evidenció un elevado poder inmunógeno con una respuesta de anticuerpos de la subclase IgG1 varias veces superior a la conseguida por la infección natural.
Hay 2 grandes líneas que investigan muy activamente el desarrollo de vacunas VLP L1 profilácticas: a) vacuna bivalente VPH16/18 (Cervarix®) formulada con un nuevo adyuvante, el 3-deacylated- monophosphoryl lipid A (MLP), que es un derivado detoxificado de un lipopolisacárido de la Salmonella minnesota, desarrollada por GlaxoSmithKline, y b) vacuna tetravalente HPV6/11/16/18 (Gardasil®) formulada con aluminio, desarrollada por MercK & Co.
Para valorar la eficacia de la vacuna, dado que el cáncer de cérvix puede prevenirse a través de la detección precoz y el tratamiento de las lesiones precursoras, tomar como objetivo final end point el desarrollo de cáncer es éticamente impracticable. Por tanto, se han buscado otros objetivos alternativos que representen aspectos relevantes de la enfermedad y permitan valorar igualmente la eficacia de la vacuna. Hay 2 potenciales objetivos virológicos: la incidencia de infección por el VPH y la infección persistente definida como la detección del mismo tipo viral entre 2 visitas espaciadas al menos 6 meses, puesto que la persistencia de la infección se considera el más poderoso predictor del ulterior desarrollo de CIN 2-3 y cáncer31-33. Los objetivos clínicos son la detección de lesiones precursoras de cáncer cervical. Dado que los verdaderos precursores del cáncer de cuello uterino son la CIN 2-3, éste debe ser el principal objetivo clínico, puesto que si la vacuna impide la aparición de dichas lesiones, se puede asumir que también previene el desarrollo de cáncer.
Hoy día se dispone de resultados de 3 ensayos clínicos controlados y aleatorizados sobre la eficacia de dicha vacuna.
El primer estudio aleatorizado en fase II y controlado por placebo, promovido por Merck Research Laboratories (Koutsky et al, 2002), ensayó una vacuna monovalente que contenía VLP del VPH-16 con adyuvante basado en aluminio, administrando 3 dosis intramusculares de 40 µg a los 0, 2 y 6 meses a mujeres de Estados Unidos de 16-23 años de edad con menos de 5 parejas previas, VPH seronegativas y ADN-VPH negativas en el momento de la inclusión34. Se evaluaron 768 mujeres en el grupo de la vacuna y 765 en el grupo placebo. La eficacia de la vacuna fue del 91% en la prevención de las infecciones incidentes o transitorias. Sin embargo, se consiguió una eficacia del 100%, tanto en la infección cervical persistente (0 en el grupo vacuna frente a 41 en el grupo placebo) como en el desarrollo de alteraciones citológicas (0 en el grupo vacuna frente a 9 en el grupo placebo). La tasa de seroconversión fue del 100%, con títulos específicos 60 veces mayores que la infección natural y sin efectos adversos. Este grupo ha comunicado datos de seguimiento a 4 años35. En el grupo vacunado han aparecido 7 infecciones persistentes frente a 116 en el de control; en el vacunado, ningún CIN II/III, y en el de control 12.
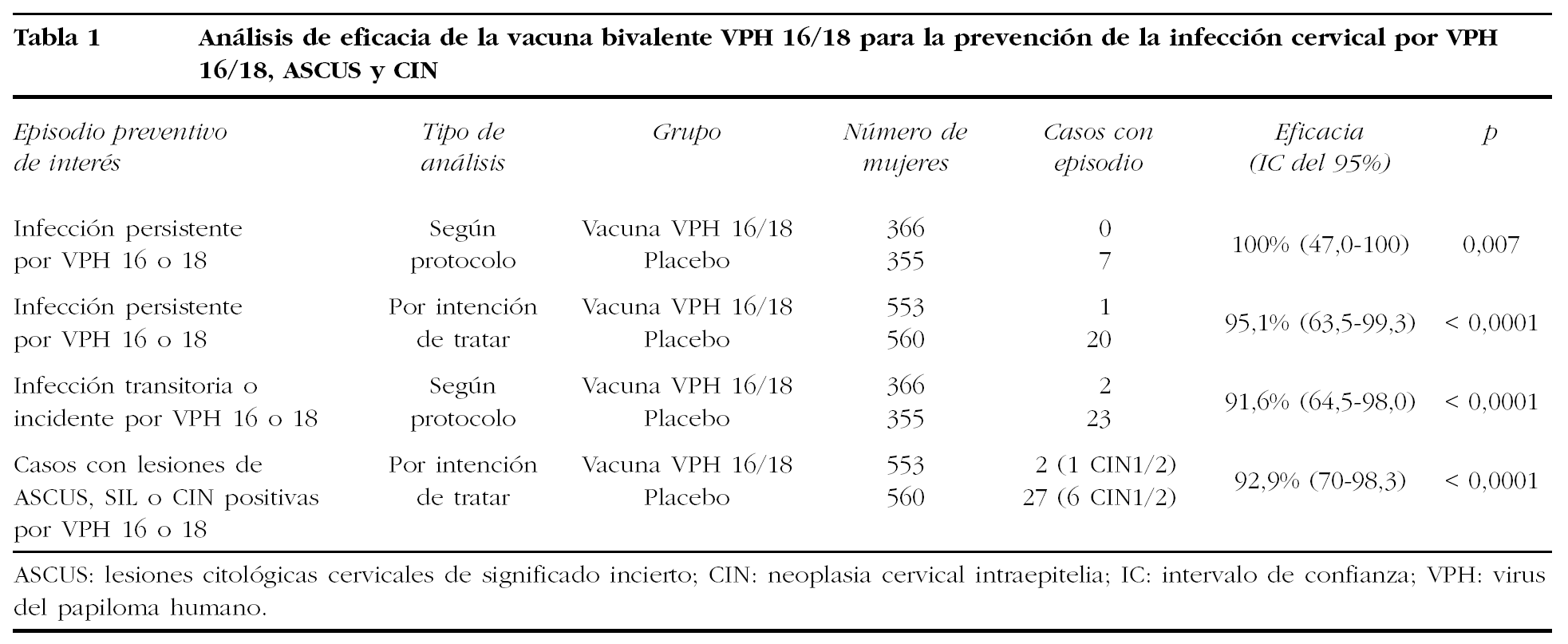
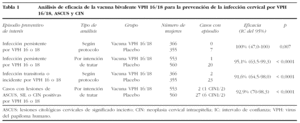
El segundo estudio que se llevó a cabo en Estados Unidos, Canadá y Brasil, promovido por GlaxoSmithKline (Harper et al, 2004) en fase IIb multicéntrico, utilizó una vacuna bivalente (VLP de VPH 16,18) expresada en baculovirus más adyuvante basado en aluminio y MPL, administrando 3 dosis intramusculares de 40 µg (20 µg de VPH 16 y 20 µg de VPH 18) a los 0, 1 y 6 meses36. Se incluyó a 1.113 mujeres entre 15 y 25 años de edad, con no más de 6 parejas previas, con serologías negativas para VPH 16 y 18 y ADN del VPH negativo para 14 tipos de alto riesgo. El tiempo de seguimiento fue de 27 meses. En la tabla 1 se resume el número de infecciones y/o lesiones cervicales en cada grupo de aleatorización y las distintas estimaciones de la eficacia de la vacuna, según un análisis por protocolo o por intención de tratar. En el análisis según el protocolo, la eficacia de la vacuna frente a la infección transitoria o persistente por VPH 16 o 18 fue del 91,6%, y frente a la infección persistente por VPH 16 o 18 del 100%. La eficacia frente a las lesiones preinvasivas de cérvix (≥ ASCUS) positivas por VPH 16 o 18 fue del 92,9% en el análisis por intención de tratar. La tasa de seroconversión fue del 100%, con títulos específicos 50 veces mayores para el VPH 16, y 80 veces mayores para el VPH 18 que los producidos en la infección natural. Tampoco se observaron efectos adversos significativos.
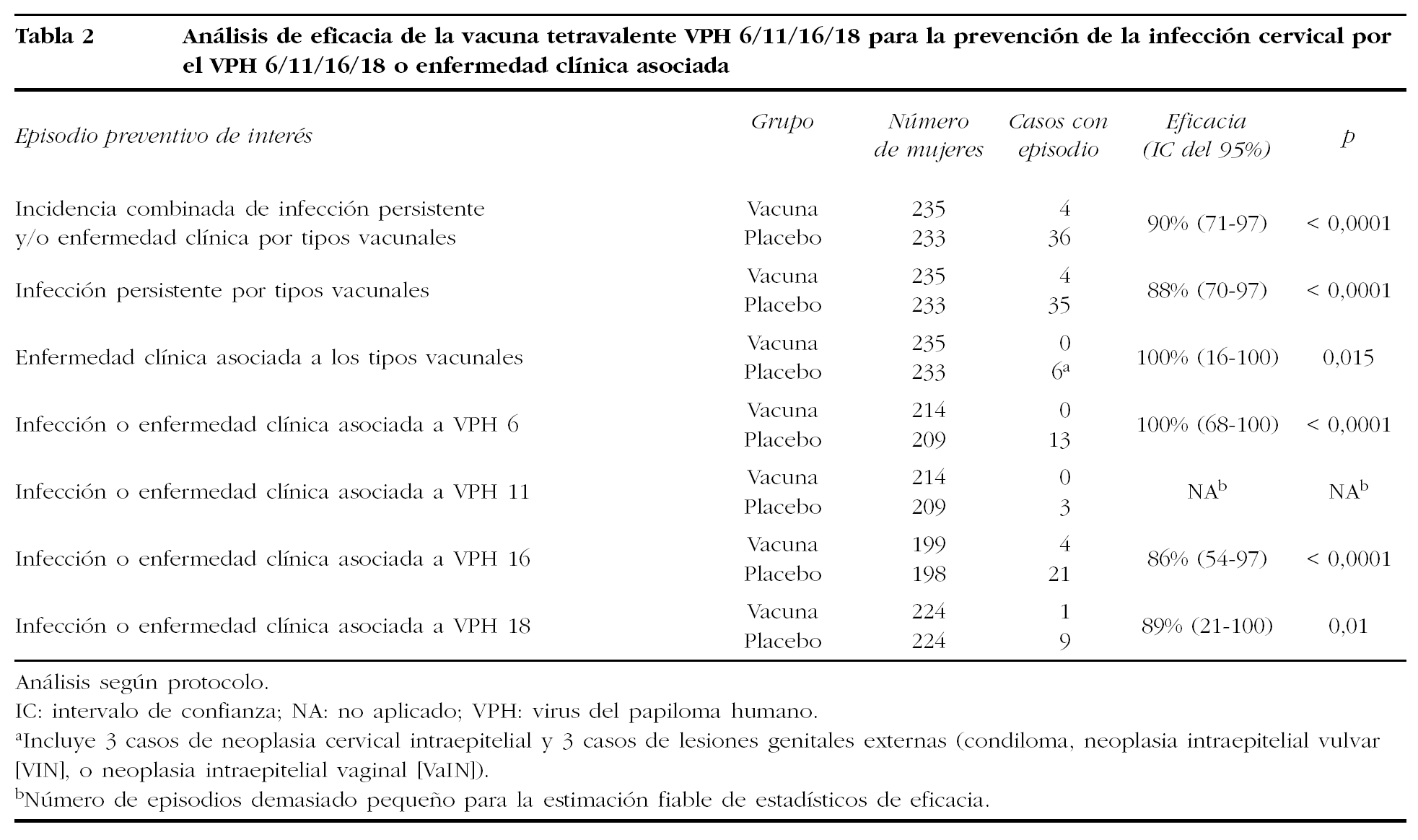
Más recientemente (Villa et al, 2005), se han publicado los resultados de un estudio en fase II, aleatorizado y multicéntrico, sobre la eficacia de una vacuna profiláctica tetravalente (VLP de VPH 16, 18, 6, 11) expresada en levadura (Saccharomyces cerevisae) más adyuvante basado en aluminio, promovido por Merck Research Laboratories37. Se asignó a 277 mujeres al grupo vacuna y a 275 al grupo placebo. Se administraron 3 dosis intramusculares de 40 µg (20 µg de VPH 16, 40 µg de VPH 18, 40 µg de VPH 6 y 20 µg de VPH 11) a los 0, 2 y 6 meses. Tras un seguimiento de 36 meses, los títulos de anticuerpos fueron permanentemente muy altos para los subtipos 16 y 18, por encima de los producidos por la infección natural, pero no para los relacionados con los subtipos 6 y 11, que se situaron a los mismos valores que los inducidos por la infección natural.
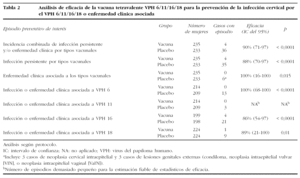
En la tabla 2 se resumen los principales resultados de los análisis de eficacia de dicha vacuna. El desenlace o resultado de interés del ensayo fue la incidencia combinada de infección por VPH 6, 11, 16 o 18, enfermedad cervical, o lesión genital externa. Está definición incluye: infección persistente por cualquiera de los 4 VPH incluidos en la vacuna, detección de ADN de VPH en la última visita, y detección histopatológica de neoplasia cervical intraepitelial (CIN), carcinoma de cérvix, o lesión genital externa (condiloma, neoplasia intraepitelial vulvar [VIN], o neoplasia intraepitelial vaginal [VaIN]) relacionada con cualquiera de los genotipos vacunales. Tal como muestra la tabla, la eficacia para la prevención de la incidencia combinada de infección y/o enfermedad fue del 90%, y del 100% para enfermedad asociada a los VPH incluidos en la vacuna. La protección conferida frente a la infección o la enfermedad por cada tipo específico fue del 100% para el VPH 6, del 86% para el VPH 16 y del 89% para el VPH 18. Para el VPH 11, al observarse sólo 3 episodios asociados a este genotipo (los tres en el grupo placebo), los autores consideraron que la estimación de eficacia no era estadísticamente fiable.
En conclusión, estos primeros ensayos muestran que la vacunas basadas en VLP son seguras (la principal reacción adversa es el dolor en el lugar de la inyección debida al adyuvante) y eficaces, tanto en la prevención de infecciones transitorias y persistentes como en el desarrollo de lesiones citológicas asociadas a ellas.
Actualmente, están en desarrollo 3 grandes ensayos en fase III aleatorizados, controlados por placebo, multicéntricos, que incluirán más de 50.000 mujeres de todo el mundo con una gran diversidad étnica y socioeconómica, y cuyos resultados definitivos estarán disponibles entre 2007 y 200938. Los 2 primeros estudios interacionales corresponden a la vacuna bivalente y tetravalente de GlaxoSmithKline y MercK & Co., respectivamente. El tercer gran estudio lo lleva a cabo el National Cancer Institut (NCI) en Costa Rica, con la vacuna bivalente VPH 16 y 18 de GlaxoSmithKline. El profundo conocimiento previo sobre la prevalencia del VPH en esta región permitirá conocer el impacto de la vacuna sobre los tipos de VPH en la población. Los resultados preliminares del estudio Merk & Co. a los 18 meses revelan una eficacia del 100% en la prevención de CIN, VAIN, VIN y condilomas asociados a los tipos de VPH incluidos en la vacuna (Barr E, 2005; datos no publicados presentados en el Advisory Committee on Immunization Practices).
COMPOSICION DE LA VACUNA. TIPO-ESPECIFICIDAD
La actual generación de vacunas basadas en las VLP de L1 de VPH sólo contiene 2 tipos de VPH-AR, el 16 y el 18. Si se asume que estos tipos virales son agentes causales del cáncer de cérvix en el 50-60 y el 10-12%, respectivamente, la vacunación del 100% de la población diana podría prevenir como máximo el 70% de dichos cánceres. Los anticuerpos neutralizantes inducidos por la vacuna VLP L1 parecen ser tipo-específicos. Algunos tipos con similitudes filogenéticas y antigénicas pueden presentar protección cruzada (p. ej., el VPH 6 y 11, el VPH 31 y 33, y el VPH 18 y 45). Aun así, posiblemente sería necesaria la incorporación de más tipos en la vacuna (p. ej., 16, 18, 31, 45 y 59) para sobrepasar una protección del 80%. Para una protección superior al 90%, posiblemente sería necesaria una vacuna polivalente que incorporase otros 6 tipos más. Los datos epidemiológicos sugieren que la transmisión de diferentes tipos de VPH es dinámica y no independiente. Algunos estudios indican una interacción sinérgica (la infección por algunos tipos facilita la infección concurrente o subsiguiente por otros tipos), mientras otros estudios sugieren una interferencia antagónica entre tipos de VPH39-41. Actualmente, se están desarrollando modelos matemáticos para explorar cómo estas interacciones pueden aumentar o disminuir la eficacia de los programas de vacunación42.
VACUNAS PROFILACTICAS. CUESTIONES PENDIENTES
Edad de vacunación
Se asume a partir modelos animales que la vacuna sólo es efectiva si se administra antes de la exposición al virus. Anticiparse al inicio sexual implica que la población diana sean las niñas prepuberales de 9-10 años de edad38. Algunos estudios realizados en Estados Unidos demuestran que los adolescentes inician muy pronto las relaciones sexuales, en algunos casos antes de los 13 años de edad. En función de las estadísticas poblacionales de la edad media, respecto a la primera relación sexual cada país deberá decidir cuál es el rango de edad óptimo para vacunar. Además, la infección por el VPH se adquiere pronto tras el inicio de la actividad sexual, con una incidencia acumulada del 40% en los primeros 16 meses43. Por tanto, se cree que los programas vacunales idealmente deberían iniciarse alrededor de los 12 años de edad44.
Vacunación en los varones
Se desconoce en gran medida la epidemiología y la patogenia de la infección por el VPH en los varones. La mayoría de las infecciones son asintomáticas; el VPH 16 es el más frecuentemente detectado, y la prevalencia de tipos específicos de VPH y la seroprevalencia para el mismo grupo de edad es menor en el varón que en la mujer45. En definitiva, hay muy pocas enfermedades detectables asociadas al VPH en el varón, por lo que la recomendación para la vacuna requiere estudios sobre la prevención de la infección44. Dicha vacunación es necesaria si se quiere conseguir la inmunización de toda la población (herd immunity). Hay dificultades respecto a la valoración de la eficacia vacunal para el VPH 16 y 18, dada la dificultad en la obtención de muestras de la extensa área cutánea anogenital, tanto para demostrar la presencia o la ausencia del virus como las lesiones derivadas. Sí parece factible valorar la incidencia de verrugas genitales para el VPH 6/1138. Los modelos teóricos de cálculo de rendimientos concluyen que si se vacunase al 80% de los varones y mujeres, únicamente se elevaría un 10% la eficacia de la cobertura de la población frente a la vacunación del 80% de las mujeres, por lo que supondría una baja eficiencia. Aunque la mayoría de los estudios sobre vacunas profilácticas se ha realizado en mujeres, se han realizado 3 estudios en varones de 10-15 años que evidencian niveles de seguridad, tolerancia e inmunogenicidad similares46-48. En los próximos 2 años estarán disponibles los resultados de los ensayos clínicos en fase III en varones y adolescentes, actualmente en desarrollo.
Vacunación en la «población de riesgo»
Sabemos que la gran mayoría de infecciones por el VPH se diagnostican en personas sin conductas apreciables de riesgo o con un riesgo medio. La protección de estas personas sería muy eficaz, ya que interrumpiría la cadena de transmisión. Una posible opción sería vacunar a la población masculina homosexual que presenta en el momento actual tasas relativamente altas de cáncer anal vinculado al VPH, que podría beneficiarse mucho del efecto preventivo de la vacuna.
Impacto en las políticas de cribado
En los países con cribados activos es probable que el impacto de la vacunación sobre la incidencia del cáncer de cérvix no sea muy alto. Es previsible que este impacto sea particularmente importante sobre las tasas de CIN II/III, quizá del orden del 50%. Además, el número de citologías atípicas se espera que se reduzca de forma muy apreciable (70%), con lo que los gastos derivados de su valoración y seguimiento deberían disminuir de forma sustancial. El cribado tendrá que mantenerse, ya que se deberá proteger a las mujeres contra los subtipos no incluidos en la vacuna. Hay una cierta preocupación acerca de que la vacuna pueda tener un efecto negativo sobre el cribado, al provocar una falsa seguridad en la mujer vacunada que puede pensar erróneamente que no necesita someterse a más controles49. Modelos de análisis matemáticos aplicados a esta cuestión prevén que en las poblaciones vacunadas se podría postergar el inicio del cribado y alargar los intervalos entre controles. Parece evidente que la recomendación en estas poblaciones incluiría un cribado cada 5 años, iniciado a los 30 años de edad como estrategia más eficiente. Iniciar antes el cribado y acortar los intervalos mejoraría muy poco la eficacia y multiplicaría considerablemente los gastos.
Duración de la protección. Dosis de recuerdo
Los estudios en fase II demuestran la potencia de la seroconversión inducida por la vacuna, con un pico de anticuerpos tras la vacunación que posteriormente desciende, pero persiste estable tras 48 meses35. Los modelos animales son esperanzadores ya que muestran una protección persistente a pesar de los bajos valores de anticuerpos. Si las vacunas se administran a niños o preadolescentes, desconocemos si los niveles de protección se mantendrán durante varias décadas o se necesitarán revacunaciones. El análisis cuidadoso de los datos que surjan de la continuidad en el seguimiento ayudará a despejar esta cuestión.
Protección cruzada
Se ha informado de la existencia de indicios de protección cruzada en la vacuna bivalente 16/18 contra otros subtipos de estructura capsular proteica muy similar31,32,45. La causa sugerida de esta inmunidad cruzada sería la respuesta inmune extra inducida por el adyuvante utilizado en esta vacuna. Se desconoce el beneficio adicional que este fenómeno representaría en la práctica clínica.
Efecto de sustitución
¿Cómo se comportarán los subtipos de riesgo actualmente muy poco prevalentes al provocar la vacuna protección frente a los subtipos ahora más prevalentes? ¿Los sustituirán? Y lo contrario: ya que se ha informado que mujeres positivas al VPH 16/18 tienen 5-7 veces mayor riesgo de adquirir una subsiguiente infección por el VPH 57 que las no infectadas, ¿evitar el contagio por los subtipos vacunados podría disminuir el riesgo de contagio por otros subtipos?
Diferencias en la composición de la vacuna según la población diana
Hay diferencias notables en la distribución de tipos de VPH asociados con el cáncer de cérvix en diferentes poblaciones50, especialmente en los tipos menos frecuentes, pues los VPH 16 y 18 siguen siendo los 2 genotipos de VPH-AR más frecuentemente detectados en los cánceres de cérvix de todas las regiones mundiales de las que se dispone de información. Actualmente, no se puede responder si esta variabilidad geográfica de los tipos menos comunes requerirá la confección de distintas vacunas que contengan diferentes cócteles de VLP de tipos de VPH para cada población específica.
Aceptación de la vacuna
La aceptación por parte de los adolescentes y los padres de una vacuna contra una enfermedad de transmisión sexual (ETS), y el adecuado soporte y la recomendación sanitaria son puntos clave en el éxito la vacuna para el VPH. Estudios recientes demuestran que mientras algunos padres consideran aceptable dicha vacuna, otros creen que su hijos no presentan un verdadero riesgo de sufrir una ETS, o expresan su preocupación de que la vacunación pueda favorecer la práctica de comportamientos sexuales de riesgo51-53. En una encuesta reciente, las madres de niños de entre 8 y 14 años de edad manifestaban una buena disposición para vacunar a sus hijas (67%) o hijos (66%). Las que rechazaban la vacuna, lo justificaban por el riesgo de efectos adversos desconocidos, la ausencia de actividad sexual en aquel momento, y por la falta de beneficio directo en los varores54. En otra encuesta realizada a los padres respecto a la vacunación de niños de entre 10 y 15 años de edad, la aceptación pasó del 55 al 75% tras leer una hoja informativa55. Por tanto, es esencial una correcta información sobre la enfermedad y la vacuna por parte de los profesionales sanitarios si se desea obtener una amplia participación en los programas de vacunación56.
Vacunación en países en vías de desarrollo
La vacunación a gran escala en estos países, donde el cáncer de cérvix provoca la mayor mortalidad, supone grandes dificultades. Las primeras vacunas en comercializarse requerirán múltiples dosis y un adecuado mantenimiento de la cadena de frío, aspectos difíciles de conseguir en dichos países. Alcanzar la población diana, niños o adolescentes jóvenes, en países donde apenas se dispone de recursos e infraestructura sanitaria, puede suponer otra limitación, teniendo en cuenta, además, que el coste inicial puede ser prohibitivo para dicha población57. Incluso sobreponiéndonos a las dificultades logísticas, las diferencias culturales respecto a la salud o estatus de las mujeres en las diferentes comunidades pueden ayudar o impedir la implementación de los programas vacunales. En definitiva, las mayores dificultades en los países en vías de desarrollo probablemente estén fuera de la esfera de la ciencia y la medicina, y requieran una muy amplia colaboración interdisciplinaria44.
Vacunas terapéuticas contra el VPH
Las vacunas profilácticas tardarán varias décadas en mostrar su impacto, mientras tanto un elevado porcentaje de mujeres ya infectadas tendrán un riesgo de desarrollar una enfermedad benigna o maligna relacionada con el VPH. Queda, pues, justificada la investigación de vacunas terapéuticas capaces de inducir inmunidad específica mediada por células. Las posibles indicaciones para las vacunas terapéuticas son: a) postexposición; b) diagnóstico de lesión intraepitelial de bajo grado (L-SIL), y c) diagnóstico de lesión intraepitelial de alto grado (H-SIL) o cáncer invasivo.
Los datos experimentales procedentes de modelos animales (perros y conejos) hacen pensar que las vacunas que tengan como dianas los genes E1 y E2 serían adecuadas tanto para mujeres postexposición como para las afectas de L-SIL. Sin embargo, en mujeres afectas de CIN-2/3 o cáncer, la expresión continua de los oncogenes E6 y E7 es esencial para la progresión y el mantenimiento del fenotipo maligno. Vacunas experimentales E6 y E7 han demostrado inmunogenicidad y eficacia, en términos de curación, en modelos de tumores trasplantables en roedores. Sin embargo, los ensayos realizados en humanos han demostrado inmunogenicidad y seguridad, pero una eficacia muy limitada58,59.
Las vacunas terapéuticas deberían ser capaces de inducir una inmunidad específica mediada por células, capaz de prevenir el desarrollo de lesiones y eliminar las existentes o incluso los tumores malignos. Utilizan péptidos recombinados derivados de los oncogenes E6 y E7 (minigenes).
Un ensayo aleatorizado aportó en el año 2004 una evidencia preliminar de que el uso de ZYC101 promovía la resolución de CIN II/III en mujeres menores de 25 años. Posteriormente, algunos ensayos clínicos preliminares han demostrado cierta actividad terapéutica que necesitará ser ratificada.
Disponibilidad de las vacunas profilácticas
En diciembre de 2005 Merck presentó la solicitud a la Food and Drugs Administration (FDA) para obtener la licencia de la vacuna tetravalente para su administración a chicas y chicos de 9-15 años y mujeres de 16-26 años de edad. La FDA debe anunciar su decisión sobre la licencia el próximo 8 de junio de 2006. Por otra parte, GlaxoSmithKline tiene previsto presentar la solicitud para obtener la licencia de su vacuna bivalente antes de finales de 2006 y obtener de este modo su comercialización durante el próximo 2007. Aunque ninguna compañía ha revelado el precio de mercado de las 3 dosis, se estima a partir de análisis de coste-efectividad un coste aproximado de 300-500 dólares.
Fecha de recepción: 5/4/06
Aceptado para su publicación: 20/4/06
Correspondencia:
Dr. A. Torné.
Institut Clínic de Ginecologia, Obstetrícia i Neonatologia. Hospital Clínic.
Villarroel, 170. 08036 Barcelona. España.
Correo electrónico: aureli@comb.es