Los glucocorticoides son usados para distintas condiciones médicas; los efectos sistémicos son muy bien conocidos, sin embargo, los efectos neuropsiquiátricos son subestimados en la práctica clínica, asociándose al uso de dosis superiores a 40mg/día de prednisona o su equivalente.
ObjetivoPresentar el caso de una mujer de 51años con episodio psicótico asociado al uso de dexametasona y el de una mujer de 62años con episodio maníaco severo asociado al uso de prednisona.
MétodoReporte de casos.
ResultadosLa sintomatología psicótica en las pacientes es producto del uso de corticoides. Se presenta la evaluación psiquiátrica y la evolución clínica; se compara la presentación clínica y se describen las modalidades terapéuticas y preventivas.
ConclusionesLos efectos neuropsiquiátricos incluyen alteraciones del afecto, comportamentales y cognitivos. La disminución o discontinuación del medicamento puede remediar los efectos adversos; no obstante, en muchos casos se requieren antipsicóticos o estabilizadores del ánimo. Aunque no hay consenso sobre la prescripción profiláctica, es aconsejable hacer recomendaciones sobre la prevención de síntomas psiquiátricos y cognitivos en pacientes con factores de riesgo.
Glucocorticoids are used for a wide variety of medical conditions. Their systemic effects are very well known, but their neuropsychiatric effects are underestimated in clinical practice. They may appear with doses greater than 40mg/day prednisone or its equivalent.
ObjectiveTo present the cases of a 51-year-old with a psychotic episode associated with the use of dexamethasone and a 62 year-old women with a severe maniac episode associated with the use of prednisone.
MethodCase report.
ResultsSteroid use is associated with the onset of psychotic symptoms. The psychiatric assessment, clinical presentation, outcome, treatment and strategies to prevent neuropsychiatric effects are presented.
ConclusionsThe neuropsychiatric effects included mood, behavioural, and cognitive disorders. To decrease or discontinue glucocorticoids can remedy adverse effects in some cases, but in other cases antipsychotics or mood stabilizers are required. Even if there is no consensus on prophylactic prescription, it is advisable to make recommendations on the prevention of psychiatric and cognitive symptoms in patients with risk factors.
Poco después que se utilizaran los primeros glucocorticoides para el tratamiento de las diferentes enfermedades, las manifestaciones de síntomas psiquiátricos comenzaron a reportarse en la literatura. Los informes de casos han mostrado que la depresión, manía e incluso psicosis y delirium pueden desarrollarse durante el tratamiento con glucocorticoides1.
En Latinoamérica existe muy escasa literatura sobre esta entidad. En este artículo presentamos 2 casos de mujeres adultas (51 y 62años), que por la inexistencia de antecedentes psiquiátricos o factores desencadenantes y el inicio agudo del episodio psicótico hicieron sospechar la relación con una condición médica.
Caso clínico número 1Paciente de 51años, mujer, natural de Bogotá, Colombia, ama de casa, de religión católica, ingresó al servicio de urgencias por cuadro de 3 meses de evolución consistente en cervicalgia secundaria a masa intradural extramedular desde el agujero occipital hasta C3-C4 que producía marcada compresión medular, con signos de mielopatía. Antecedente de hipotiroidismo subclínico en manejo farmacológico; sin historia personal ni familiar neuropsiquiátrica.
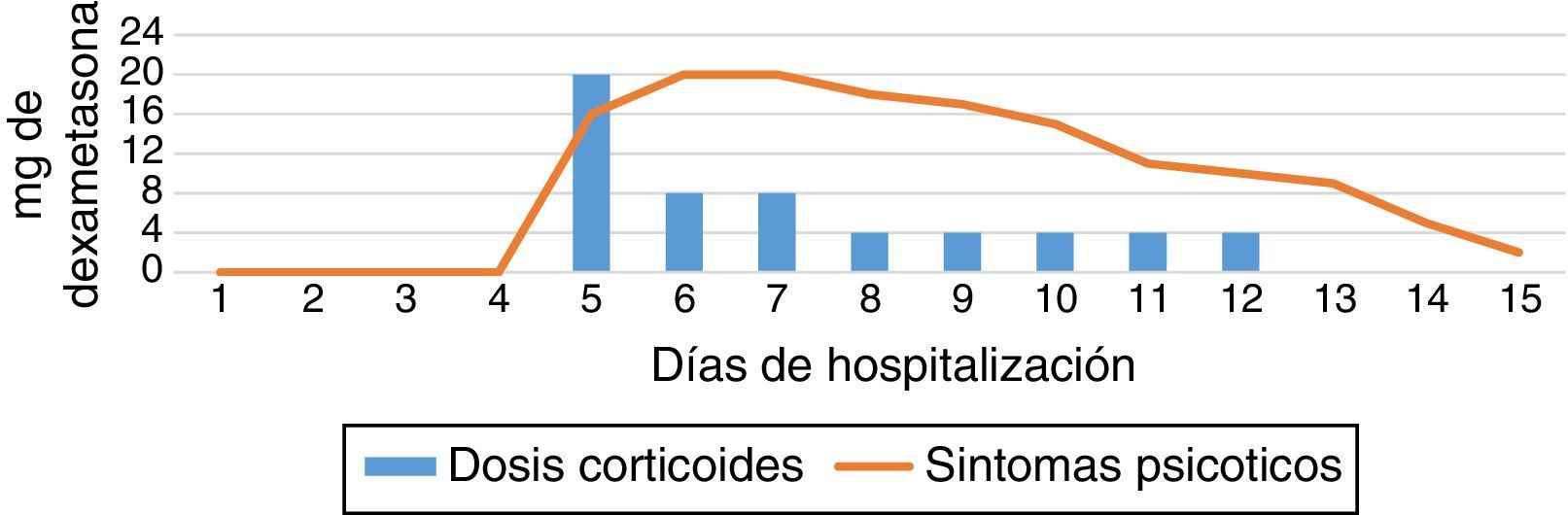
A la exploración objetiva, fuerza 4/5 con maniobras antigravitatorias positivas en miembro superior izquierdo, reflejos osteotendinosos+++/++++ generalizados, sensibilidad con hipoestesia y parestesias en miembros superiores sin un dermatoma radicular especifico, ni nivel medular. Hoffman bilateral, respuesta plantar neutral bilateral, funciones mentales superiores sin alteraciones. Fue valorada por el servicio de neurocirugía, quienes decidieron manejo quirúrgico, que se realizó sin complicaciones. Durante el procedimiento se administró 16mg de dexametasona (7:30am y 17:00pm). En el postoperatorio inmediato se instauró dexametasona 4mg cada 12h (tercera dosis a las 22:00pm en el día operatorio). En el primer día postoperatorio se encontró desorientada en espacio, orientada en tiempo y persona, logorreica con ideación de minusvalía, lenguaje incoherente y poco colaboradora, por lo que fue valorada por psiquiatría. Al examen mental, se mostró orientada en 3 esferas, con atención distráctil, lenguaje incoherente, pensamiento ilógico, incoherente, irrelevante, con ideas delirantes acerca de comunicarse con su madre muerta, alucinaciones cinestésicas, visuales y auditivas complejas «estoy en el limbo y mi mama me dice que la uci neonatal, que me apegue mucho a Dios», falsos reconocimientos, confabulaciones, cambios drásticos y súbitos en el afecto, pérdida de juicio de la realidad, introspección nula y tendencia a la inquietud motora. Se consideró episodio psicótico agudo muy probablemente a uso de corticosteroides. Se inició tratamiento con haloperidol 1mg cada 8h/día. Exámenes de control normales.
En el segundo día postoperatorio se inició la disminución de la dosis de dexametasona a 4mg cada 24h. La paciente se encontró orientada, euproséxica, continuó con discurso incoherente, asociaciones laxas, delirios de referencia, sin alucinaciones ni agitación psicomotora. Se agregó lorazepam 1mg cada 12h vía oral para inducir sueño.
Al cuarto día postoperatorio, la paciente estaba expansiva, con ideas delirantes de corte místico «Dios me mandó que les dijera cuál era su misión», sin autocrítica. Se consideró el uso del antipsicótico atípico olanzapina 5mg cada 12h; se suspendió haloperidol y lorazepam; electrocardiograma de control con trazado normal.
Al sexto día postoperatorio se mostró con ideas delirantes persistentes e irritable, se aumentó la dosis de olanzapina a 15mg al día, el cual no recibió por «sensación de ahogo y ansiedad». Al siguiente día, el servicio tratante decidió suspender los esteroides. Presentaba insomnio mixto, irritabilidad, disminución de la sintomatología psicótica sin autocrítica y renuencia a recibir medicación, por lo que se suspendió olanzapina y se continuó manejo con haloperidol por la facilidad de titularlo.
Al noveno día postoperatorio la paciente no recibió medicación; al parecer no volvió a tener síntomas psicóticos, pero en quien se observó marcada irritabilidad y renuencia a hablar respecto a sus síntomas mentales. Los familiares decidieron apoyar a la paciente en su decisión de no recibir psicofármacos. Se les dio a entender los eventuales riesgos y complicaciones de la decisión. Tres días después, dieron egreso hospitalario a la paciente con mejoría de síntomas psicóticos y buen estado posquirúrgico (fig. 1).
Caso clínico número 2Paciente de 64años, mujer, dedicada al hogar, de religión católica. Ingresó al servicio de urgencias por cuadro de una semana de evolución consistente en cambios en su comportamiento dados por irritabilidad, incremento de la actividad motora intencionada, insomnio global, agresividad verbal con su familia, labilidad afectiva, ideas extrañas de contenido místico religioso y soliloquios. Como antecedente relevante la paciente presentaba diagnóstico reciente de lupus eritematoso sistémico, por lo cual desde hacía 4 semanas venía recibiendo prednisona 50mg y prednisolona 5mg cada día. No tenía antecedes familiares o personales de enfermedad mental. Al ingreso fue valorada por psiquiatría; al examen mental se mostró orientada en 3 esferas, hipoproséxica, logorreica, taquilálica, con discurso desorganizado y habla altisonante, en actitud intrusiva, afecto marcadamente irritable, pensamiento ilógico, incoherente, con ideas de contenido místico religioso, interpretaciones delirantes de los sucesos de su alrededor, alucinaciones auditivas complejas «San Miguel me está diciendo que algo grande va a suceder, es su voz», juicio de la realidad comprometido, introspección nula, prospección incierta y tendencia a la inquietud motora. Se inició tratamiento con haloperidol 3mg/día por vía oral y se suspendió la prednisolona. Se consideró episodio maníaco severo con síntomas psicóticos, muy probablemente, secundario al uso de corticoides.
Fue estudiada descartando actividad lúpica a nivel cerebral y neuroinfección. La paciente presentó respuesta gradual de sus síntomas maníacos con el tratamiento instaurado; al tercer día se encontraba menos expansiva, con poca irritabilidad, persistían las ideas delirantes pero menos estructuradas y con menor respaldo afectivo, con buen control del insomnio. A partir del quinto día de hospitalización se comenzó la disminución gradual de prednisona. La paciente presentó temblor y rigidez en miembros superiores acompañado de marcha magnética, por lo que se consideró extrapiramidalismo secundario al uso de haloperidol. Se suspendió este último y se inició quetiapina con buena tolerancia. Al décimo día se encontraba más tranquila, sin expansividad, sin evidencia de actividad psicótica y con buen patrón de sueño; para ese momento la dosis de prednisolona estaba en 10mg. Al día 14 de hospitalización fue dada de alta con diagnóstico de manía inducida por esteroides, dejando manejo con quetiapina 37,5mg en la noche, con lo que la paciente egresó tranquila, sin ideación delirante, sin evidencia de actividad alucinatoria y sin alteraciones en su conducta motora.
DiscusiónLos glucocorticoides son fármacos antiinflamatorios, antialérgicos e inmunosupresores derivados del cortisol, hormona producida por la corteza adrenal y esencial para la adaptación al estrés físico o emocional2,3. Los glucocorticoides se convirtieron en el pilar de la terapia para una variedad de enfermedades agudas y crónicas como endocrinopatías, cáncer, enfermedades inflamatorias, autoinmunes y del tejido conectivo. La dexametasona, un glucocorticoide sintético, tiene máxima concentración plasmática tras 1-2h de su administración oral y un tiempo de vida media de 36-54h; a altas dosis (>100mg de prednisona al día) tiene efectos no genómicos. La prednisona y la prednisolona son de vida media intermedia (18-36h)4.
Debido a su eficacia, el uso de corticosteroides es común; hasta un 10% de los pacientes medicoquirúrgicos hospitalizados reciben corticosteroides5 y un 1-3% de la población general tiene esta terapia a largo plazo6.
El termino psicosis por esteroides ha sido utilizado para referirse a una mezcla heterogénea de efectos neuropsiquiátricos, entre los más comunes depresión, manía, delirium, insomnio, psicosis e incluso tendencias suicidas7, por lo que la incidencia ha oscilado entre 2-60%8-12. Una fuerte relación dosis-respuesta se demostró por primera vez en 1972 por el Programa de Vigilancia de Medicamentos de Boston9, donde la incidencia de síntomas psiquiátricos en pacientes con <40mg/día de prednisona fue del 1,3%; en pacientes recibiendo 41-80mg/día fue de 4,6%, y en pacientes con >80mg/día fue de 18,4%. Se estima que menos del 2% de los pacientes que reciben <40mg/día de prednisona desarrollarán psicosis por esteroides, mientras que aproximadamente el 18% de los pacientes tratados con dosis de >80mg/día la desarrollarán13.
Mientras los pacientes experimentan inicialmente manía o hipomanía, la terapia a largo plazo se asocia más frecuentemente con síntomas depresivos. Los déficits cognitivos son comunes tanto a corto como a largo plazo14. Los pacientes que desarrollan delirium se recuperan más rápidamente que las personas con depresión (duración media de 5,4días), manía o psicosis (duración media de 19,3días). Otros síndromes tales como el deterioro cognitivo pueden ser más duraderos15. En los casos reportados la duración de los síntomas fue 10 y 14días respectivamente.
Los criterios diagnósticos para el trastorno psicótico inducido por medicamentos son: a) alucinaciones o ideas delirantes; b) el consumo del medicamento está etiológicamente relacionado con la alteración, o los síntomas del criterio anterior aparecen durante o en el mes siguiente a una intoxicación por o abstinencia de sustancias; c) no hay otra mejor explicación de la etiología; d) la alteración no aparece exclusivamente en el transcurso de un delirium, y e) la alteración causa malestar o deterioro en las áreas social, laboral u otras16.
Los factores de riesgo incluyen género femenino17, padecer de lupus eritematoso sistémico en quienes la vasculitis cerebral, daños en la barrera hematoencefálica y los bajos niveles de complemento sérico son factores de riesgo independientes para trastornos neuropsiquiátricos inducidos por esteroides18, dosis mayor de 40mg/día de prednisona o su equivalente, antecedentes de depresión documentada, disfunción hepática o renal, inhibición del sistema CYP-450 o aumento de estrógenos exógenos y ser adulto mayor19. La relación con la historia familiar no ha sido claramente identificada20. Tampoco hay clara predisposición entre los pacientes con antecedente de evento adverso neuropsiquiátrico por medicamentos. En los casos expuestos se evidenciaron como factores de riesgo ser del género femenino, recibir dosis considerables de corticoides y padecer de lupus eritematoso sistémico en el segundo caso.
Rome y Braceland21 definieron 4 categorías o grados de respuestas psiquiátricas a corticoides (tabla 1). Nuestros casos corresponden a un grado 4 por la psicosis franca con alucinaciones, ideas delirantes místicas y de referencia, y variaciones extremas en el afecto (tabla 2 y fig. 1).
Grados
| Grados | Síntomas |
|---|---|
| Grado 1 | Sensación general de bienestar y estimulación, con una mejor concentración, energía y claridad del pensamiento |
| Grado 2 | Mayor elevación del estado de ánimo acompañada por inquietud, insomnio, aumento de la actividad motora y aceleración de la actividad mental (lindando con fuga de ideas) |
| Grado 3 | Ansiedad severa, rumiaciones, obsesiones, cambios de humor, indiferencia, llanto, desesperanza e impotencia, excitación, inquietud y fuga de ideas |
| Grado 4 | Alucinaciones, delirium y variaciones extremas en el estado de ánimo |
Fuente: Rome y Braceland21.
Conceptos clave
| - Los síntomas psicóticos inducidos por glucocorticoides se presentan con dosis mayor de 40mg/día de prednisona o su equivalente |
| - El uso de corticoides inicialmente se relaciona con la presencia de manía o hipomanía; la terapia a largo plazo se asocia más frecuentemente con síntomas depresivos |
| - Los factores de riesgo con mayor evidencia son daños en la barrera hematoencefálica, hipoalbuminemia, género femenino, antecedentes de depresión, disfunción hepática o renal e inhibición del sistema CYP-450 |
| - El paso crucial en el manejo es la suspensión o disminución de la dosis del corticoide y optimizar el tratamiento con fármacos psicotrópicos |
| - Los antipsicóticos atípicos son los fármacos de elección para el manejo de la psicosis inducida por corticoides, y el de mayor evidencia es la olanzapina |
La aparición de sintomatología está relacionada con deficiencias en las actividades hipocampo dependientes y deficiencias en el procesamiento de la corteza prefrontal22,23. El uso de corticosteroides está relacionado con cambios en la organización de las sinapsis, pérdida de células piramidales en el área CA3 asociado a patrones de astrocitosis reactiva en las áreas CA1 y CA3 del hipocampo, que sugieren que los corticoides producen cambios funcionales, que pueden ser responsables de los trastornos cognoscitivos, tales como desatención y compromiso de la memoria verbal24. Así mismo, se ha demostrado atrofia reversible en el hipotálamo y la amígdala, regiones que participan en la regulación del aprendizaje emocional y la respuesta al estrés25-27 También se ha sugerido una alteración en la síntesis de neurotransmisores (dopamina y serotonina) y neuropéptidos (beta-endorfina, somatostatina), lo que contribuye a los síntomas del estado de ánimo28. Se ha descrito que la dexametasona, particularmente, induce un proceso de apoptosis de las células granuladas en el giro dentado y en las neuronas de la región dorsomedial del cuerpo estriado29.
Actualmente, no existen medicamentos aprobados por la FDA para el tratamiento de los efectos secundarios neuropsiquiátricos inducidos por esteroides. El primer paso es suspender los esteroides si es posible, o tratar de disminuir la dosis a menos de 40mg/día de prednisona o su equivalente30.
Los antipsicóticos típicos pueden producir alteraciones en el hipocampo, limitación que sumada al alto riesgo de producción de síntomas extrapiramidales, sugiere que para el tratamiento de las crisis psicóticas se prescriba como primera opción los antipsicóticos atípicos31 que poseen, además, acción sobre los receptores serotoninérgicos. En nuestro primer caso, la paciente no toleró la olanzapina por lo que se continuó el haloperidol, mostrando adecuada respuesta sin evidencia de síntomas extrapiramidales, simultáneamente con el desescalamiento de la dexametasona; sin embargo, en el caso 2 hubo manifestaciones extrapiramidales secundarias al uso del haloperidol, por lo que requirió ajuste de manejo con un antipsicótico atípico.
También se ha analizado el uso de antipsicóticos para la prevención de los síntomas psiquiátricos o cognitivos32; Goldman y Goveas33 informaron de reducción de ambos síntomas psicóticos y afectivos cuando se utiliza olanzapina (en dosis entre 2,5-15mg/día), siendo importante tener monitorización de glucemia y peso por el riesgo metabólico. Bloch et al.34 reportaron profilaxis con clorpromazina en un paciente con historia recurrente de episodios maníacos agudos después del tratamiento con esteroides. Algunos investigadores han sugerido que el carbonato de litio es eficaz para la manía y la depresión inducida por corticosteroides35.
La fenitoína se ha demostrado que es medianamente eficaz en la prevención de los síntomas maníacos36 al competir por la unión a proteínas con los esteroides, por lo tanto, sin una superioridad clínica evidente, no es considerada de primera línea. No existe evidencia que apoye el uso de levetiracetam en la prevención de la psicosis por esteroides37.
Los estudios en animales han sugerido que la pérdida de volumen inducida por corticosteroides en el hipocampo y la amígdala se puede prevenir mediante el uso de antagonistas de N-metil-D-aspartato y agentes que disminuyen la liberación de glutamato como la lamotrigina38.
ConclusionesLos efectos neuropsiquiátricos del tratamiento con glucocorticoides varían desde la ansiedad e insomnio hasta cambios comportamentales severos como manía, psicosis e intentos de suicidio. Los síntomas afloran entre la primera y la segunda semana después de haber iniciado altas dosis o dosis de pulso de esteroides. La disminución o discontinuación del medicamento puede remediar los efectos adversos; en muchos casos se requieren fármacos psicotrópicos por la imposibilidad de suspensión de los corticoides o la severidad de los síntomas psiquiátricos. Aunque aún falta por saber sobre la prescripción profiláctica, es aconsejable hacer recomendaciones sobre la prevención de síntomas psiquiátricos y cognitivos en pacientes con factores de riesgo.
Conflicto de interesesNinguno que declarar.