Los niveles fisiológicos de secreción salival son esenciales para la salud oral1. La saliva influye en diferentes aspectos de la cavidad oral como la protección frente a la caries, la digestión, y los procesos inmunológicos. Su capacidad de promover la remineralización y reducir la desmineralización hace que la saliva juegue un papel primordial en la protección2. Además, este fluido se encuentra implicado en una gran variedad de procesos digestivos como la lubricación de las mucosas, la formación del bolo alimenticio, y la digestión enzimática del alimento3. El papel protector de la saliva para el organismo humano se concreta en el aporte de péptidos y proteínas antimicrobianos al epitelio oral4.
La saliva es secretada predominantemente por tres glándulas salivares mayores bilaterales: las parótidas, las sublin guales y las submaxilares (en conjunto son responsables de alrededor de un 90% de la producción total de saliva)3. Contribuyen además a la secreción de saliva cientos de glándulas salivares menores (vestibulares, labiales y palatinas), dispersas por toda la mucosa oral. La regulación de la secreción salival es un reflejo controlado por las ramas simpáticas y parasimpáticas del sistema nervioso autónomo5. Los impulsos, inducidos por la acción del gusto, la masticación, o el olfato son enviados desde los receptores aferentes hasta los núcleos salivares (centro de la salivación) localizados en el bulbo raquídeo3. La parte eferente del arco reflejo secretor está constituida por haces nerviosos parasimpáticos y simpáticos, que inervan separadamente las glándulas salivares, empleando como neurotransmisor acetilcolina5.
La saliva dispone de dos tipos principales de secreción de proteínas: secreción serosa que contiene amilasa y secreción mucosa que contiene mucina. La enzima amilasa interviene en la digestión inicial, mientras que la mucina ayuda a la lubricación y protección de las superficies orales. Las características físicas y químicas de la saliva varían según las diferentes glándulas salivares. Las glándulas sublinguales producen una saliva viscosa rica en mucina mientras que las glándulas parótidas serosas secretan un fluido acuoso rico en amilasa6.
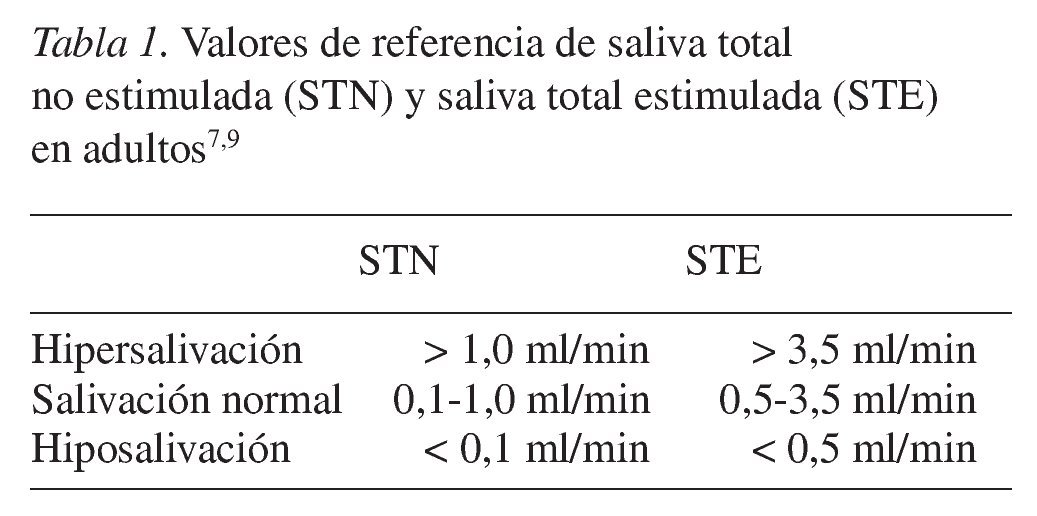
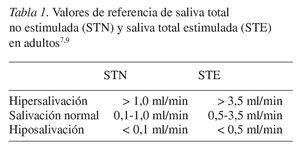
La secreción diaria normal de saliva oscila entre 1,0 y 1,5 l con una tasa promedio de 0,5 ml/min (salivación normal; tabla 1)7. La disminución del flujo de saliva se denomina hiposalivación (hipoptialismo), y puede deberse a pérdida de agua/metabolitos, lesión de las glándulas salivares o interferencia con la transmisión neural (tabla 1). Las razones más frecuentes de la hiposalivación suelen ser inflamación crónica de las glándulas salivares, síndrome de Sjögren, radioterapia, deshidratación, factores psicológicos y fármacos5,8. El aumento de la secreción de saliva se denomina hipersalivación (tabla 1). La hipersalivación tiene un origen desconocido; sin embargo, se ha descrito hipersalivación en pacientes con estomatitis herpética, estomatitis aftosa, gingivitis ulcerativa, y en pacientes portadores de prótesis removibles9.
Los distintos componentes de la saliva son: substancias orgánicas e inorgánicas, proteínas/polipéptidos, hormonas, y moléculas lipídicas. La saliva total está compuesta fundamentalmente por agua que contiene iones, como sodio, potasio, magnesio, calcio, cloruro, carbonatos, y fosfato7. También se detectan en la saliva pequeñas cantidades de compuestos orgánicos no proteicos como compuestos úricos, aminos, o ácidos grasos y glucosa7. En la saliva se han identificado más de 309 proteínas, entre las que se incluyen proteínas acidas y básicas ricas en prolina, glicoproteínas de alto y bajo peso molecular, aglutininas, cistatinas, histatinas y estaterinas10. Las proteínas salivales tienen una gran variedad de propiedades funcionales. Los diferentes grupos de proteínas de la saliva intervienen en las reacciones inmunológicas (lisozima, lactoferrina, lactoperoxidasa, inmunoglobulina, defensina)7,11-13, en la digestión (amilasa)7, y en otros muchos procesos que tienen lugar en la cavidad oral. La saliva contiene hormonas esteroideas; no esteroideas; proteicas; y péptidas, como el cortisol, la testosterona, la progesterona, el estradiol, y la aldosterona7. Numerosos estudios han demostrado la correlación que existe entre los niveles séricos y salivales de las diferentes hormonas14-16. La medición de las hormonas salivales para fines diagnósticos es un método ampliamente aceptado, no invasivo, y sencillo comparado con la recogida de muestras plasmáticas y sericas7,16-18.
El propósito de la presente revisión es resumir los conocimientos actuales que existen sobre los cambios cualitativos y cuantitativos de los componentes salivales que se producen durante la hiposalivación y discutir las posibilidades de tratamiento racional.
Fuentes de los datos y selección de estudios
Se realizó una búsqueda en las bases de datos Medline/ PubMed/Scopus de artículos escritos en Inglés y Alemán desde Marzo a Mayo de 2009. Se emplearon las siguientes palabras/frases clave en la estrategia de búsqueda: hiposalivación/boca seca/xerostomía/composición de la saliva/cambios cualitativos/cambios cuantitativos/fármacos/edad/enfermedades, trastornos sistémicos/síndrome de Sjögren/síndrome de Sicca/ radiación, radioterapia/ microflora cariogénica/ microflora periodontopatogenica/salud oral. Estos términos se usaron solos o en combinación. Se obtuvieron también algunas referencias antiguas y/o básicas mediante búsqueda manual y referencias cruzadas de la literatura disponible.
Los autores examinaron los resultados devueltos por la búsqueda Medline/PubMed/Scopus para identificar los resúmenes potencialmente relevantes. Las publicaciones que no trataban de la etiología de la hiposalivación o de los cambios en la composición salival debidos a hiposalivación u otros orígenes no se tomaron en consideración. Finalmente, se seleccionaron 94 artículos a texto completo, 71 de los cuales eran originales.
Etiología de la hiposalivación
La hiposalivación representa la disminución de la tasa de flujo salival, y el diagnostico de la misma se realiza mediante mediciones de esta tasa. La tasa de flujo salival varía de una persona a otra y se ve influida por un gran número de factores, como el grado de hidratación, la posición del cuerpo, la exposición a la luz, la estimulación previa, los ritmos circadianos, o el tamaño glandular10. Sin embargo, cuando durante la toma de muestras las condiciones son uniformes, el flujo es remarcablemente estable en todos los individuos. La mayoría de los investigadores emplean la medición de la saliva total no estimulada (STN) como criterio para definir la hiposalivación o hipofunción de las glándulas salivares19. Los valores de referencia para STN y STE en adultos se describen en la tabla 1.
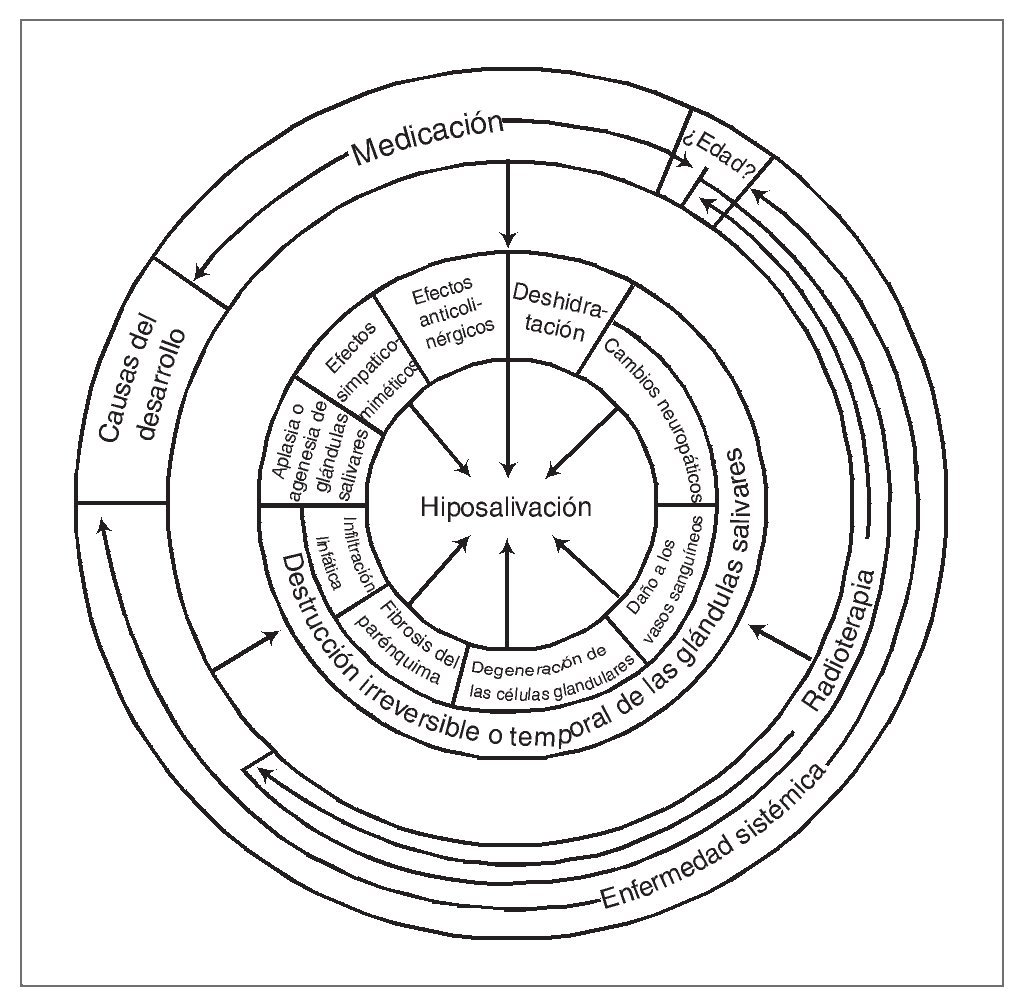
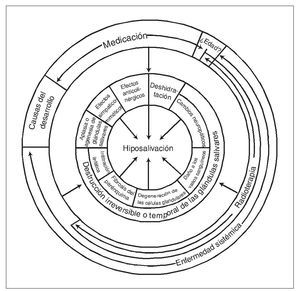
La hiposalivación puede deberse a distintos factores etiológicos (fig. 1). La etiología de este síntoma por alteraciones del desarrollo, como aplasia o agenesia de glándulas salivares, es rara20. Aunque en las glándulas salivares pueden producirse cambios estructurales considerables en relación con la edad (pérdida de epitelio secretor)20, no existen evidencias consistentes de que la edad sea una causa importante de hiposalivación21. En cambio, las diferentes enfermedades sistémicas, los fármacos, y sobre todo las enfermedades malignas de cabeza y cuello si representan factores significativos de importancia22.
Figura 1. Distintos factores etiológicos posibles de la hiposalivación.
Basándose en la experiencia clínica general la disminución de la tasa de flujo salival es común en las personas mayores en comparación con los grupos de edad más jovenes23. Sin embargo, como ya se ha mencionado antes, el proceso de envejecimiento en sí mismo no parece ser la causa principal de disminución de las tasas de flujo salival5,8,24-28. Aunque en relación con la edad se ha reseñado una disminución de la tasa de flujo salival de la saliva total en reposo y de la saliva parótida y submandibular estimuladas29,30, la hiposalivación parece ser causada secundariamente por distintas enfermedades o fármacos5.
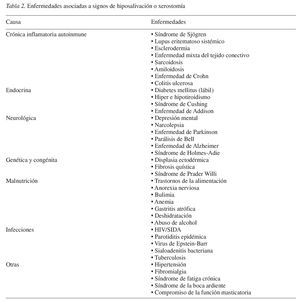
Son muchas las enfermedades sistémicas que pueden asociarse a signos de hiposalivación (tabla 2)5. Las enfermedades autoinmunes como el síndrome de Sjögren, SIDA, lupus eritematoso, artritis reumatoide, esclerodermia, así como enfermedades hormonales (diabetes mellitus), neurológicas (enfermedad de Parkinson), y enfermedades psicogénicas (depresión) pueden causar de forma irreversible o temporal una destrucción progresiva de las glándulas salivares3,5,31. La relación entre hipertensión y función salival no se ha establecido de forma clara. Mientras son varios los autores que describen tasas de flujo salival disminuidas en los pacientes hipertensos en relación a los pacientes normotensos32,33, otros investigadores no encuentran diferencias significativas entre ambos grupos34,35.
Como causa de hiposalivación se han reseñado más de 400 farmacos36. La prevalencia de hiposalivación se relaciona de forma positiva con el número total de fármacos xerogénicos y no xerogénicos en tasas de hasta el 82%37.
En la población americana un 33% a 51,7% de los individuos de edad avanzada están tomando al menos una medicación potencialmente xerogénica38,39. Distintos fármacos como los antidepresivos causan hiposalivación debido a las interferencias que producen con la transmisión en la unión neuroefectora parasimpática37,40,41. Sin embargo, la inhibición de la salivación puede ocurrir también por acción de otros fármacos sobre centros más altos del sistema nervioso autónomo5. El mecanismo del efecto xerostómico de los diuréticos puede explicarse por la deshidratación. Los diuréticos pueden afectar al transporte de agua y electrolitos a través de la membrana celular de las células acinares salivares por vasoconstricción5,37,40. Además, algunos fármacos pueden producir sequedad de boca sin reducir las tasas de flujo salival. Los medicamentos inhalados pueden producir sensaciones de sequedad oral por sus efectos tópicos37,41. La tabla 3 enumera los fármacos y agentes químicos con potencial bien conocido de disminuir el flujo salival o causar sequedad de boca.
La disfunción de las glándulas salivares y la sequedad de boca son efectos adversos serios de la radioterapia por cáncer de cabeza y cuello. Las glándulas salivares, principalmente la parótida y en grado algo menor la submaxilar, sublingual y las glándulas menores, son extremadamente radiosensibles42. Sin embargo, todavía no se ha dilucidado el mecanismo exacto que produce la hiposalivación debida a radioterapia. Por un lado, la ionización ejerce un efecto inmediato sobre las células acinares de las glándulas salivares42-44; por otro, el daño por radiación puede deberse a alteraciones y cambios de la estructura de los vasos sanguíneos o a interferencias con la transmisión nerviosa5,42. A bajas dosis, el daño parece reversible, pero la dosis de tolerancia de la glándula parótida por encima de la cual la función se ve afectada de forma irreversible es de aproximadamente entre 25 y 40 Gy44, y a la dosis tumoricida acumulativa normal de 60 a 70 Gy, se produce una importante degeneración de los acinos44. Estos factores etiológicos conducen a cambios cuantitativos y cualitativos de los componentes salivales produciendo aumento de la viscosidad, disminución de la capacidad de tamponamiento, alteración de las concentraciones de los electrolitos salivales, y cambios en el sistema antibacteriano no inmune e inmune44.
Cambios de la composición salival como consecuencia de la hiposalivación causada por diferentes factores etiológicos
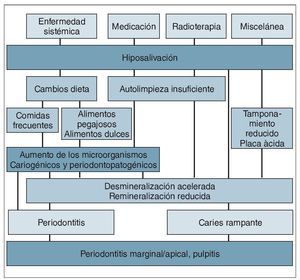
La disminución de la secreción salival conduce a cambios en la composición de la saliva. Estos cambios pueden promover la acumulación de placa y aumentan el riesgo de caries, infecciones mucosas y gingivales, e inflamación44.
Cambios de la composición salival debidos a enfermedades sistémicas
El síndrome de Sjögren es una enfermedad inflamatoria crónica autoinmune que se caracteriza por presentar además de xerostomía, queratoconjuntivitis seca. Se conoce que el síndrome de Sjögren se presenta con una gran variedad de enfermedades autoinmunes, como la artritis reumatoide, el lupus eritematoso sistémico, y la cirrosis biliar primaria45. La recientemente publicada clasificación europea indica que para definir a los pacientes con síndrome primario de Sjögren estos deben cumplir al menos cuatro de seis criterios (síntomas subjetivos orales y oculares, queratoconjuntivitis seca, sialoadenitis focal en la biopsia, evidencia instrumental de afectación de las glándulas salivares, y presencia de autoanticuerpos). El síndrome de Sjögren secundario se caracteriza por la presencia de uno de los dos síntomas subjetivos con al menos dos de los signos objetivos de los ítems de disfunción glandular46.
En pacientes con enfermedades reumáticas, la disminución de la secreción de saliva se asocia a menudo con sialoadenitis focal. En el síndrome de Sjögren primario puede verse un aumento de la infiltración de leucocitos en las glándulas salivares47, con activación linfocitaria y producción de autoanticuerpos (por ejemplo, anticuerpos antinucleares)48. En los pacientes con síndrome de Sjögren se han reseñado unas concentraciones salivales de potasio y fosfato normales con concentraciones de sodio y cloruro más elevadas, y descenso de las concentraciones de bicarbonato, y en consecuencia, con disminución del pH y de la capacidad de tamponamiento en comparación con sujetos sanos49. En el síndrome de Sjögren también se encuentra un aumento de la concentración salival de calcio y proteínas12,49. Se ha reseñado por ejemplo que en pacientes con este síndrome algunas proteínas como las inmunoglobulinas (Ig) A e IgG, la lactoferrina, la lisozima, la metaloproteinasa de matriz, la β2-microglobulina, la calicreína, la cistatina, y la albúmina se encuentran más elevadas que en los pacientes sanos12,50.
Por otro lado los recuentos de lactobacilos orales y hongos parecen encontrarse significativamente más elevados entre los pacientes con enfermedades reumáticas y síndrome de Sjögren51. La disminución de las tasas de flujo salival resulta favorable para la multiplicación de los microorganismos acidogénicos y de los hongos52,53. Sin embargo, estos datos son discutidos ya que algunos estudios han reseñado que no existen diferencias en las concentraciones de microorganismos acidogénicos y de hongos entre los pacientes con síndrome de Sjögren y los pacientes sanos52-54.
Otro ejemplo de enfermedad que afecta a las tasas y composición del flujo salival además de las enfermedades reumáticas, es la diabetes mellitus55-57. Sin embargo los datos acerca de las tasas de flujo y composición salival que se encuentran en esta enfermedad son controvertidos y parecen depender del tipo de saliva y del tipo de diabetes mellitus (insulinodependiente o no insulinodependiente)55-57. La disminución de las tasas de flujo salival y de los valores de pH así como la alteración de la función de las glándulas salivares se han reseñado tanto en la diabetes tipo 1 como en la diabetes tipo 2. En la saliva de estos pacientes se han encontrado niveles elevados de glucosa57; pero por otra parte también niveles elevados de las concentraciones de potasio, calcio, y proteínas totales55,56. Estos hallazgos podrían deberse a un hiperaldosteronismo o a la alteración de la actividad de la bomba de sodio-potasio (Na+-k+-ATPasa [adenosintrifosfatasa] que conduciría a la alteración del transporte del potasio en las glándulas salivares55. Sin embargo, otra investigación anterior mostró disminución de las concentraciones de potasio salival en pacientes diabéticos en comparación con controles sanos pareados por edad así como una disminución de la concentración de magnesio y zinc56, mientras que las concentraciones salivales de los factores de defensa antimicrobiana innatos como la lisozima, la lactoferrina, y la peroxidasa obviamente no se veían afectados57. En cambio, las concentraciones salivales de IgG e IgA si se encontraron elevadas en la saliva total de los pacientes diabeticos57.
Por otro lado es ampliamente aceptado que los niveles elevados de glucosa salival en pacientes diabéticos favorecen el crecimiento de hongos orales. La acumulación de productos de la glicosilación en la superficie epitelial favorece la adhesión de patógenos. Es probable que la disminución de las tasas de flujo salival que acompaña a la diabetes junto con una alteración de la respuesta inmunitaria favorezcan la colonización por candidas58. Por el contrario, las bacterias periodontales no se han demostrado elevadas en la saliva de los pacientes con diabetes58.
Algunas enfermedades sistémicas que no alteran de forma importante las tasas de flujo salival pueden sin embargo afectar a la composición de la saliva e incitar procesos patológicos orales. Un ejemplo de ello lo constituye la enfermedad celiaca, en la que no se dan cambios evidentes en las tasas de secreción salival pero se detecta una importante elevación de la concentración de proteínas totales, como la albumina, IgG, IgA, así como de la peroxidasa, en la saliva59.
Influencia de la medicación sobre la composición de la saliva
Uno de los principales grupos de medicamentos que afectan a la composición de la saliva son los antidepresivos tricíclicos, como la imipramina, que producen una disminución significativa del pH de la saliva60. Además, la imipramina y las dosis altas de zimelidina producen un aumento de la capacidad de tamponamiento, y de los ácidos sialicos y hexosas60. En cambio, dosis más bajas de zimelidina (100 mg/día) no producen cambios cualitativos en la composición de la saliva60. No se han observado cambios en la concentración de sodio, potasio, calcio, fosfato y proteínas tras la administración de antidepresivos tricíclicos60. Otra investigación reseñó, tras la administración de amitriptilina, un fuerte aumento de la actividad de la amilasa y del contenido en proteínas, glicoproteínas, calcio, potasio y hexosa en la saliva, lo que indicaba un fuerte efecto agonista sobre la transmisión de noradrenalina20. Las dosis aisladas de maprotilina aumentan la actividad de la amilasa salival y el contenido en proteínas61.
Se han evaluado los efectos de los fármacos psicótropos (por ejemplo, fluoxetina, sertralina, paroxetina, citalopram, clonacepam, y loracepam) sobre las concentraciones de algunos componentes salivales como las proteínas totales, la urea, y el calcio, así como sobre la actividad de la α-amilasa, el pH, y la capacidad de tamponamiento62. Los consumidores de psicótropos presentaban una significativa disminución de la tasa de flujo salival estimulado de hasta el 33,85% comparados con los controles. Sin embargo, se encontró que la composición bioquímica de la saliva no se afectaba de forma significativa por el empleo de psicotropos62.
Los diuréticos como la furosemida y el bendroflumetiacide demuestran durante el tratamiento crónico un pronunciado efecto sobre la composición de la saliva, especialmente sobre la concentración de sodio y cloruro en la saliva estimulada y no estimulada63. Otro grupo de fármacos antihipertensivos, los inhibidores de la enzima convertidora de la angiotensina (IECA) y los antagonistas de los canales del calcio, parecen no generar alteraciones en la composición salival64. En cambio, durante los periodos de tratamiento activo con antagonistas de los α-adrenorreceptores (atenolol y propanolol) las concentraciones de calcio, fosfato, cloruro, y magnesio en la saliva se reseñaron alteradas65. Estos resultados sugirieron que el transporte ductal de sodio y cloruro es controlado por los α-adrenorreceptores65. El mismo grupo de estudio reseñó también una disminución de las proteínas totales salivales, una disminución de la actividad de la amilasa, así como cambios de los ratios calculados de acido sialico/ hexosamina/proteínas totales durante el tratamiento con antagonistas de los α-adrenorreceptores66.
También se observaron aumentos significativos de la secreción de albumina en la saliva y de la lisozima salival, pero significativas disminuciones de las concentraciones de las IgG, IgA, e IgM salivales durante el tratamiento de cáncer con citostaticos67.
Cambios de la composición salival durante la radioterapia
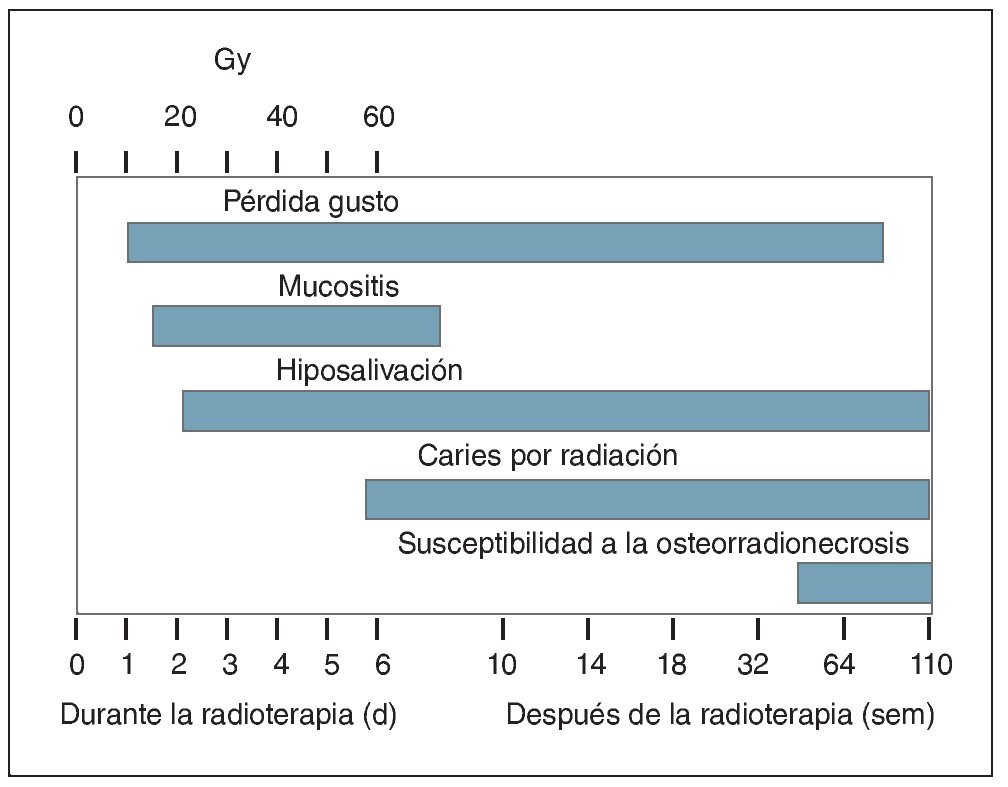
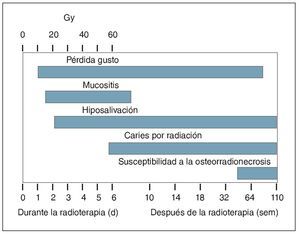
La hiposalivacion inducida por la radioterapia es el efecto adverso más común y más serio que sufren los pacientes sometidos a este tratamiento de los tumores malignos en la región de cabeza y cuello. La exposición de estas regiones a altas dosis de radiación puede conducir no solo a hiposalivación sino también a otras consecuencias clínicas para la salud oral, como mucositis, perdida del gusto, trismus, y osteorradionecrosis (fig. 2)42,44,47. Además de la reducción de las tasas de flujo salival, la calidad de la saliva sufre también cambios significativos debido a la radioterapia, como aumento de la viscosidad y desviación del pH hacia valores más acidos68,69. Durante la fase inicial de la radioterapia, las concentraciones de proteínas antimicrobianas, lactoferrina, lisozima, peroxidasa, y mieloperoxidasa en la saliva se han encontrado elevadas70. Sin embargo, en estas fases del tratamiento con radioterapia es difícil estimar qué proporción de estos cambios se debe principalmente al tumor o es secundaria a las enfermedades inflamatorias orales, como la mucositis42,44,70,71. De acuerdo con otras investigaciones después de 6 semanas de tratamiento de radioterapia se observaron en los pacientes disminuciones de la actividad de la α-amilasa, de la tasa de flujo, y de los niveles de proteínas69. Además, en los pacientes radiados la concentración de proteínas acidas y básicas ricas en prolina, como las cistatinas, histatinas, y estaterinas también parece estar reducida68. La baja concentración salival de estos componentes podría deberse a la reducción del número de células acinares, a la incompleta regeneración tisular, y a los efectos tardíos sobre el estroma como el daño vascular diferido inducido por la radiación42,68,69.
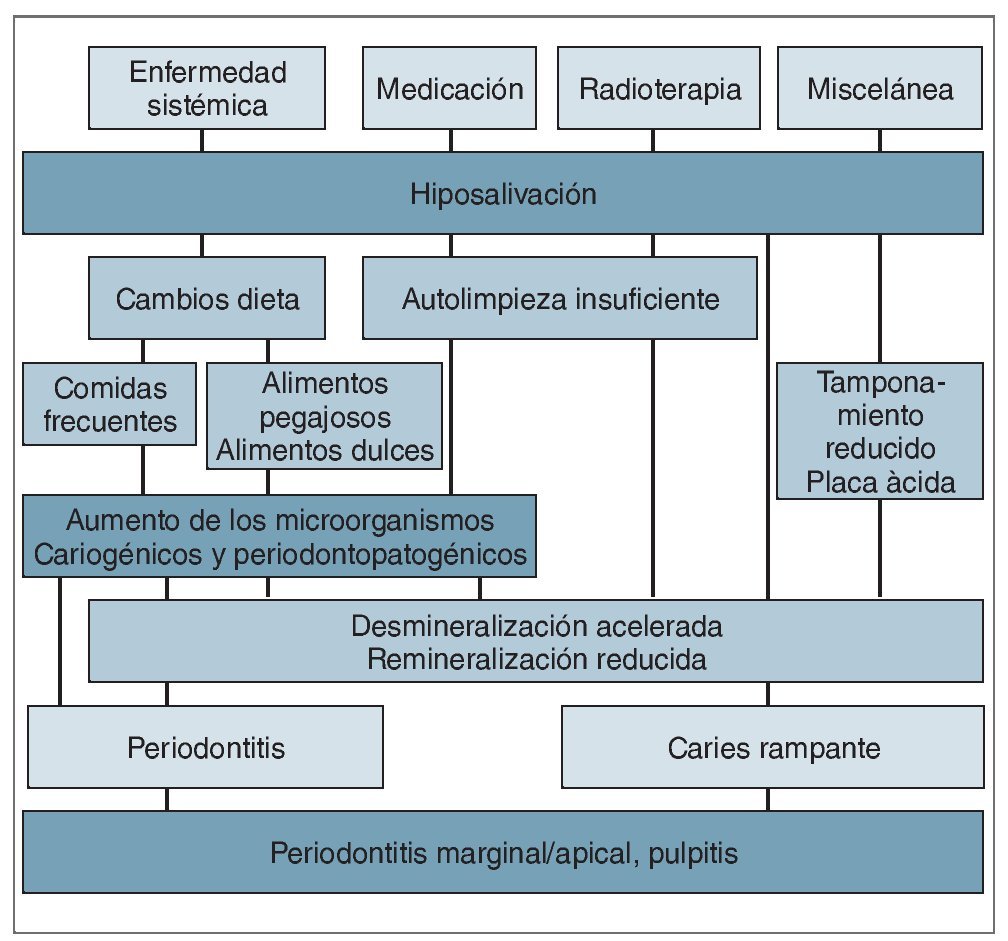
Figura 2. Consecuencias directas e indirectas de la hiposalivación de diferentes causas. (Modificado de Kielbasa44 con el permiso correspondiente).
Se han investigado también los cambios relacionados con la radiación sobre las concentraciones salivales de inmunoglobulinas. Se considera que la IgA salival juega un papel importante en la protección frente a la caries dental. La saliva total y las muestras de suero recogidas de pacientes con cáncer oral presentan niveles significativamente elevados de IgA e IgG incluso antes de la radioterapia70,72. Se han reseñado proporciones de la IgA e IgG con las proteínas totales considerablemente aumentadas durante la radioterapia y notablemente disminuidas después de ella72. La elevación de la IgA se centró fundamentalmente en las dos primeras semanas de radiación transcurridas las cuales permaneció bastante constante72. Las elevadas concentraciones de estos componentes pueden prestar cierta protección frente a las infecciones inducidas por la radiación, al menos en la primera fase del tratamiento radioterapéutico. De acuerdo con otro estudio el titulo de IgA secretoria se encontró significativamente más elevado en pacientes con glándulas salivales mayores totalmente radiadas incluso más de 6 meses después de la radiación73.
Aunque las concentraciones bacterianas totales en la saliva de los sujetos radiados parecen permanecer relativamente inalterables74, la hiposalivación inducida por la radiación se acompaña de pronunciadas desviaciones de los componentes microbianos específicos, especialmente hacia una microflora muy acidogénica72,74-76. El número de microorganismos cariogénicos como Lactobacillus, Streptococcus mutans, y Staphylococcus se ha encontrado extremadamente elevado tras radioterapia74-76. En cambio los patógenos periodontales, a diferencia de la elevada colonización de estreptococos, lactobacilos, y algunas especies de cándida, no parecen verse afectados74,75. Durante el tratamiento de radioterapia y después de él la incidencia de patógenos periodontales (como Aggregatibacter actinomycetemcomitans o Porphyromonas gingivallis) no se encontró alterada de forma significativa75,77. Se sugirió por ello que a diferencia de lo que ocurre con la «caries por radiación» no parece existir evidencia microbiológica de «periodontitis por radiación»77.
Consecuencias de la alteración de los componentes salivales sobre la salud oral
Por lo general, la hiposalivación sea cual sea su origen da lugar a cambios de la composición salival, como aumento de la viscosidad, reducción de la capacidad de tamponamiento, alteración de las concentraciones de electrolitos salivales, y cambio en los sistemas antibacterianos inmunes y no inmunes (fig. 3). Estas alteraciones pueden conducir a serias consecuencias para la salud oral. Por ejemplo, el pH medio desciende de aproximadamente 7,0 a 5,0, lo que se considera cariogénico42,44. Debido a la disminución del pH y de la capacidad de tamponamiento, los minerales del esmalte y la dentina pueden llegar a disolverse con facilidad. Como las condiciones del ambiente oral de los pacientes con hiposalivación son especialmente propensas a la desmineralización lo anterior no va seguido de la normal remineralización de los tejidos duros dentales42,44. Como consecuencia de ello, la capacidad de remineralización de la saliva queda bastante limitada.
Figura 3. Diagrama esquemático en el tiempo de la presentación y duración de las secuelas orales inducidas por la radiación. (Reimpreso de Kielbasa44 con el permiso correspondiente).
Por otro lado, la disminución de las tasas de flujo salival dan lugar a una substancial deficiencia de inmunoproteínas42,44. Estos efectos, acompañados de la reducción del aclaramiento oral en los pacientes con hiposalivación, resultan en pronunciados cambios de la flora oral (sobre todo en los pacientes radiados) dando lugar a un aumento de los microorganismos acidogénicos y cariogénicos42,44.
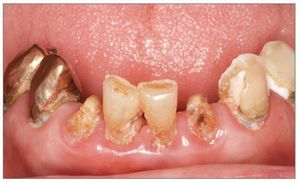
Resulta evidente que la desviación de la microflora oral hacia bacterias cariogénicas, la disminución del flujo salival (aclaramiento oral), y la alteración de la composición de la saliva (capacidad de tamponamiento, pH, inmunoproteínas, y aclaramiento oral) producen un incremento muy importante del riesgo de caries en los pacientes con hiposalivación, en especial en aquellos que han sido sometidos a radioterapia de cabeza y cuello (fig. 4)42,44.
Figura 4. Daños en la dentición en relación con la radiación.
Por otra parte, cuando el flujo salival se reduce de forma objetiva, la función oral sufre dificultades (habla, masticación y deglución), debido a que la humidificación y lubricación de los alimentos no es la suficiente42,44. La pérdida del gusto, mencionada antes, se debe no solo al efecto de la radiación sobre las papilas gustativas sino también a la hiposalivación de otros causas44. La disminución del flujo salival inhibe el transporte y solubilización de los estimulantes gustativos, lo que conduce a una disminución de los estímulos gustativos y a una disminución de la excitabilidad de las papilas gustativas44.
Bajo estas condiciones y sin medidas preventivas (higiene oral) y tratamiento de apoyo (por ejemplo, fluoración), la dentición puede quedar totalmente destruida en pocos meses (fig. 3)22,78. Aportar humedad a la mucosa oral ayuda a aliviar los síntomas de hiposalivación en los pacientes22,78.
Opciones de tratamiento en la hiposalivación
Cuando queda parénquima glandular funcional remanente, se puede tratar la hiposalivación mediante la administración de colinérgicos (por ejemplo, hidrocloruro de pilocarpina), sin embargo los sialogogos de acción sistémica deben emplearse con mucho cuidado porque a menudo ocasionan efectos secundarios79. Los estimulantes del flujo salival de acción local pueden resultar útiles por medio de la estimulación masticatoria y/o gustativa de las glándulas salivares80. Cuando no es posible estimular una mínima actividad de las glándulas salivares pueden prescribirse sustitutos de la saliva81. Sin embargo, los productos artificiales no son capaces de reemplazar adecuadamente todas las funciones de la saliva; así por ejemplo los sustitutos de la saliva muchas veces no consiguen una buena lubricación y actividad antimicrobiana82. Para mejorar sus propiedades viscoelasticas, se han añadido a los sustitutos de la saliva varios agentes espesantes (por ejemplo carboximetilcelulosa [CMC], aceite de linaza, ptialina o mucina)82. Sin embargo, algunas salivas artificiales que contienen estos espesantes (TMP Tüshaus con ptialina; Salinum, Sinclair, con aceite de linaza) han sido retiradas recientemente del mercado (Alemania) por la inestabilidad de su pH y por un ocasionalmente observado crecimiento bacteriano81. La CMC aunque no es un lubricante natural, sigue pareciendo una buena opción clínica como base de los sustitutos salivares. Un estudio cruzado prospectivo reciente mostró que la mayoría de los pacientes que sufrían xerostomía preferían un spray de CMC (Glandosane, Cell Pharm) que las soluciones basadas en gel de celulosa, aceite, o mucina, debido a su gusto y manejo83. De cualquier forma, las preferencias de los pacientes acerca de los sustitutos salivares son muy discutidas84-88. Glandosane reveló un elevado potencial de desmineralización en varios estudios in vitro, por lo que no se recomienda en pacientes dentados78,89,90. Como ya se ha mencionado antes, los sustitutos salivales a menudo presentan un potencial de desmineralización o en el mejor de los casos son neutros; solo algunos pocos tiene potencial de remineralización78,91,92. Saliva natura (con polisacáridos, Medac) se introdujo en 2006 para sustituir a Saliva medac (Medac). Sin embargo, tras largos periodos de almacenamiento se observó un efecto de desmineralización sobre la dentina92, y también sobre el esmalte78,93. Se podía conseguir remineralización in vitro con una solución de Saliva natura modificada experimentalmente, sobresaturándola levemente con fosfato de octacalcico y dihidrato de fosfato dicalcico92,94. En resumen, se ha encontrado in vitro, un sustituto salival estable que presenta un efecto de remineralización y previene la caries dental, sin embargo estos resultados deben corroborarse mediante estudios clínicos.
Conclusión
La hiposalivación es frecuente entre los pacientes que presentan diferentes enfermedades sistémicas autoinmunes, hormonales, neurológicas, y psicogénicas, pero también tras la toma de diferentes medicamentos o tras la exposición a radioterapia en la región de cabeza y cuello. La presentación de estos factores etiológicos puede acompañarse de cambios cuantitativos y cualitativos de los componentes salivales como aumento de la viscosidad, reducción de la capacidad de tamponamiento, alteración de las concentraciones de electrolitos salivales, y cambios en el sistema antibacteriano no inmune e inmune. Estas alteraciones pueden conducir a serias consecuencias para la salud oral como hiposalivación, caries rampante e infección oral por hongos, disminución de la capacidad de ingerir alimentos, dificultades en el habla, y muchos otros. Asegurar la humedad en la mucosa oral ayuda a aliviar los síntomas de hiposalivación en los pacientes. Para este propósito se han desarrollado los sustitutos salivales. Hasta la fecha, no se han realizado todavía estudios clínicos que hayan evaluado el efecto de los sustitutos salivales sobre los tejidos duros dentales. Considerando los resultados de varios estudios in vitro, los clínicos deberían optar a la hora de escoger un sustituto salival por aquellos que contienen flúor y por los que están sobresaturados con calcio y fosfato.
Correspondencia: M. Wolgin.
Abteilung für Zahnerhaltungskunde und Parodontologie, CharitéCentrum 3 für Zahn-, Mund- und Kieferheilkunde, Charité-Universitätmedizin Berlin, Assmannshauser Strasse 4-6, 14197 Berlín, Alemania.
Correo electrónico: michael.wolgin@charite.de