Los defectos de hueso alveolar siempre que se pueda deben corregirse con hueso autólogo. Aunque los autoinjertos representan el procedimiento estándar para injerto óseo, en algunos pacientes no es posible reunir suficiente cantidad de hueso. Hay que tener en cuenta también que los injertos de hueso autólogos presentan el inconveniente de requerir una segunda cirugía para recuperar el autoinjerto, lo que representa un mayor tiempo de intervención y anestesia, y presentan cierta morbilidad en las zonas donantes1. Por otra parte, los biomateriales resultan caros en comparación con el hueso de autoinjerto o de banco, y en ocasiones pueden extruirse2. Por todo ello, el empleo de hueso de aloinjerto representa una alternativa razonable cuando se necesita un material de injerto1,2.
El transplante de hueso de aloinjerto lleva haciéndose en humanos desde hace más de 100 años y cada vez es más empleado por los cirujanos ortopédicos3.
Existen varias formas de almacenamiento de aloinjertos de hueso: Entre ellas están el hueso fresco congelado (HFC), el hueso seco congelado (HSC), y el hueso fresco seco desmineralizado (HSFD). Cada una de estas formas conlleva sus riesgos y limitaciones propias y sus características de manejo especiales. El cirujano debe estar familiarizado con las propiedades de cada uno de estos materiales, para poder emplearlos adecuadamente, y debe cerciorarse de que el banco de hueso que suministra el injerto es seguro y estéril4.
El concepto de osteointegración, es decir, el anclaje directo de implantes endoóseos comercializados de titanio puro o de aleación de titanio al hueso, ha producido una autentica revolución en el campo de la rehabilitación oral5. Los principales objetivos de la literatura más reciente sobre implantes son la identificación de los factores que determinan la tasa de supervivencia a largo plazo (TSV, es decir, total de implantes que permanecen en su sitio al termino del período de seguimiento y la tasa de éxito (TE, es decir, buenos resultados clínicos, radiológicos y estéticos). En concreto, uno de los principales objetivos es identificar procedimientos estándar que acorten el tiempo de rehabilitación oral manteniendo al mismo tiempo unas elevadas tasas TSV y TE.
Son pocos los trabajos que versan sobre el tiempo que se necesita para la rehabilitación protésica con implantes colocados sobre injerto de hueso, y todos los que hay tratan de autoinjertos6-10.
El protocolo estándar en dos fases prescribe una demora de aproximadamente 4 a 6 meses desde la colocación del implante hasta la rehabilitación protésica6,7. Bell et al estudiaron implantes endosteal colocados, tras respetar un período de reposo, sobre injertos. Estos produjeron, antes de la colocación del implante, una perdida vertical media de hueso del 33,0%. Tras la colocación de los implantes la perdida vertical era despreciable en la región soportada por los mismos. Stach y Kohles7 examinaron el resultado clínico de implantes colocados mediante un mismo protocolo quirúrgico y reseñaron una TSV global a los 4 años del 98,4%.
Recientemente se ha propuesto la carga inmediata o temprana de implantes colocados sobre autoinjertos8-10. La carga inmediata significa colocar la restauración protésica final o provisional inmediatamente después de la cirugía10, mientras que la carga temprana significa colocar la restauración protésica final o provisional en los siguientes dos meses de la colocación de los implantes9,10.
En las restauraciones de carga temprana sobre autoinjertos, Raghoebar et al9 reseñaron una TSV del 95,6%, en el seguimiento poscarga de 1 año, mientras que Malchiodi et al10 presentaron una TSV del 91,0. Chiapasco et al8 se centraron en el resultado clínico de implantes dentales de carga inmediata colocados en mandíbulas edéntulas severamente atrofiadas, tras la reconstrucción con injertos autógenos multicapas, reseñando a 1 a 3 años una TSV y TE del 100% y 95,7% respectivamente. Sin embargo, en este estudio, los implantes se colocaron después de 8 meses, y no 6 meses, desde el momento del injerto.
Como el HFC presenta cada vez mayor número de aplicaciones clínicas y no se dispone de ningún trabajo sobre el tiempo «estándar» recomendable para la carga de restauraciones protésicas en implantes colocados sobre homoinjertos, se llevó a cabo un estudio retrospectivo sobre una serie de implantes cargados a los 4 meses de su colocación.
Método y materiales
Entre diciembre de 2003 y diciembre de 2006, 81 pacientes (52 mujeres y 29 hombres) con una edad media de 52 años fueron intervenidos en el Hospital Civil de Castelfranco Veneto, Italia. De ellos, 22 pacientes (10 mujeres y 12 hombres), con una edad media de 51 años, habían sido tratados con implantes colocados sobre homoinjertos antes de 6 meses (mediana de 4 meses). En todos los pacientes se obtuvo un consentimiento informado escrito aprobado por el Comité de Ética Local para poder emplear los datos obtenidos con fines de investigación. El período de seguimiento medio de los implantes fue de 27 meses (fig. 1).
Figura 1. Esquema del tratamiento.
Se colocaron injertos homólogos de HFC en los maxilares de los pacientes bajo anestesia general. El tratamiento fue realizado por 5 clínicos, todos pertenecientes al mismo equipo. Todos los pacientes fueron sometidos a injertos para aumento horizontal sin membrana. El período medio que se respetó tras la colocación de los injertos fue por lo general de 6 meses antes de proceder a la cirugía de implantes, y la restauración protésica final se retrasó 4 meses más.
Los sujetos fueron seleccionados de acuerdo con los siguientes criterios de inclusión: higiene oral controlada, ausencia de lesiones en la cavidad oral, y suficiente volumen de hueso residual (antólogo más injerto de HFC) para recibir implantes de al menos 3,25 mm de diámetro y 8,0 mm de longitud; además, los pacientes tenían que estar de acuerdo en participar en un programa de seguimiento postoperatorio.
Los criterios de exclusión fueron los siguientes: volumen insuficiente de hueso; bruxismo en grado importante; fumador de más de 20 cigarrillos/día; consumo excesivo de alcohol; radioterapia localizada de la cavidad oral; quimioterapia antitumoral; enfermedades hepáticas, sanguíneas o renales; inmunosupresión; tratamiento actual con corticoides; embarazo; enfermedades inflamatorias y autoinmunes de la cavidad oral; y mala higiene oral11,12 (puntuación de placa global > 20%).
El HFC, obtenido del Banco de Tejidos Veneto de Treviso, Italia, era hueso homologo congelado, mineralizado, no irradiado, solo desinfectado. El hueso se obtiene de cresta iliaca anterior o posterior en las primeras 12 h tras la muerte del donante. A continuación el hueso se desinfecta durante al menos 72 h a -4 ºC, en una solución poliantibiótica de vancomicina, polimixina, glacidina, y lincomicina; después de ello, la muestra se irriga con una solución salina estéril. A continuación se subdivide en bloques corticomedulares, que se empaquetan en envoltorios estériles dobles, y se congelan a -80 ºC.
Los requisitos para ser donante de hueso homologo son más estrictos que los de donantes de órganos. La presencia de factores de riesgo como enfermedades contagiosas, neoplasias, enfermedades reumáticas o degenerativas, y sepsis excluye necesariamente al donante. Para detectar posibles agentes infecciosos, las muestras de sangre del donante tomadas dentro de las 8 h siguientes a la muerte se someten a los siguientes análisis: Ac anti HIV-I/II, Ac anti-HCV, AgHbs, Ac anti-HBc, Ac anti-HBs, Ac anti-HTLV-I/II, Ac anti-Ag treponémico, Ac anti-IgG CMV, Ac anti-IgM CMV, Ac antitoxoplasma IgG, Ac antitoxoplasma IgM (Ac: anticuerpo; CMV: citomegalovirus; HCV: virus de la hepatitis C; HTLV: virus linfotrófico T humano tipo I; Ig: inmunoglobulina). También se toma un cultivo para detectar bacterias aeróbicas y anaeróbicas, micobacterias, y agentes micóticos. Para mayor seguridad, se realiza además un seguimiento serológico empleando la técnica de reacción de la polimerasa en cadena para detectar cualquier ARN o ADN de los virus HIV, HCV, y hepatitis B (HBV). Este método reduce el período de ventana diagnóstico a 7 días para HIV, HCV, y HBV.
Antes de la cirugía, se realizaron exámenes radiológicos mediante radiografía panorámica, y tomografías computarizadas.
En cada paciente, se evaluaron los niveles de cresta ósea peri-implante mediante examen calibrado de las radiografías panorámicas. Las mediciones se registraron antes de la cirugía, después de la misma, y al término del período de seguimiento. Las mediciones se realizaron mesial y distalmente a cada implante, calculando la distancia entre el borde del implante y el punto de contacto más coronal entre hueso e implante. El punto de referencia para las mediciones posteriores se estableció en el nivel de hueso registrado justo después de la colocación quirúrgica del implante. Las mediciones se redondearon a la décima de milímetro. Se empleó una lupa de 7 aumentos con escala de graduación en décimas de milímetro.
La tasa de éxito de los implantes se evaluó de acuerdo con los siguientes criterios: (1) ausencia de dolor o molestias persistentes; (2) ausencia de infección periimplante con supuración; (3) ausencia de movilidad; y (4) ausencia de reabsorción ósea peri-implante mayor de 1,5 mm durante el primer años de carga y de 0,2 mm/ año durante los años siguientes13.
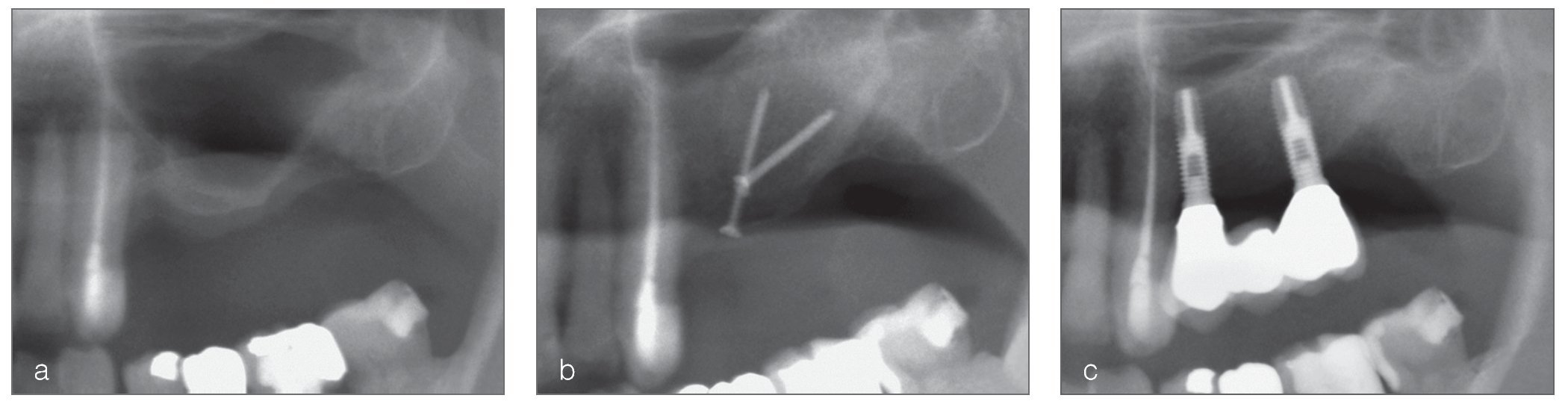
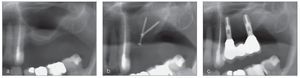
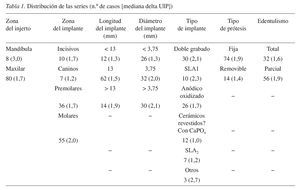
Se colocaron un total de 88 implantes en 22 pacientes: 8 (9,1%) en la mandíbula y 80 (90,9%) en el maxilar. El diámetro y longitud de los implantes osciló entre 3,25 a 5,0 mm y 8,0 a 15,0 mm, respectivamente. Había 30 de doble grabado (3i Osseotite, Biomet), 10 chorreados con arena, grano grueso, y grabados con acido (SLA), (Astra implantes, Astratech), 26 de oxidación anódica (Nobel Biocare implants, TiUnite, Nobel Biocare), 12 CaPO4 (fosfato cálcico) erosionados con cerámica (resorbable blast media[RBM]implants, Lifecore Biomedical), 7 SLA2 (Sweden & Martina, Sweden & Martina Spa) y tres tipos, 2 ITI (ITI implants, Straumann) y 1 Biotec (Povolaro di Dueville, Vicenza). Los implantes se colocaron para remplazar 10 incisivos, 7 caninos, 36 premolares, y 35 molares (fig. 2).
Figura 2. Maxilar superior izquierdo antes de la cirugía (a), después del injerto de hueso (b), y al término del período de observación (c).
Todos los pacientes se sometieron al mismo protocolo quirúrgico. Se administró profilaxis antibiótica con 500 mg de amoxicilina dos veces al DIA durante 5 días comenzando una hora antes de la cirugía. Se empleó anestesia local mediante infiltración de articaína/epinefrina, y analgesia posquirúrgica con 100 mg de nimesulide dos veces al día durante 3 días. Se dieron instrucciones de higiene oral.
Se realizó una incisión crestal y se levantó un colgajo mucoperióstico. Los implantes se colocaron de acuerdo con los procedimientos recomendados por el fabricante (por ejemplo, número y tipo de taladros empleados para la perforación del hueso). La plataforma del implante se posicionó a nivel de la cresta alveolar. Los puntos de sutura se retiraron a los 14 días de la cirugía. Después de un período medio de 4 meses desde la colocación del implante, se retiraron las prótesis provisionales, y se colocó la restauración final normalmente durante las siguientes 8 semanas. El número de unidades de prótesis (es decir, relación implante/corona) fue de 0,7. Todos los pacientes fueron incluidos en un régimen estricto de revisiones (una revisión cada mes).
Como no se perdió ningún implante (TSV = 100%) y no se detectaron diferencias estadísticas entre las variables estudiadas, la ausencia de reabsorción de la cresta ósea o la presencia de una reabsorción pequeña se consideró como indicador de TE para evaluar el efecto de los diferentes factores relativos a huésped, implante, y oclusión.
La diferencia entre la unión implante-pilar y el nivel de la cresta ósea se definió como la distancia de la unión implante-pilar (UIP) y se calculó en el momento de la intervención y durante el seguimiento. La UIP delta es la diferencia entre la UIP en la revisión final y la UIP registrada justo después de la operación. Las medianas delta UIP fueron estratificadas de acuerdo con las variables de interés.
Se realizaron pruebas estadísticas univariadas (algoritmo de Kaplan-Meier) y multivariadas14,15 (regresión de Cox) (nivel de significación P < 0,05).
Resultados
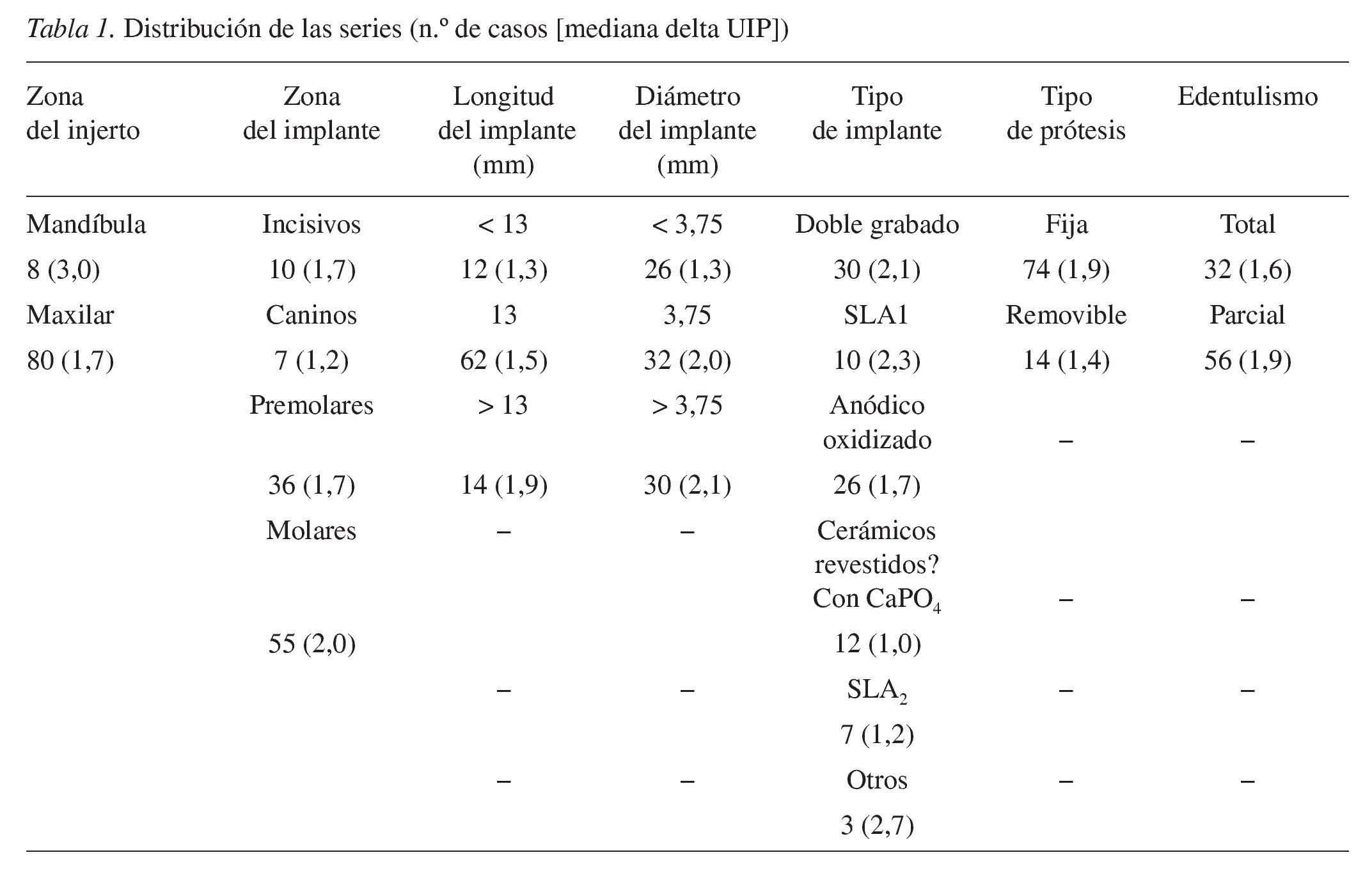
La tabla 1 presenta la UIP delta mediana de acuerdo con las variables estudiadas.
En el período postoperatorio no se perdió ningún implante.
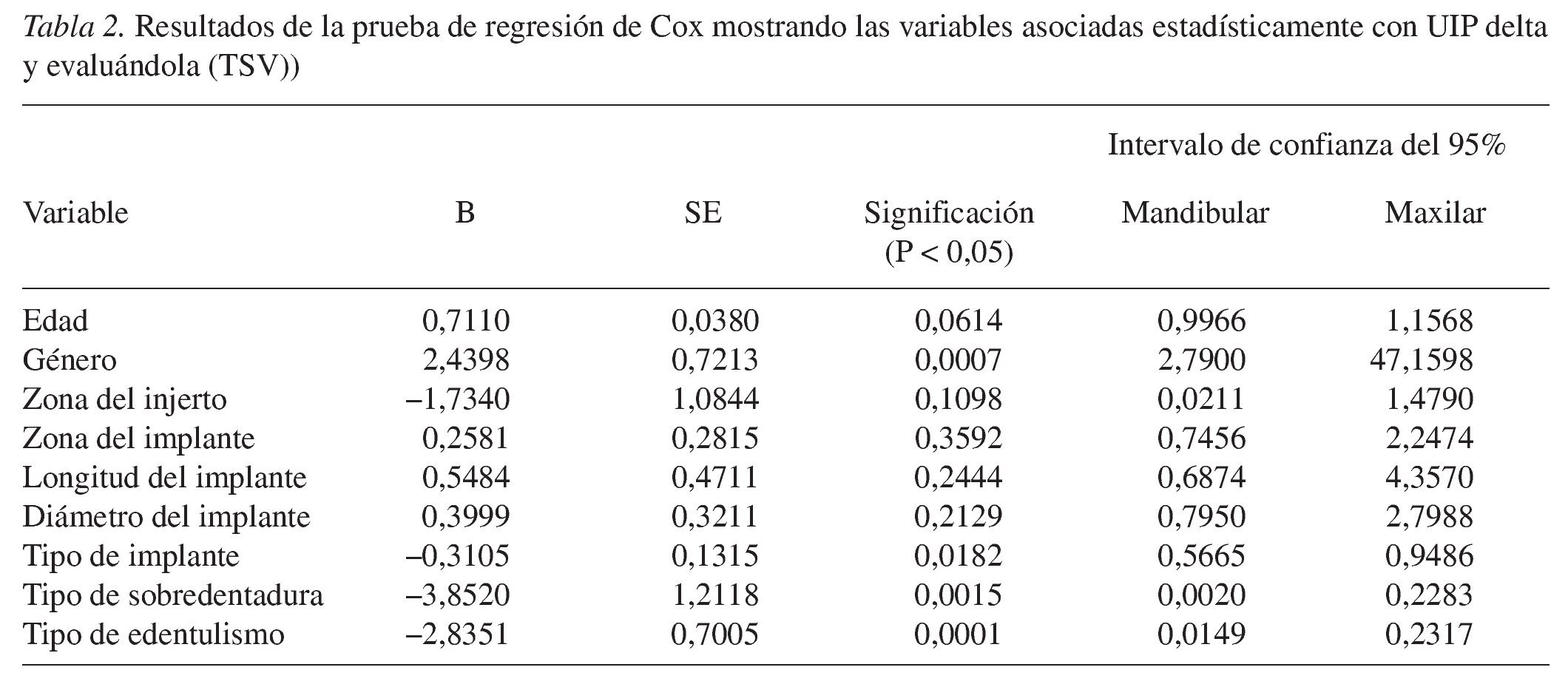
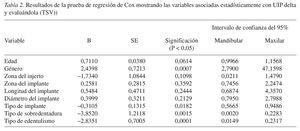
La tabla 2 muestra el tipo de implante (CaPO4 erosionado con cerámica y SLA2; ver tabla 1), restauración de prótesis (sobredentaduras removibles), y tipo de edentulismo (edentulismo total) correlacionados con una UIP delta significativamente inferior desde el punto de vista estadístico (es decir, perdida de cresta ósea reducida) y por lo tanto un mejor resultado clínico.
La UIP delta mediana fue de 2,0 para los implantes cargados 4 meses después y de 1,8 para un grupo de 209 implantes colocados sobre HFC después de 6 meses. (no se muestran los datos; pueden solicitarse). No se encontraron diferencias estadísticamente significativas (prueba de rango log = 0,26, df = 1, P = 0,6073).
Discusión
Los principales objetivos de la literatura reciente son la identificación de las normas generales que permiten conseguir buenas TSV y TE a largo plazo (es decir, buenos resultados clínicos, radiológicos y estéticos). Son distintas las variables que pueden influir en el resultado final, pero en general se agrupan como factores relativos a (1) la cirugía, (2) el huésped, (3) el implante y (4) la oclusión16. Los factores relativos a la cirugía comprenden distintas variables como el exceso de trauma quirúrgico por ejemplo el trauma térmico17, preparación del hueso, y grado de afilado y diseño de los taladros18. Los factores relativos al huésped más importantes son la calidad y cantidad de hueso18,19, mientras que los factores más importantes relativos a los implantes son la longitud20 y diseño21-23, recubrimiento de la superficie24 y diámetro25. Finalmente, las variables de interés en los factores relativos a la oclusión son la calidad y cantidad de fuerza26 y diseño de la prótesis27. Todas estas variables son materia de investigación científica ya que todas ellas pueden influir en el resultado clínico.
En general, los factores relativos a los implantes más relevantes son la longitud, diámetro, y tipo de los mismos. En el presente estudio, el tipo de implante tuvo un impacto estadísticamente significativo sobre el resultado clínico, dando lugar a resultados estadísticamente mejores en los implantes con superficies CaPO4 erosionadas con cerámica y los SLA2. Stach y Kohles7 reseñaron que la calidad del hueso influye sobre los implantes mecanizados, y viceversa, los diferentes tipos de implantes podrían arrojar resultados distintos cuando se colocan sobre materiales de injerto diferentes.
Se cree que la calidad del hueso, un factor relacionado con el huésped, es uno de los predictores más importantes del resultado. Es bien conocido que la mandíbula (especialmente la región interforaminal) presenta una mejor calidad de hueso que el maxilar, y probablemente este hecho justifica por qué los informes que existen sobre implantes de carga inmediata son informes sobre implantes colocados en la mandíbula28. Los presentes datos mostraron que el HFC es un material efectivo para restaurar volumen de hueso alveolar, ya que no se perdió ninguno de los implantes y el nivel de reabsorción de hueso marginal fue bajo. Por otro lado, las variables relativas a los maxilares en los que se colocó el injerto y a la zona de los implantes no fueron estadísticamente significativas.
Entre los factores relativos a la oclusión, no se detectaron diferencias respecto a la TSV. Sin embargo, se detectó un resultado mejor en las prótesis removibles y en los pacientes totalmente edéntulos. Estos datos finales no son sorprendentes, ya que los pacientes parcialmente edéntulos, sobretodo los que presentan historia de periodontitis crónica, pueden presentar profundidades de bolsa al sondaje a largo plazo significativamente mayores, pérdida de hueso marginal perimplantario, e incidencia de perimplantitis en comparación con los pacientes que presentan buen estado de salud periodontal29.
No se encontraron diferencias de TSV y TE cuando se compararon los implantes colocados sobre HFC y cargados después de 4 meses (grupo 1) respecto a los cargados después de 6 o más meses (grupo 2). Los informes previos8-10 demostraron que la carga temprana y la carga inmediata son procedimientos aptos para injertos antólogos.
Todos los pacientes fueron sometidos a injertos con HFC sin membrana debido a que en el presente estudio solo se quería estudiar la efectividad del HFC. Existen varios tipos de membranas para regeneración tisular guiada; dan buenos resultados y se usan de forma generalizada en los defectos intraóseos30. Serán necesarios estudios adicionales para verificar si las membranas presentan ventajas frente al empleo de HFC solo.
Conclusión
Una demora de cuatro meses desde el injerto hasta la colocación de los implantes resulta un período seguro para obtener altas TSV y TE.
Agradecimientos
Este trabajo fue sufragado por FAR de la Universidad de Ferrara (F.C.), Ferrara. Italia, y por Regione Emilia Romagna, Programa di Recerca Regione Universitá 2007-2009 Area 1B: Patologia osteoarticolare: recerca pre-clínica e aplicazioni cliniche Della medicina rigenerativa Unità Operativa n. 14.
Correspondencia: Francesco Carinci.
Chair of Maxillofacial Surgery.
Arcispedale S. Anna, Corso Giovecca 203, 44100 Ferrara, Italia.
Correo electrónico: crc@unife.it