En el transcurso de los procesos de cicatrización que siguen a una extracción dentaria se observa normal-mente una pérdida de volumen de la cresta alveolar. Esta pérdida puede comprometer el lecho de tejido duro y de tejido blando para las implantaciones posteriores, pero también puede influir en el resultado estético del tratamiento con puentes. Para evitar los procesos de re-absorción, se han desarrollado en los últimos años di-versos procedimientos destinados a preservar el hueso maxilar. Además del relleno de los alvéolos con material de sustitución ósea y de la cobertura con membra-nas o injertos de mucosa, se han estudiado numerosas técnicas destinadas a optimizar el lecho de tejido duro y de tejido blando para los tratamientos posteriores. Sin embargo, todos estos procedimientos interfieren en el proceso de cicatrización fisiológico del organismo, un hecho que hay que tener presente en el momento de planificar e implantar medidas encaminadas a la preservación de los alvéolos.
AntecedentesEn la implantología moderna, el posicionamiento tri-dimensional correcto de un implante es una condición importante para mantener la estabilidad funcional y es-tética a largo plazo29. Colocar un implante excesivamen-te hacia vestibular favorece la aparición de recesiones estéticamente desfavorables en la mucosa vestibular o que el cuerpo de titanio trasluzca a través de la mucosa como consecuencia de la delgadez de la tabla ósea vestibular. Una inserción excesivamente hacia palatino o lingual puede complicar el tratamiento protésico posterior. Pero, en determinadas circunstancias, la altura del hueso mesial y distal adyacente al implante puede reper-cutir considerablemente en la estética blanca y roja por la influencia de la papila52. Estos y otros factores ponen de relieve la importancia crucial de disponer de un lecho óseo suficiente para el tratamiento con implantes.
El tejido óseo está sometido a un proceso de remo-delación continuo durante el que las trabéculas óseas se reorientan en función de distintas situaciones de carga. Los aumentos crecientes de la carga fisiológica se acom-pañan de un incremento de la densidad o de la masa ósea. En cambio, las disminuciones de carga progresi-vas hasta llegar a la inactividad se asocian a una pérdida de tejido óseo52. Además, algunos procesos que afectan sobre todo al hueso del maxilar como periodontitis cró-nicas, quistes de gran tamaño, inflamaciones o también masas tumorales provocan pérdidas importantes de hueso de la cresta alveolar.
En diversos estudios clínicos se demostró que la pérdida significativa de tejido óseo durante el período de cicatrización postextracción era un fenómeno habitual53. Esto sugiere la necesidad de abordar de forma preventi-va ya en el momento de la extracción las reabsorciones óseas asociadas a esta sobre todo en las distintas alterna-tivas de rehabilitación con implantes.
Cicatrización del alvéolo de extracciónAntes de reflexionar sobre las técnicas para la preservación de los alvéolos de extracción se debe estudiar el mecanismo que hace posible la cicatrización del tejido óseo y del tejido blando después de la extracción denta-ria. La bibliografía recoge diversos estudios en animales de experimentación en los que se confeccionaron pre-paraciones histológicas a partir de segmentos maxilares extraídos en distintas fases de la cicatrización3,17,18. Estos estudios se complementan con estudios clínicos obser-vacionales diseñados habitualmente como estudios lon-gitudinales1,2,12,48,53. De estos estudios se ha derivado una secuencia cronológica dividida en cinco etapas de cicatrización histológica:
- 1)
Formación y maduración de un coágulo sanguíneo.
- 2)
Organización del coágulo por neoformación de va- sos sanguíneos y fibroblastos (4 a 5 días).
- 3)
Formación de una matriz provisional (14 a 16 días).
- 4)
Organización ósea de la matriz provisional y recu- brimiento de los alvéolos con tejido epitelial (hasta 6 se- manas).
- 5)
Remodelación ósea/remodelación1,2,12 (5 a 10 se- manas).
El seguimiento de los cambios dimensionales del hueso después de la extracción permite demostrar una pérdida del volumen óseo original tanto en sentido vertical como en sentido horizontal. En relación con este proceso se ha demostrado el predominio de reabsorcio-nes en la pared ósea alveolar vestibular del maxilar3,40. Este fenómeno se manifiesta con menor intensidad en la mandíbula, lo que se atribuye a una cortical ósea más gruesa en comparación con la del maxilar. La re-absorción de predominio vestibular provoca indefec-tiblemente un desplazamiento de la apófisis alveolar central en sentido lingual40. La intensidad de la atrofia parece ser máxima durante los primeros 3 a 6 meses después de la extracción dentaria48, mostró grandes diferencias en función de la región48 y se vio influida por factores como el número de dientes extraídos, el tamaño del defecto y la composición del hueso7,51. En resumen, tanto en estudios clínicos como en estudios preclínicos se pudieron observar reabsorciones siste-máticas de hasta 2mm en sentido vertical y de hasta 4mm en sentido horizontal en el primer año después de la in-tervención3,16,31,36,37,48,53.
Método de extracciónExisten evidencias de que el propio procedimiento qui-rúrgico de la extracción ya influye notablemente en la pérdida de tejido óseo prevista en relación con la extracción dentaria. Se trata por una parte de prevenir con un procedimiento lo más atraumático posible una posible fractura de la pared alveolar vestibular, que a menudo es extremadamente delgada (figs. 1 a 4). Asimismo se dispone de sistemas de extracción especiales cuyo uso consecuente proporciona una luxación menos traumá-tica. En el mercado existen, además de periostótomos, elevadores y fórceps especiales de formas diferentes, sistemas sofisticados que suelen basarse en la fijación de la raíz y en la aplicación controlada de fuerzas exclusi-vamente verticales.
En dientes con grandes lesiones de caries o con frac-turas radiculares intraoperatorias se deben evitar expo-siciones u osteotomías amplias desde vestibular debido a la especial tendencia de la cresta alveolar a la reabsor-ción en esta localización3. En un estudio en animales de experimentación, el despegamiento del mucoperiostio se asoció ya de por sí a un aumento de la pérdida de tejido óseo26. Los elevadores de raíces con formas específicas o abordajes en mesial o distal de la raíz pueden contribuir a preservar la integridad de la tabla vestibular. Como procedimiento alternativo en presencia de porciones radiculares de menor tamaño se puede utilizar un abordaje similar al de las apicectomías. También en este caso hay que tener en cuenta que el despegamiento del mucoperiostio ya conlleva una pérdida de tejido óseo26.
Esponjas de colágenoUn método sencillo para rellenar el alvéolo es aplicar una esponja de colágeno en la herida de extracción (figs. 5 a 12). En estudios propios hemos observado que los co-lágenos dentales disponibles actualmente son capaces de activar las plaquetas y de favorecer la coagulación a tra-vés de las mismas incluso después de procesar el material de origen animal46. Como se sabe por las membranas de colágeno es imprescindible asegurar una elevada bio-compatibilidad y naturalidad del colágeno utilizado. Si bien los colágenos reticulados se reabsorben con mayor lentitud, pueden favorecer complicaciones cicatriciales y reabsorciones óseas debido a su tendencia a reabsor-berse con un componente inflamatorio8,44,45. Según los resultados de un estudio reciente, la presencia de fibroblastos del ligamento periodontal no parece influir en la regeneración ósea17. Sin embargo, en este estudio se observó una presencia significativamente mayor de tejido mineralizado después de la aplicación de esponja de colágeno que en alvéolos control no tratados, lo que su-giere una cierta ventaja a favor del uso de esponjas de colágeno17.
La cobertura de alvéolos postextracción con membra-nas de PTFEe dio lugar a una alteración dimensional de la cresta alveolar significativamente menor en com-paración con alvéolos de control no tratados37. Se obtu-vieron resultados comparables con el uso de membra-nas de PLA/PGA36. Sin embargo, la exposición precoz de la membrana de PTFEe dio lugar a un empeora-miento significativo de los resultados37. Para conseguir la integración sumergida de la membrana sin colgajo de desplazamiento coronal, Chen y Dahlin20 recomen-daron cubrir el alvéolo postextracción y la membrana con un injerto de tejido conjuntivo libre. Esta técnica permitió la integración de 22 de un total de 24 mem-branas durante un período de 6 meses sin problemas de exposición20. Jung et al32 también obtuvieron buenos resultados con esta técnica. El injerto de tejido conjuntivo procede habitualmente del paladar. El defecto generado cura por segunda intención con formación de tejido de granulación (figs. 6 y 7). Con el sellado del alvéolo postextracción se proporciona soporte al tejido blando, de modo que la menor contracción de la herida facilita el manejo posterior del tejido blando. Con me-didas protésicas se puede conseguir un efecto similar: inmediatamente después de la extracción se coloca un póntico que se extiende por debajo del margen gingival. Un método relativamente nuevo consiste en aplicar una membrana de colágeno en vestibular por dentro y por en-cima del alvéolo, tras lo que se produce la granulación libre de la encía sobre la membrana (figs. 13 a 21). Hay que tener en cuenta que los colágenos expuestos a la cavi-dad oral se reabsorben de forma notablemente más rápida que las matrices con integración sumergida. Se responsa-biliza de este fenómeno a distintos gérmenes marcadores periodontopatógenos, los cuales tienen la capacidad, igual que los macrófagos y los fibroblastos, de sintetizar cola-genasas15,49. Se debería prescindir de la cobertura plásti-ca completa de cara a un futuro manejo del tejido blando especialmente en la zona estética. Todas las técnicas con membrana se pueden complementar con el uso de material de sustitución ósea para proporcionar un plus de esta-bilidad al alvéolo.
En un estudio con animales de experimentación la im-plantación infracrestal de conos de hidroxiapatita con forma de raíz prefabricados y no reabsorbibles permitió reducir la atrofia vertical de la cresta alveolar en compa-ración con los alvéolos postextracción no tratados24,41,47. Sin embargo, estas estructuras implantarias sólidas mos-traron en condiciones clínicas una tasa de fracaso eleva-da34 especialmente en comparación con la hidroxiapatita particulada22. Se puede llevar a cabo un relleno análogo al defecto del alvéolo postextracción utilizando gránulos de β-fosfato tricálcico (β-TCP) que se conforman ade-cuadamente mediante poliláctidos (PLA)/poliglicólidos (PLG) después de la toma de impresión de la raíz del diente exodonciado38,39. Aunque se ha demostrado his-tológicamente que los gránulos de β-TCP se reabsorben en un período de 60 semanas, parecía que la regeneración de los alvéolos postextracción era más dilatada en el tiempo en comparación con el grupo control no tra-tado38. Se describió un caso clínico en el que la implantación de una réplica de raíz de poliláctido permitió preservar las dimensiones de la apófisis alveolar durante un período de observación de 21 meses50. Sin embargo, no se lograron confirmar estos resultados en estudios en animales de experimentación propios42.
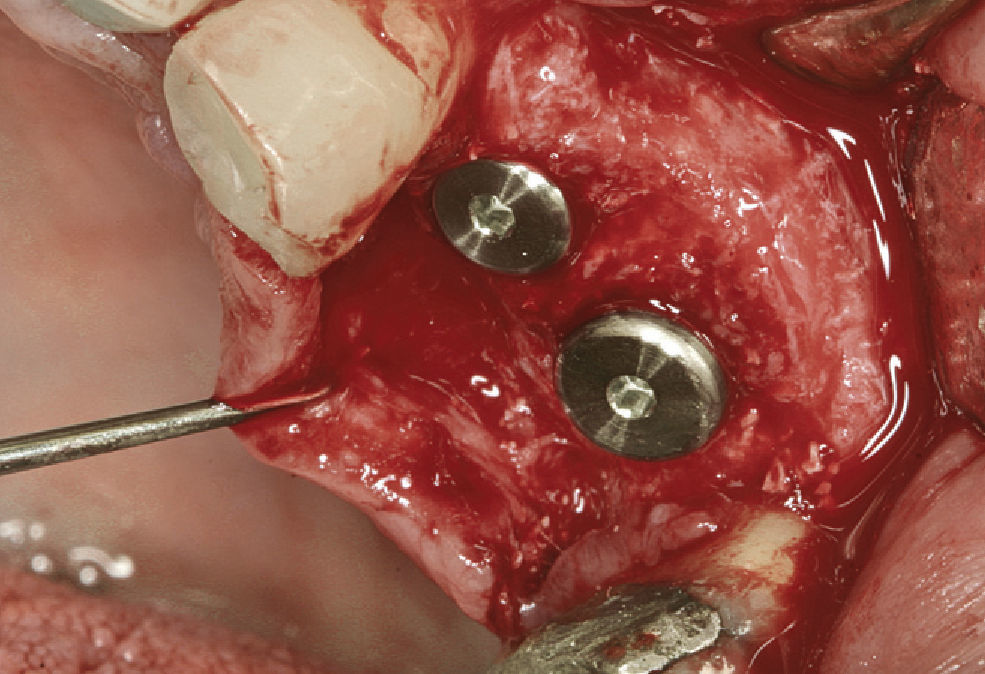
Materiales de sustitución óseaSe ha investigado en diversos estudios la influencia posi-tiva del relleno adicional del alvéolo postextracción con materiales que ofrecen soporte a la membrana (figs. 22 a 27). Dies et al25 mostraron que una membrana de PTFEe con y sin aplicación de material de sustitución ósea alogénico o xenogénico propició la regeneración de defectos de dehiscencia vestibulares en el alvéolo postextracción después de un período de 6 a 9 meses. Sin embargo, la calidad histológica del hueso regenerado fue mejor en el grupo control en el que no se utilizó material de sustitución ósea25. Carmagnola et al19 obtuvieron resultados comparables, dado que el uso de material de sustitución ósea xenogénico dio lugar a una cicatriza ción sobre todo a expensas de tejido conjuntivo en la zona del alvéolo postextracción. Por otro lado, el uso exclusivo de una membrana de colágeno nativo propor-cionó una calidad de hueso similar a la observada en el grupo control no tratado19.
Aunque en otras descripciones de casos clínicos el material de sustitución ósea alogénico, xenogénico y aloplástico influyó positivamente en la regeneración ósea en la zona del alvéolo postextracción, en muchos casos no se logró demostrar su capacidad de reabsorción en el período de observación correspondiente5,6,14,54,55. Al contrario, Becker et al10 observaron que los injertos óseos alogénicos, xenogénicos y autógenos provocaron en la misma medida un retraso en la cicatrización alveolar. La aplicación de una hidroxiapatita nanocristali-na en forma de pasta se asoció a la permanencia de una cantidad residual importante de material en los alvéolos después de 6 meses en algunos casos, mientras que en el grupo control la cicatrización evolucionó con norma-lidad43. Tampoco se observaron ventajas en relación con los cambios de dimensión. No obstante, se pudo cons-tatar que por medio del uso de materiales de sustitución ósea y de membranas era posible influir positivamente en la reabsorción ósea postextracción en la zona de la cresta alveolar en comparación con grupos control no tratados23.
Implantes inmediatosLos implantes inmediatos9,13,21,27,35,28 se colocan en el alvéolo inmediatamente después de la extracción del dien-te. Es conveniente que el implante se coloque en una posición orientada más hacia palatino. En general, los espacios periimplantarios curan sin complicaciones y sólo requieren rellenarse con un material adecuado los espacios de grandes dimensiones11. En un estudio en ani-males de experimentación no se consiguió compensar los procesos de reabsorción de la cortical ósea vestibu-lar mediante la implantación inmediata de un implante de titanio roscado4. Hay que recalcar, sin embargo, que en este estudio se había efectuado una desperiostización del lugar de extracción, un procedimiento que ya de por sí se acompaña de una pérdida ósea26. Happe30 parte de la base de que el implante inmediato puede proporcio-nar resultados estables a largo plazo y estéticamente sa-tisfactorios en pacientes con un biotipo gingival grueso y un alvéolo intacto. En los procedimientos de carga en dos tiempos y aumento simultáneo se pueden utilizar injertos pediculados de tejido conjuntivo palatino para cubrir con un tejido vital los defectos previamente relle-nados33. La conexión de la corona provisional en el procedimiento de carga inmediata favorece el soporte del tejido blando inmediatamente después de la intervención.
Evaluación crítica de distintas técnicasEn un estudio de revisión actual se identificaron mediante una búsqueda en Medline 135 estudios publicados entre 1999 y 2008 sobre el tema del acondicionamiento alveolar y se evaluó su nivel de evidencia científica53. Los au-tores llegaron a la conclusión siguiente después de selec-cionar 37 estudios en humanos: existen diversas técnicas quirúrgicas capaces de disminuir las pérdidas de dimensión en sentido horizontal y en sentido vertical después de una extracción dentaria. Los resultados difieren sobre todo en relación con el alcance de la regeneración ósea y con la presencia de restos de material de sustitución ósea en los alvéolos. A pesar de que ninguna de las técnicas destaca por encima de las demás, se pudo mostrar que la cobertura completa del alvéolo con tejido blando no pa-rece ser imprescindible. Por ahora, los datos disponibles no han permitido llegar a conclusiones basadas en la evidencia relativas al resultado estético del tratamiento, la estabilidad a largo plazo o la tasa de supervivencia de los implantes53. Los distintos procedimientos no parecieron influir de forma significativa en la posibilidad general de colocar implantes posteriormente.
ConclusiónEn general, se puede afirmar que, junto con una técnica de extracción atraumática, el procedimiento de la preser vación alveolar («socket preservation») con uso de material de sustitución ósea y membranas o injertos de tejido mucoso es un tratamiento de eficacia probada sobre todo en la zona estética. Pero por otra parte hay que tener pre-sente que toda manipulación supone una interferencia en los procesos de cicatrización fisiológicos del alvéolo post-extracción. Esta posibilidad puede incrementar la tasa de complicaciones y fracasos especialmente en relación con la falta de experiencia de los terapeutas. Aunque a veces el material de sustitución ósea introducido sólo es rodea-do por tejido conjuntivo, se prevé que gracias al soporte del tejido blando se logrará preservar su contorno sobre todo en el caso de material resistente a la reabsorción. De este modo durante la colocación del implante se facilita la reconstrucción de posibles defectos óseos.