Entre las alternativas a la cirugía conservadora del cáncer de mama, la ablación por radiofrecuencia (ARF) es la que ha alcanzado mayor difusión. Nuestro objetivo es determinar la factibilidad, seguridad y eficacia de esta técnica en nuestro medio.
Material y métodosSe realiza ARF de carcinomas de mama con anestesia local y en la sala de ecografía, tratamiento quirúrgico y comprobación histológica posterior, evaluando los efectos de la ARF sobre el tumor y los tejidos circundantes.
Se incluyeron 35 pacientes con edad media de 61,2±8,25 años, todas con carcinoma infiltrante confirmado percutáneamente,<2cm, alejado de la piel y la pared torácica. Tamaño tumoral medio 8,9±2,9mm. Se realizó linfadenectomía selectiva antes de la ARF. A las 2–4 semanas de ésta se llevó a cabo el tratamiento quirúrgico.
El grado de necrosis de coagulación y la afectación de márgenes se evaluaron con tinción de hematoxilina-eosina, y la viabilidad celular o efectividad de la ARF mediante NADH-diaforasa.
ResultadosEl 85,7% de pacientes no sintió molestias. El 11,4% refirió dolor ligero que pudo ser controlado. El dolor intenso obligó a detener el procedimiento en 1 paciente. No se produjeron otras complicaciones.
Se encontraron cambios de necrosis coagulativa en todos los casos, catalogada como completa en 32/35 (91,4%). La NADH-diaforasa resultó negativa en 27/32 casos en que se realizó. Una fue ligeramente positiva y 4 no valorables.
ConclusiónLa ARF es una técnica factible, bien tolerada, segura y eficaz en casi el 90% de los tumores infiltrantes de mama. La confirmación de su eficacia deberá hacerse mediante seguimiento prolongado de pacientes no intervenidas, con ensayos clínicos en fase III cuidadosamente diseñados y monitorizados.
Among the alternatives to breast conserving surgery in breast cancer, radiofrequency ablation is the most widespread. We aimed to determine the feasibility, safety, and efficacy of this technique in our environment.
Material and methodsWe performed radiofrequency ablation of breast carcinomas under local anesthesia in the ultrasonography examination room.
We included 35 patients (mean age=61.2±8.25 years) with invasive carcinomas measuring less than 2cm (mean diameter=8.9±2.9mm) and located far from the skin and chest wall. Prior to radiofrequency treatment, all patients underwent core biopsy to confirm that the tumors were invasive carcinomas and selective lymphadenectomy. Carcinomas were excised 2 to 4 weeks after radiofrequency treatment and analyzed histologically to evaluate the effects of radiofrequency treatment on the tumor and surrounding tissue.
The degree of coagulation necrosis and involvement of the margins was evaluated using hematoxylin and eosin staining. Cellular viability or effectiveness of the radiofrequency treatment was evaluated using NADH diaphorase.
ResultsIn total, 85.7% of patients reported no discomfort; 11.4% reported mild, controllable pain. Intense pain required the procedure to be discontinued in one patient. No other complications occurred.
Signs of coagulation necrosis were observed in all cases; coagulation necrosis was classified as complete in 32/35 (91.4%). NADH diaphorase was negative in 27 of the 32 cases in which it was performed; one case was slightly positive and the other four were impossible to evaluate.
ConclusionRadiofrequency ablation of breast carcinomas is feasible, well tolerated, safe, and efficacious in nearly 90% of invasive tumors. The efficacy of the technique should be confirmed through extended follow-up of patients without subsequent surgical intervention in carefully designed and monitored phase III trials.
El tratamiento conservador del cáncer de mama, definido como la extirpación quirúrgica del tumor y tejido circundante, asociada a linfadenectomía axilar y complementada con radioterapia, fue, hasta hace pocos años, el tratamiento de elección para pacientes con cáncer de mama en estadios I y II. Ello fue así desde que, en los años ochenta, vieran la luz varios ensayos clínicos en fase III que demostraron, para estas pacientes, resultados similares a los de la mastectomía, en cuanto a supervivencia global y supervivencia libre de enfermedad1–6.
Más recientemente, se desarrolló la técnica de biopsia del ganglio centinela, de morbilidad considerablemente menor que el vaciamiento axilar completo y, por ello, actualmente tratamiento de elección, con eficacia demostrada de la inyección intra y peritumoral del radiotrazador7.
No obstante, la cirugía conservadora de la mama sigue siendo un tratamiento invasivo y de resultado cosmético variable.
Además, y debido al desarrollo de programas de cribado, ha aumentado considerablemente la proporción de carcinomas infiltrantes diagnosticados en estadios precoces, muy frecuentemente<2cm8. En consecuencia, el interés por erradicar los tumores malignos primarios de la mama sin necesidad de cirugía es creciente. Actualmente, esto comienza a vislumbrarse posible debido a la introducción de técnicas ablativas percutáneas, que se han utilizado por varios grupos con resultados dispares9. La radiofrecuencia (ARF) es la que ha alcanzado mayor difusión. Con ella se han obtenido resultados verdaderamente prometedores, con muy buena respuesta al tratamiento y complicaciones secundarias infrecuentes y de menor importancia10–18.
El objetivo de nuestro estudio es determinar si, también en nuestro medio, la ARF de los tumores malignos primarios de la mama es una técnica factible y segura, así como tratar de evaluar y cuantificar su eficacia.
Los resultados que se presentan en este trabajo constituyen los primeros 35 casos de una serie de 50 que pretendemos completar. Su publicación preliminar se debe al hecho de que el ensayo se está demorando en el tiempo, debido a una cierta dificultad en la selección y reclutamiento de pacientes.
Material y métodosEn el año 2005, en el seno de la Unidad de Patología Mamaria (UPM) de nuestro hospital, se decidió comenzar un ensayo clínico consistente en realizar ARF de tumores malignos de mama, infiltrantes y de tamaño<20mm. Todas las pacientes serían intervenidas posteriormente, a fin de conocer los efectos de la ARF sobre el tumor y los tejidos circundantes. La serie se daría por finalizada cuando se hubieran realizado las primeras 50 ablaciones con los mencionados requisitos y metodología.
El estudio recibió la aprobación como ensayo clínico por el Comité Ético de Investigación Clínica del Departamento de Salud del Gobierno de la Comunidad Autónoma, con las siguientes bases:
Criterios de inclusión y exclusiónDichos criterios se referencian en las tablas 1 y 2.
Criterios de inclusión de pacientes
| Pacientes diagnosticadas de carcinoma infiltrante de mama mediante biopsia con aguja gruesa. El diagnóstico percutáneo incluye determinación del tipo y grado histológicos, receptores hormonales y expresión del oncogén Her-2-NEU |
| Tumores claramente visibles y medibles por ultrasonidos, con diámetro<2cm en las 3 dimensiones |
| Tumores alejados al menos 1cm de la piel y de la pared torácica, a fin de evitar posibles quemaduras por efecto de la ablación por radiofrecuencia |
Criterios de exclusión de pacientes
| Sospecha de componente intraductal extenso en mamografía o confirmación histológica del mismo, siempre que éste resulte superior al 25% |
| Pacientes sometidas a quimioterapia neoadyuvante |
| Pacientes en estado de embarazo o lactancia |
| Tumor recurrente o recidivante |
| Alteración severa de pruebas de coagulación |
| Tumores multicéntricos o multifocales |
| Pacientes portadoras de marcapasos |
Cuando el radiólogo de la UPM detecta una posible candidata, en la biopsia con aguja gruesa (BAG) correspondiente extrae al menos 3 cilindros de tejido. Uno de ellos se incluye en suero para congelación y posterior empleo como testigo de positividad en la determinación de la enzima nicotinamida adenin nucleótido-diaforasa (NADH-diaforasa). Los demás cilindros se incluyen en formol para realizar la habitual tinción con hematoxilina-eosina (HE), receptores hormonales y HER-2-NEU. Las pacientes y las lesiones que reúnen los criterios de inclusión y ninguno de los de exclusión, se consideran potencialmente elegibles y, por tanto, el radiólogo realiza una propuesta formal de inclusión.
La admisión definitiva se realiza en la consulta de cirugía de la UPM, donde tras información exhaustiva, verbal y escrita, la paciente es invitada a participar. Se recalca expresamente que la técnica no reportará beneficio individual alguno, pero puede representar un avance futuro para otras mujeres.
Cuando en la exploración clínica o radiológica se sospecha de la presencia de adenopatías axilares metastásicas, este extremo se confirma mediante punción ecoguiada. Si no hay sospecha o no se consigue confirmación, se realiza linfadenectomía del ganglio centinela con anterioridad a la ARF, ya que ésta podría alterar la migración del coloide (sulfuro coloidal de tecnecio 99mTc).
En la presente serie, los hallazgos de resonancia magnética (RM) no fueron considerados criterios incluyentes ni excluyentes.
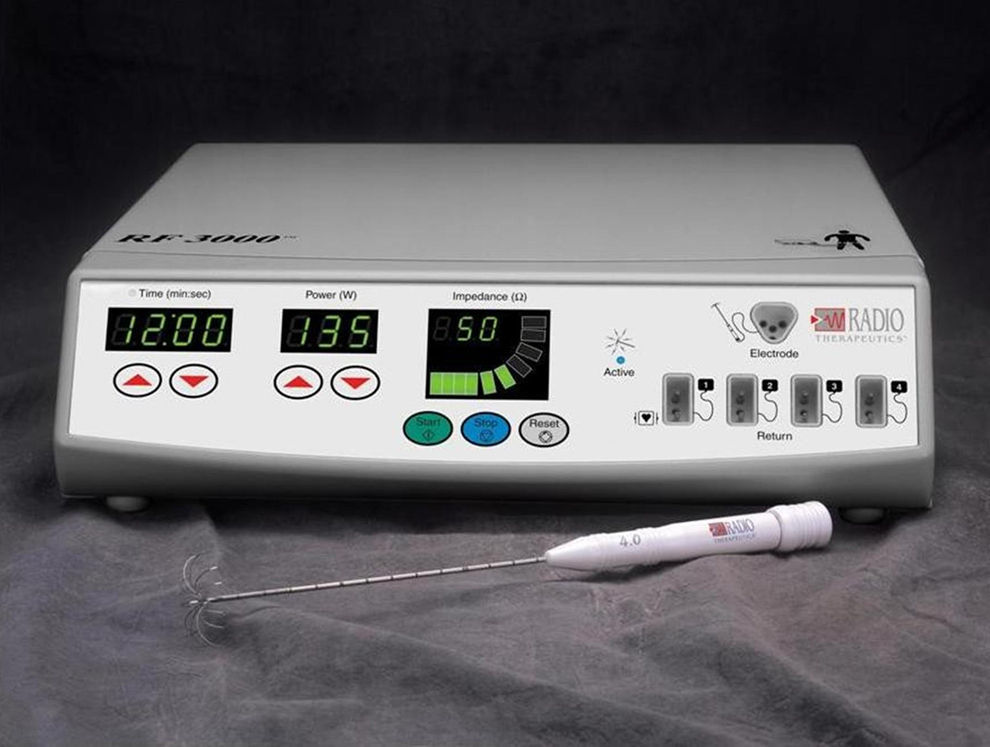
InstrumentaciónSe empleó un generador de corriente alterna de la firma Boston Scientific (RF 3000®) con electrodos LeVeen CoAccess® (electrodos de aguja LeVeen SuperSlim®) específicamente diseñados (fig. 1).
Generador de corriente alterna RF 3000 y electrodo tipo LeVeen, con las púas o electrodos secundarios desplegados. En la cara frontal del generador pueden observarse las ventanas para monitorizar el tiempo aplicado (izquierda), la potencia de la corriente aplicada (centro) y la impedancia tisular registrada (derecha), así como los interruptores para comenzar y finalizar el paso de corriente. En el lado derecho, las conexiones con el electrodo principal y las 4 placas de retorno.
El sistema de electrodos consta de un juego introductor (cánula) y un electrodo expansible multifilamento (EEM) colocado coaxialmente dentro de la cánula, aunque la ablación se realizó siempre en una única posición, sin utilizar el sistema coaxial para aplicar la corriente en diferentes áreas del tumor. Nosotros empleamos cánulas de 15cm de longitud y calibre de 17G.
La configuración del EEM desplegado, en forma de paraguas, permite crear una zona de ablación esferoidal predecible. Nuestro objetivo es que esta zona abarque al tumor y un margen de tejido circundante. Por ello, seleccionamos el diámetro del electrodo (distancia entre las puntas de los filamentos desplegados) en función del diámetro máximo del tumor a tratar. Para tumores <12mm, empleamos un electrodo de 2cm, mientras que para tumores >12mm, escogemos uno de 3cm.
Se aplican a la paciente 4 electrodos desechables o parches de retorno (ValleyLab PolyHesive®), que se conectan a los receptáculos de retorno del generador.
Técnica de ablaciónLos procedimientos son ejecutados en la sala de ecografía mamaria del Servicio de Radiología, con un ecógrafo de alta resolución (Siemens SONOLINE Antares® ultrasound system). La ablación se realiza siempre con participación de personal de enfermería y 2 especialistas, radiólogo y cirujano, ambos especializados en patología mamaria y miembros de nuestra UPM.
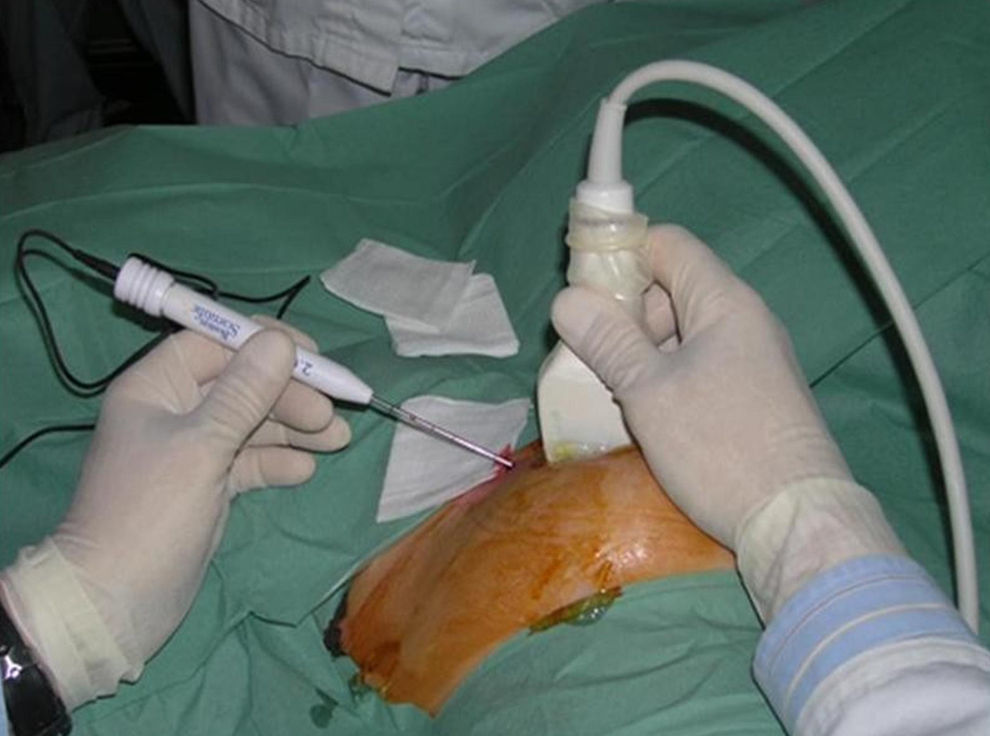
El radiólogo escoge la vía de entrada, señala el punto cutáneo a través del cual introducirá la cánula-electrodo e inyecta 5ml de mepivacaína al 2% por vía subcutánea. En condiciones de esterilidad, se administra la anestesia local profunda (20–30ml de mepivacaína al 2%, diluidos en 30ml de suero fisiológico), desde el punto de entrada hacia el tejido mamario peritumoral. Esta infiltración suele realizarla el cirujano dirigido por control ecográfico del radiólogo. Visualizando en tiempo real, se infiltra anestésico entre la piel y el tumor, entre éste y la fascia pectoral, proximalmente al tumor, sobrepasado éste y a ambos lados. Es decir, rodeando completamente al nódulo tumoral, cuya visibilidad ecográfica queda ligeramente reducida, aunque algo más tarde se recupera. El motivo de la dilución es conseguir una distribución adecuada y homogénea del anestésico en todos los alrededores del nódulo maligno, sin alcanzar dosis que pudieran resultar tóxicas. Luego el radiólogo realiza una pequeña incisión e introduce la cánula-electrodo, siempre bajo control ecográfico (fig. 2) y con una dirección tan paralela a la pared torácica como sea posible. El extremo distal del electrodo principal se coloca en el centro del nódulo y, verificada su correcta colocación, se despliega desde el exterior el grupo de electrodos secundarios, avanzando enérgicamente la porción móvil del mango. Tras comprobar que el grupo de electrodos se ha desplegado correctamente, se conecta el cable de interconexión generador-electrodo y se activa éste. Las ventanas que muestran la potencia aplicada, el tiempo transcurrido y la impedancia tisular, quedan entonces activadas y comienzan a mostrar los valores correspondientes.
Habitualmente, se selecciona una potencia inicial de 5W para electrodos de 2cm y de 10W para electrodos de 3cm. Se va incrementando la potencia, 5W cada 2min. Tras un período variable, de entre 5 y 25min, se produce un incremento brusco de la impedancia, que alcanza valores >250Ω, a la vez que resulta imposible incrementar manualmente la potencia aplicada. Este momento corresponde al punto temporal que denominamos roll-off, situación en la que se da por finalizado este primer ciclo, ya que la aplicación de corriente resulta ineficaz por la elevación de la impedancia. Las potencias que suelen alcanzarse llegan hasta los 25–30W. Tras 30s de descanso, se inicia una segunda fase del procedimiento, generalmente más breve en el tiempo. El procedimiento se interrumpe de nuevo cuando la impedancia tisular supera los 250Ω (segundo punto roll-off).
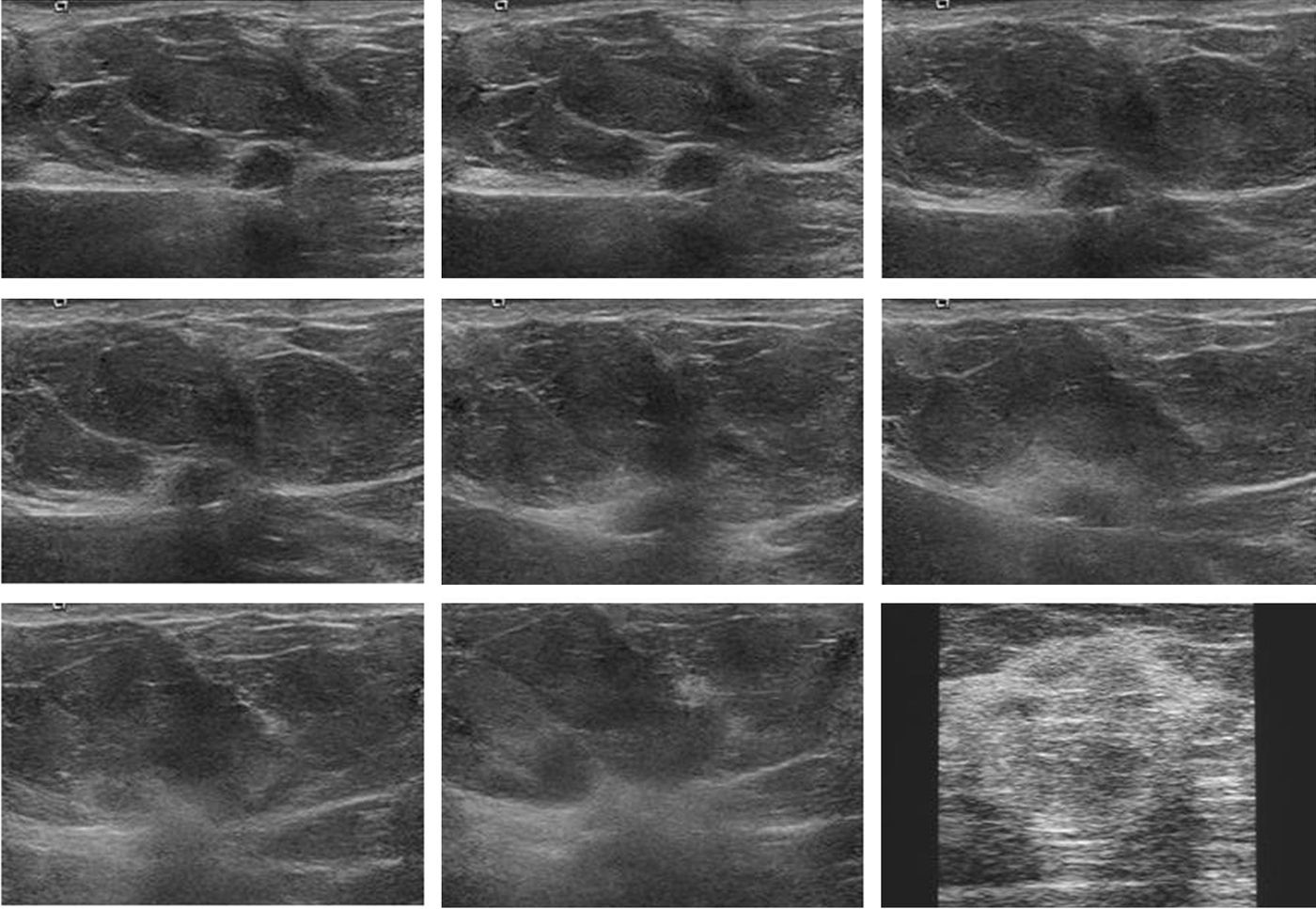
Durante el procedimiento, se producen cambios en el tejido que hay que tratar, que consisten en una progresiva pérdida de nitidez de la imagen nodular asociada a un incremento de su ecogenicidad. Finalmente, la imagen ecográfica del tumor desaparece por completo, formándose en ocasiones una masa palpable a su alrededor (fig. 3).
Serie de imágenes ecográficas obtenidas durante la ablación, tras la aplicación del electrodo de ARF. Se observa un empeoramiento progresivo de la delimitación del nódulo tumoral, acompañado de un aumento de su ecogenicidad, que finaliza con la formación de una masa palpable mal definida y de elevada ecogenicidad.
Finalizado el procedimiento, el radiólogo retrae los electrodos secundarios y extrae el principal, dando por concluido el procedimiento.
Cuidados postoblaciónInmediatamente después del procedimiento, se coloca, sobre la piel de la zona tratada, una bolsa de suero helado que se mantiene durante 20min para reducir al máximo la posibilidad de quemaduras cutáneas. Posteriormente, se permite a las pacientes regresar a su domicilio, animándoles a contactar con la unidad en el caso de percibir cualquier posible incidencia relacionada con el tratamiento.
Tratamiento quirúrgicoTodas las pacientes son sometidas a tratamiento quirúrgico diferido, que consiste siempre en cirugía conservadora guiada por arpón metálico a las 2–4 semanas tras la ARF. El arpón se coloca incluso en los casos en que, después de la ARF, la lesión se hace palpable, con el fin de señalar su centro de un modo más preciso. El tratamiento incluye linfadenectomía axilar en los casos en que se demuestra prequirúrgicamente afectación axilar y en aquellos otros en que se objetiva afectación del ganglio centinela.
Evaluación histopatológicaTras tomar imágenes radiológicas para confirmar la inclusión de la lesión, igual que en cualquier otro procedimiento de localización con arpón metálico, la pieza quirúrgica se envía al servicio de anatomía patológica. El manejo histológico incluye los siguientes pasos:
- •
Estudio peroperatorio. Pintado con tinta china y muestreo de la pieza para determinar el estado de los márgenes, macroscópicamente o por congelación.
- •
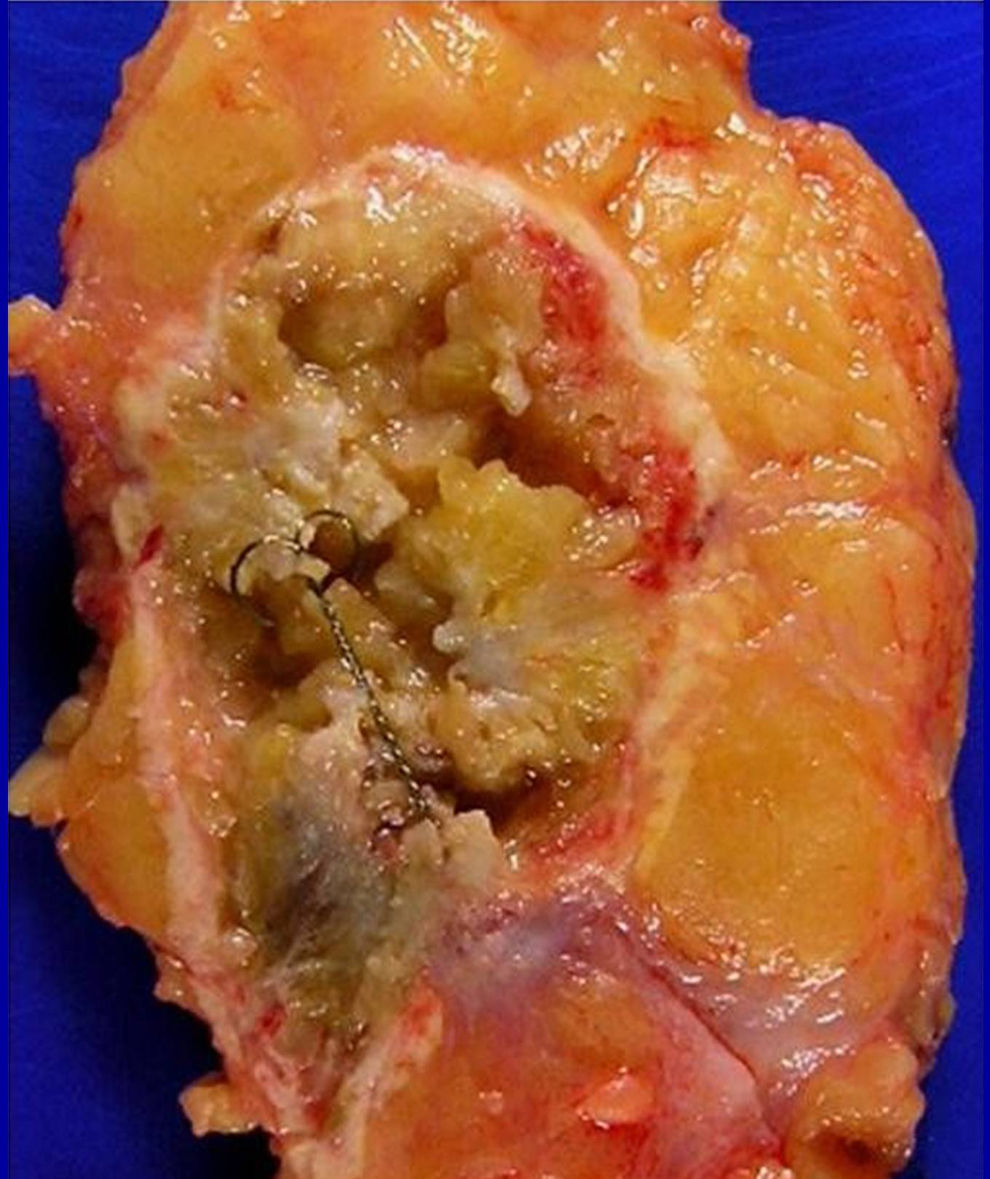
Fotografía del corte más representativo que muestre los efectos de la ARF sobre la lesión. Se observa una imagen en diana: en el centro de la zona de ablación está el tumor, más o menos conservado, por fuera hay una zona blancoamarillenta que corresponde a la zona de necrosis grasa y el límite del efecto de la ARF lo marca un halo rojo correspondiente a una zona hiperémica, por fuera del cual el tejido no presenta lesiones secundarias al tratamiento (fig. 4).
Figura 4.Sección macroscópica de una pieza con arpón, procedente de una cuadrantectomía en una paciente a la que se aplicó ablación por radiofrecuencia (ARF) con anterioridad al tratamiento quirúrgico. Puede observarse un anillo nacarado alrededor de una zona hiperémica que rodea al tumor y grasa peritumoral, destruidos por efecto de la corriente alterna, circundando al arpón metálico. El tejido graso situado en las zonas más alejadas, fuera del anillo, no muestra signos macroscópicos de afectación por ARF.
(0.2MB). - •
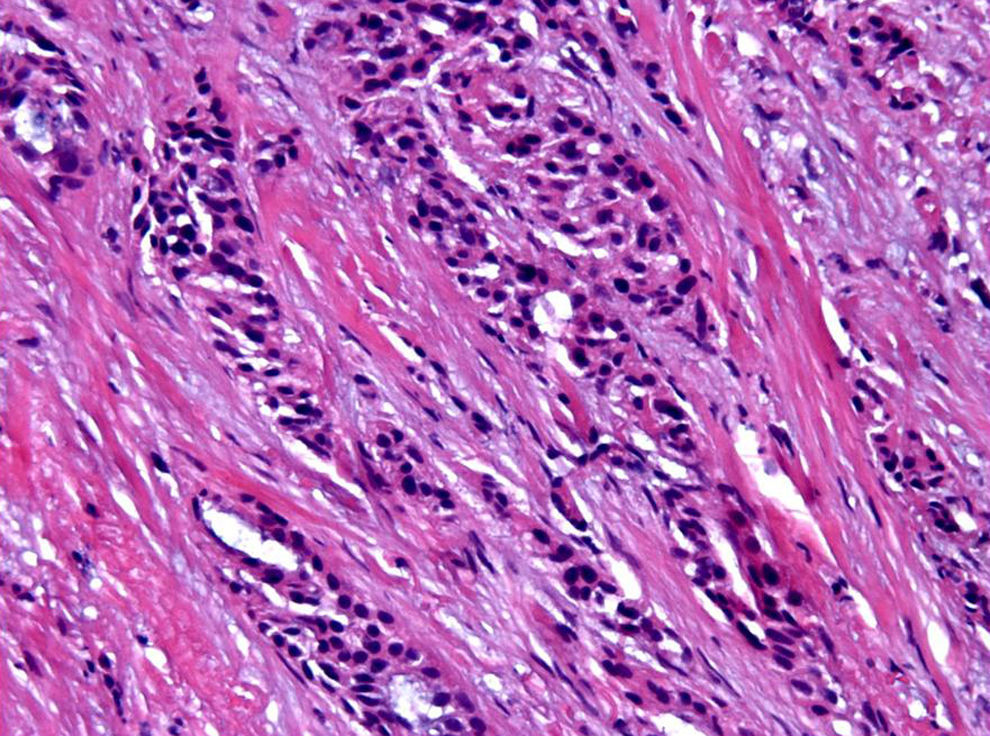
El análisis microscópico con HE demuestra diferentes grados de necrosis de coagulación, caracterizados por deshidratación, picnosis nuclear y eosinofilia citoplasmática, y que van desde una destrucción tumoral completa hasta la presencia de tumor reconocible, con conservación de la arquitectura e incluso de la morfología celular, aunque con signos de necrosis coagulativa (fig. 5).
- •
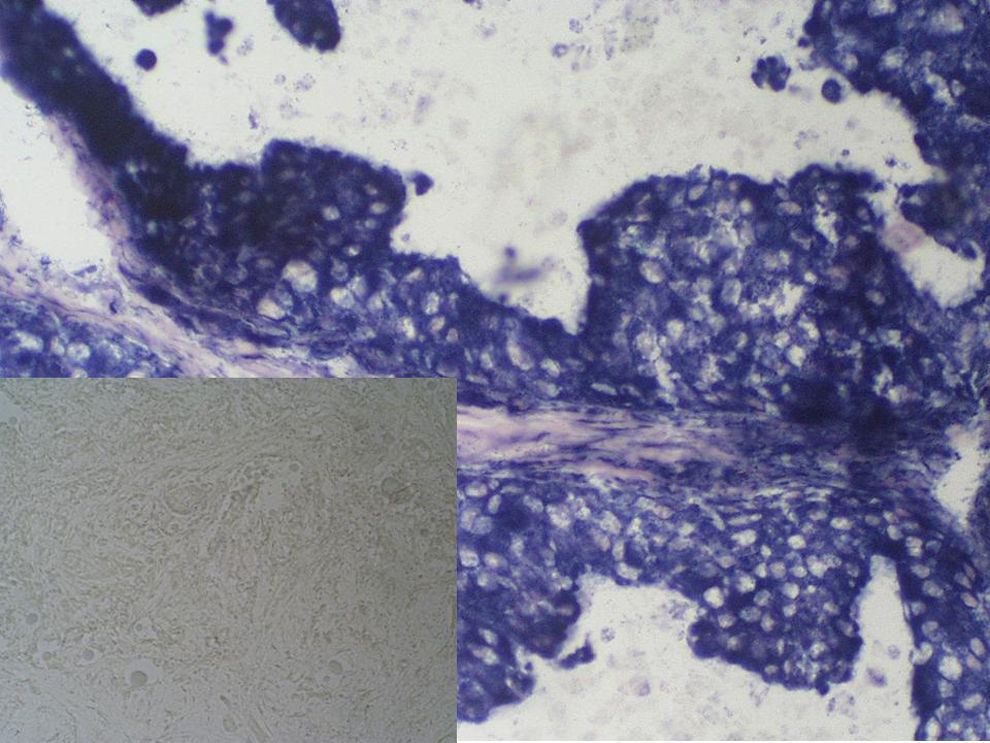
La efectividad de la técnica de ARF se evalúa comprobando la necrosis celular mediante una técnica histoquímica: la NADH-diaforasa, que mide la actividad oxidativa mitocondrial. El tejido con actividad enzimática se tiñe de azul mientras que el tejido necrótico no capta el colorante (fig. 6). Dicha técnica se realiza en material congelado; por tanto, es necesario congelar muestras representativas del tumor residual. El número de cortes que hay que congelar dependerá del tamaño del tumor residual. Como control positivo se usa el cilindro congelado procedente de la BAG.
Figura 6.Preparación obtenida con la tinción de NADH-diaforasa. En el rectángulo grande puede observarse la positividad de la prueba en la preparación testigo, correspondiente a una muestra de biopsia con aguja gruesa de un carcinoma de mama, antes del efecto de la ablación por radiofrecuencia (ARF). En el rectángulo pequeño, completa negatividad de la prueba en la preparación realizada sobre la pieza posquirúrgica, extraída tras la aplicación de la ARF.
(0.17MB). - •
Estudio convencional diferido con cortes de HE de la pieza quirúrgica para determinar el tamaño del tumor y el estado de los márgenes quirúrgicos. El tipo histológico y demás parámetros se asumen tal como se determinaron en su momento sobre la muestra de BAG obtenida antes de la ARF. Además de la zona de ablación, el patólogo deberá estudiar las zonas situadas por fuera del tejido sometido a ARF, donde pudieran existir áreas de componente intraductal o incluso infiltrante.
Durante 48 meses se han realizado 35 procedimientos. La edad media de las pacientes es de 61,2 años (rango: 44–79 años). La media del diámetro tumoral máximo, medido por ecografía, fue de 8,9mm (rango: 4–14mm).
La impedancia inicial media del tejido fue de 127,9±27,2Ω. La duración media total del procedimiento (descontados los 30s de descanso entre fases) fue de 657,7 (10min y 58s)±304,5s.
Durante el procedimiento de ablación, 30 pacientes (85,7%) no sintieron molestias o bien éstas fueron muy ligeras. Cuatro (11,4%) refirieron dolor ligero/moderado en los últimos minutos, sensación que pudo ser adecuadamente controlada administrando más anestesia subcutánea. Una paciente se quejó, desde el comienzo de la prueba, de dolor creciente que llegó a hacerse intenso, no cediendo a pesar del anestésico y obligándonos a detener el procedimiento a los 540s (9m exactos) de acción de la ARF, antes de llegar al punto de roll-off.
No se produjeron otras complicaciones, salvo la aparición de hematoma cutáneo en 2 casos (5,7%).
El tratamiento quirúrgico de las 35 pacientes se llevó a cabo una mediana de 10,5 días después de la ablación. Se diagnosticaron 33 carcinomas ductales infiltrantes y solamente 2 lobulillares infiltrantes. Varios tumores presentaban componente intraductal, sin que ninguno de ellos llegase al 25% que se considera indicativo del criterio de componente intraductal extenso. El estudio histológico posquirúrgico confirmó, en todos los casos, el tipo de tumor previamente diagnosticado en la BAG. El grado histológico de los tumores fue: 18 tumores de grado I, 12 de grado II y 5 de grado III.
La clasificación molecular de los tumores fue: 20 tumores tipo luminal A; 13 tipo luminal B; 1 HER-2 y 1 triple negativo o basal-like.
El tamaño tumoral, medido sobre la pieza quirúrgica postablación, osciló entre 4 y 20mm (media: 10mm).
La tinción con HE demostró cambios de necrosis coagulativa en todos los casos. En 32 de los 35, la necrosis se consideró completa; es decir, que todo el tumor presentaba signos de necrosis, no existiendo focos adicionales fuera del anillo hiperémico. En 2 pacientes (5,8%), se demostró persistencia de carcinoma intraductal fuera del anillo. En otra más (2,9%) se detectó un segundo foco tumoral (infiltrante e intraductal), no detectado con anterioridad en las pruebas radiológicas. La eficacia del procedimiento, de acuerdo a este parámetro, sería de 32/35, es decir del 91,4%.
La viabilidad celular, valorada mediante la NADH-diaforasa, se realizó en 32 de los 35 casos. En los 3 restantes, la prueba no se realizó, exclusivamente por problemas técnicos de coordinación entre los servicios de radiología y anatomía patológica. La prueba resultó negativa en 27 de los 32 casos en que se realizó. En una paciente se detectó persistencia de tumor infiltrante residual parcialmente viable (NADH-diaforasa positiva parcial) y en otras 4, la prueba se consideró “no valorable”, debido a que la muestra elegida macroscópicamente para congelación no incluía tumor, sino solamente tejido normal.
La tinción con NADH-diaforasa tuvo, por tanto, un resultado negativo en el 84,4% de los casos en que se realizó (27 de 32) y en el 96,4% de los casos considerados “valorables” (27 de 28). La paciente cuyo procedimiento hubo de ser detenido debido al dolor, presentaba signos de ablación completa y negatividad total de la NADH-diaforasa.
La linfadenectomía del ganglio centinela resultó negativa en 23 pacientes y positiva en 4, a las que posteriormente se realizó linfadenectomía axilar completa. En el resto de pacientes se hizo linfadenectomía axilar directa.
DiscusiónLas técnicas de ablación térmica empleadas hasta la fecha para tumores malignos primarios de mama incluyen: ARF, crioablación, ultrasonidos focalizados de alta energía, láser de alta frecuencia y microondas9,19. La que ha adquirido mayor difusión es la ARF20, que consiste en la inducción de necrosis por coagulación tisular, mediante la aplicación de energía electromagnética procedente de una corriente alterna de frecuencia<30MHz. La aplicación directa de corriente en el tejido diana induce vibración y oscilación de los iones tisulares. Las colisiones entre iones generan calor, que eleva gradualmente la temperatura local. Este calentamiento acaba causando coagulación tisular.
La forma y volumen de ablación dependen del electrodo empleado, de su tamaño y de la temperatura local alcanzada. La elevación térmica y necrosis coagulativa comienzan en el tejido que rodea las puntas de los electrodos secundarios (filamentos) y, desde ahí, se expanden. Cuando la zona de ablación está a punto de completarse, la impedancia tisular asciende exponencialmente hasta llegar a impedir el paso de la corriente, lo que indica que se ha producido la coagulación completa del tejido diana. Por ello, el registro permanente de la impedancia tisular durante el procedimiento permite monitorizar, de forma más o menos precisa, el efecto del tratamiento.
En el algoritmo que nosotros utilizamos, comenzamos aplicando una potencia baja, que incrementamos lenta y gradualmente a fin de evitar una coagulación rápida del tejido que rodea las puntas de los filamentos, que impediría la conducción del calor a las zonas vecinas y dejaría focos de tumor viable. Aspectos como el diseño del electrodo, su tamaño y los algoritmos de ejecución, todavía no están plenamente establecidos y pueden ser objeto de investigación por grupos interesados en el tema.
Otro aspecto que se debe considerar son los factores tisulares que afectan a la ARF. Por ejemplo, la energía se transmite mal a través de la grasa20, por lo que tal vez sea necesario ajustar los parámetros del tratamiento en función de las proporciones entre tejido graso y fibroglandular.
La asociación de radiofrecuencia y radioterapia se ha demostrado muy eficaz en un modelo experimental con ratas21.
Jeffrey et al10 publicaron la primera serie de ARF guiada por ecografía, en 5 pacientes con cáncer de mama, 4 de ellas tratadas previamente con neoadyuvancia. Los tumores tenían un diámetro máximo entre 4 y 7cm. Los procedimientos se realizaron en quirófano, bajo anestesia general e inmediatamente antes del tratamiento quirúrgico. Histológicamente, la zona de ablación tenía un diámetro entre 0,8 y 1,8cm. La determinación de la NADH-diaforasa demostró ausencia de células viables en todas las pacientes, excepto una, en la que encontraron un pequeño foco de tumor viable, revistiendo parcialmente un quiste. No hubo complicaciones secundarias al tratamiento. Los autores concluyeron diciendo que la ARF causa muerte celular en el carcinoma infiltrante y podría ser aplicable en el tratamiento de tumores<3cm.
Izzo et al11 trataron con ARF ecoguiada a 26 pacientes con carcinoma infiltrante ≤3cm. Los procedimientos se realizaron en el quirófano, bajo anestesia general, y todas las pacientes fueron intervenidas posteriormente. La NADH-diaforasa demostró ausencia de células viables en el 96% y sólo en una paciente (4%) se produjo una quemadura cutánea en la piel situada justo por encima de un tumor superficial.
Burak et al12 trataron con ARF guiada por ecografía a 10 pacientes diagnosticadas de carcinoma infiltrante ≤2cm con tratamiento quirúrgico diferido posterior. Los procedimientos se realizaron en consulta, bajo anestesia local y sedación. Únicamente 2 pacientes experimentaron dolor. No se produjeron complicaciones, salvo mínima equimosis. A todas las pacientes se les realizó RM con gadolinio, antes y después del procedimiento. Nueve presentaban realce en la RM pre-ARF y sólo 1 mostró realce en la RM post-ARF. Únicamente en esa paciente se evidenció persistencia de tumor viable residual.
Fornage et al13 trataron con ARF ecoguiada a 20 pacientes diagnosticadas de carcinoma infiltrante ≤2cm. Dos pacientes habían sido previamente sometidas a quimioterapia. El procedimiento se realizó en el quirófano, bajo anestesia general, y las pacientes fueron sometidas a cirugía inmediata posterior. La NADH-diaforasa fue negativa en todas las pacientes. En una de las dos pacientes sometidas previamente a neoadyuvancia, se encontró un foco de carcinoma alejado del tumor tratado por ARF, no visible radiológicamente (ni siquiera retrospectivamente). No hubo complicaciones.
Oura et al22 publicaron la primera serie de ARF guiada por ecografía sin tratamiento quirúrgico posterior. Trataron a 52 pacientes con carcinoma ≤2cm en el quirófano y bajo anestesia general. Para evaluar la eficacia, realizaron un estudio citológico de la zona de ablación y una RM, que no demostraron tumor viable en ningún caso. Realizaron un seguimiento (clínico y ecográfico) de las pacientes durante una media de 15 meses. El tumor seguía siendo visible ecográficamente en 30 pacientes e indetectable en 22. En este tiempo, no detectaron progresión tumoral local ni metástasis ganglionar o a distancia en ningún caso. El resultado estético del tratamiento se consideró “excelente” o “bueno” en el 94% de pacientes.
Susini et al23 publicaron una serie más corta, consistente en 3 pacientes ancianas, sin confirmación quirúrgica aunque también con seguimiento mínimo de 18 meses, incluyendo RM, con excelentes resultados.
En la literatura científica se han publicado otros estudios de ARF para tumores malignos primarios de la mama14–18,24, todos con un número de participantes igual o inferior a 25 y la mayoría con cirugía posterior. Los resultados son consistentes: la ARF de carcinomas infiltrantes de pequeño tamaño es una técnica factible, segura y eficaz (ausencia de células tumorales viables en más del 90% de los casos tratados). Una de las escasas excepciones es la serie publicada por Solá et al25, que no realizaron la NADH-diaforasa como comprobante de la viabilidad celular.
Por tanto, esta técnica se vislumbra como una posible alternativa a la cirugía en el tratamiento de estos tumores. Ciertamente, la equivalencia de ambas técnicas, en cuanto a progresión tumoral local y supervivencia (global y libre de enfermedad), deberá antes ser demostrada mediante ensayos clínicos en fase III, cuidadosamente diseñados, aleatorizados y monitorizados. Algunos grupos de trabajo ya han empezado11,12,26.
Nuestro trabajo constituye un ensayo clínico en fase II y la serie que presentamos, con 35 pacientes, es una de las más amplias publicadas hasta ahora en la bibliografía. Nuestro estudio es, además, el único en que la ARF se ha llevado a cabo en una sala convencional de ecografía, bajo anestesia local y sin añadir sedación, que es el escenario más probable en el que esta terapia podría aplicarse en un futuro. El tratamiento ha sido bastante bien tolerado por todas las pacientes excepto 1 (2,9%). No se detectaron efectos secundarios, salvo la aparición de hematoma cutáneo en 2 casos (5,7%).
La colocación prequirúrgica del arpón metálico, que se realiza pocas semanas después de la ARF, entraña ocasionalmente algunas dificultades, dado que el tumor puede quedar difuminado en la mamografía y en la ecografía. Sin embargo, más frecuentemente quedan imágenes residuales en la mamografía, de modo que, comparando los estudios radiológicos anteriores a la ARF con los realizados el día de la intervención, y con ayuda de la masa palpable que origina la ARF, la colocación del arpón metálico no suele resultar problemática para un radiólogo experto.
En nuestros resultados, hasta el momento se ha evidenciado ausencia de viabilidad celular en el componente infiltrante en el 96,4% de los casos en que se realizó la NADH-diaforasa y ésta resultó valorable. Este dato concuerda con otros estudios publicados. En el estudio histológico con HE se pueden observar en la zona de coagulación tisular, células aparentemente normales que, sin embargo, son inviables. Por este motivo, además del estudio histológico convencional, es necesario realizar una técnica específica para evaluar la viabilidad celular9. Para tal propósito, hemos usado la técnica histoenzimática basada en la reducción de un compuesto químico (nitro azul de tetrazolio) por la enzima NADH-diaforasa, lo que resulta en un intenso pigmento azul intracitoplasmático. La valoración de la viabilidad celular por esta técnica puede resultar en ocasiones problemática, ya que plantea dificultades para los patólogos a la hora de realizar adecuados cortes para congelación, sobre tejidos en ocasiones adiposos y/o necrosados, así como el dilema de cuál es la zona con tumor residual más adecuada para congelar y cuánto material se ha de congelar en los tumores más pequeños. Ello fue la causa de los 4 casos en los que esta prueba no resultó valorable en nuestra serie. Se ha demostrado que la actividad de esta enzima, presente constitutivamente en las células viables, cesa inmediatamente después de la muerte celular27. Consiguientemente, esta técnica permite determinar de forma precisa e inmediata la existencia de muerte celular y su extensión, siendo mucho más objetiva que el estudio con HE, pues su interpretación se basa, únicamente, en la presencia o ausencia de pigmento azul intracitoplasmático27. La prueba es ampliamente conocida y aceptada por los patólogos como medida de la actividad oxidativa mitocondrial y, por tanto, de viabilidad celular, si bien debemos reconocer que la verdadera inviabilidad celular en el tejido post-ARF deberá demostrarse mediante el seguimiento a largo plazo de pacientes no intervenidas quirúrgicamente, comparando sus tasas de supervivencia con las de las pacientes tratadas con cirugía más radioterapia, aspectos todos ellos que se deberán evaluar mediante ensayos clínicos en fase III.
Una desventaja de la ARF frente al tratamiento quirúrgico es, precisamente, la imposibilidad de confirmar microscópicamente la presencia de un margen peritumoral de tejido mamario libre de enfermedad, especialmente de componente intraductal extensivo (CIE), lo que constituye una importante limitación a la hora de realizar ARF de tumores malignos de mama como única terapéutica. Por este motivo, hemos excluido del estudio los tumores con CIE (demostrado por BAG o sugestivo radiológicamente) y también los tumores sometidos a quimioterapia neoadyuvante, ya que ésta puede provocar un encogimiento del tumor que deje áreas de tumor residual radiológicamente ocultas13. En nuestro estudio, hubo únicamente 3 pacientes en las que observamos persistencia de CIE fuera del anillo hiperémico que marca el efecto de la ablación. Una de ellas fue erróneamente incluida, ya que el CIE debió haberse sospechado en la mamografía, que mostraba algunas calcificaciones sospechosas en las proximidades del nódulo tumoral.
En nuestro estudio, el diagnóstico de carcinoma lobulillar infiltrante en la BAG no fue considerado como un criterio de exclusión, algo que sí se hizo en otras series, basándose en su frecuente mala visualización por ecografía. No obstante, de los 35 casos de carcinoma infiltrante incluidos en nuestro trabajo, tan sólo 2 eran de estirpe lobulillar. Ninguno de estos dos tumores presentó problema alguno en los resultados (ablación completa y NADH-diaforasa negativa).
Otra de las deficiencias atribuidas a la ARF ecoguiada es la imposibilidad de monitorizar el efecto del tratamiento, por la instauración progresiva de una zona hiperecogénica mal definida, que oculta el tumor e impide visualizar el tejido subyacente. Esta zona, que se cree que se debe a microburbujas de vapor de agua y otros productos celulares formados como resultado de la vaporización tisular durante el calentamiento activo, se ha demostrado que no es un marcador preciso de la zona de coagulación tisular19. La RM, por el contrario, sí que es capaz de delimitar con cierta precisión la zona de ablación12,24. Puede emplearse, además, para dirigir la colocación del electrodo en el interior del tumor así como para monitorizar el procedimiento24. Los resultados preliminares obtenidos hasta la fecha indican que la RM puede ser útil para determinar la persistencia de tumor viable residual12. Por desgracia, la RM continúa siendo una técnica de disponibilidad muy inferior a la ecografía y, por ello, nuestro proyecto fue diseñado sin participación de la RM. Esta técnica se considera universalmente como la más adecuada para la estadificación, ya que demuestra la máxima sensibilidad para detectar multifocalidad, multicentricidad e incluso componente intraductal extensivo. Pero además, es de prever que la RM llegará a ser la técnica más eficaz, tanto para la aplicación de técnicas ablativas percutáneas o transcutáneas como para la monitorización del efecto y la detección de recidivas.
Otro aspecto que hay que considerar es que todavía se desconoce la historia natural de los cambios postablación. Es posible que, como sucede en el estudio histológico, el tumor tratado deje de ser visible en las pruebas radiológicas, por lo que puede ser útil dejar colocado un pequeño marcador metálico en el lecho en el que asentaba el tumor primario, para poder detectar posible progresión tumoral local en controles radiológicos ulteriores. Además, al igual que sucede tras el tratamiento quirúrgico conservador, después de la ablación se podrían producir cambios (cicatriz fibrosa, necrosis grasa, etc.) en las pruebas radiológicas mamarias, cuya frecuencia, intensidad y evolución actualmente se desconocen, pudiendo simular una neoplasia o dificultar la detección de recidiva local. Parece previsible que el resultado estético de la mama tratada por ARF sea mejor que el obtenido tras la cirugía conservadora, pero esto todavía debe ser debidamente demostrado en estudios longitudinales.
Con relación a la eficacia de la ARF, en nuestra serie se han constatado 4 fallos del procedimiento (3 por presencia de tumor fuera del anillo hiperémico y 1 por positividad parcial de la NADH-diaforasa), lo que significa que la eficacia global ha sido hasta el momento del 88,6%.
En conclusión, y aún con resultados preliminares, la ARF guiada por ultrasonidos de carcinomas infiltrantes de mama<2cm, realizada bajo anestesia local y en una sala de ecografía, constituye un método factible, generalmente bien tolerado, muy seguro y eficaz en casi el 90% de los tumores, con algunas deficiencias solamente en el componente intraductal. La adecuada selección y estadificación de los tumores, así como la realización de la técnica por radiólogos bien entrenados, son aspectos de máxima importancia para obtener resultados óptimos.
La dificultad de reclutamiento de pacientes nos induce a plantear para el futuro diseños multicéntricos cooperativos y a sustituir el actual electrodo por modelos que permitan tratar tumores más cercanos a la piel y la pared torácica.
Declaración de conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
AutoríaTodos los autores han participado en el desarrollo del trabajo.
L. Apesteguía (primer firmante) ha contribuido íntegramente en el desarrollo de las diferentes partes del trabajo, incluyendo la concepción y diseño del estudio. Como radiólogo, ha contribuido, de forma crítica, en la ejecución de todas y cada una de las partes del estudio y ha ejecutado todos los procedimientos de ablación realizados hasta la fecha. Ha realizado la recogida y registro de datos y ha efectuado su tratamiento estadístico definitivo. Ha contribuido en la búsqueda y revisión bibliográfica y ha sido el redactor jefe del artículo definitivo que se envía a la revista.
A. Ovelar (segunda firmante), corredactora del artículo. Ha contribuido sustancialmente al trabajo de búsqueda y revisión bibliográfica. Ha sido la encargada de redactar el borrador inicial del artículo, incluyendo el tratamiento estadístico provisional de los datos, y ha colaborado decisivamente en el desarrollo de su versión definitiva.
F. Domínguez-Cunchillos (tercer firmante) ha contribuido sustancialmente al desarrollo del estudio, incluyendo su concepción y diseño. Como cirujano, ha participado activamente en su ejecución, tal y como se detalla en el artículo, y ha colaborado con aportaciones críticas al trabajo.
C. Alfaro, como radióloga, miembro de la UPM, ha colaborado activamente en la selección y reclutamiento de pacientes para el estudio. Además, ha colaborado en la recogida de datos, en la revisión bibliográfica y en la revisión crítica del trabajo que se remite.
R. Trujillo y M.A. Sanz, como cirujanos, ambos han participado activamente en la ejecución del estudio, tal y como se detalla en el artículo.
C. de Miguel, B. Reparaz y Y. Ruiz de Azúa, como anatomopatólogas, todas ellas han participado activamente en la ejecución del estudio, tal y como se detalla en el artículo. Además, han contribuido sustancialmente a la redacción de la parte anatomopatológica del artículo.