Los tumores triples negativos (TN) constituyen el subgrupo de cáncer de mama (CM) más agresivo. Nuestro objetivo es analizar los principales factores radiopatológicos de estos tumores para crear un perfil de riesgo.
Materiales y métodosEs un estudio constituido por 140 pacientes diagnosticadas de CM TN desde enero del 2007 a diciembre del 2016. Se analizaron los factores radiológicos en resonancia magnética (RM) de estadificación: tamaño, necrosis, hallazgos asociados, adenopatías, parámetros de perfusión y difusión. En biopsias diagnósticas se estudiaron características del componente infiltrante: tipo histológico, Scarf-Bloom, Ki67 y p53 y el componente in situ. Se analizaron las adenopatías histológicamente positivas y en las piezas quirúrgicas: tamaño, invasión linfovascular/perineural y adenosis microglandular. El seguimiento finalizó en abril de 2018. Se evaluó la relación de los factores radiopatológicos con la recidiva y la supervivencia libre de enfermedad (SLE).
ResultadosLos tumores con tamaño igual o superior a 25 mm en RM, realce no nodular, edema mamario o retracción del complejo aréola-pezón y adenopatías presentaron más recidivas y menor SLE. Los carcinomas lobulillares infiltrantes, el tamaño posquirúrgico>20 mm y p53 <15% también se asociaron con la recidiva y una menor SLE. Las adenopatías histológicamente positivas se relacionaron con un mayor porcentaje de recidivas, y la invasión linfovascular, con una menor SLE. El análisis multivariante ha definido que el tamaño en RM>25 mm, el realce no nodular, las adenopatías en RM, y la expresión menor del 15% de p53 son variables pronósticas independientes.
ConclusionesEl tamaño igual o superior a 25 mm, realce no nodular y adenopatías en RM, y una expresión inferior al 15% de p53 condicionan una menor SLE.
Triple-negative tumors are the most aggressive type of breast cancer. We aimed to analyze the main radiologic and histopathologic factors of these tumors to create a risk profile.
Materials and methodsWe analyzed data from 140 patients diagnosed with triple-negative breast cancer between January 2007 and December 2016, with follow-up through April 2018. We analyzed the following variables in the breast MRI done for staging: size, necrosis, associated findings, adenopathies, and perfusion and diffusion parameters. We analyzed the following variables in histopathologic studies of biopsy specimens: histological type, Scarf-Bloom, Ki67, and p53 in the infiltrating component as well as in the in situ component. We analyzed the following variables in histopathologic studies of positive lymph nodes and surgical specimens: size, lymphovascular/perineural invasion, and microglandular adenosis. We analyzed the relation between the radiologic and histopathologic factors and recurrence and disease-free survival.
ResultsMRI tumor size>25mm, non-nodular enhancement, breast edema, areola-nipple complex retraction, and lymph-node involvement were associated with recurrence and lower disease-free survival. Invasive lobular carcinoma, postsurgical size>20mm, and p53<15% were also associated with recurrence and lower disease-free survival. Histologically positive lymph nodes were associated with a greater percentage of recurrence and lymphovascular invasion and with lower disease-free survival. The multivariate analysis found that the variables MRI size>25mm, non-nodular enhancement, adenopathies on MRI, and p53 expression <15% were independent predictors of lower disease-free survival.
ConclusionsIn triple-negative breast tumors, factors associated with lower disease-free survival are non-nodular enhancement, size>25mm, and adenopathies on MRI, and p53 expression <15% on histopathologic study.
Los tumores triples negativos (TN) representan el 11-20% de los cánceres de mama (CM) y se caracterizan por la ausencia de receptores hormonales y de HER21. Son el subgrupo con mayor riesgo de recidiva y mortalidad2,3. En RM se presentan como tumores unifocales con necrosis interna y realce “en anillo”4,5. Su agresividad y la ausencia de dianas terapéuticas ha motivado el estudio de los factores pronósticos6,7.
Los objetivos son:
- 1.
Identificar qué factores radiológicos valorados en RM de estadificación y anatomopatológicos se asocian con recidiva tumoral y con una menor supervivencia libre de enfermedad (SLE).
- 2.
Crear un perfil de riesgo mediante un score pronóstico para establecer un seguimiento individualizado de estas pacientes.
Es un estudio retrospectivo observacional con recogida de datos desde enero de 2007 hasta diciembre de 2016. Se incluyeron 140 pacientes con CM TN diagnosticadas y tratadas en nuestro centro. Los criterios de inclusión fueron: RM de estadificación, subtipo TN por inmunohistoquímica, tratadas o no con quimioterapia neoadyuvante (QTN). Los criterios de exclusión fueron: CM no TN, RM no valorable o no disponible. Para la realización del estudio no fue necesaria la aprobación del comité de ética al ser un estudio retrospectivo observacional.
Los estudios se realizaron en un aparato de RM de 1,5 T (GE Healthcare, Milwaukee, EE. UU.), con antena de superficie de 8 canales8.
Factores radiológicos valorados en resonancia magnética de estadificaciónEn la secuencia potenciada en T2 se analizó la señal intralesional (hiperintensa, isointensa o hipointensa). En la secuencia dinámica hemos valorado el tamaño tumoral (eje mayor en milímetros), número de lesiones (única, multifocal, multicéntrica o bilateral), presencia de hallazgos asociados y el realce tumoral según el léxico BI-RADS de la 4.a edición porque la mayoría de las pacientes fueron diagnosticadas antes de la última edición9. En los tumores con realce nodular se analizó: morfología, márgenes y realce interno. Y si el realce era no nodular, se determinó la distribución y el realce interno.
Se consideraron adenopatías sospechosas en RM aquellas con: diámetro> 1 cm en eje corto, morfología redondeada, pérdida del hilio graso y engrosamiento cortical excéntrico10–12.
Mediante el posprocesado de la secuencia dinámica, se determinó el valor máximo de realce intralesional, el tiempo en alcanzar el máximo realce o TTP (time to peak) del 1.° al 6.° minuto, y las curvas funcionales (tipo 1 o progresiva, tipo 2 o meseta y tipo 3 o lavado).
Mediante el análisis de las secuencias de difusión, calculamos los porcentajes de restricción intratumoral, colocando un ROI (4 mm2) en la región tumoral de máxima restricción y otro en el tejido fibroglandular normal, para obtener los porcentajes de difusibilidad, y el porcentaje de restricción se calcula con la resta de los porcentajes de difusibilidad de cada tejido.
Factores anatomopatológicosSe valoraron las siguientes características del componente infiltrante: tipo histológico, Scarf-Bloom, CK5/6, ki67 y p53 y la presencia de carcinoma in situ (CIS) y su grado (alto/no alto).
Se estudió la presencia de adenopatías confirmadas histológicamente (en biopsia o piezas posquirúrgicas), el tamaño tumoral anatomopatológico (AP), la invasión linfovascular o perineural y la presencia de adenosis microglandular en las piezas posquirúrgicas.
Los estudios de RM y los factores AP fueron analizados por dos radiólogos con más de 10 años de experiencia y un anatomopatólogo con más de 5 años de experiencia en la sección de mama.
SeguimientoLas pacientes fueron seguidas hasta la fecha del fallecimiento o la fecha final de seguimiento (31-4-2018), y se determinó el número y tipo de recidiva: local, ganglionar, visceral, ósea, cerebral y múltiple.
Los datos recopilados se emplearon para calcular las curvas de supervivencia y el tiempo libre de enfermedad, definido como el período de tiempo desde la fecha de la RM hasta la recidiva, fallecimiento o del último registro de seguimiento.
Análisis estadísticoHemos analizado la correlación de los factores radiológicos y AP con la recidiva tumoral y la SLE mediante el programa IBM-SPSS ®, Statistics 22.0.
La relación entre las distintas variables y la recidiva tumoral se analizó mediante la prueba de la χ2 para variables categóricas y los test de comparación de medianas o de medias U de Mann-Whitney para variables cuantitativas.
Las variables cuantitativas significativas (tamaño tumoral en RM y AP y valor p53) se dicotomizaron en dos categorías mediante el análisis de curvas ROC para su inclusión en el análisis multivariante. El análisis comparativo se realizó con la prueba de la χ2.
Se compararon las medias de supervivencia con el test de Log-rank de Kaplan Meier, y la probabilidad de supervivencia a los 5 años mediante el método actuarial.
El análisis multivariante se realizó mediante el modelo de regresión de Cox. Mediante el comando para SPSS, UAB All Sets Reg Cox seleccionamos el conjunto de variables con mayor poder descriptivo y predictivo. Se calculó la fórmula de regresión de Cox y se asignó una puntuación a cada variable según su coeficiente multiplicador B. Se le aplicó el valor 1 al menor y al resto, su valor proporcional. Se calcularon las curvas y tiempos de supervivencia para cada año según la puntuación del score.
ResultadosAnálisis descriptivo de los factores radiopatológicosLa muestra estuvo constituida por 140 mujeres, con una media de edad al diagnóstico de 55,5±13,1 años. En RM, los TN fueron lesiones únicas, con hiperseñal en T2, realce nodular “en anillo”, TTP al 2.° minuto y curva funcional tipo 2.
El carcinoma ductal infiltrante fue el tipo histológico más frecuente, con una mediana de Scarf-Bloom de 7. El CIS estuvo presente en un 42,9%, las adenopatías fueron positivas en el 38,8% y un 11% asociaron invasión linfovascular.
SeguimientoLa recidiva tumoral se observó en 47 (34,7%) pacientes. La mediana de seguimiento en las pacientes con recidiva y sin ella fue de 18,5 y 82,3 meses, respectivamente. La recidiva local fue la más frecuente (11,8%), seguida de la visceral (7,4%), múltiples (8,8%), ósea (3,7%), ganglionar (1,5%) y cerebral (1,5%). La media estimada de SLE fue de 88,4 meses y la probabilidad de SLE a los 5 y 10 años fue del 66,7% y 54,2%, respectivamente.
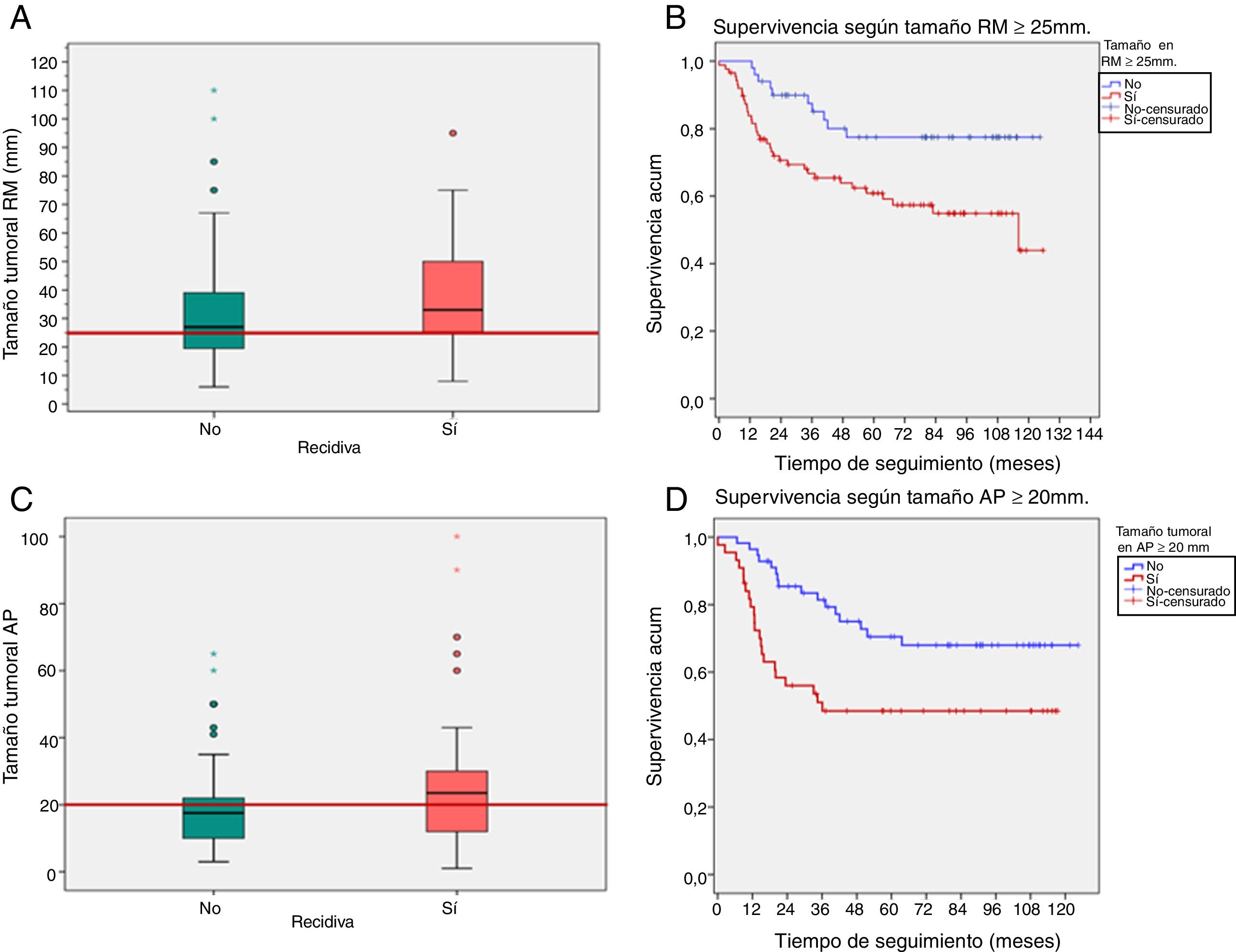
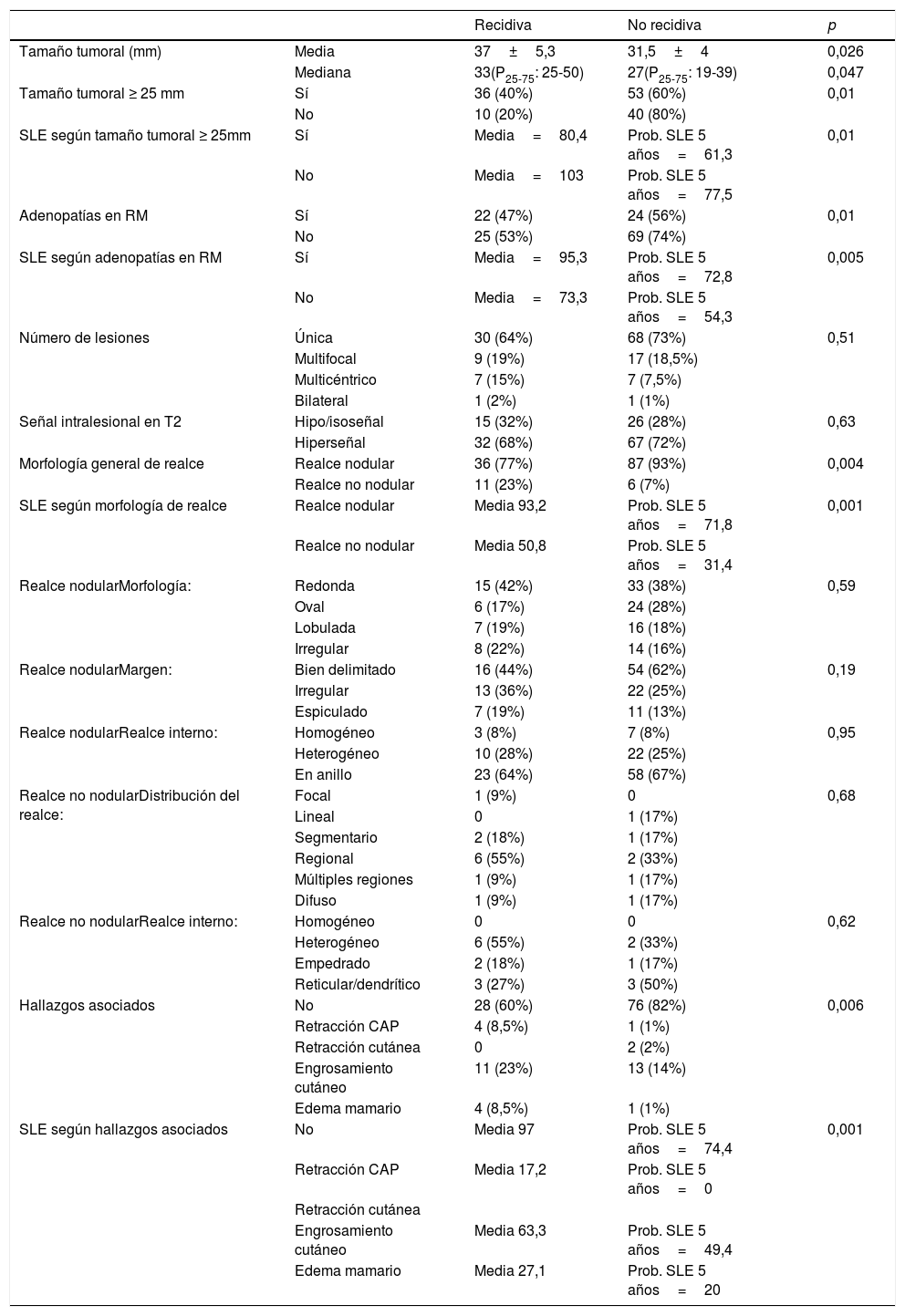
Correlación pronóstica de los factores radiopatológicosEl tamaño tumoral en RM ≥ 25 mm y en AP ≥ 20 mm (puntos de corte de curvas ROC) se asoció con mayor porcentaje de recidivas (p=0,01 y p=0,03, respectivamente) y menor SLE (p=0,01 y p=0,007, respectivamente) (fig. 1).
A-D) Recidiva y supervivencia según el tamaño tumoral en resonancia magnética (RM) y anatomopatología (AP). Las gráficas de caja y bigotes (A y C) representan las recidivas según los tamaños tumorales (las líneas rojas muestran los valores de 25 y 20 mm, respectivamente). Curvas de supervivencia (B y D) según tamaño tumoral ≥ 25mm en RM (A y B) y≥20 mm en AP (C y D).
Supervivencia acum.: supervivencia acumulada.
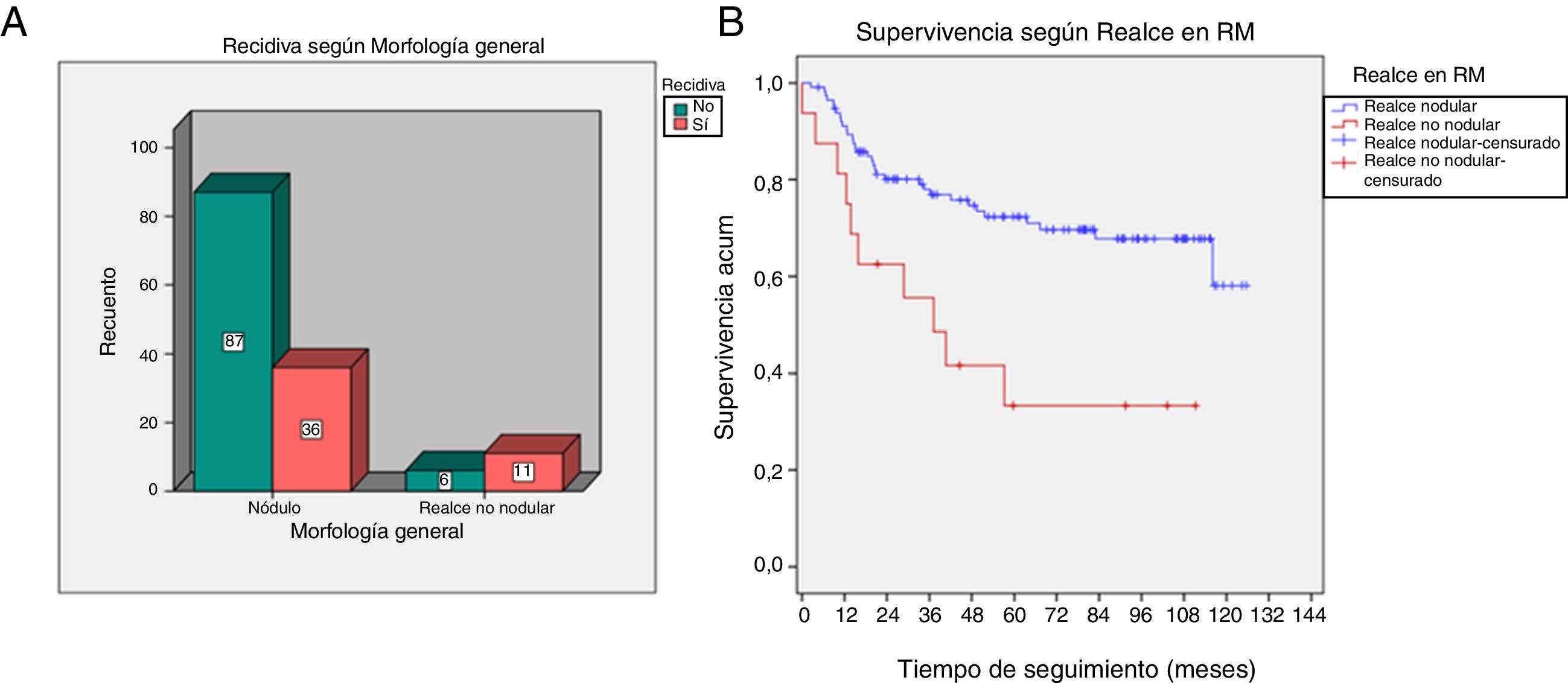
El realce no nodular en RM se asoció significativamente con la recidiva (p=0,004) y con menor SLE (p=0,001) (fig. 2).
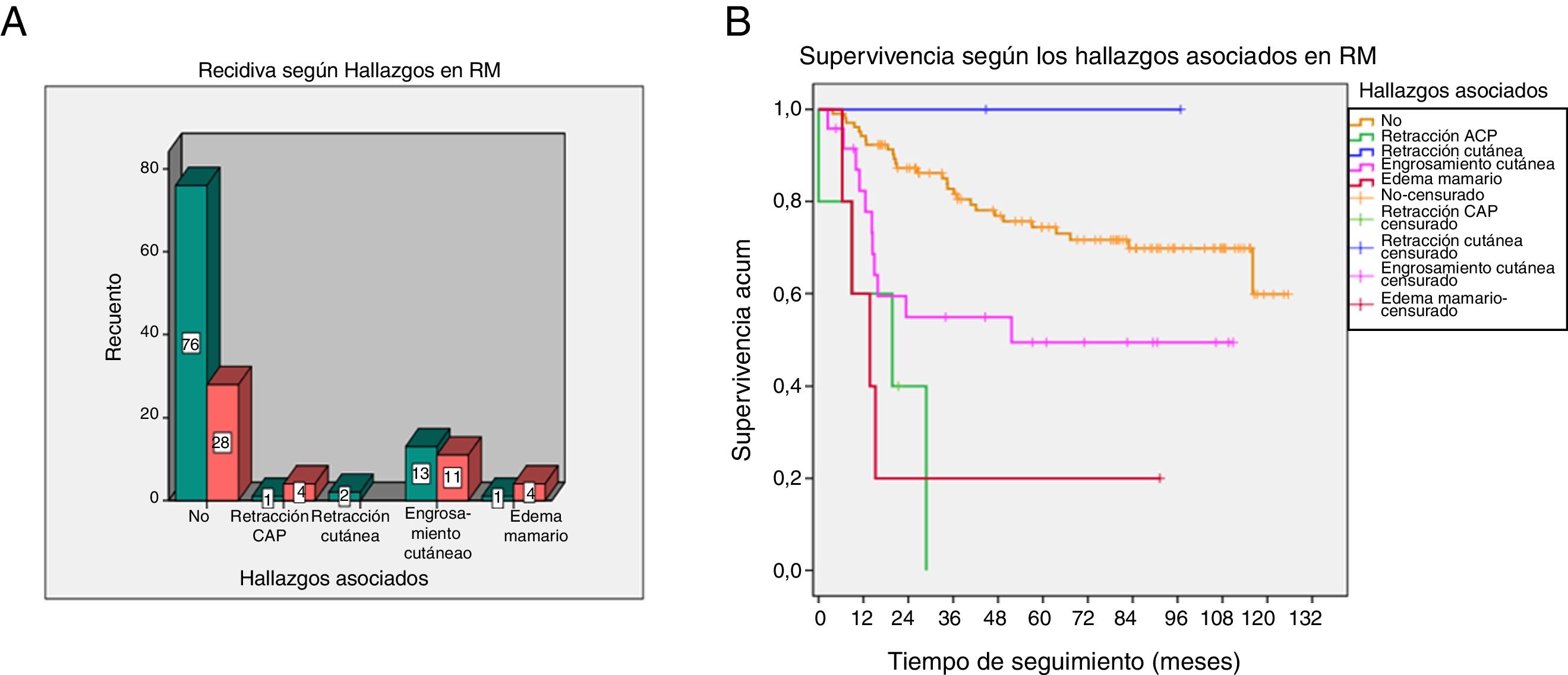
La retracción del complejo areola-pezón (CAP) y el edema mamario asociaron más recidivas (p=0,006) y menor SLE (p <0,001) (fig. 3).
A y B) Recidiva y supervivencia según los hallazgos asociados en resonancia magnética (RM). La gráfica de caja y bigotes (A) representa las recidivas según la presencia de hallazgos asociados en RM. Gráfica de supervivencia (B) de los hallazgos asociados.
Supervivencia acum.: supervivencia acumulada.
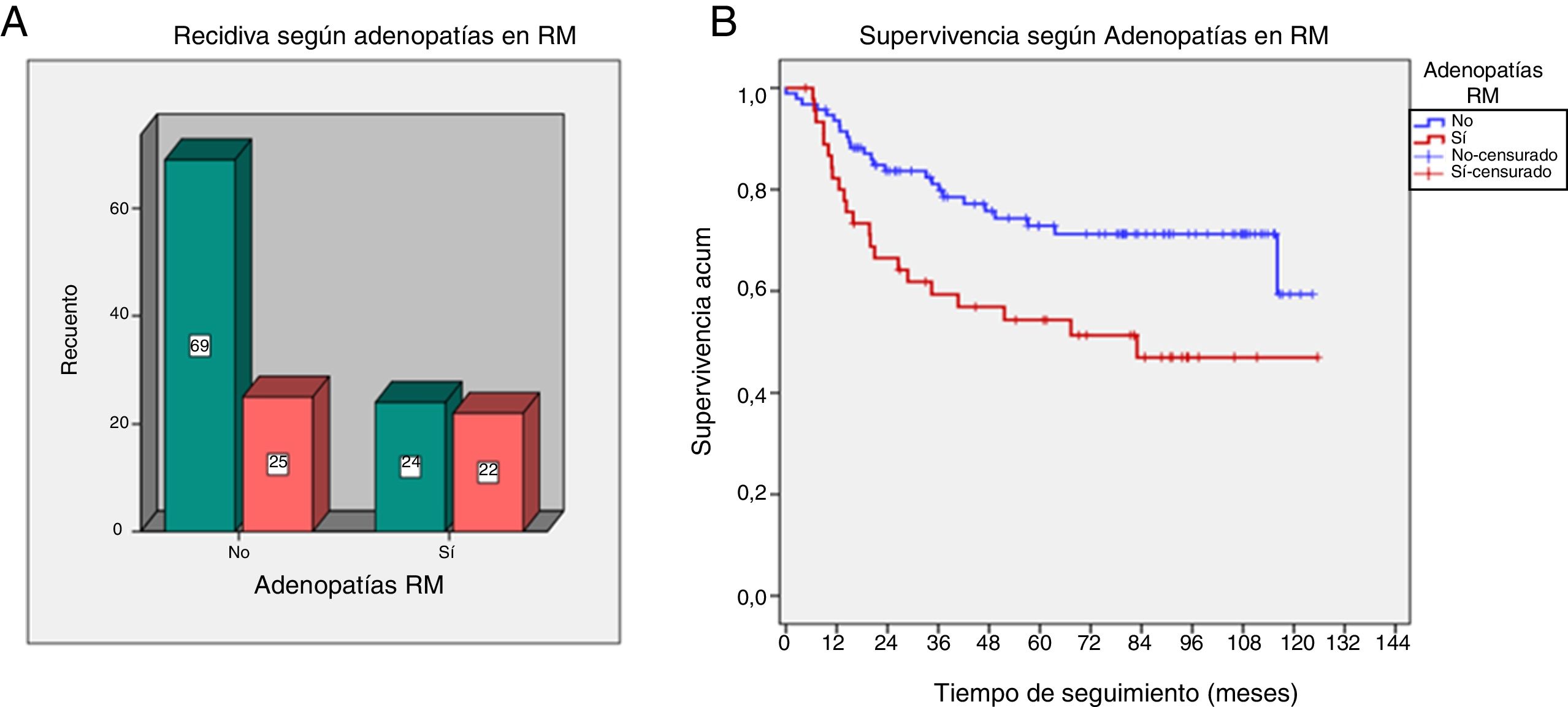
Las pacientes con adenopatías en RM y AP asociaron mayor proporción de recidivas (p=0,01 y p=0,03, respectivamente). Se demostró una menor SLE en las pacientes con adenopatías en RM (p=0,005) (fig. 4).
A y B) Recidiva y supervivencia en presencia de adenopatías sospechosas en resonancia magnética (RM). La gráfica de caja y bigotes (A) representa las recidivas según la presencia de adenopatías en RM. Gráfica de supervivencia (B) según presencia de adenopatías.
Supervivencia acum.: supervivencia acumulada.
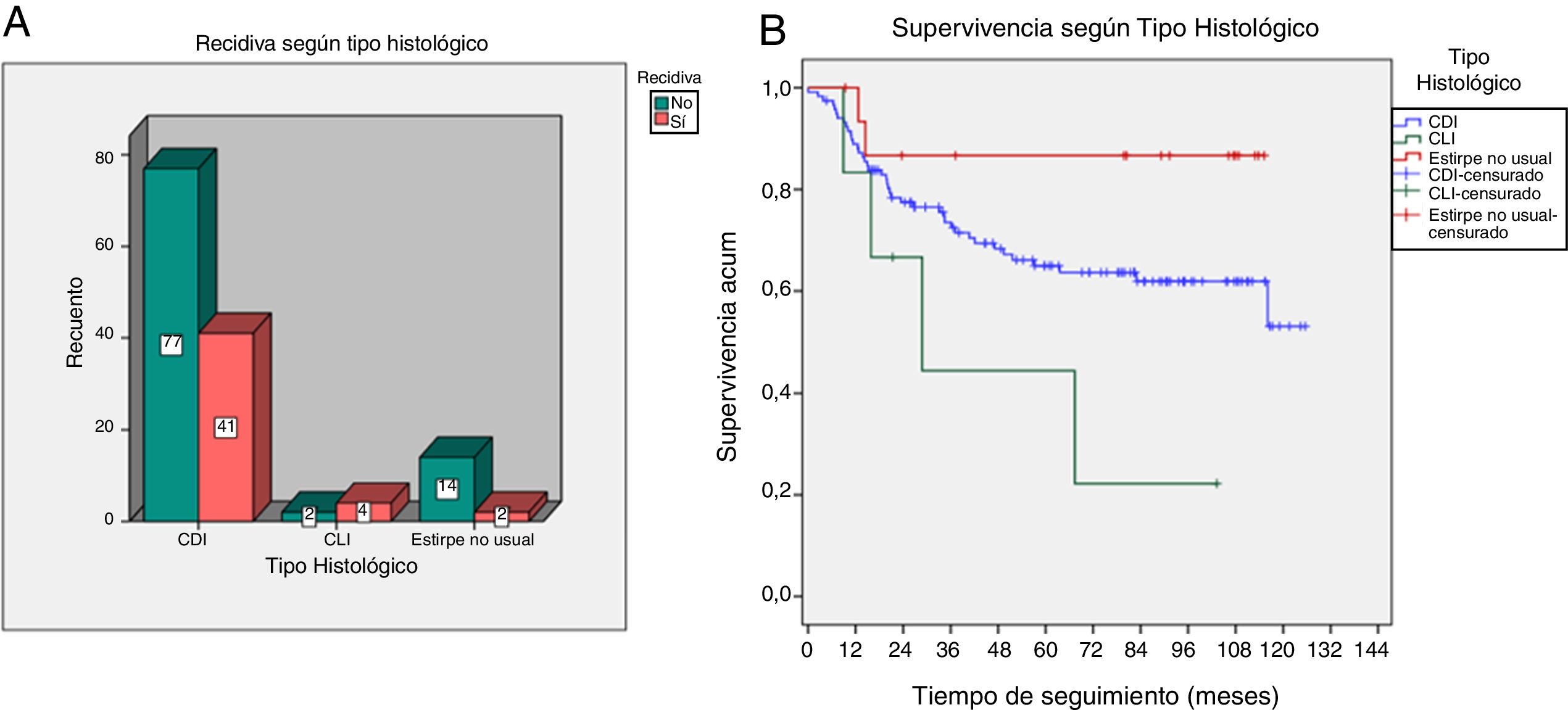
El carcinoma lobulillar infiltrante presentó mayor proporción de recidivas (p=0,04) y menor SLE (p=0,048), con una probabilidad de supervivencia a los 5 años del 44,4%, frente al 65% en los ductales y 86,7% en estirpe no usual (fig. 5).
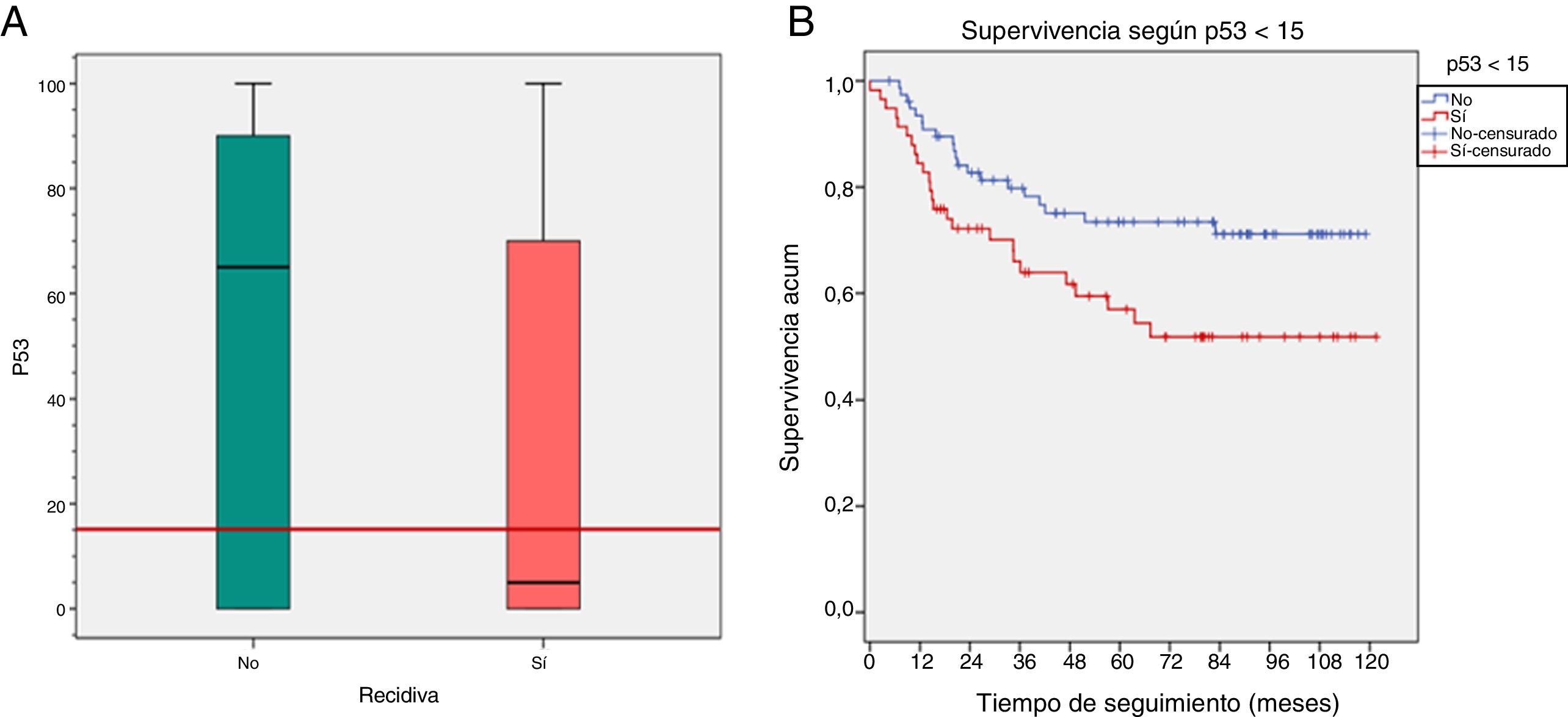
La expresión de p53 <15% (punto de corte de las curvas ROC) se relacionó con la recidiva (p=0,03) y con una menor SLE (p=0,024) (fig. 6).
Se demostró una menor SLE (p=0,028) en pacientes con invasión linfovascular (probabilidad de SLE a los 5 años del 40,7%) frente a las que no presentaron invasión (69,8%).
No se encontraron diferencias pronósticas en el resto de los factores radiopatológicos analizados.
Los resultados radiopatológicos se muestran en las tabla 1 A, 1 B y 2.
Resultados de factores valorados en resonancia magnética de estadificación
| Recidiva | No recidiva | p | ||
|---|---|---|---|---|
| Tamaño tumoral (mm) | Media | 37±5,3 | 31,5±4 | 0,026 |
| Mediana | 33(P25-75: 25-50) | 27(P25-75: 19-39) | 0,047 | |
| Tamaño tumoral ≥ 25 mm | Sí | 36 (40%) | 53 (60%) | 0,01 |
| No | 10 (20%) | 40 (80%) | ||
| SLE según tamaño tumoral ≥ 25mm | Sí | Media=80,4 | Prob. SLE 5 años=61,3 | 0,01 |
| No | Media=103 | Prob. SLE 5 años=77,5 | ||
| Adenopatías en RM | Sí | 22 (47%) | 24 (56%) | 0,01 |
| No | 25 (53%) | 69 (74%) | ||
| SLE según adenopatías en RM | Sí | Media=95,3 | Prob. SLE 5 años=72,8 | 0,005 |
| No | Media=73,3 | Prob. SLE 5 años=54,3 | ||
| Número de lesiones | Única | 30 (64%) | 68 (73%) | 0,51 |
| Multifocal | 9 (19%) | 17 (18,5%) | ||
| Multicéntrico | 7 (15%) | 7 (7,5%) | ||
| Bilateral | 1 (2%) | 1 (1%) | ||
| Señal intralesional en T2 | Hipo/isoseñal | 15 (32%) | 26 (28%) | 0,63 |
| Hiperseñal | 32 (68%) | 67 (72%) | ||
| Morfología general de realce | Realce nodular | 36 (77%) | 87 (93%) | 0,004 |
| Realce no nodular | 11 (23%) | 6 (7%) | ||
| SLE según morfología de realce | Realce nodular | Media 93,2 | Prob. SLE 5 años=71,8 | 0,001 |
| Realce no nodular | Media 50,8 | Prob. SLE 5 años=31,4 | ||
| Realce nodularMorfología: | Redonda | 15 (42%) | 33 (38%) | 0,59 |
| Oval | 6 (17%) | 24 (28%) | ||
| Lobulada | 7 (19%) | 16 (18%) | ||
| Irregular | 8 (22%) | 14 (16%) | ||
| Realce nodularMargen: | Bien delimitado | 16 (44%) | 54 (62%) | 0,19 |
| Irregular | 13 (36%) | 22 (25%) | ||
| Espiculado | 7 (19%) | 11 (13%) | ||
| Realce nodularRealce interno: | Homogéneo | 3 (8%) | 7 (8%) | 0,95 |
| Heterogéneo | 10 (28%) | 22 (25%) | ||
| En anillo | 23 (64%) | 58 (67%) | ||
| Realce no nodularDistribución del realce: | Focal | 1 (9%) | 0 | 0,68 |
| Lineal | 0 | 1 (17%) | ||
| Segmentario | 2 (18%) | 1 (17%) | ||
| Regional | 6 (55%) | 2 (33%) | ||
| Múltiples regiones | 1 (9%) | 1 (17%) | ||
| Difuso | 1 (9%) | 1 (17%) | ||
| Realce no nodularRealce interno: | Homogéneo | 0 | 0 | 0,62 |
| Heterogéneo | 6 (55%) | 2 (33%) | ||
| Empedrado | 2 (18%) | 1 (17%) | ||
| Reticular/dendrítico | 3 (27%) | 3 (50%) | ||
| Hallazgos asociados | No | 28 (60%) | 76 (82%) | 0,006 |
| Retracción CAP | 4 (8,5%) | 1 (1%) | ||
| Retracción cutánea | 0 | 2 (2%) | ||
| Engrosamiento cutáneo | 11 (23%) | 13 (14%) | ||
| Edema mamario | 4 (8,5%) | 1 (1%) | ||
| SLE según hallazgos asociados | No | Media 97 | Prob. SLE 5 años=74,4 | 0,001 |
| Retracción CAP | Media 17,2 | Prob. SLE 5 años=0 | ||
| Retracción cutánea | ||||
| Engrosamiento cutáneo | Media 63,3 | Prob. SLE 5 años=49,4 | ||
| Edema mamario | Media 27,1 | Prob. SLE 5 años=20 |
| Recidiva | No recidiva | p | ||
|---|---|---|---|---|
| TTP (time to peak) | 1.er minuto | 14 (30%) | 29 (31%) | 0,53 |
| 2.° minuto | 19 (40%) | 35 (38%) | ||
| 3.er minuto | 2 (4%) | 13 (14%) | ||
| 4.° minuto | 7 (15%) | 9 (10%) | ||
| 5.° minuto | 2 (4%) | 2 (2%) | ||
| 6.° minuto | 3 (6%) | 5 (5%) | ||
| TTP (time to peak) | Media | 2,43±1,48 | 2,3±1,35 | 0,79 |
| Mediana | 2 (1-3,5) | 2 (1-3) | 0,98 | |
| Intensidad de realce tumoral | Media | 1.582,4±390 | 1.701±390 | 0,21 |
| Mediana | 1.562 | 1.690 | 0,28 | |
| Curva funcional | Tipo 1 | 2 (4%) | 4 (4%) | 0,97 |
| Tipo 2 | 28 (60%) | 57 (61%) | ||
| Tipo 3 | 17 (36%) | 32 (34%) | ||
| Media de ADC | Media | 1,27×10-3±0,24×0-3 | 1,24×10-3±0,25×10-3 | 0,34 |
| Mediana | 1,25×10-3 | 1,20×10-3 | 0,84 | |
| Restricción difusión (%) | Media | 38,05±18,5 | 33,07±16,5 | 0,07 |
| Mediana | 43 (26-48) | 33,5 (21-41) | 0,14 |
CAP: complejo areola-pezón; P: significación estadística; Prob. SLE 5 años: probabilidad de supervivencia libre de enfermedad.
Resultados de los factores anatomopatológicos
| Recidiva | No recidiva | p | ||
|---|---|---|---|---|
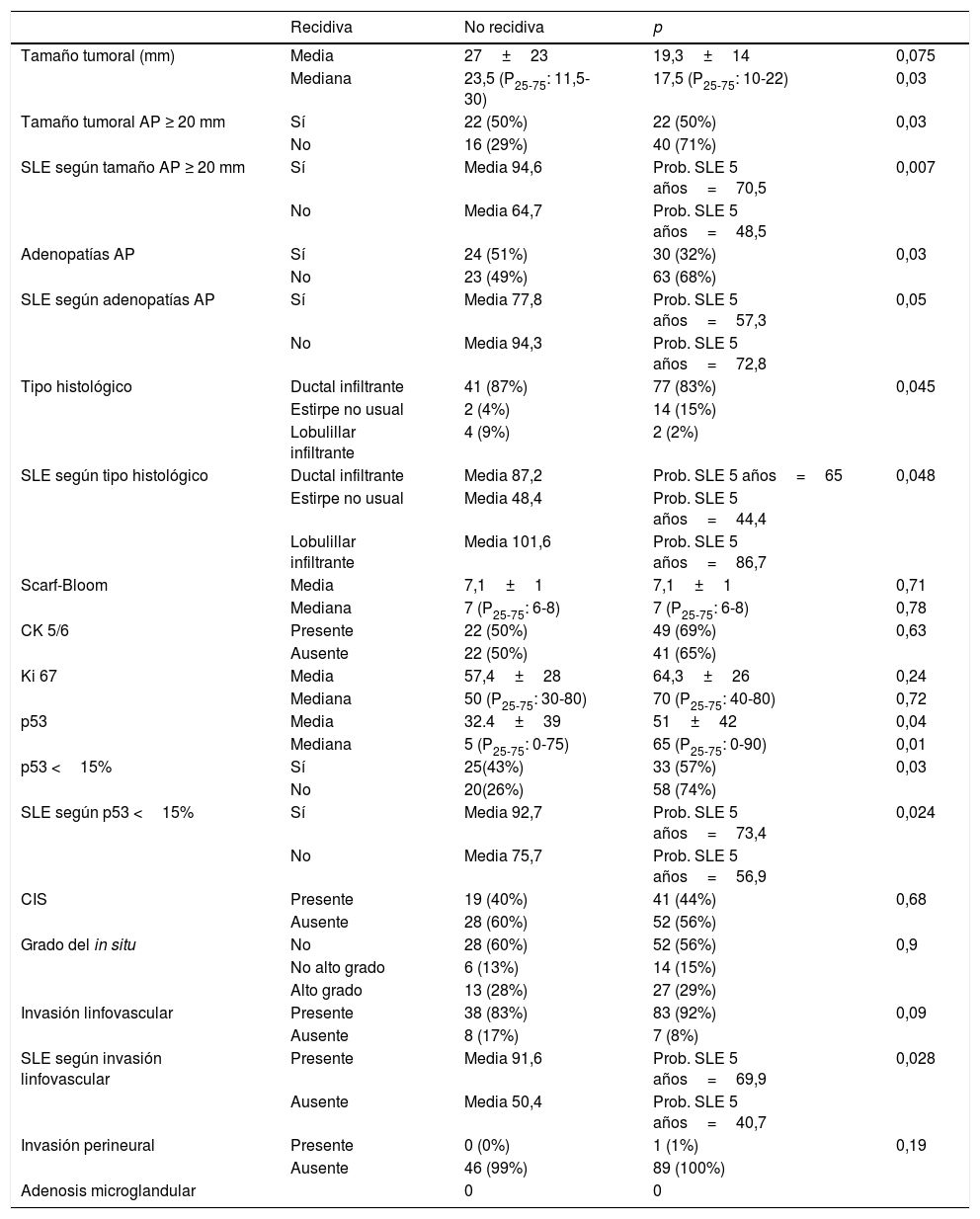
| Tamaño tumoral (mm) | Media | 27±23 | 19,3±14 | 0,075 |
| Mediana | 23,5 (P25-75: 11,5-30) | 17,5 (P25-75: 10-22) | 0,03 | |
| Tamaño tumoral AP ≥ 20 mm | Sí | 22 (50%) | 22 (50%) | 0,03 |
| No | 16 (29%) | 40 (71%) | ||
| SLE según tamaño AP ≥ 20 mm | Sí | Media 94,6 | Prob. SLE 5 años=70,5 | 0,007 |
| No | Media 64,7 | Prob. SLE 5 años=48,5 | ||
| Adenopatías AP | Sí | 24 (51%) | 30 (32%) | 0,03 |
| No | 23 (49%) | 63 (68%) | ||
| SLE según adenopatías AP | Sí | Media 77,8 | Prob. SLE 5 años=57,3 | 0,05 |
| No | Media 94,3 | Prob. SLE 5 años=72,8 | ||
| Tipo histológico | Ductal infiltrante | 41 (87%) | 77 (83%) | 0,045 |
| Estirpe no usual | 2 (4%) | 14 (15%) | ||
| Lobulillar infiltrante | 4 (9%) | 2 (2%) | ||
| SLE según tipo histológico | Ductal infiltrante | Media 87,2 | Prob. SLE 5 años=65 | 0,048 |
| Estirpe no usual | Media 48,4 | Prob. SLE 5 años=44,4 | ||
| Lobulillar infiltrante | Media 101,6 | Prob. SLE 5 años=86,7 | ||
| Scarf-Bloom | Media | 7,1±1 | 7,1±1 | 0,71 |
| Mediana | 7 (P25-75: 6-8) | 7 (P25-75: 6-8) | 0,78 | |
| CK 5/6 | Presente | 22 (50%) | 49 (69%) | 0,63 |
| Ausente | 22 (50%) | 41 (65%) | ||
| Ki 67 | Media | 57,4±28 | 64,3±26 | 0,24 |
| Mediana | 50 (P25-75: 30-80) | 70 (P25-75: 40-80) | 0,72 | |
| p53 | Media | 32.4±39 | 51±42 | 0,04 |
| Mediana | 5 (P25-75: 0-75) | 65 (P25-75: 0-90) | 0,01 | |
| p53 <15% | Sí | 25(43%) | 33 (57%) | 0,03 |
| No | 20(26%) | 58 (74%) | ||
| SLE según p53 <15% | Sí | Media 92,7 | Prob. SLE 5 años=73,4 | 0,024 |
| No | Media 75,7 | Prob. SLE 5 años=56,9 | ||
| CIS | Presente | 19 (40%) | 41 (44%) | 0,68 |
| Ausente | 28 (60%) | 52 (56%) | ||
| Grado del in situ | No | 28 (60%) | 52 (56%) | 0,9 |
| No alto grado | 6 (13%) | 14 (15%) | ||
| Alto grado | 13 (28%) | 27 (29%) | ||
| Invasión linfovascular | Presente | 38 (83%) | 83 (92%) | 0,09 |
| Ausente | 8 (17%) | 7 (8%) | ||
| SLE según invasión linfovascular | Presente | Media 91,6 | Prob. SLE 5 años=69,9 | 0,028 |
| Ausente | Media 50,4 | Prob. SLE 5 años=40,7 | ||
| Invasión perineural | Presente | 0 (0%) | 1 (1%) | 0,19 |
| Ausente | 46 (99%) | 89 (100%) | ||
| Adenosis microglandular | 0 | 0 |
AP: anatopatológica; CIS: carcinoma in situ; Prob. SLE 5 años: probabilidad de SLE a los 5 años.
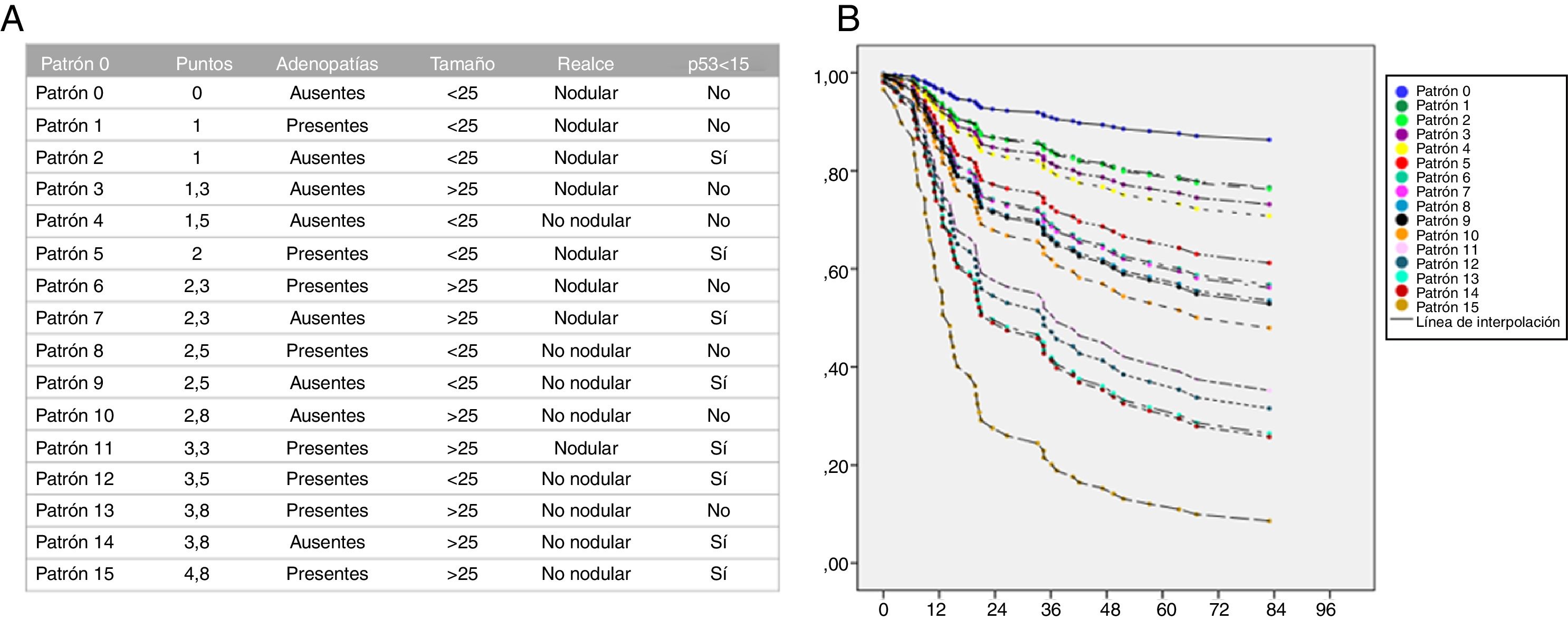
Respecto al análisis de regresión de Cox, obtuvimos las siguientes odds ratio: adenopatías en RM=1,8; tamaño tumoral ≥ 25 mm=2,1; realce no nodular=2,3 y p53 <15%=1,8.
La fórmula de regresión fue:
0,60*adenopatías en RM+0,75*tamaño ≥ 25+0,85*realce no nodular+0,61 p53 <15
Y se definieron las siguientes puntuaciones:
- •
Adenopatías en RM=1
- •
p53 <15%=1
- •
Tamaño ≥ 25 mm=1,3
- •
Realce no nodular=1,4
Se calcularon los patrones y curvas de riesgo anuales para cada combinación de factores predictores según su puntuación.
Las pacientes sin factores de riesgo de recidiva (puntuación 0) tendrían una probabilidad de SLE a los 5 años del 88%, mientras que las que tuvieran 4 (puntuación 4), del 12% (fig. 7).
DiscusiónEl tamaño tumoral se ha considerado un factor pronóstico independiente en los tumores TN13–15. En nuestro trabajo, hemos establecido un punto de corte para el tamaño tumoral en RM (>25 mm) y AP (≥20 mm), a partir del cual se apreció un mayor índice de recidivas y una menor SLE, hallazgo no definido previamente en la literatura científica.
El realce no nodular se asoció con un peor pronóstico, pero no se estableció relación con la distribución o realce interno. No hay autores que concluyan que el realce no nodular condicione un peor pronóstico; sin embargo, se ha descrito que podría estar relacionado con la presencia de CIS, que en RM suele mostrar un realce no nodular16–18.
El edema mamario y la retracción del CAP asociaron un mayor índice de recaídas y una menor SLE, hallazgos relacionados con invasión linfovascular14,19 y con tumores grandes, próximos al pezón y multifocales20.
Las adenopatías tumorales se han considerado el factor pronóstico independiente más importante del CM. Hay autores que no concluyen correlación pronóstica y otros han demostrado una menor SLE en tumores con afectación N2 frente a N1 o N021. Nosotros coincidimos en que la presencia de adenopatías asocia un peor pronóstico.
El subtipo histológico también podría ser un factor pronóstico22–26. En nuestro estudio, todas las pacientes con carcinoma lobulillar infiltrante fueron tratadas con QTN con mayor porcentaje de recidivas y una menor SLE. Este resultado coincide con otros autores que afirman que los carcinomas lobulillares asocian una menor respuesta a la quimioterapia, lo que condicionaría menores índices de respuesta completa patológica y un peor pronóstico.
La sobreexpresión de la proteína p53 es más prevalente en los tumores TN; en cambio, es muy debatida su asociación pronóstica27–30. La sobreexpresión de p53 se ha considerado resultante de mutaciones en el gen PT53. No obstante, la correlación entre las mutaciones del gen y su expresión proteica no es concluyente31–33. Hemos establecido un punto de corte de p53 (15%) y la expresión inferior al 15% asoció un peor pronóstico.
La invasión linfovascular se ha considerado un factor de riesgo independiente de recidiva tumoral34. Coincidimos con otros autores en que la invasión linfovascular se asocia con una menor SLE.
La adenosis microglandular es una rara lesión proliferativa que podría ser un precursor de los tumores TN35. Sin embargo, no la identificamos en ninguna de las piezas quirúrgicas; por tanto, de ser un precursor, su presencia no implicaría un peor pronóstico.
LimitacionesNuestro score pronóstico se ha obtenido de manera retrospectiva en una muestra heterogénea, sin categorización según el tratamiento recibido, y debe ser validado mediante un estudio prospectivo con homogeneización de las pacientes.
No se ha valorado la respuesta radiopatológica, considerada uno de los factores pronósticos más relevantes36,37, al no disponer de un número suficiente de pacientes tratadas con QTN.
ConclusionesHemos definido los factores independientes radiopatológicos de menor SLE y creado un perfil de riesgo de recidiva que podría condicionar un seguimiento individualizado de las pacientes con un score de alto riesgo. No obstante, estos resultados deben validarse mediante un análisis prospectivo con una muestra más homogénea.
Como radiólogos, debemos considerar la inclusión de la RM en el seguimiento de las pacientes con CM TN que han sido tratadas con cirugía conservadora, que presenten un score de alto riesgo y asocien un patrón mamario denso. El empleo de la RM se justifica por la mayor sensibilidad de esta técnica de imagen para la detección de recidiva tumoral.
Autoría- 1.
Responsable de la integridad del estudio: CSS.
- 2.
Concepción del artículo: CSS, CGM y SCC.
- 3.
Diseño del artículo: CSS, CGM y ISA.
- 4.
Obtención de datos: CSS, CGM, SCC y DRC.
- 5.
Análisis e interpretación de los datos: CSS, CGM, SCC, BGB y ISA.
- 6.
Tratamiento estadístico: BGB.
- 7.
Búsqueda bibliográfica: CSS, CGM, SCC, DRC y ISA.
- 8.
Redacción del trabajo: CSS, CGM, SCC y BGB.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: CSS, CGM, SCC, DRC, ISA y BGB.
- 10.
Aprobación de la versión final: CSS, CGM, SCC, DRC, ISA y BGB.
Los autores declaran no tener ningún conflicto de interés.