INTRODUCCIÓN
La demostración de calcificaciones es un aspecto importante en la caracterización de las diferentes lesiones intracraneales. La calcificación está presente en diversas patologías intracraneales, tanto procesos tumorales, infecciosos, vasculares como metabólicos. La presencia de calcificaciones, su localización y las características morfológicas de las mismas influyen en el posible diagnóstico diferencial, haciéndolo más limitado, y consecuentemente en el manejo de los pacientes.
El calcio habitualmente se manifiesta en las imágenes de resonancia magnética (RM) como una disminución o ausencia de señal tanto en las secuencias potenciadas en T1 como en las potenciadas en T2, como consecuencia de la ausencia de protones móviles en el seno de las calcificaciones, que son los responsables de la señal en estudios de RM. La reducción de la intensidad de señal es evidente tanto en secuencias eco del spin como en secuencias eco de gradiente, si bien, en estas últimas la pérdida de la señal es más intensa debido a que son más sensibles a la susceptibilidad magnética existente en los tejidos calcificados.
Sin embargo, la experiencia demuestra que las calcificaciones pueden aparecer como focos de intensidad variable tanto en las secuencias potenciadas en T1 como en T2, manifestándose como áreas hiperintensas, isointensas o hipointensas en ambos tipos de secuencias. Esta variabilidad en su apariencia hace inespecífica su presentación, lo que dificulta la identificación de calcificaciones en los estudios de RM1.
La causa de este comportamiento no es bien conocida, aunque se han sugerido varias teorías para explicar esta variable forma de presentación.
En esta revisión hemos pretendido demostrar la variabilidad e inespecificidad de la apariencia de las calcificaciones en RM.
MATERIAL Y MÉTODOS
Hemos revisado a 21 pacientes con calcificaciones intracraneales de diversa etiología demostradas en tomografía computarizada (TC). Estos pacientes fueron sometidos posteriormente a estudios de RM.
Los estudios de TC fueron realizados con un equipo helicoidal Somaton Plus.
Los estudios de RM se llevaron a cabo con un imán 1.5 Tesla y una antena de cuadratura craneal transmisora/receptora. Las series obtenidas incluyen axiales y sagitales eco del spin (ES) potenciadas en T1 y axiales ES potenciadas en T2.
Analizamos la intensidad de señal objetivada en el seno de las lesiones tomando como referencia la señal de la corteza cerebral y clasificamos la intensidad de señal en tres grupos: hiperintensidad, isointensidad e hipointensidad para las secuencias potenciadas tanto en T1 como en T2.
En 12 pacientes se realizó cirugía y existe un diagnóstico anatomopatológico de las lesiones. En los 9 pacientes restantes no hay confirmación histopatológica, por lo que se establece el diagnóstico a partir de los datos clínicos, los hallazgos analíticos y/o radiológicos y la evolución clínica.
RESULTADOS
Las lesiones intracraneales calcificadas estudiadas correspondían a diversas etiologías. Entre los procesos de origen neoplásico se incluyen dos papilomas de los plexos coroideos, dos oligodendrogliomas, un germinoma de la glándula pineal, un teratoma, un neurocitoma central, un craneofaringioma y cuatro meningiomas, uno de ellos múltiple. Tres casos correspondían a malformaciones vasculares, un aneurisma y dos malformaciones arteriovenosas. Tres pacientes presentaban calcificaciones inespecíficas en los ganglios de la base y uno depósito de sustancias paramagnéticas. También se recogió un caso de lesiones calcificadas intracraneales como consecuencia de cisticercosis y otro de calcificaciones múltiples secundarias a tratamiento radioterápico.
Al comparar la señal de las calcificaciones con la corteza cerebral en las secuencias potenciadas en T1 se observaron únicamente cinco casos de hiposeñal. Doce casos de calcificaciones se identificaron como focos isointensos con respecto a la sustancia gris cortical y en cuatro casos dichas lesiones calcificadas se manifestaron como áreas de hiperseñal (tabla 1).
En las secuencias potenciadas en T2, trece de los casos de calcificaciones intracraneales se presentaron como áreas hipointensas, siete casos como isointensas y dos hiperintensas (tabla 2). En el caso del paciente con cisticercosis, se encontraron diferentes características de señal en las distintas calcificaciones intracraneales en el mismo paciente, por lo que se han considerado como dos formas de presentación radiológica, incluyendo estos hallazgos como dos casos.
Por tanto, la presentación más frecuente de las calcificaciones en las secuencias potenciadas en T1 fue la isoseñal. En las secuencias potenciadas en T2, el hallazgo más frecuente fue la hiposeñal.
DISCUSIÓN
La calcificación es una característica importante de las lesiones intracraneales que limita el posible diagnóstico diferencial, por tanto, es de gran utilidad su identificación en las técnicas de imagen diagnósticas. La aparición de la TC supuso una revolución en la neurorradiología y en la actualidad su importante desarrollo permite obtener una buena visualización de las principales estructuras del sistema nervioso central. Sin embargo, con la aparición y desarrollo de la RM, que proporciona una mayor resolución y capacidad para identificar las diferentes estructuras anatómicas encefálicas con la ventaja adicional de obviar la radiación ionizante, la TC ha pasado a un segundo plano en el estudio de la patología intracraneal, convirtiéndose la RM en la técnica de elección para el estudio de diversas afecciones del sistema nervioso central. No obstante, la TC sigue teniendo indicaciones actualmente en diversas situaciones clínicas, entre ellas el estudio de lesiones óseas y calcificadas por su gran capacidad para visualizar el hueso y las calcificaciones frente a la RM. Por otra parte, la mayor disponibilidad de la TC hace de esta técnica la primera exploración radiológica que se realiza ante una sospecha de patología intracraneal. Teniendo en cuenta que la TC es una técnica muy sensible para demostrar calcificaciones y que la presencia de éstas es de gran importancia en el establecimiento de un posible diagnóstico diferencial ante una lesión, la TC ofrece una información complementaria de gran utilidad para llegar al diagnóstico, a pesar de que la RM sea la técnica de elección para el estudio de las lesiones intracraneales.
En RM obtenemos la señal de los diferentes tejidos porque los protones móviles contenidos en ellos al ser sometidos a una onda de radiofrecuencia generan un campo magnético y emiten una onda de radiofrecuencia que es recogida y transformada en imágenes bidimensionales. En RM las calcificaciones se presentan teóricamente como focos de hiposeñal en las secuencias potenciadas en T1 y T2 como consecuencia de la ausencia de protones móviles en la calcificación, que son los responsables de la formación de la imagen en RM (fig. 1). Sin embargo, en ocasiones, calcificaciones objetivadas por otras técnicas de imagen como la TC se presentan como áreas hiperintensas, isointensas o hipointensas en RM en secuencias potenciadas en T1 y T2 (figs. 2, 3 y 4). Esta variabilidad en su apariencia hace que la RM sea poco específica para la demostración de calcificaciones intracraneales1.
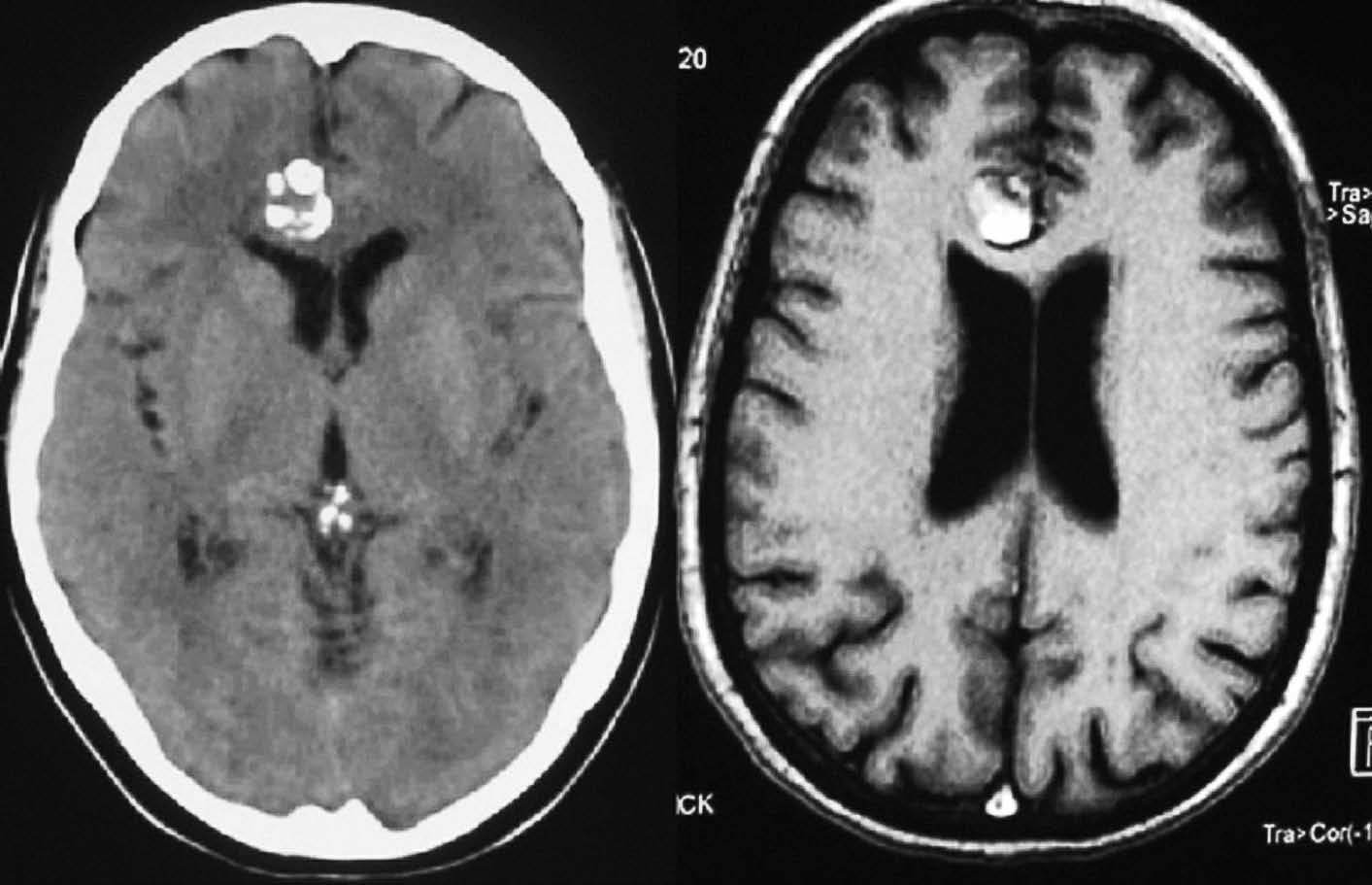
Fig. 1.—Meningioma calcificado frontal derecho, que se presenta como hipointenso en las secuencias de RM potenciadas en T1 y T2.
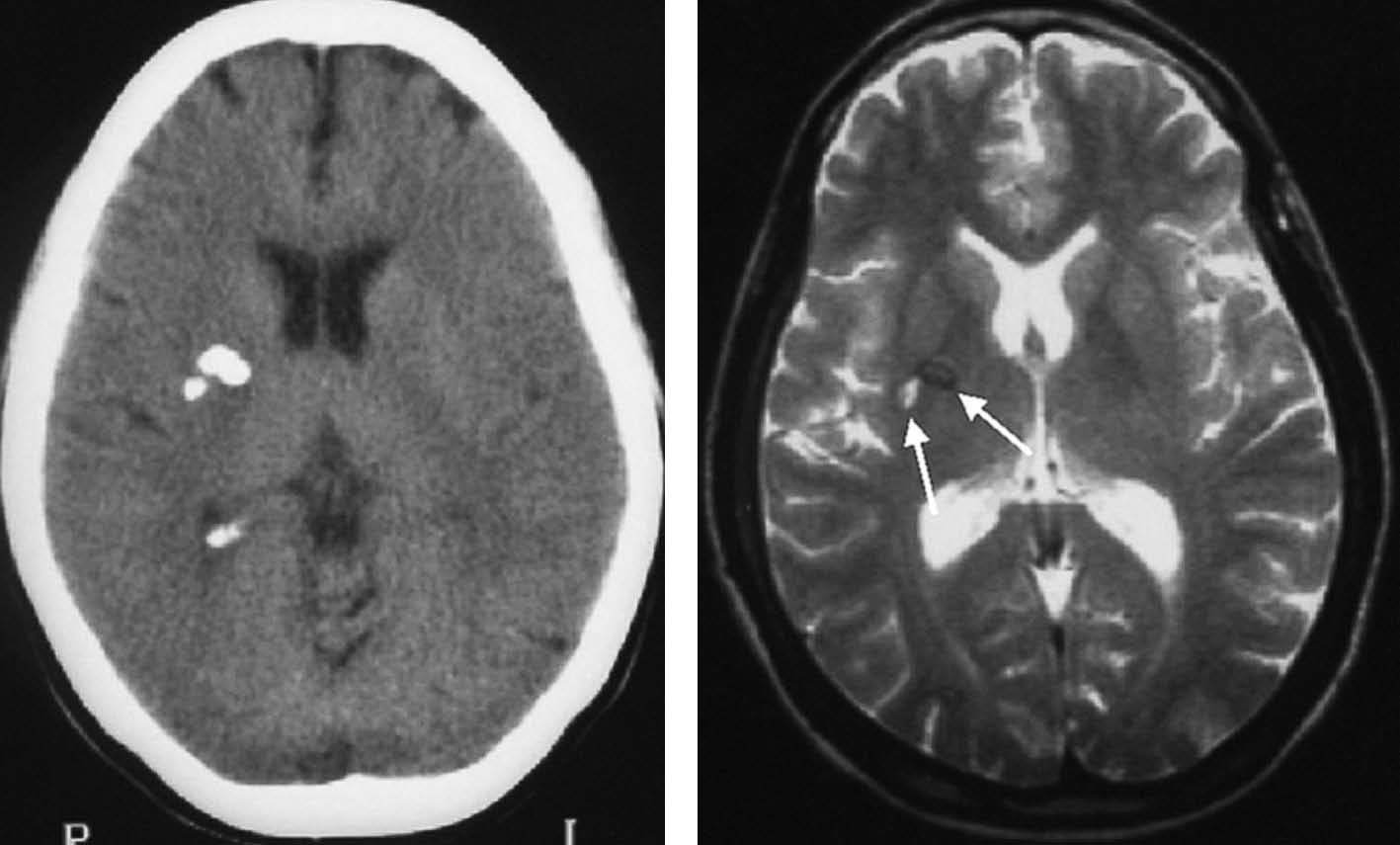
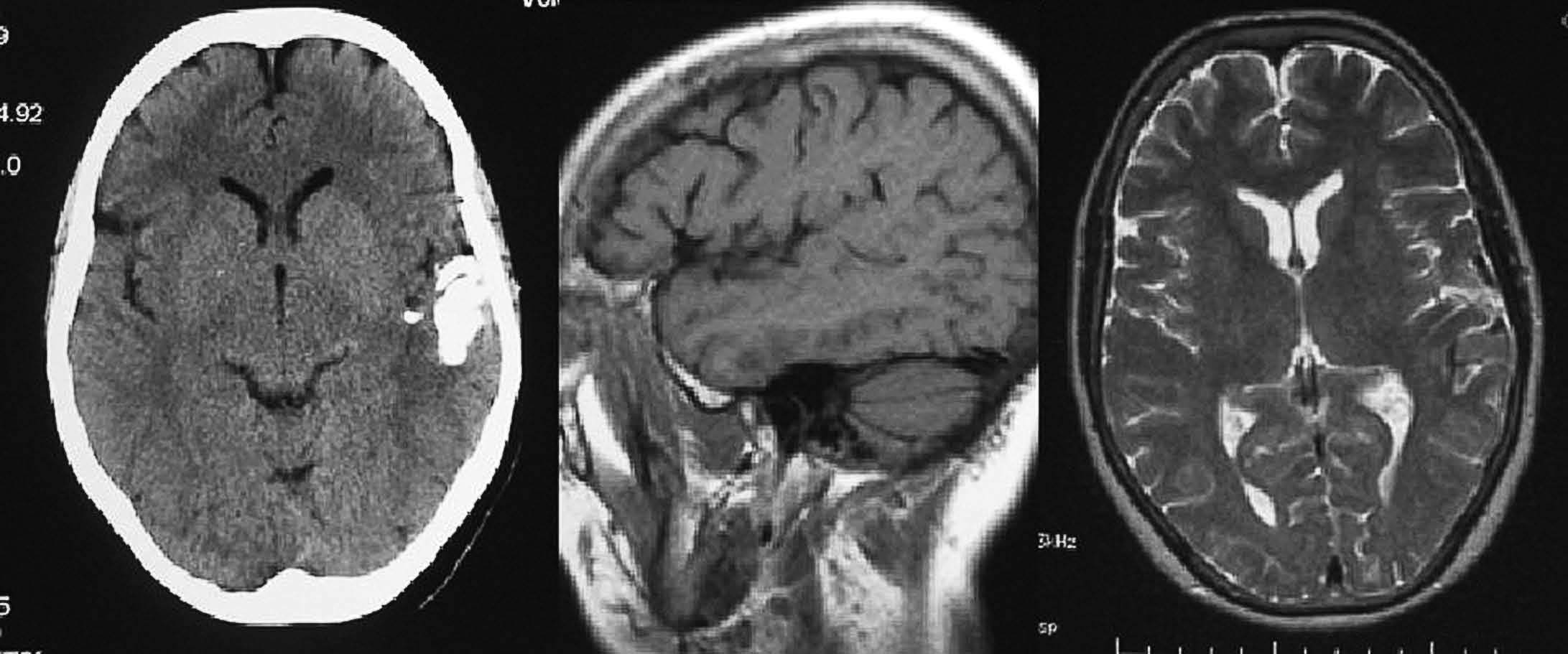
Fig. 2.—Cisticercosis. Calcificaciones visibles en la TC en el brazo posterior de la cápsula interna derecha. En la RM se presentan con intensidad variable en secuencias potenciadas en T2, como un área hiperintensa y otra hipointensa.
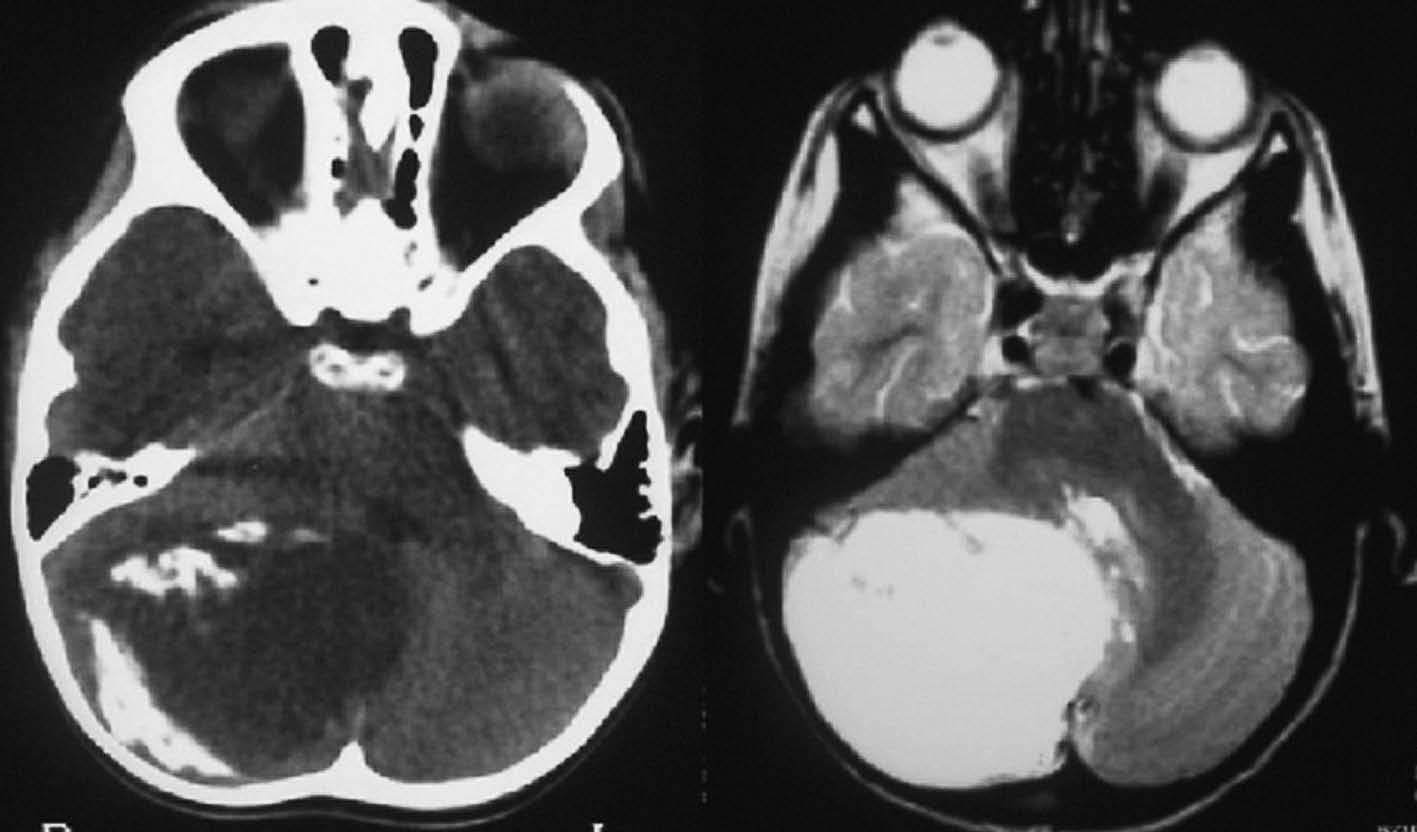
Fig. 3.—Oligodendroglioma. Masa en hemisferio cerebeloso derecho con calcificación periférica que se manifiesta hiperintensa en la secuencia potenciada en T2.
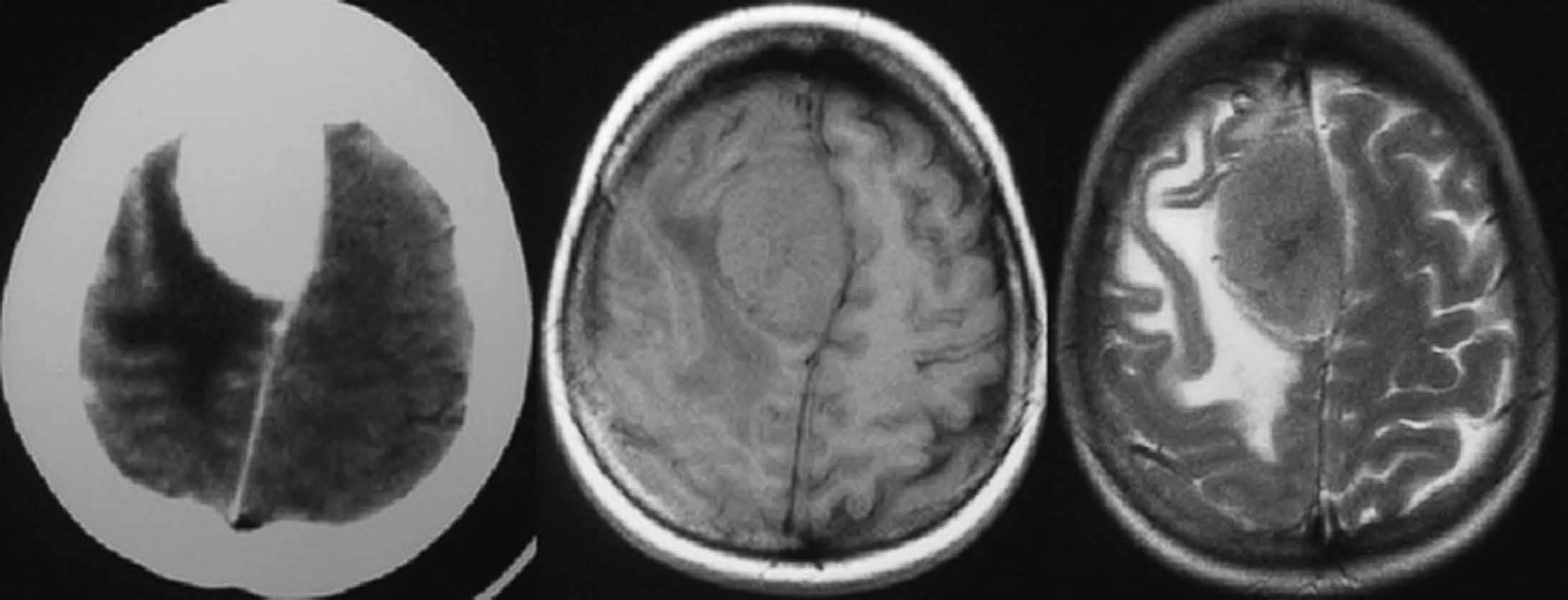
Fig. 4.—Meningioma. Masa calcificada extraaxial frontal parasagital derecha, que en la RM se comporta como una masa predominantemente isointensa con respecto al córtex cerebral en secuencias potenciadas en T1 y T2, con áreas de menor intensidad en su interior en T2.
Para explicar la hiperintensidad como manifestación de la calcificación (figs. 5 y 6) algunos autores apuntaron inicialmente a que eran los tejidos subyacentes a la calcificación los que poseían propiedades que acortaban el tiempo de relajación T1 y que la calcificación únicamente no lograba enmascar la hiperintensidad inherente de ese tejido. Sin embargo, posteriormente se ha postulado que el calcio por sí mismo puede causar una hiperintensidad en las imágenes potenciadas en T1 debido a propiedades inherentes al mismo3. El mecanismo exacto del paradójico aumento de señal en las secuencias de RM potenciadas en T1 es desconocido. Por el momento se ha atribuido a un mecanismo de superficie-relajación2 que produce un acortamiento de los tiempos de relajación T1 y T2. El calcio de las estructuras óseas, las calcificaciones distróficas y las calcificaciones tumorales están compuestas principalmente por hidroxiapatita o minerales similares4. Algunos autores han demostrado experimentalmente que la hidroxiapatita cálcica suspendida en gel agarosa produce un acortamiento del tiempo de relajación T1 bajo condiciones adecuadas y consideran que el acortamiento del tiempo de relajación está directamente relacionado con la superficie del área de los cristales del calcio en el gel agarosa. En los casos en los que la superficie es muy grande demostraban que predominaba el efecto T1, produciendo un aumento neto de la intensidad de señal en RM2. Los efectos más marcados fueron obtenidos para cristales de calcio que presentaban una superficie mayor y más irregular. Así, materiales que tenían la misma composición química y tamaño tuvieron efectos en la relajación marcadamente diferentes que parecían ser dependientes del grado de irregularidad microscópica de la superficie del cristal de calcio.
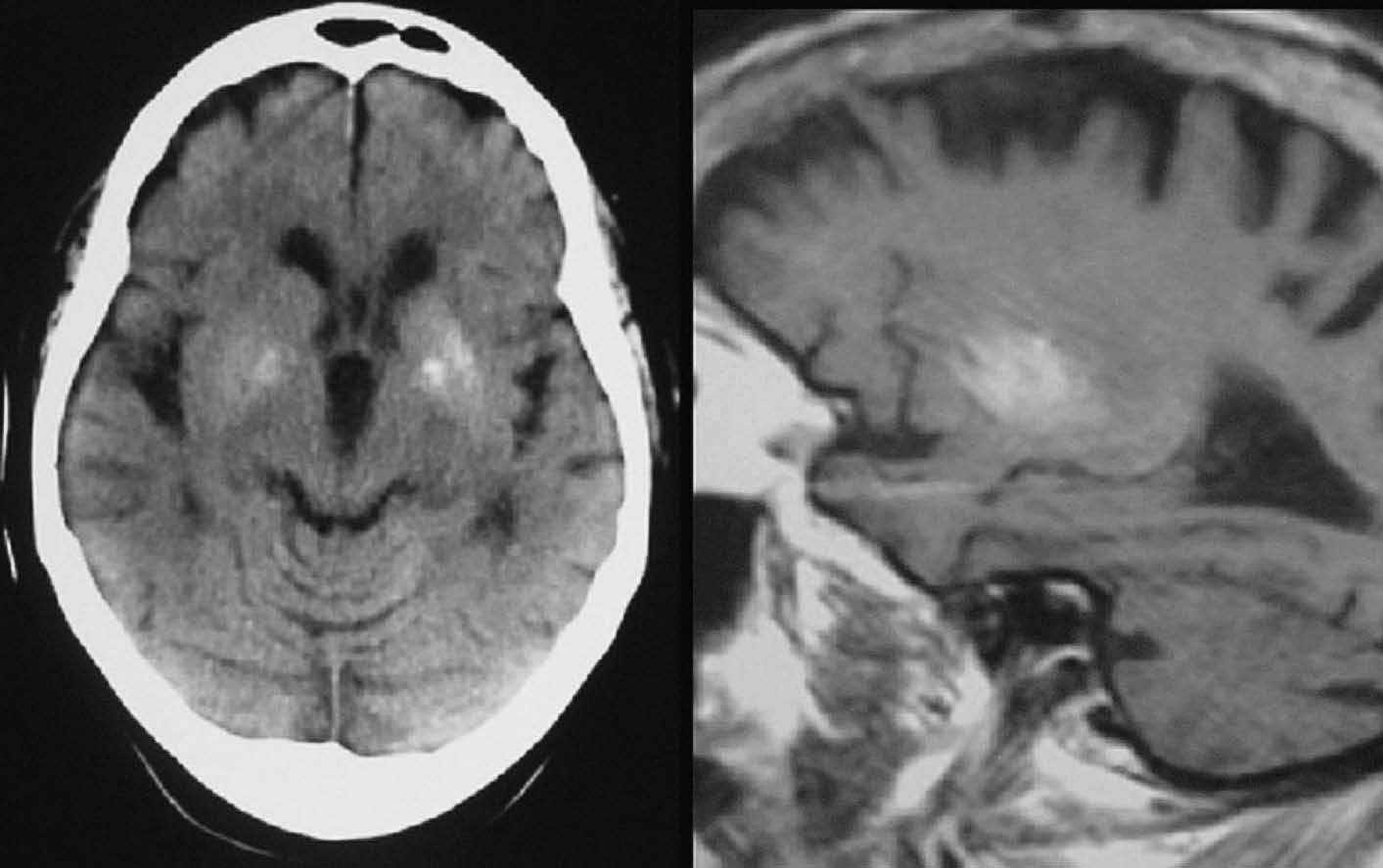
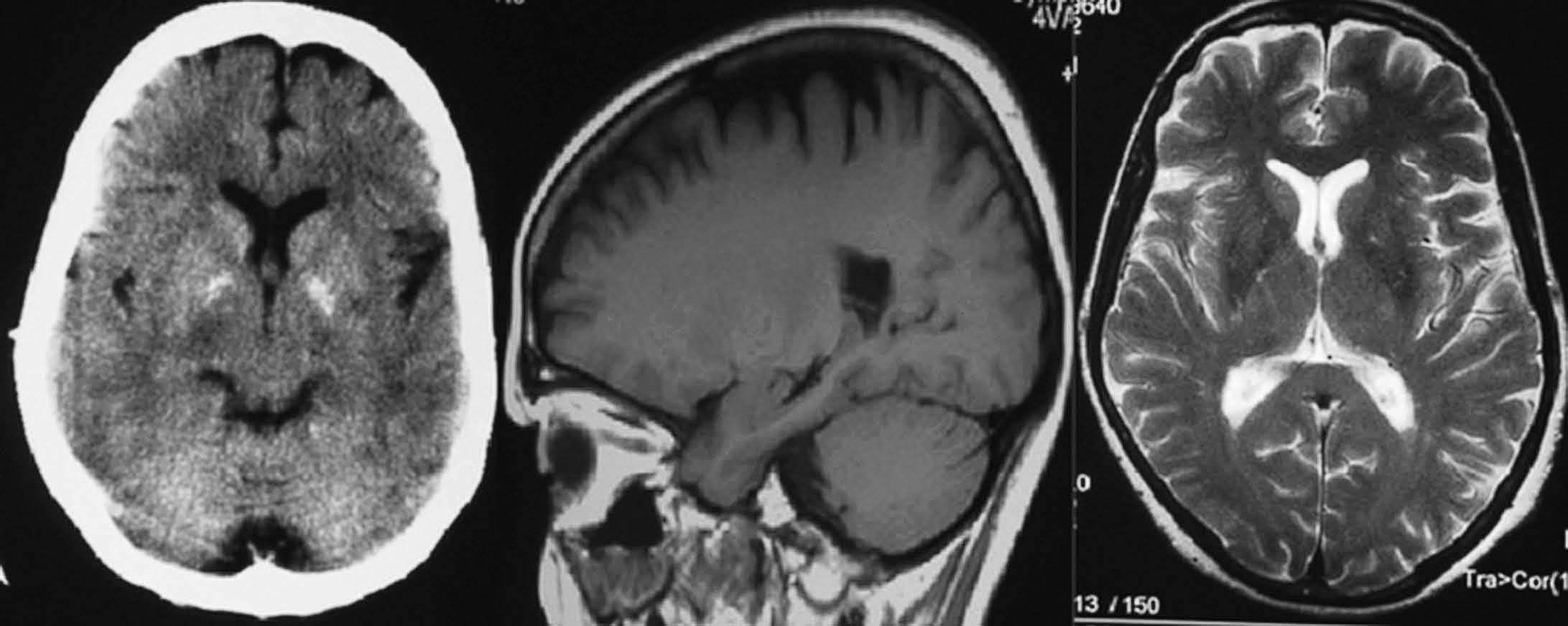
Fig. 5.—Aneurisma de arteria pericallosa derecha. Masa calcificada frontal parasagital derecha que, en RM, en secuencias potenciadas en T1, se manifiesta como hiperintensa.
Fig. 6.—Calcificaciones bilaterales en ganglios de la base vistas en TC, que en la RM aparecen como áreas de hiperseñal en T1.
En las lesiones calcificadas existe una menor cantidad de protones móviles, es decir, una menor densidad protónica. El calcio causa un cambio en la relajación T2 y en densidad protónica, aumentando la relajación T2 y disminuyendo la densidad protónica. Estudios experimentales demostraban que cuando la concentración de calcio en la calcificación era superior a 30-40%5, la disminución de la densidad protónica y la reducción de la relajación T2 anulan el potencial aumento de la intensidad de la señal derivado de un acortamiento de la relajación T1, disminuyendo la señal a medida que aumenta la concentración de calcio. En los casos en que domina la reducción del tiempo de relajación T1 sobre la disminución de la densidad protónica y T2 las lesiones calcificadas muestran un aumento de la señal en T15. Solamente en aquellos casos en los que la superficie del cristal de calcio es muy grande o muy irregular puede predominar el efecto T1, produciendo un aumento neto de la intensidad de señal.
Además, algunos autores como Tenner et al afirman que el acortamiento del tiempo de relajación T1 que ocasionalmente se observa en algunos tejidos calcificados puede ser consecuencia, además de la presencia de calcio, de la asociación de macromoléculas o sustancias paramagnéticas6. En este sentido, también Tsuchiya et al encuentran que en 7 de 10 regiones calcificadas existe un realce tras la administración de gadolinio que implica que en esa zona de tejido calcificado hay tumor y que este tejido tumoral genera una señal en las imágenes no realzadas, siendo responsable, por tanto, en parte del aumento de señal detectado en estas secuencias1.
Cuando el calcio se presenta como hiperintenso en las secuencias potenciadas en T1 es necesario diferenciarlo de otras situaciones de hiperintensidad en estas secuencias como la grasa, la sangre y las lesiones que contienen melanina7.
En los casos en los que el calcio se visualiza como isointenso (figs. 7, 8, 9 y 10) puede ser debido a que exista un número suficiente de protones móviles en el seno del tejido blando del intersticio de la calcificación, de forma que, si un vóxel contiene tantos protones móviles como calcio, puede predominar la señal de los primeros y generar una señal apreciable. En los casos en los que el calcio se manifiesta como isointenso, la calcificación puede no diferenciarse del tejido adyacente y pasar desapercibida. Las calcificaciones pequeñas comparadas con el tamaño del vóxel pueden pasar también desapercibidas por la señal de los tejidos vecinos por efecto de volumen parcial.
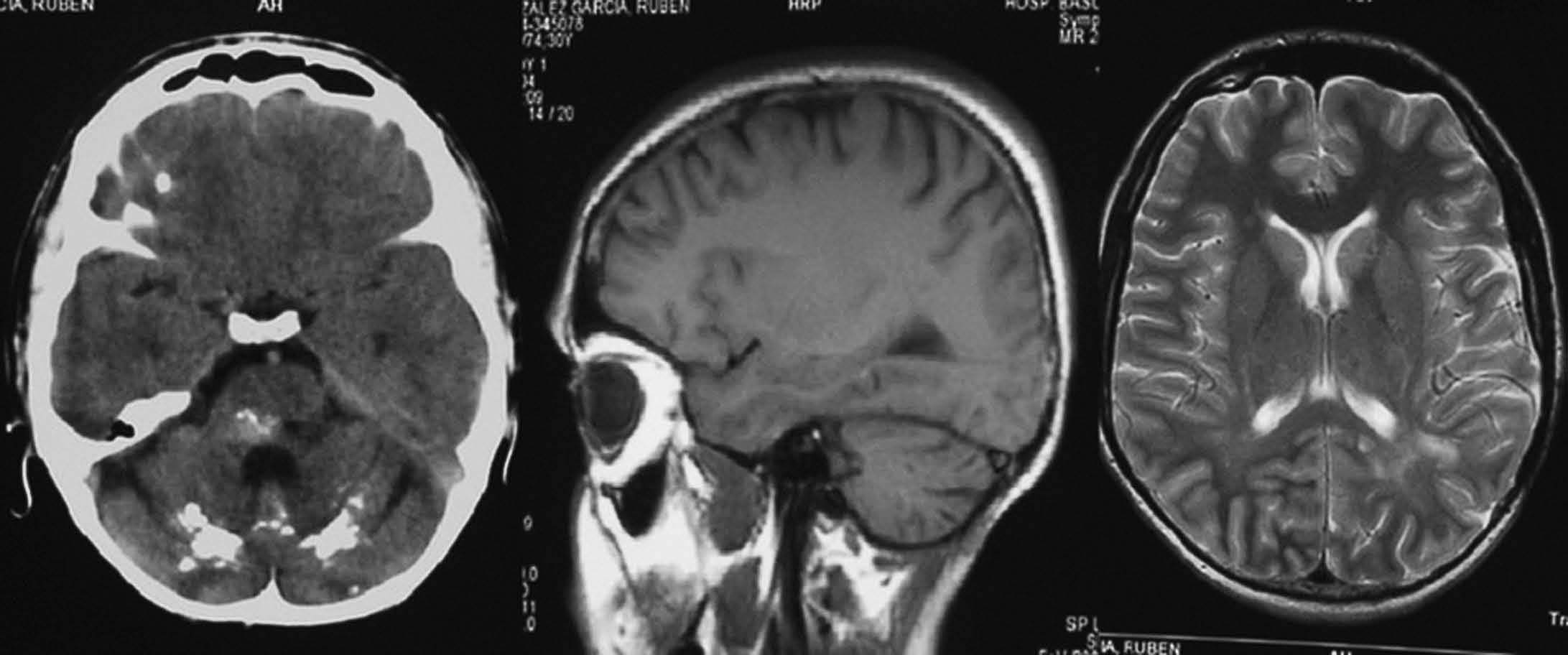
Fig. 7.—Calcificaciones groseras en ambos lóbulos occipitales secundarias a radioterapia. En las imágenes de RM no se observan alteraciones en el lugar de dichas calcificaciones, presentándose como isointensas con el parénquima cerebral.
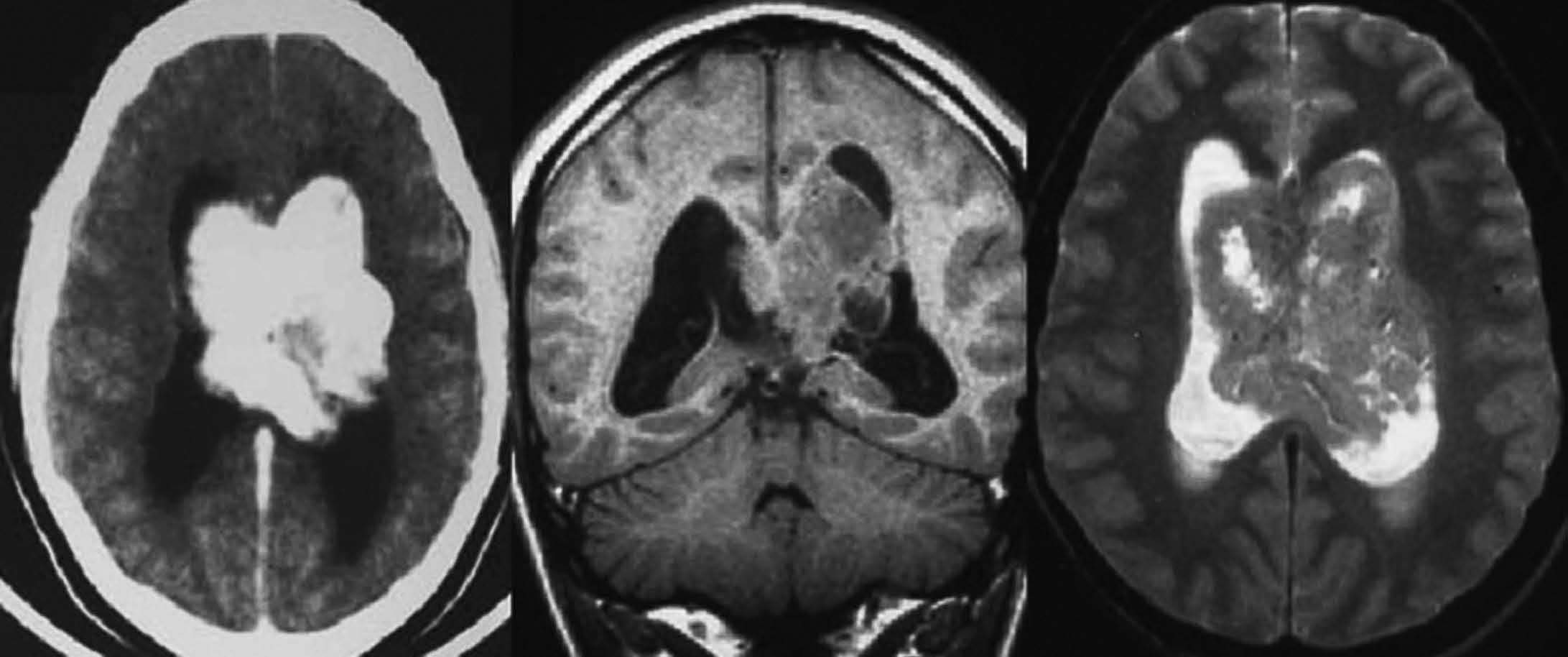
Fig. 8.—Neurocitoma central. Gran masa intraventricular calcificada en TC. En RM se objetiva masa intraventricular isointensa con respecto a la corteza cerebral tanto en secuencias potenciadas en T1 (coronal) como T2.
Fig. 9.—Malformación arteriovenosa. Calcificación temporoparietal izquierda con cierta morfología serpinginosa en TC, isointensas en imágenes de RM.
Fig. 10.—Calcificación inespecífica. Calcificaciones bilaterales en los ganglios de la base vistas en TC, isointensas en RM, no siendo posible su identificación.
En algún estudio se ha descrito que las secuencias potenciadas en T2 son las más sensibles para la demostración del calcio. Esto es debido a que habitualmente las lesiones se ven como áreas de baja intensidad de señal en T1 y como áreas de elevada intensidad de señal en T2 por su tendencia a acumular agua8. Por esto, la disminución de la señal debida a la calcificación aumenta el contraste frente al aumento de la señal en T2 de la lesión alrededor del foco de calcificación, pero puede ser menos manifiesto cuando esa área está rodeada de una disminución de la señal en las secuencias T1. En las secuencias T2 eco de gradiente la caída de la señal es más profunda debido a que estas secuencias son más sensibles a susceptibilidad magnética existente en las lesiones calcificadas3. Las secuencias eco de gradiente T2 no son capaces de diferenciar entre la calcificación y la hemorragia debido a que ambas muestran baja intensidad de señal, sin embargo esta distinción es posible con las secuencias eco de gradiente en fase, donde la calcificación presenta un desplazamiento de fase positivo, mientras que las lesiones hemorrágicas revelan un desplazamiento de fase negativo4. En esta revisión nosotros sólo hemos valorado la intensidad de señal detectada en secuencias ES T1 y T2.
Por otra parte, es conocida la presencia de sustancias paramagnéticas en algunas calcificaciones4, que modifican el tiempo de relajación. Así, el hierro en su forma libre contenido en la calcificación podría ser la causa de la relativa caída de señal por acortamiento preferente del tiempo de relajación T2. Por tanto, el acortamiento del tiempo de relajación T2 tampoco es específico del calcio y no se puede excluir que este efecto sea debido a las sustancias paramagnéticas contenidas en las lesiones calcificadas4.
En resumen, la forma de presentación de las calcificaciones en RM es variable e inespecífica9, existiendo un amplio espectro en su apariencia desde focos de hiperintensidad a hipointensidad tanto en secuencias potenciadas en T1 como en T2, pasando desapercibidas en determinadas ocasiones. Este hecho supone una limitación de la RM en la identificación de lesiones calcificadas en general e intracraneales en particular, pese a ser la técnica de elección en el estudio de las lesiones del sistema nervioso central. Por tanto, la TC, que posee una gran sensibilidad para la identificación de calcificaciones, sigue siendo una herramienta diagnóstica complementaria a las exploraciones craneales de RM por su capacidad de detección de calcio en el seno de la lesiones intracraneales, proporcionando, de este modo, información adicional para establecer un correcto diagnóstico y manejo del paciente.