Congreso Nacional SERAM Málaga 2022: Informe radiológico: ¿qué y cómo?
Más datosLa enfermedad hepática crónica (EHC) es una patología extremadamente común en la que la imagen juega un papel clave. Sin embargo, la realización de un correcto informe radiológico es un reto en la EHC debido a sus múltiples etiologías y la gran variedad de hallazgos radiológicos. Por ello, el uso de informes estructurados adaptados a los distintos escenarios clínicos resulta fundamental. El presente artículo recoge el papel de la imagen y las cuestiones fundamentales a reflejar en un informe radiológico para el diagnóstico de la EHC, para la identificación y manejo de las lesiones focales en los pacientes con hepatopatía crónica (incluyendo el uso de LI-RADS) y para el diagnóstico, estadificación y decisión de manejo del carcinoma hepatocelular.
Chronic liver disease is extremely common, and imaging plays a key role in its management. Elaborating an effective imaging report for chronic liver disease is challenging because of its multiple etiologies and the broad spectrum of imaging findings. For this reason, it is fundamental to use structured reports tailored to the different clinical scenarios. This paper covers the role of imaging and the fundamental questions that should be reflected in a radiology report for the diagnosis of chronic liver disease, both in relation to the identification and management of focal lesions in patients with chronic liver disease (including the use of LI-RADS) and in relation to diagnosis, staging, and decision-making in the management of hepatocellular carcinoma.
La enfermedad hepática crónica (EHC) consiste en un deterioro progresivo de la función hepática secundario a un proceso continuo de inflamación, destrucción y regeneración del parénquima hepático que conduce al desarrollo de fibrosis y cirrosis. Si bien la fibrosis suele ser irreversible, puede no serlo en una etapa inicial de su desarrollo si se elimina el agente causal y las lesiones no son extensas. La cirrosis es la etapa final y está caracterizada por la alteración de la arquitectura del hígado con fibrosis, formación de nódulos de regeneración y desarrollo de neoangiogénesis1.
El espectro de etiologías que conducen a la EHC es amplio e incluye abuso de alcohol, infecciones, toxinas, enfermedades autoinmunes o trastornos genéticos y metabólicos (tabla 1). Aproximadamente el 40-60% de los casos en Europa y Norteamérica son debidos al abuso de alcohol y al hígado graso no alcohólico (EHGNA), mientras que el 25-30% es el resultado de la hepatitis vírica crónica1.
Etiología de la cirrosis hepática
| Metabólica-tóxicaAlcoholEnfermedad de hígado graso no alcohólico (resistencia a la insulina, síndrome metabólico)Cirrosis infantil de la India |
| InfecciosaVirus de las hepatitis, C y DEsquistosomiasis |
| AutoinmuneHepatitis autoinmuneCirrosis biliar primariaColangitis autoinmuneSíndromes de solapamiento o superposición |
| Inducido por fármacosArsénico, metotrexato, isoniazida, amiodarona, α-metildopa, cloruro de carbono |
| Genético-hereditariaHemocromatosis hereditariaEnfermedad de WilsonDéficit de alfa-1 antitripsinaPorfiria cutánea tardaEnfermedades por depósito de glucógenoGalactosemiaTirosinemiaAbetalipoproteinemiaFibrosis quística |
| Enfermedades biliaresCirrosis biliar secundaria (obstrucción biliar por estenosis, litiasis de larga evolución, etc.)Colangitis esclerosante primariaColangitis asociada IgG 4Colangiopatía isquémicaDuctopeniaAtresia de vías biliaresSíndrome de Alagille |
| VascularInsuficiencia cardíaca crónica derecha («cirrosis cardiaca»)Pericarditis constrictiva crónicaSíndrome de Budd-ChiariSíndrome de obstrucción sinusoidal (enfermedad venoclusiva)Telangiectasia hemorrágica hereditaria (enfermedad Rendu-Osler-Weber) |
| Criptogenéticaa |
La historia natural de la cirrosis muestra 2fases con pronóstico y supervivencia diferentes. La primera, denominada «cirrosis compensada», se caracteriza por ser una fase asintomática de duración variable en la que los pacientes pueden llegar presentar hipertensión portal (HP) y varices esofágicas2.
A medida que la enfermedad progresa, y con el desarrollo de un mayor grado de HP y de deterioro de la función hepática, aparecen las complicaciones de la segunda fase denominada «cirrosis descompensada», como serían la ascitis, la hemorragia por varices, la encefalopatía hepática o la aparición de ictericia. La progresión a la fase descompensada determina un empeoramiento del pronóstico de los pacientes con una disminución progresiva de su supervivencia que pasaría de un 61% el primer año a solo un 7% a los 10 años1–3.
Por otra parte, la aparición de carcinoma hepatocelular (CHC) puede complicar el curso de la enfermedad tanto en la fase compensada como descompensada. De ahí, la gran importancia de un diagnóstico precoz del CHC que, combinado con una terapia curativa, mejora la supervivencia a los 5 años del 40 al 70%4.
La EHC es una enfermedad extremadamente común en la que la imagen desempeña un papel clave, pudiéndose distinguir 3escenarios clínicos diferentes5,6.
- 1.
Diagnóstico de la EHC:
- –
Hallazgos en imagen.
- –
Cuantificación de grasa, hierro y fibrosis.
- –
Biomarcadores.
- –
Vigilancia.
- 2.
Identificación y manejo de la lesión focal (uso de Liver Imaging Reporting and Data System [LI-RADS]).
- 3.
CHC.
En estos diferentes entornos clínicos, el uso de un lenguaje conciso y estandarizado en el informe radiológico va a resultar fundamental para una adecuada toma de decisiones sobre el manejo de los pacientes.
Diagnóstico de la enfermedad hepática crónicaHallazgos morfológicos en imagenLa ecografía es la técnica inicial de elección en la evaluación del paciente con EHC, dado que es accesible y sensible en la detección de alteraciones morfológicas hepáticas, lesiones focales, trombosis portal e HP. Los principales hallazgos que sugerirían la presencia de cirrosis con base en distintas técnicas de imagen se resumen en la tabla 2. Entre ellos, debemos destacar la nodularidad de la superficie hepática detectada con sonda lineal, al ser el signo más directo de la existencia de fibrosis2. Por otra parte, la detección de signos de HP es muy importante desde un punto de vista pronóstico (fig. 1). Así, la identificación de varices portosistémicas cambiaría la clasificación de una cirrosis compensada de grado 1 a 2 y la presencia de ascitis de una cirrosis compensada a descompensada, que se asocia a una menor supervivencia1,2. La incorporación de la elastografía de transición (FibroScan®, EchosensTM, París, Francia) ha permitido valorar de forma no invasiva la fibrosis hepática y es el mejor método para descartar la cirrosis hepática con un valor predictivo negativo >90%7.
Signos de hepatopatía en las técnicas de imagen
| ECOGRAFIA | TC | RM | |
|---|---|---|---|
| CONTORNOS | Nodularidad-micronódulos < 3 mm-macronódulos >3 mm-mixtaLa presencia de modularidad en la superficie hepática muestra una sensibilidad del 54% y especificidad del 95% para la presencia de fibrosisLisos | Nódulos de regeneración son isodensosSolo visibles en el 25% de los TC | Nódulos de regeneración son isointensos en T1 y en T2Visibles en el 50% de las RMEn ocasiones son sideróticos con presencia de hemosiderina (hiposeñal en secuencias de RM potenciadas tanto en T1 como en T2) |
| MORFOLOGÍA | AtrofiaEl 25% de los hígados cirróticos son de tamaño y forma normales36% muestran atrofia difusa | Segmento medial del LHI (IV)Segmentos posteriores del LHD (VI-VII) | Segmento medial del LHI (IV)Segmentos posteriores del LHD-Aumento del espacio periportal >10 mm.El espacio hiliar periportal mide normalmente menos de 10 mm medido desde el borde anterior de la rama portal derecha al borde posterior del segmento medial del lóbulo izquierdo. Una medida mayor de 10 mm muestra una sensibilidad del 93% y una especificidad del 92% para el diagnóstico de cirrosis-Aumento de la fosa vesicular-Aumento de la cisura mayor interlobar-Cisura hepática posterior derecha, muesca aguda en la superficie posterior derecha del hígado que muestra una sensibilidad del 72% y una especificidad del 98% para el diagnóstico de cirrosis |
| Hipertrofia | Segmento lateral del LHI (II-III) y lóbulo caudado | ||
| QUISTES PERIBILIARES | Hallazgo poco frecuenteProducidos por la inflamación periportal | Patrón lineal o en racimo de localización periportal | Fácilmente visualizados en las secuencias de CPRM |
| HETEROGENEIDAD25% de los casos | Patrón heterogénoGrasa, hierro o fibrosis | Densidad heterogénea | Señal heterogénea |
| GRASA | Aumento difuso de la ecogenicidad hepáticaBorramiento de los márgenes vascularesAumento de atenuación acústicaCUALITATIVAGrado 1 leve: ecogenicidad superior al RDGrado 2 moderada: borramiento de los vasos portalesGrado 3 severa imposibilidad para visualizar los vasos portales, el diafragma y las partes posteriores del LHDLimitaciones- Sensibilidad del 50-62%- Variabilidad- No reconoce depósitos menores del 30%- Limitado en pacientes con elevado IMCCUANTITATIVAUso de CAP mediante el FibroScan sensibilidad del 75% y especificidad del 77%Uso de parámetros como el coeficiente de atenuación y el Backscatter coeficienteOtras patologías hepáticas pueden afectar a la atenuación de las ondas, así como la presencia de fibrosis | Valores de atenuación < 48 UH indica presencia de esteatosisValor de atenuación del hígado normal entre 50-65 UH > 10 UH superior al bazoTCED variabilidad en los estudios, menor sensibilidad que TC monoenergéticoLimitaciones- Uso de radiación- No detecta esteatosis menores al 30%- Errores: hierro, amiodarona, glucógeno, edema, hepatitis. | CUALITATIVACaída de señal en las secuencias de eco de gradiente T1 en fase y fuera de faseCUANTITATIVAEspectroscopiamétodo más precisoSensibilidad del 73-89% y especificidad del 92-96%Localizarlo en el interior del parénquima en el LHD- Univoxel- Método PRESS O STEAM- Métodos basados en el desplazamiento químicoMR-PDFFLimitaciones-no detecta esteatosis < 15%-susceptibilidad magnética por el depósito de hierro |
| HIERRO | Hiperintensidad en TC | Hipointensidad en secuencias T2Hiperintensidad en secuencia de eco de gradiente potenciada en T1 fuera de faseMedidas de ratio de intensidad de señal | |
| FIBROSIS | CUANTITATIVA-2D-SWEF0-F1 < 7 kPa (<1,5 m/s)Baja probabilidad de fibrosis clínicamente significativa (no se requieren pruebas adicionales)F2-F3: 7-15 kPaRiesgo intermedio de fibrosis si factores de riesgo presentes (pruebas adicionales según criterio médico)F4 >15 kPa (> 2,2 m/s)Riesgo de fibrosis alto, la elastografía se considera diagnósticaPermite el diagnostico de fibrosis (F4) con una sensibilidad del 83% y especificidad del 89% con un valor de corte de 15 kPaPermite el diagnóstico de HPSólo debe de usarse en hígados cirróticos virus C- Fibroscan o TEUsada por los digestivosNo consta de imagen asociada | Parcheada (áreas de baja atenuación poco definidas)Bandas perilobulares de baja atenuaciónPuentes de baja atenuación entre los nódulos de regeneraciónFibrosis difusa, signo del ojo de buey, manguito periloblillar | Bandas de hiperseñal en T2Fibrosis confluente, aparece en un 32% de los casos.Se acompaña de atrofia del segmento medial izquierdo o anterior derecho y retracción de la cápsula y extensión desde la porta hepatis a la cápsulaHiperrrealce en fase arterial que se hace isointenso con elparénquima circundante en fase venosa y con realce tardío persistente.CUANTITIVAElastografía por RM2,5 kPa normal2,5 a 3,0 kPa normal o inflamación. Completar con hallazgos clínicos y pruebas de laboratorio3,0 a 3,5 kPa estadio 1-23,5 a 4 kPa estadio 2-34 a 5 kPa estadio 3-4> 5 kPa estadio 4 |
| SIGNOS DE HIPERTENSIÓN PORTAL (HP)La HP se define como un incremento del gradiente de la presión venosa hepática superior a 5 mmHg, si es superior a > 10 mmHg es clínicamente significativa y >12 mmHg se considera una HP severa. Su diagnóstico es vital dado que se utiliza como un marcador de respuesta al tratamiento y de riesgo de desarrollo de CHC, descompensación hepática, mortalidad e indicador de la presencia de varices esofágicas | |||
| BAZO | >13 cmsensible no especificoÁrea >45 cm | Presencia de cuerpos sideróticos de Gamma-Gandy, focos hipointensos en T1 específico de HP | |
| Arteria HEPATICA | Aumento de diámetro | Aumento de diámetro y tortuosidad | |
| VENA PORTA | Dilatación de la vena porta >13 mmSensibilidad del 40%Especificidad del 100% | Dilatación de la vena porta y VMS > 11 mmVena esplénica > 11 mm | |
| CIRCULACION SISTÉMICA PERIPORTAL | Repermeabilización de la vena umbilical y colaterales esplenorenalesVarices esofágicas | Permite obtener mapa anatómicoLa detección precisa de varices esofágicas y gástricas es clínicamente relevante, dadasu propensión al sangrado.Los estudios de TC y RM demuestransensibilidad del 58 al 96% y especificidad del 45 al 82%, con menor sensibilidad reportada para várices < 3-5 mm de tamaño. | |
| ASCITIS | Paso de cirrosis compensada a descompensada | ||
| ECO DOPPLER | IR > 0,7 arteria hepáticaVelocidad portal disminuida < 13 cm/s | ||
Backscatter coeficiente: coeficiente de retrodispersión; CAP: parámetro de atenuación controlada; CPRM: colangiografía por RM; HP: hipertensión portal; IMC: índice de masa corporal; IR: índice de resistencia; KPa: kilopascal; LHD: lóbulo hepático derecho; LHI: lóbulo hepático izquierdo; PDFF: proton density fat fraction; PRESS: point resolved spectroscopy; RD: riñón derecho; RM: resonancia magnética; STEAM: stimulated echo acquisition mode; SWE: elastografía por shear-wave; TC: tomografía computarizada; TCED: TC energía dual; TE: elastografía de transición; VMS: vena mesentérica superior.
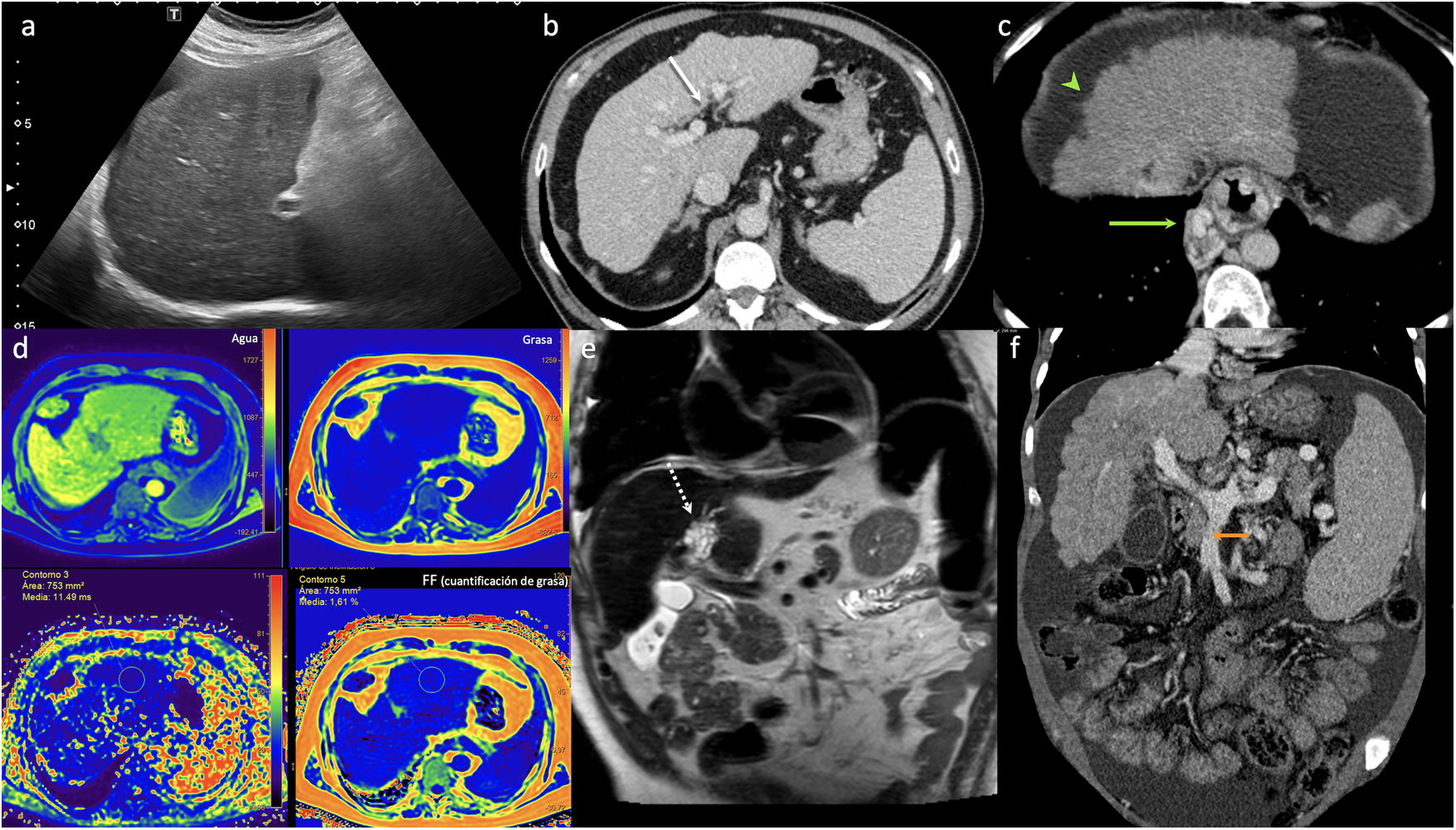
Diferentes signos de hepatopatía en imagen. La ecografía en modo B (a) muestra un parénquima con ecoestructura heterogénea. La flecha blanca en la TC en plano axial (b) muestra un aumento del espacio periportal> 10mm. En la figura c la cabeza de flecha verde ilustra la nodularidad en la superficie hepática, mientras que la flecha señala las múltiples lesiones tubulares en relación con varices periesofágicas. La valoración en RM mediante secuancia DIXON-quant (d) representada en los mapas de color (en color en la versión online) de los distintos parámetros obtenidos confirma la presencia de depósito férrico en un hígado cirrótico, dado que el valor obtenido en el mapa T2* (abajo a la izquierda en d) es menor de 20 ms (11.48), mientras que el porcentaje de grasa del parénquima hepático en el mapa de fracción grasa (fat-fraction) (abajo derecha en la imagen d) es del 1,6%, lo que indica ausencia de esteatosis. La imagen de RM en plano coronal en secuencias potenciadas en T2 (e) en otro paciente con cirrosis identifica múltiples quistes peribiliares (flecha punteada blanca) y una baja señal del parénquima hepático sospechosa de depósito férrico. La TC en plano coronal (f) muestra signos de hipertensión portal con un aumento de calibre de la vena mesentérica inferior (flecha naranja) y una evidente esplenomegalia.
La EHC pueden presentarse con una amplia variedad de hallazgos patológicos, que pueden superponerse, incluyendo inflamación, fibrosis, enfermedad biliar y depósito de grasa y hierro. Actualmente, las técnicas de imagen permiten, con base en distintos parámetros, una evaluación integral de todos estos componentes para un correcto informe estructurado en pacientes con hepatopatía crónica (tabla 3).
Informe estructurado de paciente con hepatopatía crónica
| Informacion clínica |
| Técnica |
| Estudios previos |
| (Sí/no) |
| Hallazgos de cirrosis en imagen |
| (Sí/no) |
| Cápsula hepática: micronodular/macronodular/lisa |
| Parénquima hepático: heterogeneidad (grasa/hierro/fibrosis) |
| Morfología: hipertrofia de lóbulos hepático izquierdo, caudado, atrofia |
| Lesiones focales |
| (Sí/no) |
| Sí |
| - tamaño |
| - segmento |
| - número de lesiones |
| - lesión clasificable con criterio de hepatocarcinoma |
| •→Hiperrrealce no anular en fase arterial |
| •→Lavado en fase portal o tardia (solo portal si ácido gadoxético) |
| •→Cápsula |
| •→Crecimiento (duplicidad > 6 meses) |
| •→Tumor en vena |
| -lesión no clasificable |
| Recomendación de otra técnica |
| Seguimiento |
| Signos de hipertensión portal |
| Bazo: tamaño y en que diámetro (axial, coronal) |
| Porta: diámetro y permeabilidad |
| Ascitis: su presencia indica fase descompensada |
| Varices portosistémicas (gástricas; esofágigas, repermeabilización de la vena umbilical) |
| Colaterales |
| Vasos |
| Anatomía de la arteria hepática/variante anatómica |
| Vía biliar |
| Hallazgos extrahepáticos |
| Pitfalls |
La EHGNA es una entidad que se caracteriza por la presencia de> 5% de grasa en el hígado, con una prevalencia que oscila entre el 20 y el 30% en los países occidentales. La esteatosis hepática puede progresar a esteatohepatitis no alcohólica, la forma más agresiva de la EHGNA, asociada con complicaciones hepáticas como fibrosis, insuficiencia hepática y CHC8. A pesar de que actualmente el método de elección para detectar la esteatosis hepática es la biopsia del hígado, los métodos no invasivos basados en la RM con técnicas de espectroscopia o en el desplazamiento químico de los protones (como proton density fat fraction [PDFF]) han demostrado una alta precisión en la cuantificación de la grasa hepática y una buena correlación con los resultados de la biopsia. Las principales limitaciones de estas técnicas serían su disponibilidad limitada y su alto coste8,9.
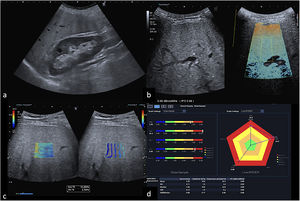
Además, recientes estudios han demostrado el papel de la ecografía en la cuantificación de la esteatosis con técnicas que miden los cambios en las propiedades acústicas del hígado debidos a la presencia de grasa (fig. 2). La técnica CAP (parámetros de atenuación controlada), que está disponible en la misma plataforma que la elastografía de transición o FibroScan®, permite una evaluación simultánea de la esteatosis hepática y de la fibrosis en la misma región del hígado y puede ser útil en la estratificación del riesgo en la EHGNA, aunque con una precisión inferior a la biopsia hepática8,10.
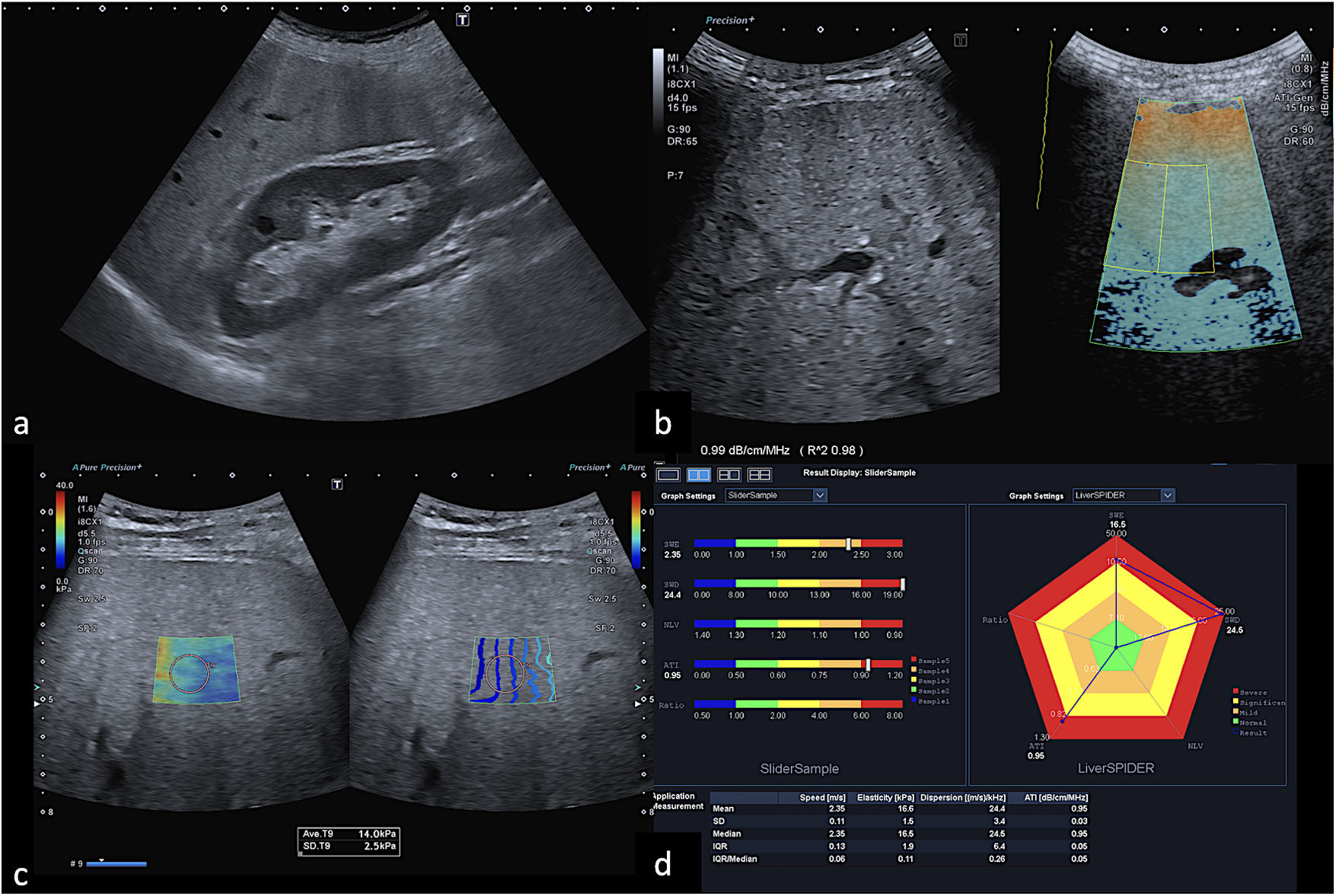
Valoración multiparamétrica del parénquima hepático mediante ecografía. Varón de 54 años con hepatopatía alcohólica. La ecografía en modo B (a) muestra un aumento difuso de la ecogenicidad hepática en relación con esteatosis. Se realiza valoración mediante ATI (attenuation imaging) (b), que confirma un valor de 0,95dB/cm/MHz, hallazgo que se ha correlacionado con grados de esteatosis severa S3 (R2*: 98%). Asimismo, se realiza 2D-SWE (Canon Medical) (c) y se obtienen 10 medidas de velocidad de cizallamiento en el lóbulo hepático derecho, con el paciente en decúbito supino, acceso por ventana intercostal a más de 1cm de profundidad de la cápsula hepática. La media de velocidad de cizallamiento es de 2,35 m/s±0,11. Mediana 2,35 m/s, 16,6kPa, IQR 1,9, IQR/med 11%. El mapa de representación de estos parámetros (d) indica la presencia de fibrosis y esteatosis grave; se identifican sus valores alcanzando el hexágono de color rojo.
Finalmente, la TC espectral o de energía dual, con su capacidad en la valoración de materiales, ha demostrado ser una técnica fiable en la valoración de la esteatosis hepática11.
Depósito de hierroLa sobrecarga férrica puede tener diferentes causas: primaria (hemocromatosis hereditaria), secundaria (hemosiderosis) o ser de mecanismo desconocido, como ocurre en la cirrosis. El exceso de hierro se deposita en los tejidos, fundamentalmente en el hígado, que almacena el 70% del mismo, siendo por ello la medición de la concentración de hierro en el parénquima hepático el método de referencia. Tanto las medidas de ratio de la intensidad de señal en el parénquima hepático como el tiempo de relajación R2* mediante RM han sido validadas como técnicas de referencia para el diagnóstico, cuantificación y monitorización del tratamiento12.
FibrosisEl uso de técnicas de imagen que permiten la valoración de la fibrosis hepática ha supuesto un cambio en el seguimiento de las complicaciones y la respuesta al tratamiento de los pacientes con hepatopatía crónica2. A pesar de que la biopsia hepática sigue siendo el gold standard para el diagnóstico, su uso se ha disminuido en estas últimas décadas, gracias a la aparición de métodos no invasivos como la elastografía. Esta técnica presenta una alta sensibilidad para la predicción de la cirrosis, dado que la rigidez del parénquima hepático aumenta progresivamente con la fibrosis7. Aunque la técnica más validada es la elastografía de transición (FibroscanTM), actualmente el uso de la elastografía cuantitativa con ondas de choque permite no solo tener una imagen en tiempo real evitando los artefactos, sino también tener una gradación de la fibrosis. Los valores de las medidas dependen del software de las diferentes casas comerciales (fig. 2), pero se considerarían valores normales aquellos menores de 7kPa, de riesgo intermedio entre 7 y 15kPa y claramente patológicos mayores de 21kPa13.
Por otra parte, debemos recordar que la progresión de la fibrosis es paralela al aumento de la presión portal y que, con frecuencia, los pacientes con fibrosis severa en la etapa precirrótica tienen un gradiente de presión venosa hepática> 5mmHg. Esta excelente correlación de la fibrosis con el gradiente de presión venosa ha hecho que la elastografía sea una técnica clave en el abordaje terapéutico del paciente, incluyendo el cribado del CHC y la presencia de varices esofágicas7. Además, el desarrollo de CHC se vincula a la presencia de fibrosis, siendo menor del 1% anual en pacientes con hepatitis crónica sin fibrosis e incrementándose al 3-7% anual cuando el paciente desarrolla cirrosis14.
La elastografía por RM ha demostrado ser una técnica consistente para la valoración integral y cuantitativa del hígado, dado que la RM además de medir la dureza hepática permite cuantificar el depósito graso y férrico15. Un protocolo completo de RM cuantitativa multiparamétrica debiera incluir secuencias de elastografía para la evaluación de la fibrosis hepática y las secuencias de eco de gradiente con múltiples tiempos de eco codificadas por desplazamiento químico para la cuantificación simultánea de la esteatosis hepática (PDFF) y la cuantificación de hierro en el hígado (R2) en una sola apnea12.
La difusión ha sido poco usada en la valoración de la fibrosis hepática. Algunos estudios muestran una disminución de los valores del coeficiente de difusión aparente (ADC) con el aumento de la fibrosis, incluso con buenos resultados para establecer el grado de fibrosis. Sin embargo, la difusión hepática puede verse influida por múltiples factores como la edad, el sexo o la presencia de depósitos de hierro o grasa que pueden alterar significativamente sus valores16.
BiomarcadoresEl uso de biomarcadores de imagen no invasivos representa un abordaje atractivo para el manejo de los pacientes con hepatopatía. Así, la elastografía se ha implantado como un biomarcador en imagen, tanto para la identificación de riesgo de HP como para la presencia de varices. Las guías de Baveno VI establecen que pacientes con valores de elastografía de transición <20 y recuento de plaquetas> 150.000 no requerirían de estudio endoscópico para el diagnóstico de varices17.
El ácido gadoxético (Gd-EOBDTPA) es un medio de contraste hepatoespecífico de RM con el que es posible la realización tanto de estudios dinámicos (para valorar el paso del medio de contraste al espacio extracelular) como en fase hepatobiliar (en la que se demuestra la captación de contraste por los hepatocitos con función conservada). El contraste hepatoespecífico permite una valoración semicuantitativa y cuantitativa de la función hepática. Algunos trabajos publicados sugieren que la valoración cuantitativa del parénquima hepático mediante el índice Relative Liver Enhancement (RLE) permitiría diferenciar la presencia de esteatosis de la de esteatohepatitis y seleccionar a aquellos pacientes que precisarían biopsia. Este mismo método ha sido también validado como un predictor independiente de la presencia de fibrosis y en la valoración del riesgo de descompensación hepática en pacientes tras la remisión de la infección por virus C, permitiendo así una estrategia terapéutica individualizada.
Por otra parte, métodos cualitativos de valoración de la función hepática como el FunctionalLiverIndexScore (FLIS) se han erigido como biomarcadores predictivos del desarrollo de eventos desfavorables relacionados con EHC (como la descompensación hepática) y de la supervivencia tras trasplante ortotópico18.
Vigilancia de los pacientesEn general, deben considerarse para cribado todos los pacientes cirróticos en estadio funcional Child-Pugh A y B, independientemente de la etiología de la cirrosis. Los pacientes con datos de mal pronóstico, como mala función hepática o con síntomas de descompensación (encefalopatía hepática recurrente, ascitis refractaria, hemorragia por varices no controlada o peritonitis bacteriana espontánea) deben de ser valorados para trasplante hepático. En estos casos, la prueba radiológica recomendada es la ecografía abdominal, al ser una técnica no invasiva, barata, bien tolerada por los pacientes y que presenta una sensibilidad del 60-80% y una especificidad superior al 90% para la detección precoz de CHC14. El intervalo temporal recomendado entre estudios ecográficos de cribado es de 6meses, no siendo necesario acortarlo en pacientes con mayor riesgo de desarrollar CHC. No existen datos científicos para recomendar el seguimiento de pacientes con EHGNA sin cirrosis y en pacientes con VHC sin fibrosis avanzada que hayan conseguido respuesta viral sostenida4.
Lesión focal hepática en paciente hepatópata y uso del Liver Imaging Reporting and Data SystemEl sistema de informe LI-RADS está compuesto por 4 diferentes algoritmos que intentan estandarizar la terminología, los informes radiológicos y el manejo de los pacientes con riesgo elevado para el desarrollo de CHC con base en los hallazgos de imagen19. El informe radiológico en estos pacientes es complejo debido a la coexistencia de los signos de EHC con la presencia de lesiones benignas y malignas o secuelas de terapias locorregionales previas20. Dado que el CHC puede ser diagnosticado con base en criterios de imagen sin necesidad de biopsia, la definición de los hallazgos radiológicos clave y el uso de un lenguaje preciso y estandarizado resultan fundamentales5,19. Debemos recordar que el LI-RADS ha sido incorporado por la American Association for the Study of the Liver Diseases (AASLD), pero no está aceptado por la European Association for the Study of the Liver (EASL).
Existen diferentes cuestiones a considerar para un uso correcto del LI-RADS:
- –
LI-RADS debe usarse en un contexto clínico adecuado constituido por pacientes con alto riesgo de desarrollo de CHC: pacientes con cirrosis y pacientes con hepatitis B incluso sin cirrosis. LI-RADS no debe aplicarse en pacientes menores de 18 años, en pacientes con fibrosis hepática congénita o en aquellos con cirrosis secundaria a trastornos vasculares.
- –
Los criterios LI-RADS pueden usarse con distintas técnicas de imagen en función del escenario clínico: a) US para cribado; b) TC/RM para diagnóstico y estadificación; c) US con contraste para diagnóstico, y d) evaluación de respuesta a terapias locorregionales. Además, si no se dispone de un contexto clínico adecuado, puede mencionarse la categoría LI-RADS bajo un uso condicional.
- –
Una adecuada técnica de adquisición de las imágenes y una óptima calidad diagnóstica de las mismas resultan fundamentales.
- –
Los hallazgos de imagen claves a valorar en cada lesión serían: tamaño de la lesión, hiperrealce no anular en fase arterial, lavado, cápsula y crecimiento de la lesión con relación a estudios previos.
- –
Las medidas de las lesiones deben realizarse en el plano axial, de borde exterior a borde exterior (incluida la «cápsula», si está presente), en aquella imagen donde se observe con mayor claridad y preferiblemente en fase portal.
- –
Para el uso de estudios previos en la valoración de criterios como el crecimiento de las lesiones es preciso utilizar la misma fase, la misma técnica y el mismo plano.
- –
Finalmente, debe recordarse que aproximadamente el 10-15% de los CHC presentan características atípicas, presentándose como lesiones hipovasculares en las imágenes en la fase arterial tardía, y que en los pacientes con EHC pueden aparecer otros tipos de tumores malignos diferentes del CHC.
Actualmente, el CHC constituye la sexta neoplasia más frecuente en el mundo y la tercera causa de muerte por cáncer14. El CHC es un tumor raro en pacientes sin enfermedad hepática previa. Sin embargo, la presencia de cirrosis, independiente de la causa, incrementa el riesgo de CHC con una incidencia anual entre el 2 y el 4% (superando, por lo tanto, el umbral del 1,5%) y haciendo que el cribado mediante imagen sea un proceso coste-efectivo.
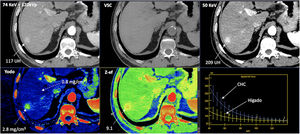
El CHC puede diagnosticarse con el uso TC o RM multifásico debido al cambio del aporte vascular de las lesiones durante la carcinogénesis con el aumento de su red arterial, la disminución de los tractos portales y el desarollo de un drenaje venoso anómalo (fig. 3). Este cambio se traduce en un patrón clásico de hiperrealce en la fase arterial y lavado en fase venosa o tardía, hallazgo que tiene una sensibilidad entre el 66 y el 82%, y una especificidad superior al 90% para el diagnóstico de CHC en pacientes con cirrosis y nódulos de más de 1cm de tamaño21. Según las guías EASL, una lesión> 10mm con hallazgos típicos en una técnica de imagen dinámica (TC o RM) no precisa de biopsia, siendo posible establecer el diagnóstico de CHC con base en la imagen. Sin embargo, si el comportamiento de la lesión es atípico, debe realizarse otra técnica de imagen o biopsia. Recientemente, se ha incorporado el uso de ecografía con contraste como segunda técnica diagnóstica dado que su uso permite diferenciar el colangiocarcinoma intrahepático del CHC, mostrando este último un intenso realce arterial con un lavado después de los 60 s. Además, debemos de considerar que el tamaño de la lesión influye en el manejo de la misma. Si es menor de 1cm, la guía europea recomienda control cada 4 meses. Si la lesión es estable durante 24 meses el paciente volvería al cribado convencional, mientras que de existir crecimiento se valoraría mediante el algoritmo diagnóstico en busca de datos de imagen confirmatorios de CHC.
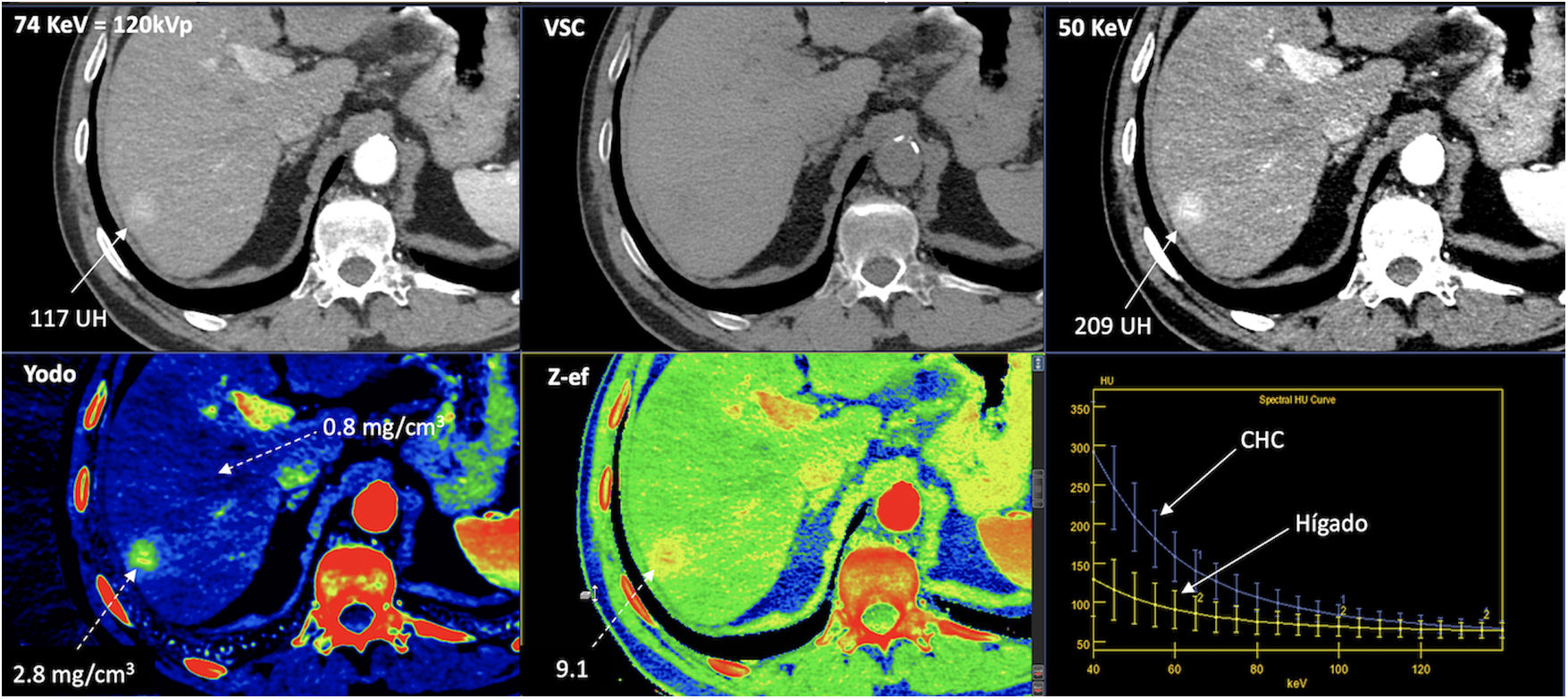
Carcinoma hepatocelular (CHC) en un paciente de 56 años. Estudio de TC espectral en fase arterial tardía. Procesado de la adquisición obteniendo imagen del estudio a 70KeV (equivalente a una imagen policromática convencional de 120 KVp) que muestra una lesión nodular hepática tenuemente hipervascular con relación al parénquima en el segmento posterior del lóbulo hepático derecho. La modificación del nivel de energía de la reconstrucción de la imagen, disminuyéndola hasta 50KeV, permite mostrar el hiperrealce en fase arterial con mucha mayor claridad. Véase también cómo la densidad de la lesión cambia al modificar la energía usada (117 UH a 74KeV y 209 UH a 50KeV) ante el gran aumento de densidad que muestra del yodo en las bajas energías. Este fenómeno se puede apreciar en las curvas espectrales (abajo a la derecha). Véase el importante cambio de densidad de la lesión (CHC) con el aumento de los niveles de energía comparado con la curva del parénquima (que capta menos yodo en esta fase arterial y por ello cambia menos que la lesión con los distintos niveles de energía). La TC espectral permite cuantificar la concentración de yodo, siendo de 2,8mg/cm3 en el CHC y de 0,8mg/cm3 en el parénquima normal en la fase arterial. La técnica permite además la creación de imágenes virtuales sin contraste (VSC) y la valoración del z efectivo de las lesiones (Z-ef) que representan el número atómico.
En el caso de pacientes sin hepatopatía crónica, la aplicación de estos criterios de imagen no es válida y es necesario la realización de una biopsia para obtener el diagnóstico de CHC.
Por otra parte, una estadificación precisa del CHC permite definir las opciones terapéuticas y el pronóstico del paciente. Existen múltiples sistemas de estadificación, aunque los más utilizados son el TNM del American Joint Committee on Cancer (AJCC) y el sistema del Barcelona Clinic Liver Cancer (BCLC). Ambos evalúan datos de imagen como el número y el tamaño de las lesiones, su extensión local, y la presencia de metástasis extrahepáticas. Además, en el caso del BCLC, combina características de imagen del tumor con la gravedad de la enfermedad del hígado y el estado funcional. Por ello, en la decisión del tratamiento del CHC debemos de considerar una serie de elementos claves en imagen (tabla 4). La cirugía es una opción terapéutica si es una lesión única, no existe invasión vascular y la función hepática está conservada. En caso de no cumplir estos criterios, debe valorarse la posibilidad de trasplante. Según los criterios de Milán, los pacientes con un nódulo <5cm o hasta 3 nódulos ≤ 3cm, en ausencia de invasión macrovascular o enfermedad extrahepática, son candidatos a trasplante. Por otra parte, cuando se plantea una resección hepática mayor, el informe radiológico debe cuantificar si el futuro remanente hepático será suficiente18.
Diagnóstico del carcinoma hepatocelular en imagen y elementos a considerar
| Criterios en imagen de European Association for the Study of the Liver (EASL) | Medición | Número de lesiones | Invasión portal | Enfermedad extrahepática |
|---|---|---|---|---|
| Lesiones> 10 mmHiperrealce en fase arterial con lavado en fase portal o tardía si uso de contrastes extracelularesSi uso de contrastes hepatobiliares, solo lavado en fase portalLa ecografía con contraste realce en fase arterial con lavado más allá de los 60 s | Medir de fuera a fuera, incluyendo la cápsulaEvitar mediciones en fase arterial y en difusiónTamaño <5cm contraindica el trasplante | > 3 lesiones> 3cm contraindica el trasplante | Predilección por invadir la vena porta, seguido por las hepáticas y por la VCIInvasión portal: 29-65% casosInvasión venas hepáticas: 15-54%Aumento de tamaño del vasoLa vena porta mide>23 mmNeovascularización del tromboLa masa sigue recibiendo flujo arterial que drena directamente a la porta y se identifica un shunt arterioportalLa invasión portal obliga a tratamiento paliativo | Extensión directaextensión hematógenainvasión linfáticaLocalizaciones:– Pulmón (55%)– Ganglios linfáticos (53%)– Hueso (28%) lítica, expansiva e hipervascularLocalización lumbosacra o torácica:– Glándula adrenal (11%)– Peritoneo/omento (11%)– Cerebro (2%) |
| Patrón atípico, 10-15% hipovasculares | También aparece enfermedad metastásica tras el trasplante hepático |
La realización de un correcto informe radiológico es un reto en la EHC debido a sus múltiples etiologías y la gran variedad de hallazgos radiológicos. Por ello, el uso de informes estructurados mejora la comunicación con los clínicos y cirujanos.
Autoría- 1.
Responsable de la integridad del estudio: SBG, RFG.
- 2.
Concepción del estudio: SBG.
- 3.
Diseño del estudio: SBG, RFG.
- 4.
Obtención de los datos: SBG, RFG.
- 5.
Análisis e interpretación de los datos: SBG, RGF.
- 6.
Tratamiento estadístico: SBG, RGF.
- 7.
Búsqueda bibliográfica: SBG, RGF.
- 8.
Redacción del trabajo: SBG, RGF.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: SBG, RGF.
- 10.
Aprobación de la versión final: SBG, RGF.
Los autores declaran no tener ningún conflicto de intereses.