La espondilodiscitis (ED) es una infección vertebral conocida desde la Antigüedad. Su incidencia está aumentando por el incremento de la expectativa de vida y de las enfermedades debilitantes. La distribución por edad es bimodal, con afectación de los menores de 20 años y de los adultos de 50-70 años. Según su origen, se clasifican en ED piógenas, granulomatosas y parasitarias, siendo las primeras las más frecuentes y ocasionadas habitualmente por Staphylococcus aureus o Escherichia coli. La presentación clínica es insidiosa, por lo que el diagnóstico puede retrasarse, sobre todo en la ED tuberculosa. Los pacientes presentan al inicio dolor espinal de tipo inflamatorio, aunque durante el curso de la enfermedad pueden tener fiebre, astenia y déficits neurológicos como complicaciones más graves. El diagnóstico se establece basándose en datos clínicos, radiológicos, de laboratorio, microbiológicos e histopatológicos. La resonancia magnética es la técnica diagnóstica de elección. El diagnóstico diferencial se realiza, entre otros procesos, con la osteocondrosis erosiva intervertebral, tumores, la espondiloartropatía axial, la espondiloartropatía de los pacientes en hemodiálisis, cambios epifisarios de Modic tipo 1 y la neuroartropatía axial de Charcot. El tratamiento se basa en erradicar la infección con antibióticos, evitar la inestabilidad espinal con fijación vertebral y eliminar el tejido infectado con un desbridamiento amplio, obteniendo muestras para análisis etiológico.
Spondylodiscitis is an infection of the spine that has been known since ancient times. Its incidence is rising, due to the increases in life expectancy and debilitating conditions. Its age distribution is bimodal, affecting persons younger than 20 years of age or persons aged 50-70 years. According to its origin, it is classified as pyogenic, granulomatous or parasitic, though the first form is the most common, usually caused by Staphylococcus aureus or Escherichia coli. The clinical presentation is insidious, resulting in a delayed diagnosis, particularly in tuberculous spondylodiscitis. The initial onset usually involves inflammatory back pain, though the disease may course with fever, asthenia and neurological deficit, these being the most severe complications. Diagnosis is based on clinical, radiological, laboratory, microbiological and histopathological data. Magnetic resonance imaging is the technique of choice for the diagnosis of spondylodiscitis. The differential diagnosis involves, among other conditions, intervertebral erosive osteochondrosis, tumour, axial spondyloarthropathy, haemodialysis spondyloarthropathy, Modic type 1 endplate changes and Charcot's axial neuroarthropathy. Treatment is based on eliminating the infection with antibiotics, preventing spinal instability with vertebral fixation, and ample debridement of infected tissue to obtain samples for analysis.
La espondilodiscitis (ED) u osteomielitis vertebral es una infección de la columna vertebral, infrecuente, que ha afectado a la humanidad desde la Edad del Hierro. Últimamente su incidencia está aumentando por el incremento de la población susceptible y la mayor sospecha diagnóstica.
La columna vertebral, por su amplia vascularización, es asiento frecuente de focos secundarios de sepsis, y es la localización del 2-7% de todas las osteomielitis1–3. Si el disco intervertebral está infectado, se denomina discitis; si es el platillo epifisario, osteomielitis o espondilitis, aunque lo habitual es que, en el momento del diagnóstico, ambos estén infectados, por lo que se emplea el término de espondilodiscitis. Además, pueden desarrollarse abscesos epidurales y prevertebrales. En el 95% de los casos, la espondilodiscitis afecta al cuerpo vertebral, y en el 5% restante a los elementos posteriores4.
Prevalencia y epidemiologíaLa incidencia anual de ED en los países desarrollados es de 0,5-2,5 casos/100.000 habitantes. Su prevalencia está aumentando por la mayor expectativa de vida de la población, el aumento de las enfermedades inmunodepresoras y debilitantes, y el uso de técnicas invasivas que generan bacteriemia. La mortalidad estimada es del 2-4% en los países desarrollados.
La distribución por edad es bimodal. El primer pico se produce en los menores de 20 años, sobre todo en infectados por el virus de la inmunodeficiencia humana (VIH) e inmigrantes, sin diferencias según sexo. El segundo pico, a los 50-70 años de edad, con más casos, representa el 3-5% de todas las osteomielitis5. Es más frecuente en los varones (2:1-5:1V/ M) debido al aumento de las enfermedades crónicas.
Los factores predisponentes que se asocian al desarrollo de ED son la existencia de un foco infeccioso o bacteriemia previa, diabetes mellitus, insuficiencia renal crónica, hemodiálisis, trasplante renal, inmunodepresión, antecedentes de cirugía vertebral o de neoplasias, consumo de drogas por vía parenteral, portadores de catéteres epidurales o vasculares, infección por VIH/sida, edad avanzada, tratamiento crónico con esteroides, alcoholismo, cirrosis hepática, fibrosis pulmonar, enfermedades reumatológicas, obesidad con un índice de masa corporal > 30, infección tuberculosa en otro órgano o reactivación de un foco latente, etc.5–10.
Vías de diseminaciónLa ED es el resultado de una infección que alcanza el hueso por vía hematógena, inoculación directa o desde un foco contiguo6. La diseminación hematógena es la más frecuente, tanto en la infancia como en la edad adulta: en los adultos supone el 60-75% de los casos y en los niños el 65-80%. Puede ser arterial o venosa, siendo la arterial la más común. En los adultos, los cuerpos vertebrales tienen un aporte arterial anterior y posterior. El anterior procede de arterias intercostales y lumbares, que se dividen en ramas terminales no anastomóticas. La vascularización posterior procede de las arterias espinales que forman una red anastomótica con las vértebras contiguas, lo que explica la infección de segmentos adyacentes y del disco intervertebral. El foco inicial de la infección suele localizarse en la zona más vascularizada del cuerpo vertebral (anterior y subcondral), ocasionando un infarto óseo; desde ahí se extiende al disco y a la médula ósea de la vértebra adyacente.
La diseminación hematógena también puede producirse a través del sistema venoso, mediante el plexo de Batson, cuyos flujo y dirección dependen de la presión abdominal y pélvica, y aunque no es frecuente por su elevada resistencia al flujo, puede ser una vía retrógrada de contaminación vertebral desde infecciones abdominales. En la columna cervical, el plexo venoso faríngeo prevertebral puede ser la vía de diseminación de infecciones localizadas en la cabeza o el cuello.
En los neonatos y los niños, el disco está vascularizado, de modo que un émbolo séptico tras una bacteriemia puede alcanzar el disco y producir una discitis, típica de la infancia y excepcional en la edad adulta. En la adolescencia, estos vasos discales empiezan a obliterarse.
La inoculación directa (15-40% de los casos) suele ser iatrogénica tras punción lumbar, infiltración con anestesia, discectomía percutánea, etc. En estos casos, el disco es el lugar inicial de la infección.
La infección por un foco contiguo se produce en el 3% de los casos, desde infecciones cervicales o pélvicas, como un absceso retrofaríngeo, una rotura esofágica, etc.1.
EtiologíaLas ED pueden estar ocasionadas por diferentes microorganismos: bacterias, que producen espondilitis piógenas11; micobacterias, Brucella spp. y hongos, causantes de las espondilitis granulomatosas; y parásitos, que producen las espondilitis parasitarias, muy raras. En la mayoría de los casos son monomicrobianas, y en un tercio de los casos no se llega a identificar ningún agente etiológico.
Actualmente, la mayoría de las ED son piógenas (62-78%), ocasionadas sobre todo por Staphylococcus aureus (30-80% de los casos) y bacterias gramnegativas como Escherichia coli (>25%). Otros microorganismos causales son Streptococcus spp., Enterococcus spp., Pseudomonas aeruginosa, Brucella spp., Candida albicans, Salmonella spp. y otros estafilococos.
La mayor parte de las ED granulomatosas están ocasionadas por Mycobacterium tuberculosis y Brucella spp. La incidencia de ED tuberculosa es del 21-24% de los casos, y es muy frecuente en pacientes infectados por el VIH, en quienes más del 60% de las ED están causadas por M. tuberculosis12. La brucelosis es una zoonosis transmitida a los humanos por contacto con animales infectados, consumo de leche y productos lácteos no pasteurizados, o inhalación de restos de animales contaminados. Tras la sacroileítis, la ED es la infección osteoarticular más frecuente ocasionada por Brucella spp. (20-35% de los casos), y la columna lumbar es la localización más habitual13. En el área mediterránea y Europa del Este, la tuberculosis y la brucelosis son endémicas y la incidencia de infecciones por estos patógenos está aumentada. En nuestro medio, la incidencia de ED por brucelosis ha disminuido considerablemente, mientras que la ED tuberculosa se mantiene estable, sobre todo en población inmigrante7,14.
El segmento vertebral infectado varía según la etiología. En la ED piógena, la columna lumbar es la más afectada (45-58% de casos), seguida de la dorsal (30-35%), la cervical (3-20%) y el sacro. En la ED tuberculosa, la columna dorsal y la charnela dorso-lumbar son las más afectadas (60%), seguidas de la lumbar (30%), la cervical (5%) y el sacro, y puede haber afectación de múltiples segmentos (2-10%). En la ED brucelósica, la afectación lumbar es la más habitual (75%), seguida de la dorsal (17%) y la cervical (8%)13.
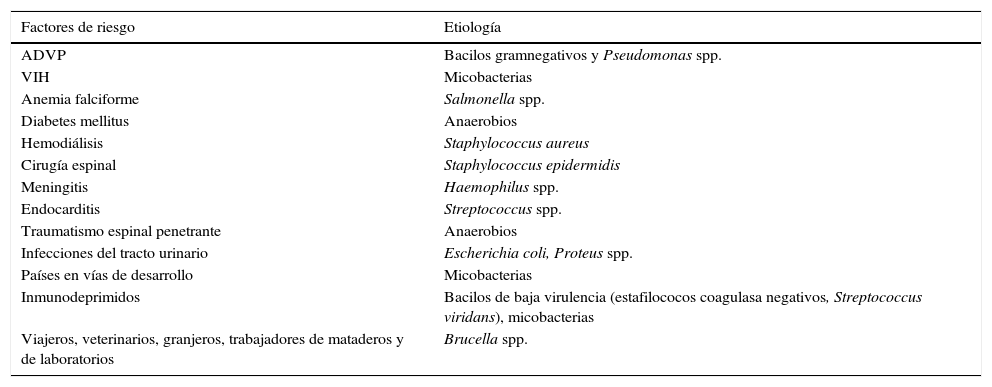
Existen situaciones clínicas y epidemiológicas que favorecen la infección espinal por determinados patógenos, siendo las asociaciones más frecuentes las mostradas en la tabla 1.
Factores de riesgo asociados al desarrollo de espondilodiscitis por determinados patógenos
| Factores de riesgo | Etiología |
|---|---|
| ADVP | Bacilos gramnegativos y Pseudomonas spp. |
| VIH | Micobacterias |
| Anemia falciforme | Salmonella spp. |
| Diabetes mellitus | Anaerobios |
| Hemodiálisis | Staphylococcus aureus |
| Cirugía espinal | Staphylococcus epidermidis |
| Meningitis | Haemophilus spp. |
| Endocarditis | Streptococcus spp. |
| Traumatismo espinal penetrante | Anaerobios |
| Infecciones del tracto urinario | Escherichia coli, Proteus spp. |
| Países en vías de desarrollo | Micobacterias |
| Inmunodeprimidos | Bacilos de baja virulencia (estafilococos coagulasa negativos, Streptococcus viridans), micobacterias |
| Viajeros, veterinarios, granjeros, trabajadores de mataderos y de laboratorios | Brucella spp. |
ADVP: adictos a drogas por vía parenteral; VIH: virus de la inmunodeficiencia humana.
Las manifestaciones clínicas de la ED son muy inespecíficas, con un inicio insidioso y una evolución indolente, de modo que el diagnóstico puede retrasarse, sobre todo en la ED tuberculosa, lo que empeora el pronóstico. Este retraso diagnóstico favorece la progresión de la infección, con destrucción de la vértebra y del disco, ocasionando colapso vertebral, cifosis, inestabilidad espinal y compresión neural. También puede organizarse un absceso epidural (que comprime el cordón medular) y en el psoas (ocasionando dolor y contractura de la pierna y la cadera). En estadios avanzados, puede haber complicaciones neurológicas por compresión medular (por restos óseos, tejido de granulación o absceso epidural) o por isquemia espinal (por trombosis séptica de venas epidurales o infiltración inflamatoria)1,4,15, menos frecuentes, pero más graves (fig. 1).
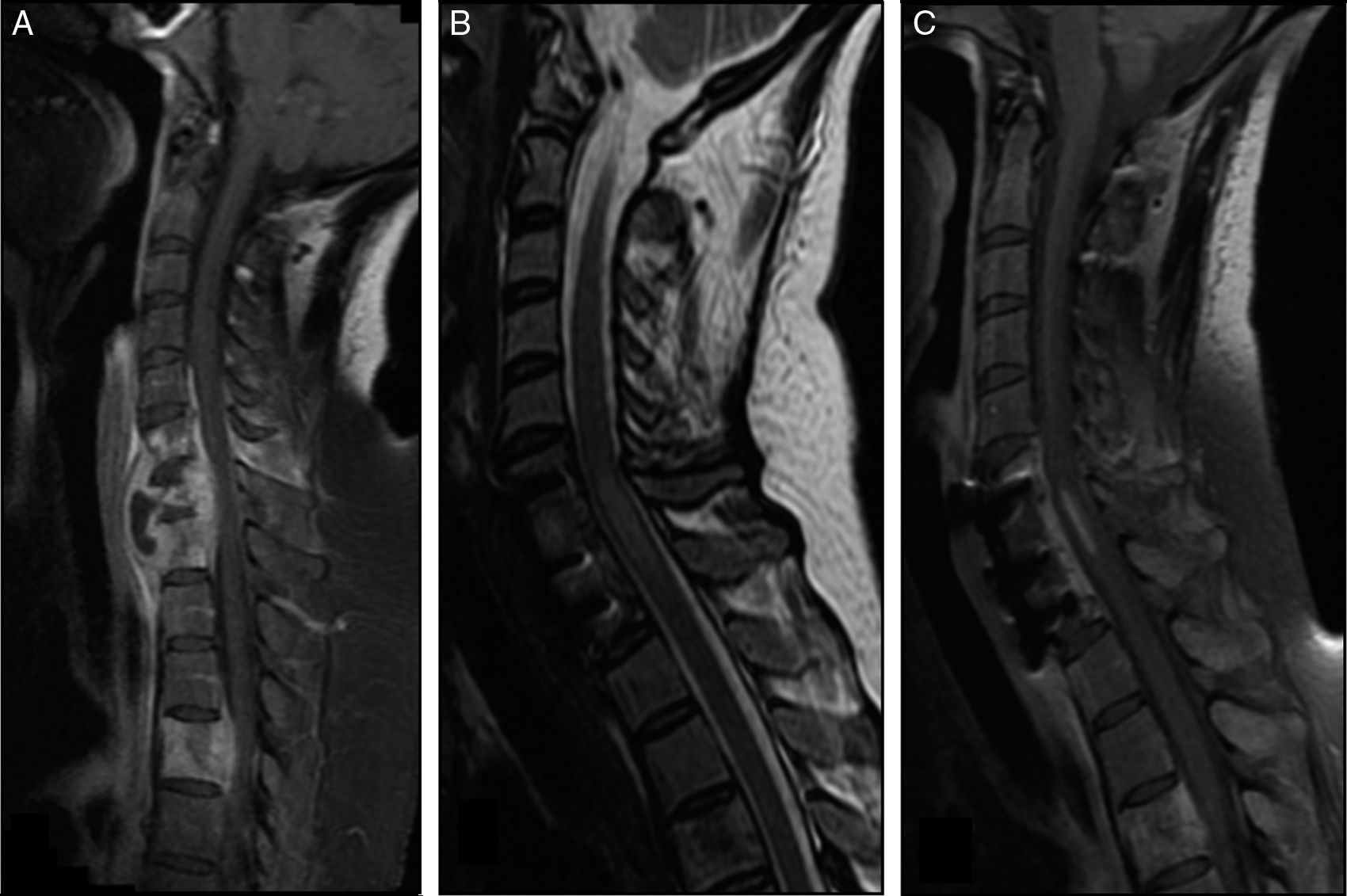
Paciente con espondilodiscitis tuberculosa cervical y mielopatía compresiva residual. A) Sagital FSE T1 con supresión de la grasa tras la administración de gadolinio (Gd). Se observa destrucción de C7, infección de C6, D1 y D4, y abscesos prevertebral y epidural con compresión medular. B) Sagital FSE T2. Se observa una mielopatía cervical tras descompresión cervical urgente y fijación anterior. C) Sagital FSE T1 con supresión de la grasa tras administrar Gd. Se observa la captación medular del contraste.
El síntoma más común es el dolor espinal (85-90% de los casos), con el cual a menudo debuta el cuadro clínico. Suele ser insidioso, crónico, de carácter inflamatorio, que aumenta con el movimiento y no se alivia con el reposo. La fiebre (>38°C) está presente en menos del 20% de los pacientes y es más frecuente en la ED piógena (48% de los casos) que en la tuberculosa (17%). Sólo un tercio de los pacientes con ED tuberculosa tienen fiebre a lo largo de su enfermedad. Las características inespecíficas de ambos síntomas contribuyen al retraso del diagnóstico y a que aparezcan complicaciones más graves.
También puede haber náuseas, vómitos, pérdida de peso, confusión, tortícolis o disfagia (por un absceso retrofaríngeo secundario a una ED cervical), debilidad de las extremidades y disfunción de los esfínteres (por compresión espinal o de la cola de caballo). Los déficits neurológicos y la deformidad espinal son más frecuentes en la ED tuberculosa (10-45% de los pacientes).
En los niños, la presentación es muy inespecífica e incluye irritabilidad, dolor abdominal, incontinencia o incapacidad para gatear, sentarse o andar. La aparición de fiebre es muy rara, y los síntomas neurológicos son excepcionales4,16–19.
DiagnósticoEl diagnóstico se basa en criterios clínicos, de laboratorio, microbiológicos, histopatológicos y radiológicos.
Los parámetros de laboratorio más útiles para el diagnóstico y el seguimiento de la respuesta al tratamiento son la velocidad de sedimentación globular (VSG) y la proteína C reactiva (PCR). La VSG (medida en mm/h) está elevada en más del 90% de los pacientes; sin embargo, aunque es un índice sensible, es inespecífico de infección. La PCR (medida en mg/l) está elevada en más del 90% de las ED y es más específica que la VSG; se considera el mejor marcador de respuesta al tratamiento y su descenso es más rápido que el de la VSG20. El recuento leucocitario tiene una baja sensibilidad porque no siempre está elevado en los pacientes con ED.
En las infecciones por Brucella spp. se considera un diagnóstico probable cuando hay anticuerpos antibrucela o seroconversión entre dos muestras obtenidas en 2 o 3 semanas. Se usan técnicas de seroaglutinación, como el Rosa de Bengala (enfrenta el suero a antígenos brucelares), la seroaglutinación de Wright (un título de 1/80 se considera positivo en medio urbano y no endémico), el test de Coombs antibrucela y la inmunofluorescencia indirecta7.
Antes del inicio del tratamiento antibiótico deben obtenerse muestras para urocultivo y hemocultivo, puesto que el 60% de los hemocultivos identifican al patógeno. Sin embargo, si son negativos, hay que realizar biopsia para obtener material para su estudio microbiológico.
La biopsia percutánea guiada con tomografía computarizada (TC) o con fluoroscopia es superior a los hemocultivos en la detección del microorganismo21–23. Es la técnica de elección en el diagnóstico de las lesiones espinales de origen dudoso, con resultados positivos en más del 90% de los casos, pero depende de la experiencia del radiólogo, de la calidad de la muestra, de la ausencia de tratamiento antibiótico previo, etc.
Antes de realizarla, hay que comprobar el estado de coagulación del paciente y obtener el consentimiento informado. La vía de acceso vertebral más usada es la transpedicular, aunque también se emplean, según la facilidad de abordaje de la lesión, la transcostovertebral y la vía directa. Las complicaciones son poco frecuentes, siendo las más habituales la hemorragia local y el neumotórax.
La biopsia abierta se hace cuando la percutánea ofrece un resultado negativo. Si el tratamiento de la ED va a ser quirúrgico (por déficit neurológico, inestabilidad espinal, sepsis, etc.), se realiza como técnica inicial.
A las muestras obtenidas se les realiza tinción de Gram, cultivo para aerobios, anaerobios, hongos, micobacterias y Brucella spp., reacción en cadena de la polimerasa y análisis histopatológico. En la ED tuberculosa, el bajo rendimiento de la microscopía y el lento procesamiento que requieren los cultivos obligan a buscar alternativas diagnósticas más rápidas. En este sentido, los métodos moleculares han mostrado recientemente un alto rendimiento diagnóstico24.
Técnicas de imagenEl papel de las técnicas de imagen en el estudio de las ED es localizar el área infectada y su extensión vertebral y paravertebral, identificar la zona más adecuada para tomar una biopsia y valorar las complicaciones neurológicas o infecciosas.
Radiografía simpleEs la prueba inicial en caso de sospecha de ED. Tiene unas bajas sensibilidad y especificidad (57%) en el diagnóstico precoz y sólo se observan anomalías a partir del 30% de destrucción ósea. La forma tuberculosa suele diagnosticarse en fases más avanzadas y hay anomalías radiológicas en el 90% de los casos.
Los signos más precoces son el borramiento de los platillos epifisarios y la disminución de la altura discal, visibles a las 2-8 semanas del inicio de la infección. A partir de las 12 semanas se observa erosión del borde anterior vertebral y de las epífisis, y disminución de la altura discal. Posteriormente, según la inmunocompetencia del paciente y la virulencia del patógeno, pueden producirse geodas subcondrales, angulación, colapso y cifosis. Si hay extensión a los tejidos blandos, la radiografía cervical puede mostrar desplazamiento de la vía aérea o digestiva; la dorsal, desplazamiento fusiforme de las líneas paravertebrales; y la dorsolumbar, borramiento o convexidad de los psoas.
Al curar se observa neoformación ósea con esclerosis, osteofitos, disminución del espacio intervertebral y reparación de las lesiones líticas, que aparecen más rápidamente en las ED no tuberculosas4,25.
La brucelosis puede ocasionar erosiones en la superficie anterosuperior de los platillos vertebrales (lo que se denomina epifisitis brucelar), grandes osteofitos anteriores en forma de «pico de loro», e infección completa de los platillos y cuerpos vertebrales sin deformación vertebral ni gas intradiscal. Estos hallazgos la diferencian de otras formas de ED13,26.
Técnicas con radionúclidosSon más sensibles que la radiografía para detectar precozmente la enfermedad. La gammagrafía trifásica con Tc-99m es sensible (90%), pero no específica (78%), para las infecciones espinales. La gammagrafía con Ga-67 y la SPECT (single photon emission computed tomography) con Ga-67 tienen una sensibilidad y una especificidad similares. La gammagrafía con leucocitos marcados con In-111 tiene muy baja sensibilidad (17%). La PET (positron emission tomography) con 18-fluorodesoxiglucosa es inespecífica, ya que da resultados falsos positivos en patología degenerativa, fracturas osteoporóticas, cirugía espinal previa, etc. Estas técnicas están indicadas cuando se sospecha que la ED forma parte de una afectación osteoarticular más amplia que plantea un diagnóstico diferencial con enfermedad metastásica.
Tomografía computarizadaTiene más sensibilidad que la radiografía para diagnosticar alteraciones óseas, visibles en las primeras 2 semanas en el 50% de los casos. Permite hacer reformateo multiplanar y sirve de guía para la toma de biopsia percutánea. Valora nítidamente los arcos posteriores, el canal vertebral y los tejidos perivertebrales, y son más evidentes la osteólisis, las erosiones, las geodas, los secuestros, las calcificaciones residuales y el gas dentro de los abscesos. El uso de contraste yodado muestra el realce de los flemones y abscesos. Por el contrario, no valora con nitidez la extensión de los abscesos en el espacio epidural ni en las foraminas.
Resonancia magnéticaEs la técnica de elección en el estudio de las ED por sus altas sensibilidad (96%) y especificidad (94%). Su capacidad multiplanar y de caracterización tisular proporciona un gran detalle anatómico espinal. Deben realizar secuencias en los planos axial y sagital potenciadas en T1, T2 con supresión de la grasa o STIR para ver el edema interóseo y la extensión a las partes blandas adyacentes, y secuencias T1 con administración de gadolinio (Gd).
La infección suele iniciarse en la superficie anterolateral subcondral del cuerpo vertebral. El hallazgo radiológico más precoz, pero inespecífico, es la formación de un edema medular en dos vértebras contiguas y del disco adyacente que está disminuido de altura, pero puede haber sólo una vértebra infectada o más de dos. El edema óseo es hipointenso en T1 e hiperintenso en T2, T2 con supresión de la grasa y STIR. Sin embargo, el hallazgo más específico es la destrucción de los platillos epifisarios, visible en T1 como una disrupción focal de la cortical epifisaria, más evidente tras la administración de Gd. También puede haber infección de los tejidos blandos perivertebrales y epidurales (fig. 2).
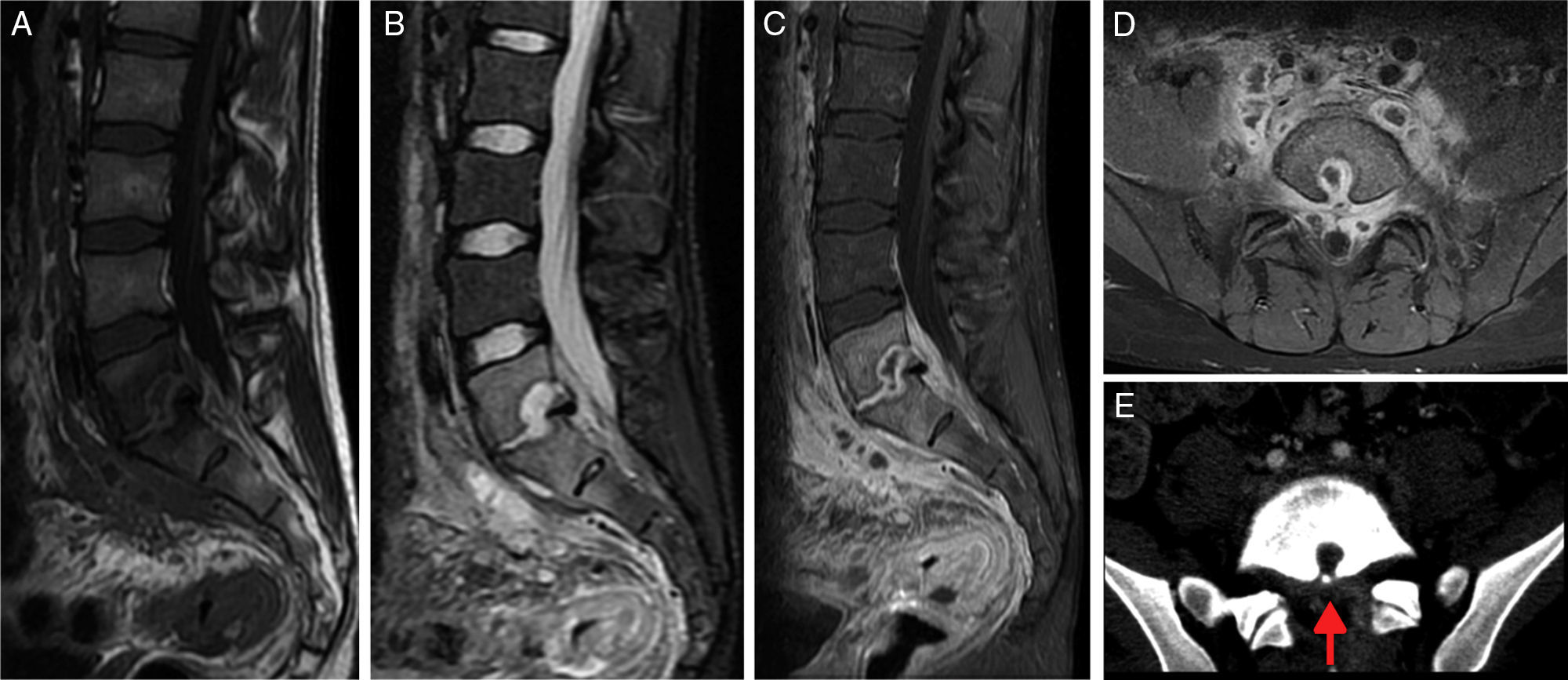
Varón de 21 años de edad con lumbalgia y fiebre. Análisis con velocidad de sedimentación globular y proteína C reactiva elevadas al ingreso y hemocultivos negativos. En la resonancia magnética se aprecia, en sagital FSE T1 (A) y STIR (B), un edema medular en L5 y S1, erosiones de los platillos vertebrales con absceso intraóseo en L5, disminución de la altura discal y secuestro óseo. En sagital y axial FSE T1 con saturación grasa tras administrar gadolinio (C y D) se observa mejor el absceso intraóseo de L5, el realce epifisario y discal, y las colecciones del espacio paravertebral y epidural. En la tomografía computarizada axial (E) se ve el secuestro óseo (flecha roja). En la muestra conseguida por biopsia percutánea creció Staphylococcus aureus.
La altura discal también se ve disminuida precozmente excepto en la ED tuberculosa, en la que se preserva hasta estadios avanzados. La señal discal en T1 es hipointensa con respecto a las vértebras e hiperintensa en T2, T2 con supresión de grasa y STIR, pero en estadios precoces de la infección, el disco puede ser hipointenso en T2 hasta en un 13% de los casos27,28.
Al progresar, la infección de la médula ósea vertebral muestra un patrón típico con una señal disminuida en T1, alta en T2 y STIR, y captación de Gd. Sin embargo, puede haber un patrón atípico sin erosión epifisaria o hipointensidad en T2 por esclerosis ósea. El arco posterior también puede infectarse, lo que ocurre con más frecuencia en las formas tuberculosas.
La infiltración epidural, paravertebral o subligamentosa es más frecuente en la ED tuberculosa (fig. 3). Tiene que valorarse con secuencias T1 con supresión de grasa tras la administración de Gd, que permite diferenciar un flemón de un absceso. El flemón muestra una captación densa y homogénea, mientras que en el absceso es anular y periférica.
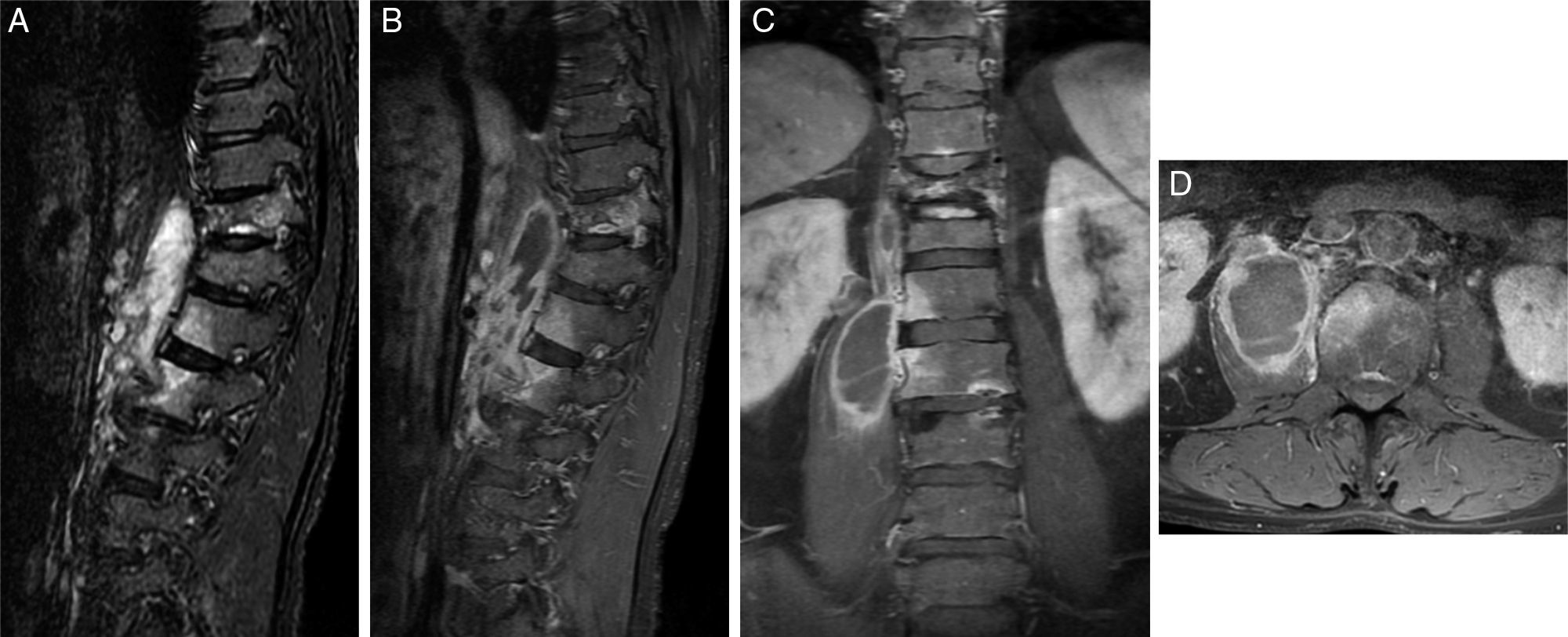
Paciente con espondilodiscitis tuberculosa. A) Sagital STIR. Se observa edema óseo en la mitad derecha de L1, L2 y L3, disminución de la altura de los cuerpos de D11 y D12, platillos epifisarios bien definidos y altura discal respetada. B) Sagital FSE T1 con saturación grasa tras administrar gadolinio (Gd). Muestra captación focal de los cuerpos de D11, L1, L2 y L3, y un absceso paravertebral derecho. C) Coronal FSE T1 con Gd y supresión grasa. Se ve el absceso del psoas derecho, y los platillos vertebrales lumbares y los discos conservados. D) Axial FSE T1 con saturación grasa y administración de Gd. Muestra el absceso del psoas y una captación de la mitad derecha del cuerpo vertebral.
En las ED curadas se siguen observando alteraciones en la RM sin signos clínicos ni analíticos de infección. El signo más precoz que indica curación es la disminución del tejido inflamatorio y de la captación de Gd. La hiperintensidad en T2 y STIR, y la captación de Gd de la médula ósea, el tejido epidural y paravertebral, también van disminuyendo y vuelven a la normalidad al año del inicio del tratamiento. Al final, la médula ósea es reemplazada por grasa (hiperintensa en T1 e isointensa en T2), fibrosis o esclerosis (hipointensidad en T1 y T2)1.
Diagnóstico diferencialHay numerosas situaciones patológicas que pueden confundirse con una infección espinal. A continuación se comentan las más frecuentes.
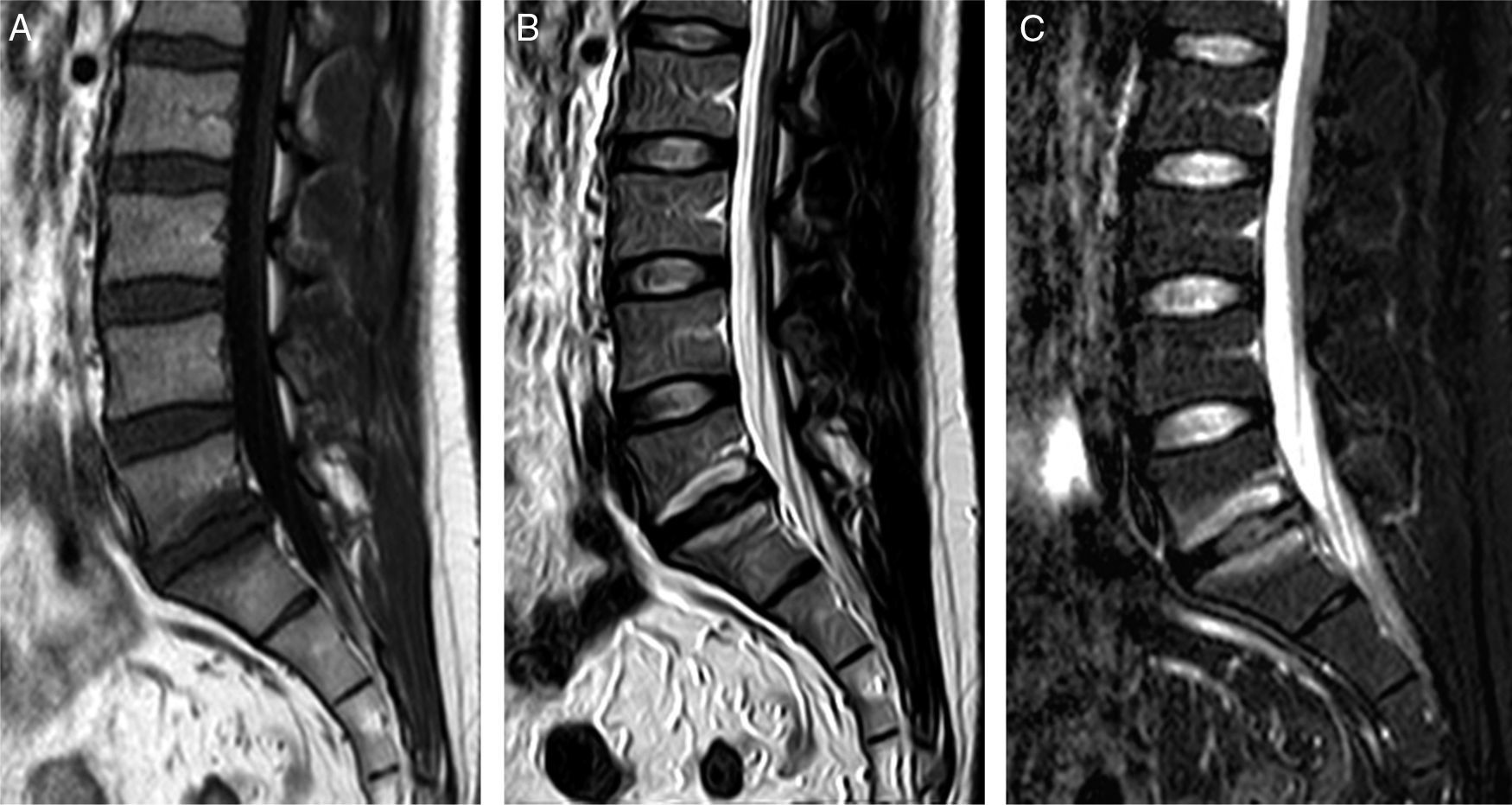
Osteocondrosis erosiva intervertebralEs una degeneración inflamatoria discal aguda que puede cursar con dolor lumbar. Es más frecuente en L4-L5 y L5-S1. Hay una degeneración y pérdida de altura rápida del disco, con disminución de la tensión de las fibras anulares y aumento de la movilidad segmentaria, que ocasionan inestabilidad disco-vertebral, estrés óseo y edema medular. Se produce un intento de reparación de la rotura discal con crecimiento de tejido de granulación.
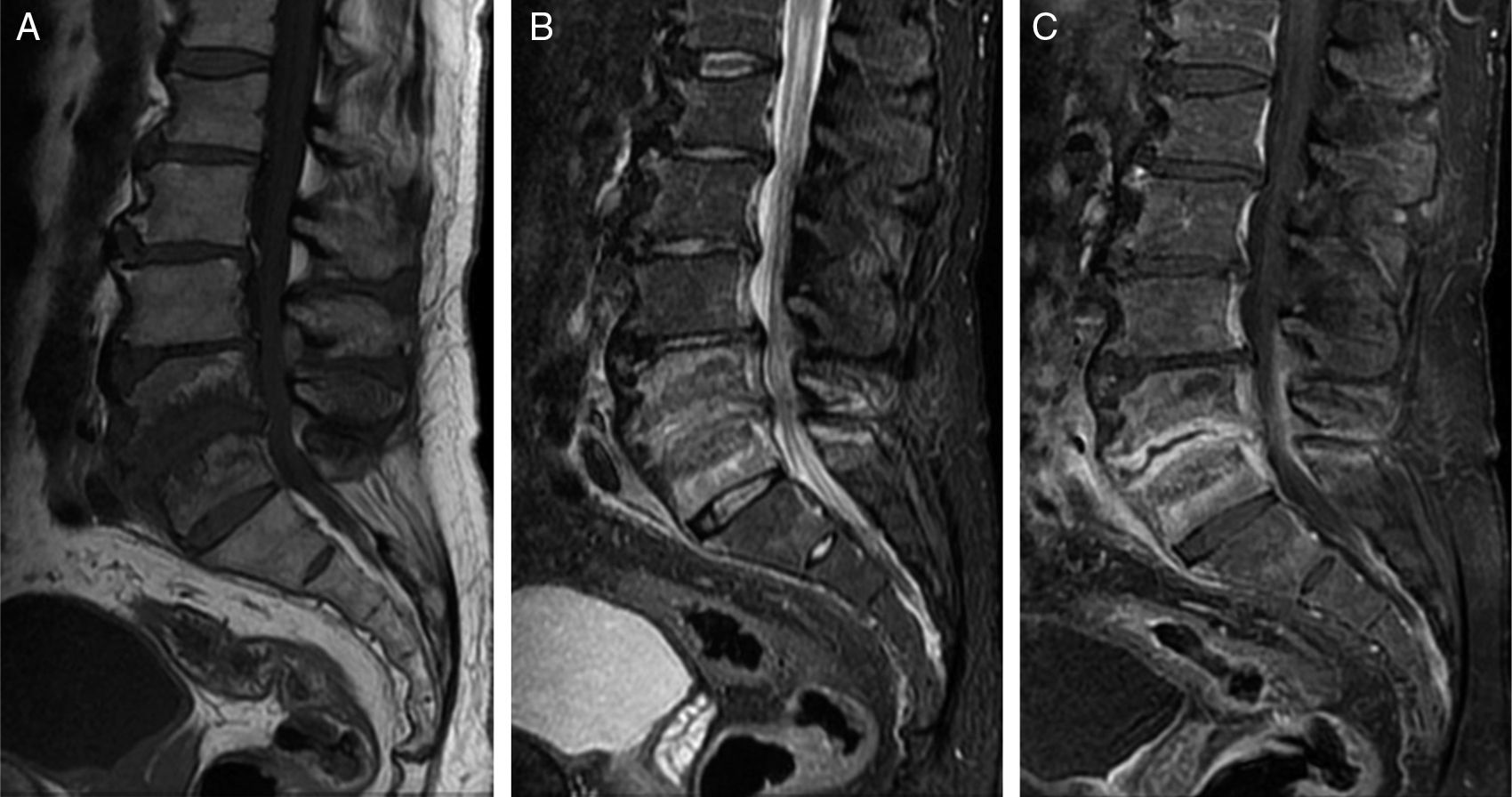
En la RM (fig. 4) se observa pérdida de altura discal con edema medular lineal epifisario que no suele extenderse más allá de la mitad de la vértebra (en la ED infecciosa, el edema puede afectar a toda la vértebra), sin destrucción cortical. El edema medular y de los platillos vertebrales muestra hipointensidad en T1 y es variable en T2, hipointenso o hiperintenso. Un foco intradiscal hiperintenso en T2 corresponde a tejido granulomatoso reparativo vascularizado. Con el uso de Gd se aprecian mejor el contorno epifisario y la captación focal en el anillo fibroso y en el tejido de granulación.
Osteocondrosis erosiva intervertebral. Varón de 60 años de edad con lumbalgia de 3 meses de evolución tras levantar peso. A) Sagital FSE T1. Se observa una disminución de la altura discal de L4-L5, borramiento de los platillos epifisarios y alteración de la señal de la médula ósea. B) FSE T2 con supresión de grasa. La señal ósea de L4 y L5 es heterogénea, con edema y grasa epifisaria. C) FSE T1 con saturación de la grasa tras administrar gadolinio. Se observa un realce del contraste en la periferia del disco. La analítica y los hemocultivos fueron negativos. Se realizó biopsia percutánea, cuyo resultado fue inflamación crónica y ausencia de patógenos.
Pueden ocasionar destrucción cortical e infiltración medular y en los tejidos paravertebrales, pero el espacio discal rara vez está afectado. La destrucción de los elementos posteriores es más frecuente en los tumores que en las ED.
Espondiloartropatía axial seronegativaEngloba enfermedades inflamatorias sistémicas, como la espondilitis anquilosante, y manifestaciones musculoesqueléticas de la enfermedad inflamatoria intestinal, la psoriasis y la artritis reactiva. La TC evalúa los cambios morfológicos, mientras que la RM diagnostica muy precozmente los cambios inflamatorios en las entesis que se inician en la inserción vertebral del anillo fibroso discal. En la RM se observa un edema subcondral en el borde anterior y posterior vertebral, así como en los platillos epifisarios. Al avanzar, pueden aparecer erosiones angulares, deformación y cuadratura de las esquinas anteriores de los cuerpos vertebrales, esclerosis y osificación de ligamentos paravertebrales y del disco.
Si la entesitis afecta a la unión discovertebral, se denomina espondilodiscitis aséptica o lesión de Andersson, que puede confundirse con una ED infecciosa. En la RM se aprecian erosiones semicirculares circunscritas rodeadas de edema subcondral en ambos lados del disco. Sin embargo, la presencia de osteofitos anteriores y sindesmofitos la diferencia de la ED infecciosa29.
Espondiloartropatía destructiva en pacientes en hemodiálisisSe desarrolla en pacientes sometidos a hemodiálisis durante más de 5 años, por depósito de amiloide con beta-2-microglobulina en el disco y los ligamentos. Las lesiones son más frecuentes en la columna cervical y lumbar, y se caracterizan por erosiones e irregularidades epifisarias, disminución de la altura discal y ausencia de osteofitos, sin datos clínicos ni analíticos de infección. En la RM, los platillos vertebrales son hipointensos en T1 y T2, al igual que el disco, diferenciándose de la ED30,31.
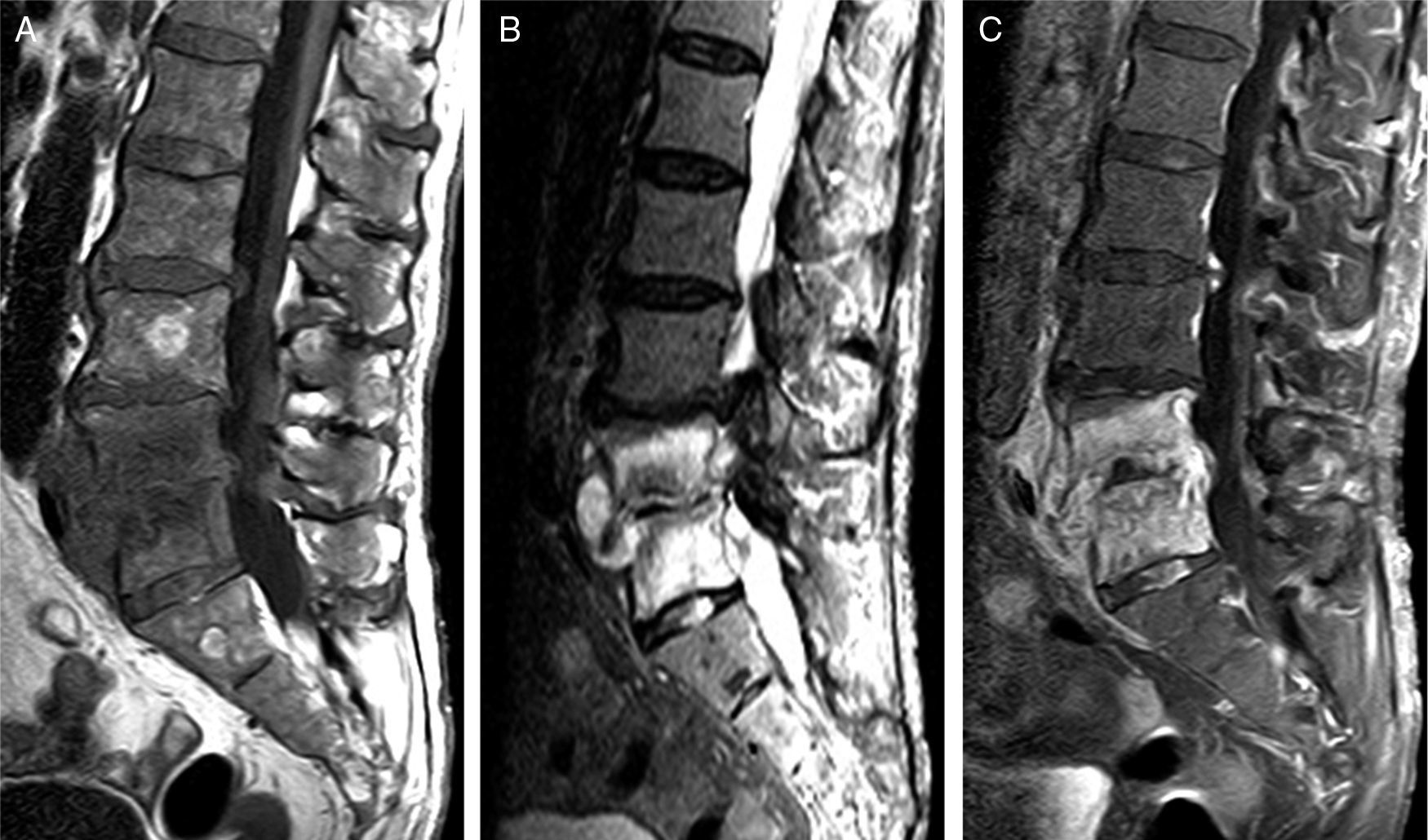
Cambios discogénicos vertebrales (Modic tipo 1)Se producen por disrupción del platillo epifisario, microfracturas trabeculares y aumento del contenido de agua extracelular y de tejido fibroso vascularizado en la médula ósea. En la RM, la señal medular es idéntica a la de la ED infecciosa, pero el disco es hipointenso en T2 (fig. 5).
Cambios discogénicos vertebrales de Modic tipo 1. A) Sagital FSE T1. Se observa una banda lineal hipointensa en los platillos epifisarios inferior de L5 y superior de S1, que tienen un contorno nítido. B) Sagital FSE T2. C) STIR. En B y C puede verse una hiperintensidad lineal epifisaria y el disco con su altura conservada.
Es una artropatía destructiva por pérdida de la sensibilidad propioceptiva debida a lesión espinal o de los nervios periféricos, congénita o adquirida. La columna lumbar es el área más afectada. Las causas más frecuentes son diabetes, siringomielia, tumores medulares, mielomeningocele, traumatismos, alcohol y amiloidosis. La pérdida de sensibilidad propioceptiva ocasiona cambios degenerativos óseos y cartilaginosos, microfracturas trabeculares, subluxación, fragmentación y destrucción articular.
Al inicio hay pinzamiento discal y esclerosis de los platillos vertebrales. Al avanzar, se produce erosión y destrucción de los cuerpos vertebrales con esclerosis u osteólisis, debris, desorganización articular y facetaria, hemartros, calcificación de tejidos paraespinales y osteofitos hipertróficos. Al final se produce cifosis, escoliosis o dislocación. Estos hallazgos son muy característicos de la espondiloartropatía de Charcot y no de la ED (fig. 6).
Neuroartropatía de Charcot. Varón de 78 años de edad con hiperostosis esquelética difusa idiopática avanzada. Sufrió una caída accidental que le produjo una fractura de C6-C7 y quedó tetraparético. A los 5 años presentó dolor hiperálgico lumbar. A) Sagital FSE T1. Se observa edema en L4 y L5, disminución del espacio intervertebral, pérdida de definición de los platillos epifisarios y colección prevertebral. B) Sagital FSE T2 con saturación grasa. Muestra edema medular, esclerosis epifisaria, osteofito hipertrófico en L4 rodeado de la colección y pérdida de altura discal. C) Sagital FSE T1 con saturación grasa y administración de gadolinio. Puede verse la captación de contraste en las vértebras y su ausencia en el disco. Se hizo biopsia percutánea cuyo resultado fue inflamación crónica sin presencia de patógenos.
La TC valora la destrucción vertebral y la neoformación ósea. En la RM se observa una disminución de la altura discal, con isointensidad en T1 y T2, mientras que el cuerpo vertebral es hipointenso en T1 e hiperintenso en T2. El tejido inflamatorio perivertebral capta Gd. El diagnóstico definitivo es histopatológico, al excluir la presencia de infección en biopsia discal o vertebral o en el líquido articular32,33.
TratamientoEl tratamiento de la ED se basa en tres pilares: antibióticos para eliminar la infección, fijación del segmento infectado para evitar la inestabilidad y desbridamiento en caso de déficits neurológicos o presencia de abscesos en el canal medular34.
El tratamiento antibiótico está indicado si no hay déficit neurológico, inestabilidad espinal ni dolor intratable. Se inicia tras tener un diagnóstico microbiológico definitivo, con cultivo. Sin embargo, en caso sepsis o cuadros fulminantes se inicia un tratamiento empírico que cubra S. aureus y E. coli.
No hay guías establecidas sobre el tiempo de duración de la antibioticoterapia ni la vía de administración. En las ED piógenas, el tratamiento intravenoso se administra durante 2-4 semanas y después se continúa por vía oral hasta un total de 6 semanas a 3 meses. Si es una ED tuberculosa, el tratamiento se basa en cuatro fármacos (isoniazida, rifampicina, pirazinamida y etambutol) durante 2 meses, seguidos de 7-10 meses con isoniazida y rifampicina. En caso de ED fúngica, se inicia tratamiento antimicótico.
Además del tratamiento antibiótico, se intenta estabilizar el segmento afecto con inmovilización, sobre todo si hay dolor sin riesgo de inestabilidad. En la columna cervical se utilizan collarines, y en la columna dorsal y lumbar, corsés.
El tratamiento quirúrgico se realiza en caso de déficits neurológicos, inestabilidad, cifosis, lesiones compresivas en el canal, sepsis o fallo del tratamiento médico. La finalidad es descomprimir y estabilizar el canal medular, desbridar los tejidos infectados, los abscesos paravertebrales y epidurales, y tomar muestras para su estudio histológico y microbiológico. En la columna cervical, el abordaje suele ser anterolateral y se estabiliza realizando corpectomía e injerto óseo; en la dorsal, el abordaje anterior a veces es complementado con uno posterior secundario o secuencial; y en la lumbar suele hacerse un abordaje posterior. Para evitar la sobreinfección del material de fijación empleado, tras el desbridamiento se aplican antibióticos locales5,19,24.
PronósticoEn los países desarrollados, la mortalidad por infección vertebral es menor del 5%. Sin embargo, las secuelas neurológicas permanentes, que son infrecuentes, resultan devastadoras. Determinadas situaciones empeoran el pronóstico, como la edad avanzada, la infección cervical o dorsal, la diabetes y las cardiopatías crónicas.
ConclusionesLa ED es una enfermedad infrecuente que está aumentando por la mayor expectativa de vida, por el incremento de la población susceptible y por la sospecha diagnóstica. Su presentación clínica es inespecífica e insidiosa, lo que ocasiona que en el momento del diagnóstico la enfermedad esté avanzada.
El diagnóstico se basa en una alta sospecha clínica junto con datos analíticos y radiológicos, y se confirma con un diagnóstico inequívoco microbiológico o histopatológico, aunque en un tercio de los casos no se aísla el microorganismo causante. La RM es la técnica más adecuada para valorar la localización y la extensión de la infección. La TC sirve de guía para la toma de biopsia percutánea y para el drenaje de las colecciones.
El tratamiento suele ser conservador, con antibióticos específicos e inmovilización. La cirugía queda relegada a los casos en que hay inestabilidad espinal, déficits neurológicos, sepsis, deformidad o fallo del tratamiento médico. El pronóstico es bueno, con una mortalidad baja, aunque con importantes y escasas secuelas neurológicas, que pueden ser permanentes.
Conflicto de interesesLos autores declaran no tener ningún conflicto de intereses.
A los doctores Torcuato García de la Oliva y Juan de Dios Colmenero Castillo por su paciencia, correcciones, enseñanzas continuas y, sobre todo, por su cariño.