La resonancia magnética (RM) es una técnica de probada eficacia en el estudio del corazón. Sus aplicaciones clínicas se dirigen preferentemente al estudio del ventrículo izquierdo, quedando el ventrículo derecho relegado a un segundo plano. Este artículo ofrece una revisión de la anatomía y fisiología del ventrículo derecho, así como de las manifestaciones de la afección más frecuente en esta cámara cardíaca: infarto, miocardiopatías, masas y fallo cardíaco derecho. El conocimiento de los rasgos diferenciales del ventrículo derecho con respecto al izquierdo y de las particularidades del protocolo de estudio mediante RM, consigue un mayor rendimiento de la técnica en aquellos casos en que el motivo de petición o los hallazgos de imagen apuntan al ventrículo derecho. La RM reúne características para apoyar desde la imagen el protagonismo creciente que los clínicos están otorgando al ventrículo derecho en el manejo de las enfermedades cardiopulmonares.
Magnetic resonance (MR) imaging has proven efficacy in the study of the heart. Its clinical applications are directed primarily at the study of the left ventricle, and the right ventricle is relegated to the background. This article reviews the anatomy and physiology of the right ventricle, as well as the manifestations of most common diseases affecting this chamber of the heart: infarction, cardiomyopathy, masses, and right heart failure. Knowing the distinctive features of the right ventricle with respect to the left and the particularities of the MR imaging protocol results in better technical performance in cases in which the reason for the examination or imaging findings point to the right ventricle. The importance of the right ventricle in the management of cardiopulmonary disease is growing and MR imaging can provide clinicians with the support they need.
Tradicionalmente se ha prestado menor atención al ventrículo derecho (VD) que al ventrículo izquierdo (VI), por la escasa relevancia que se concedía a su función. Además, durante mucho tiempo, la radiografía de tórax y la angiografía han sido las únicas técnicas disponibles para valorar el VD, ambas con limitaciones, y la segunda con unos riesgos no despreciables1. La ecocardiografía se convirtió rápidamente en una técnica de primera línea por su disponibilidad, seguridad, coste y eficacia diagnóstica, aunque presenta limitaciones para valorar el VD debido a su situación retroesternal, y al método empleado para calcular sus volúmenes. La tomografía computarizada (TC) es la técnica no invasiva de elección para estudiar la vasculatura pulmonar y coronaria, pero su uso en la evaluación de las cámaras cardíacas sigue siendo limitado, y hay que recordar sus riesgos (radiación ionizante, contrastes iodados). Aunque la resonancia magnética (RM) está consolidada en otras áreas, ha sido necesario esperar el desarrollo de avances técnicos en bobinas, secuencias, y programas de procesado para abordar con garantías el estudio del corazón. La RM permite actualmente explorar la anatomía y la función del VD de forma no invasiva gracias a su resolución espacial y temporal, su capacidad multiplanar y de contraste tisular, y su inocuidad. Presenta limitaciones inherentes a la técnica, como el largo tiempo de estudio, la necesidad de colaboración del paciente, los problemas de sincronización en corazones arrítmicos y sus contraindicaciones generales, sin olvidar su coste y la aún no suficiente disponibilidad, así como la menor experiencia con esta técnica (tabla 1).
Técnicas de imagen para el estudio del VD
| Limitaciones técnicas | Ventaja diagnóstica | Indicaciones en el estudio del VD | |
| Angiografía | • Riesgos (invasivo, radiación) | • Información hemodinámica | • Diagnóstico HTP |
| Ecocardiografía | • Mala ventana acústica• Situación del VD• Cálculo de volúmenes | • Disponibilidad• Experiencia• Ausencia de riesgos• Información hemodinámica• Valvulopatías | • Técnica de primera línea |
| CT | • Riesgos (radiación, contrastes)• Necesidad de beta bloqueantes | • Información vascular (coronaria y pulmonar)• Detección de calcio• Tiempo de exploración corto | • Estudio HTP |
| RM | • Arritmias, no colaboradores• Contraindicaciones a la RM• Tiempo de exploración• Disponibilidad | • Cuantificación de volúmenes• Detección de fibrosis• Capacidad multiplanar• Resolución tisular | • Cálculo de la función del VD• DAVD• VD dilatado de causa desconocida• Infarto del VD• Masas de VD |
DAVD: displasia arritmogénica del VD; HTP: hipertensión pulmonar; VD: ventrículo derecho.
El VD es la cámara cardíaca que tiene una situación más anterior y apenas contribuye a la silueta cardíaca en la radiografía de tórax. Tiene una forma compleja, sin un eje de simetría2, y es más difícil de definir que el VI, al cual se adapta y envuelve parcialmente, presentando en las secciones axiales una forma triangular. El VD recibe en diástole la sangre del retorno venoso sistémico y la bombea a la circulación pulmonar en sístole, constituyendo el VD y la circulación pulmonar una unidad funcional3. Funciona como una bomba de volumen, con una función doble: mantener una baja presión venosa sistémica y una adecuada perfusión pulmonar. Ambos ventrículos difieren en su arquitectura, fisiopatología, metabolismo y flujo coronario (tabla 2), y estas diferencias deben tenerse en cuenta en la realización y evaluación de todo estudio de imagen cardíaca.
Rasgos del VD diferenciales con respect al VI
| Anatomía y morfología |
| Forma irregular sin eje de simetría |
| Banda moderadora y otras trabéculas |
| No continuidad tricúspide-pulmonar |
| Patrón de contracción peristáltico |
| Análisis cuantitativo |
| Masa muscular < VI |
| Volumen: 10-20%>VI |
| Fracción eyección<VI |
| Volumen/latido=VI |
| Fisiopatología |
| Mayor resistencia a la isquemia |
| Menor consumo de O2 |
| Resistencia pulmonar=1/10 sistémica |
| Más distensible |
| Mejor adaptación a la sobrecarga de volumen |
| Mayor variación con la respiración |
VD: ventrículo derecho; VI: ventrículo izquierdo.
El VD puede valorarse con un protocolo estándar: evaluación morfológica (secuencias con sangre negra: doble inversión recuperación o Inversión recuperación [IR], half fourier Acquisition Single Shot Turbo Spin Echo [HASTE], short time inversion recovery [STIR]), movimiento en modo cine (secuencias de precesión libre en estado estacionario, steady state free precession, SSFP) y realce miocárdico (secuencias IR con contraste y supresión de la señal miocárdica).
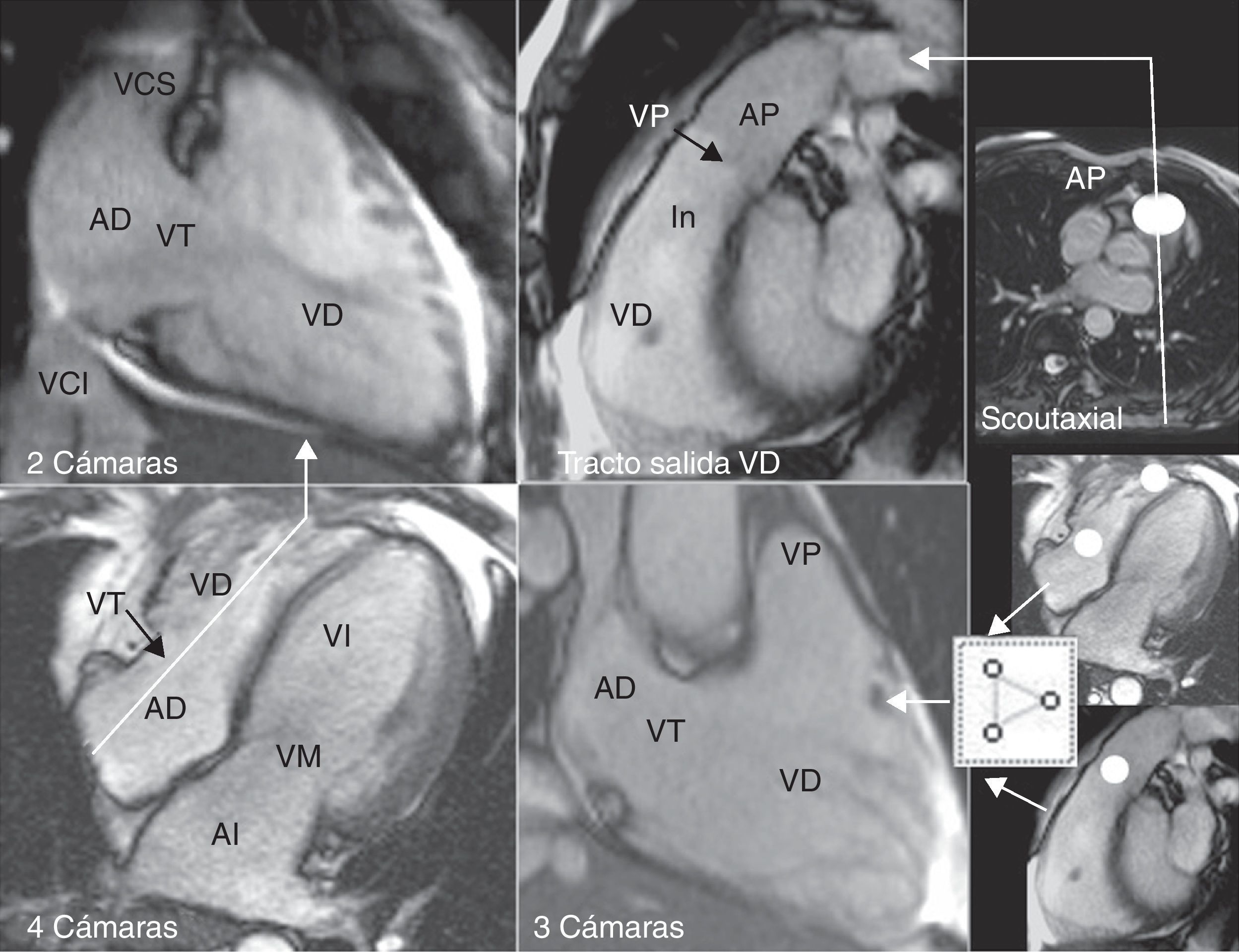
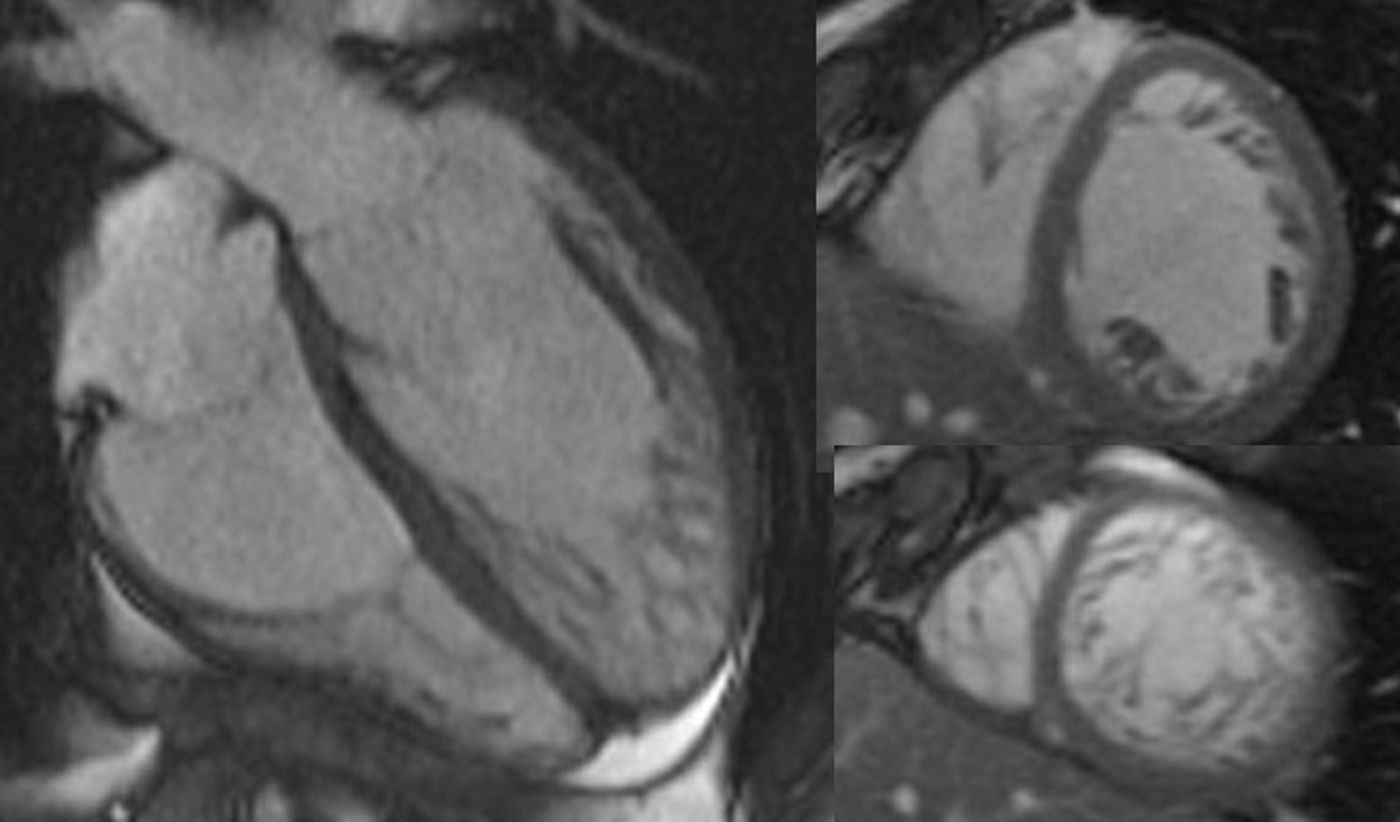
Los planos «básicos» para estudiar el VD en RM son el 4 cámaras (4C) y el eje corto (EC), que se obtienen de manera rutinaria en cualquier protocolo de RM cardíaca. Cuando la sospecha clínica apunta al VD, es conveniente disponer de planos específicos (fig. 1): dos cámaras derechas (2CD), tres cámaras derechas (3CD o entrada-salida del VD,) y tracto de salida del VD (TSVD). Las imágenes axiales (doble IR y cine) con menor campo de visión consiguen mayor resolución espacial de la pared libre del VD, lo cual puede ser útil en la displasia arritmogénica del VD (DAVD).
Planos empleados en RM para estudiar el ventrículo derecho: 4 cámaras, 2 cámaras derechas, 3 cámaras derechas y tracto de salida del ventrículo derecho (AD: aurícula derecha; AI: aurícula izquierda; AP: arteria pulmonar; In: infundíbulo; VD: ventrículo derecho; VCI: vena cava inferior; VCS: vena cava superior; VI: ventrículo izquierdo; VM: válvula mitral; VP: válvula pulmonar; VT: válvula tricúspide).
En función de los hallazgos o la sospecha clínica se pueden añadir otras técnicas con fines específicos. La angio-RM pulmonar requiere una alta resolución temporal para separar las fases arterial y venosa, y es útil para valorar las arterias (hipertensión pulmonar) y las venas pulmonares (retorno venoso anómalo como causa de cortocircuito). El estudio del flujo mediante las secuencias de contraste de fase es útil en la cuantificación de valvulopatías y cortocircuitos. Requiere una cuidadosa técnica, con una estricta perpendicularidad al vaso, una adecuada selección de la velocidad de codificación, y una situación apropiada en el isocentro del imán. Y aún así presenta un margen de error debido a limitaciones inherentes a la técnica4. La perfusión cardíaca requiere una resolución temporal alta, sacrificando la resolución espacial y la cobertura anatómica, y aunque se diseñó para detectar la isquemia miocárdica, es útil en el diagnóstico de los cortocircuitos intracardíacos y las masas cardíacas debido al contraste endocavitario generado. La secuencia FLIRT (Fixed Long Time Inversion Recovery) inmediatamente poscontraste, puede resultar útil en la detección de trombos y masas.
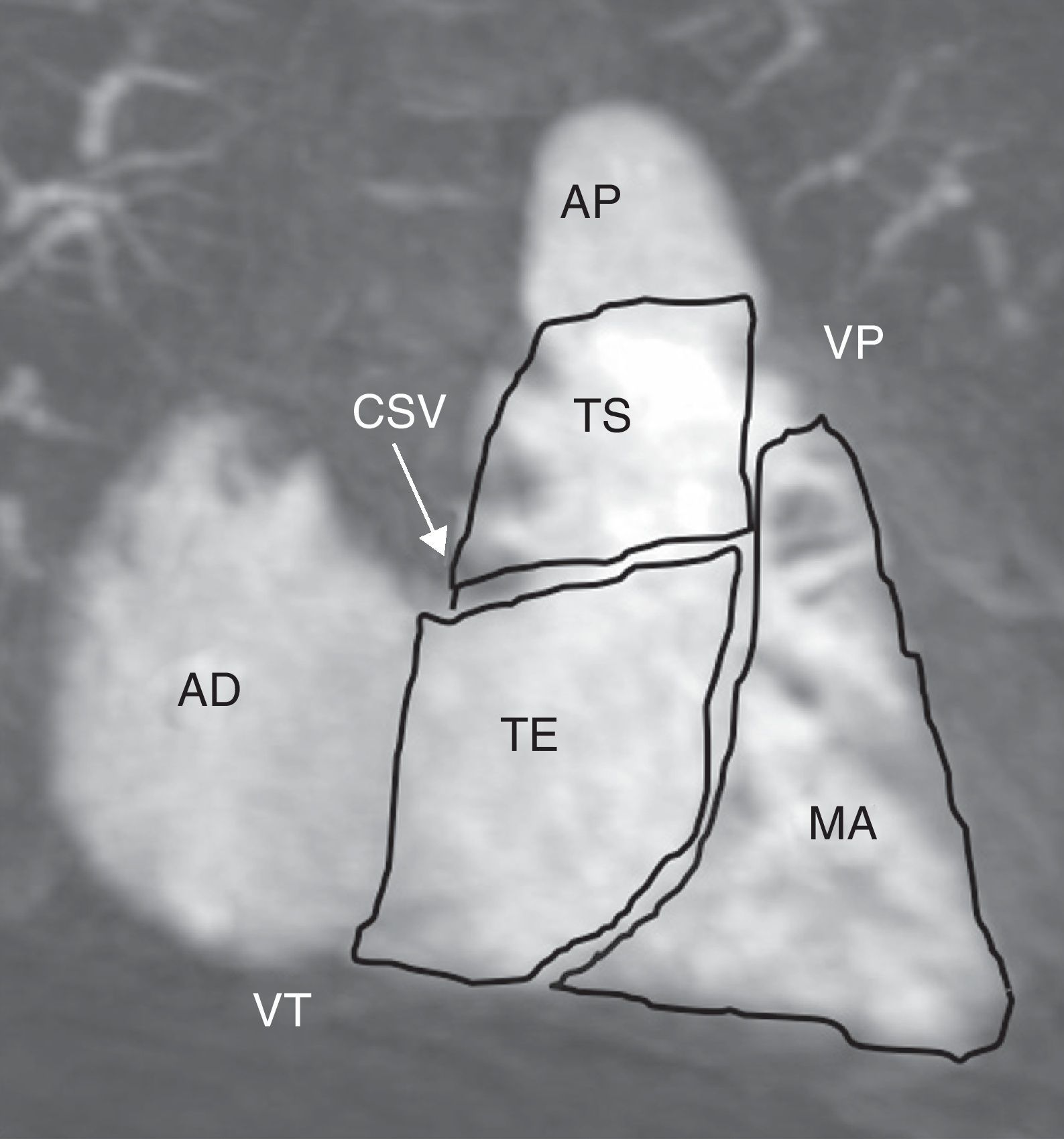
Anatomía del ventrículo derechoEl VD se divide en tres regiones5,6: tracto o cámara de entrada, tracto o cámara de salida y miocardio apical o cuerpo (fig. 2). El tracto de entrada (inlet) contiene el aparato valvular tricúspide, que se extiende desde el anillo valvular, a través de las cuerdas tendinosas, hasta la inserción de los músculos papilares. El tracto de salida (outlet) se extiende desde la cresta supraventricular hasta la válvula pulmonar. Incluye al infundíbulo o cono arterial, que es el estrechamiento de la parte superior del VD, por debajo de la válvula pulmonar, caracterizado por una superficie endocárdica lisa. El tracto de entrada y el de salida forman una «V» cuyo vértice es el miocardio apical, trabeculado. El VD tiene tres paredes: pared libre o retroesternal (que se divide en pared anterior y lateral), pared inferior o diafragmática y septo interventricular.
Anatomía regional del ventrículo derecho: MIP fino de angio-RM 3D contrastada en las cavidades derechas, con efecto ventriculográfico, demostrando la división del VD en tracto de entrada (TE), tracto de salida (TS) y miocardio apical (MA) (AD: aurícula derecha; AP: arteria pulmonar; CSV: cresta supraventricular; VD: ventrículo derecho; VT: válvula tricúspide).
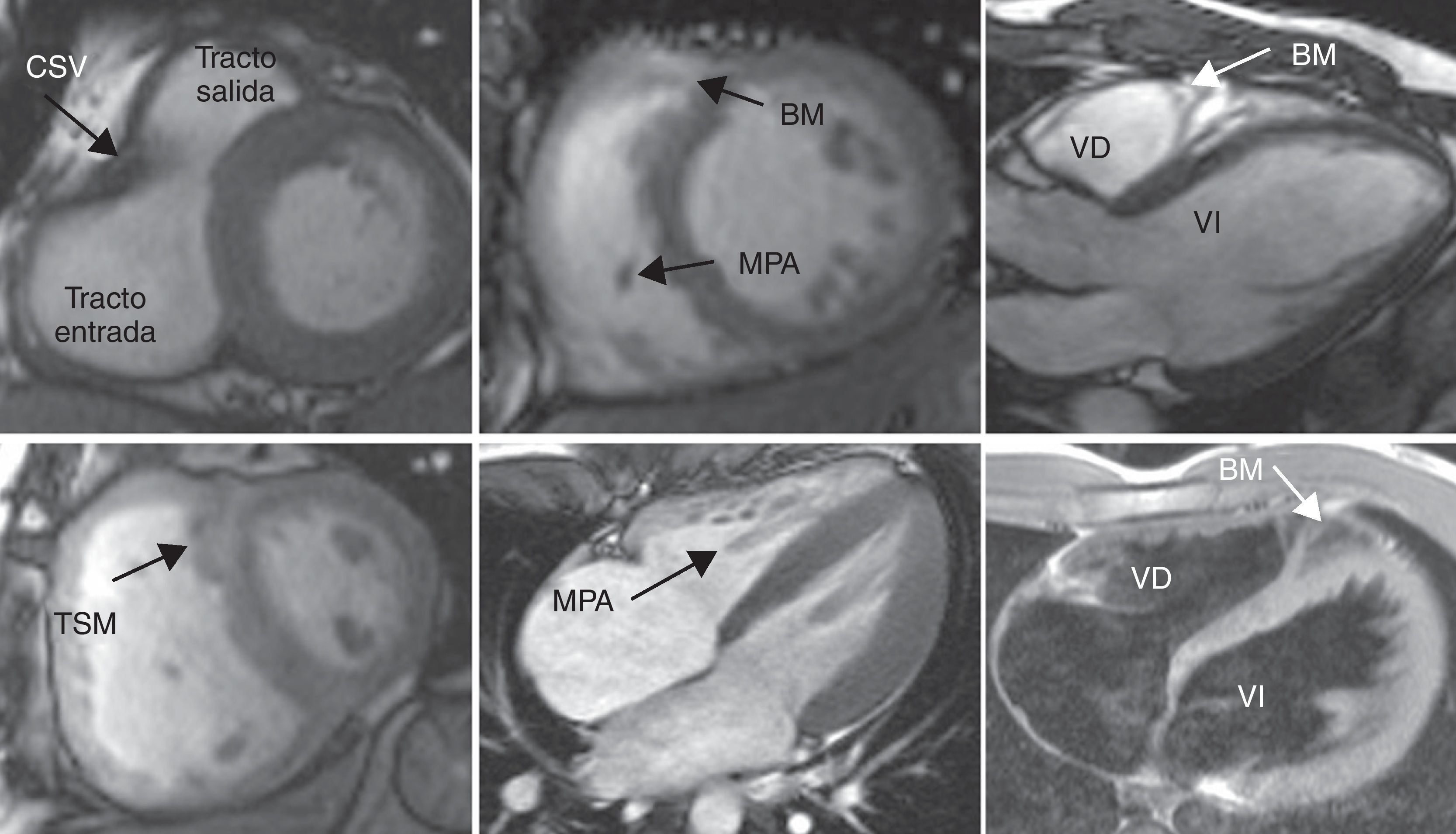
El VD presenta en su superficie endocárdica una serie de bandas, trabéculas y músculos (fig. 3), rasgos característicos y diferenciales con respecto al VI5,6. Los músculos papilares reciben la inserción de las valvas tricúspides, son numerosos y pequeños, y tienden a insertarse en el septo, al contrario que en el VI. La cresta supraventricular (espolón de Wolff) es un engrosamiento muscular que separa la válvula pulmonar de la tricúspide (en el VI hay continuidad entre las válvulas). La banda moderadora contiene fibras del sistema de conducción eléctrico, y conecta el septo con la porción apical de la pared anterior, separando el tracto de salida del miocardio apical. Se identifica de manera consistente en el plano de 3C del VI y en el EC. La trabécula septomarginal o septal es un engrosamiento muscular del septo interventricular en forma de «Y», una de cuyas ramificaciones es la banda moderadora. Es visible en RM únicamente cuando hay una hipertrofia del VD. Las trabéculas apicales son unas trabéculas carnosas que tabican el ápex.
El VD normal presenta un diámetro transverso inferior al del VI, no contribuye al ápex cardíaco y tiene una pared fina (menor o igual a 5mm en la cara inferior 7,8). El septo interventricular debe ser convexo hacia el VD en todas las fases del ciclo cardíaco. El VD puede presentar variantes en su forma que en ocasiones plantean problemas diagnósticos. Además, la angulación de los ejes largos influye en su forma 9. El pectus excavatum produce una deformidad en la pared libre del VD.
La perfusión del VD6, si la dominancia es derecha (80% de la población), depende mayoritariamente de la coronaria derecha, que irriga la pared lateral (ramas agudas marginales), la pared inferior y el septo inferior (arteria descendente posterior). La pared anterior y el septo anterior dependen de la coronaria izquierda (descendente anterior), y el infundíbulo es irrigado por la rama conal. Si la dominancia es izquierda, la arteria descendente posterior se origina de la coronaria izquierda, por lo que ambas coronarias contribuyen de manera similar a la perfusión del VD. El aporte coronario al VD es más favorable que al VI, ya que se realiza tanto en sístole como en diástole y cuenta con presencia de colaterales.
Fisiología del ventrículo derechoEl VD está acoplado al VI, y ambos deben bombear el mismo volumen/latido. La interdependencia ventricular6 se refiere a la mutua dependencia de sus funciones2, y tiene un sustrato anatómico: comparten fibras miocárdicas (sobre todo en el septo interventricular), y un mismo espacio dentro del pericardio.
La contracción del VD comienza en el tracto de entrada, progresa hacia el miocardio apical, y finaliza en el infundíbulo con un patrón peristáltico. Es un movimiento complejo, diferenciándose tres componentes6: desplazamiento hacia dentro de la pared libre, tracción en los puntos de inserción en el VI y desplazamiento hacia el ápex del anillo tricúspide, causado por las fibras longitudinales. Este último es uno de los principales componentes de la eyección del VD y se puede cuantificar como índice de función sistólica a través del «movimiento sistólico del plano valvular tricúspide» (TAPSE, tricuspid annular plane systolic excursion)6, que en condiciones normales debe ser superior a 2cm.
La RM se considera el estándar de referencia para la evaluación del volumen y la función sistólica del VD3,10. La ecocardiografía presenta limitaciones debidas a la situación retroesternal del VD, la mala definición de su superficie endocárdica y la dificultad para aplicar modelos volumétricos que permitan emplear una fórmula geométrica para calcular su volumen.
La RM permite realizar un análisis cuantitativo del VD, a partir de una serie consecutiva de cortes en cine que incluya toda su extensión. Esto habitualmente se realiza en EC, aprovechando las secuencias para cuantificar el VI. Sin embargo, este cálculo no está exento de problemas ya que suele ser difícil identificar el plano valvular11, debido a su mala visualización, y a su movimiento durante el latido cardíaco. Para definir con certeza en qué corte finaliza la aurícula y comienza el VD se puede obtener una referencia de líneas en secuencias en modo cine del EC sobre 4C y 2CD, de modo que se pueda identificar el plano valvular en sístole y diástole. Otra solución es trazar los contornos en las imágenes obtenidas en 4C, si bien requiere una adquisición que no se obtiene rutinariamente. Hay que ser cuidadoso en la inclusión completa del tracto de salida.
El análisis cuantitativo del VD permite obtener el volumen telediastólico (VTD) y el volumen telesistólico (VTS), con valores absolutos y normalizados, y calcular el volumen/latido, el gasto cardíaco y la fracción de eyección (FE). El volumen del VD es un 10-20% superior al del VI, con lo cual para conseguir un volumen/latido igual que el del VI debe presentar una FE inferior. El aumento del VTD indica dilatación, y el descenso de la FE, disfunción sistólica6,7. Se puede cuantificar su masa, aunque no se hace rutinariamente debido a la dificultad para trazar contornos epi y endocárdicos, al ser la pared tan fina. La masa miocárdica es mucho menor que la del VI, y su incremento refleja una hipertrofia2.
La función diastólica del VD no ha sido tan estudiada como la del VI, y puede ser estimada con RM de un modo similar a la ecocardiografía, analizando los patrones de flujo a través de la válvula tricúspide, en las venas pulmonares y la vena cava inferior6,7.
Patología del ventrículo derechoConsideraremos cuatro grupos: fallo cardíaco derecho, isquemia, enfermedades del miocardio y masas. Excluimos de esta revisión las cardiopatías congénitas.
Fallo cardíaco derechoLa causa más frecuente del fallo ventricular derecho es el fallo ventricular izquierdo. El fallo primario del VD puede ocurrir por una lesión directa (isquemia, miocardiopatía), o por sobrecarga, ya sea de presión (aumento de poscarga) o de volumen (aumento de precarga)11. Se produce así una disfunción, y el VD pone en marcha unos mecanismos adaptativos: hipertrofia, dilatación, desplazamiento del septo e insuficiencia tricúspide. Cuando estos mecanismos se ven sobrepasados y el VD es incapaz de mantener su función, se produce el fallo del VD, con aparición de12: congestión venosa periférica, edemas, ascitis, y en último término shock cardiogénico. Debido a la interdependencia ventricular, el fallo cardíaco derecho acaba provocando fallo izquierdo, y viceversa. En las sobrecargas del VD y en las cardiopatías con fallo cardíaco derecho, la RM constituye una excelente técnica de imagen para valorar la evolución, la respuesta al tratamiento y establecer el pronóstico de una manera no invasiva.
La sobrecarga de presión o hipertensión pulmonar (HTP), consiste en un aumento de la presión en la circulación pulmonar, ya sea primario (idiopática, o asociada a esclerodermia, infección por VIH y otras afecciones), o secundario (obstrucción crónica al flujo aéreo, tromboembolismo pulmonar crónico). La HTP se diagnostica cuando la presión media en la arteria pulmonar (PAP) supera los 25mmHg. La PAP se determina mediante cateterización del corazón derecho12,13, aunque la ecocardiografía puede estimarla3 mediante el análisis doppler de la insuficiencia tricuspídea. Aunque no puede establecer el diagnóstico, la RM tiene un papel relevante en la HTP, ya que aporta información de la estructura y función de la unidad arteria pulmonar-ventrículo derecho. La aparición de tratamientos médicos que en algunos casos mejoran el mal pronóstico que conlleva la HTP ha impulsado el interés por encontrar marcadores que monitoricen su evolución.
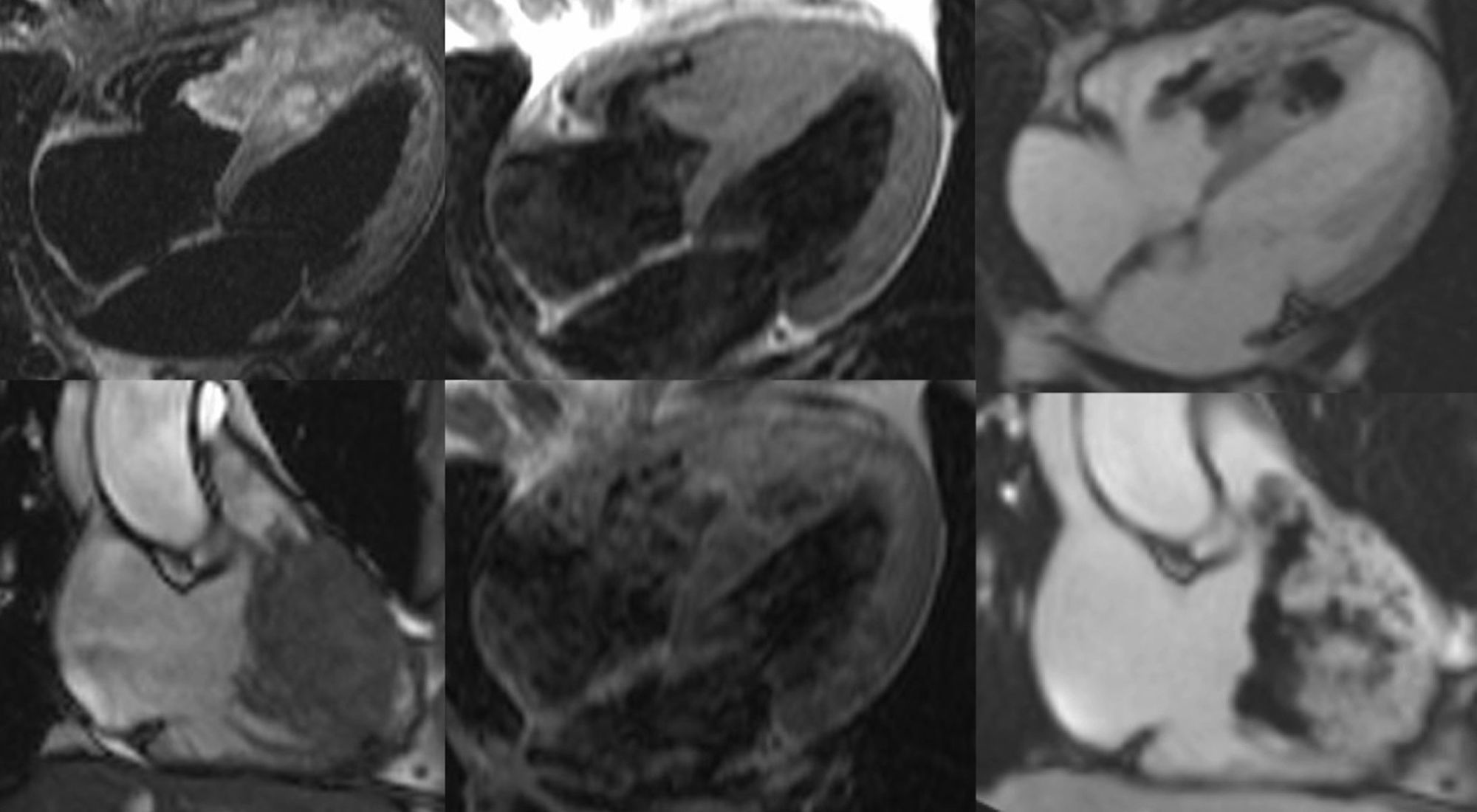
La semiología cardíaca de la HTP en RM refleja la sobrecarga de presión del VD2,11, (fig. 4): hipertrofia, dilatación y disfunción sistólica del VD, y dilatación retrógrada de la aurícula derecha, la vena cava inferior y las venas suprahepáticas. La RM además demuestra el movimiento anómalo del septo interventricular14, que en sístole (y en diástole al incrementar la gravedad) se aplana e incluso se hace convexo hacia el VI, de manera contraria al movimiento normal, afectando a la función del VI12. Se han estudiado diferentes parámetros (masa, VTD, VTS, volumen/latido y FE del VD, e índices que miden la deformidad septal) obteniéndose correlaciones variables con la PAP. Esta correlación es insuficiente para establecer el diagnóstico de HTP mediante RM, pero es útil en la monitorización de la respuesta al tratamiento2,15–17. Se pueden detectar focos de realce miocárdico en las inserciones ventriculares por fibrosis, probablemente por estrés mecánico18.
Hipertensión pulmonar (HTP): imágenes en modo cine steady state free precession (SSFP) 4 cámaras en diástole (izquierda arriba) y sístole (izquierda abajo), proyección de máxima intensidad (MIP) axial de angio-RM pulmonar (derecha arriba), y realce miocárdico tardío (secuencia inversión recuperación tras la introducción de contraste) Eje corto (derecha abajo). Varón VIH (+) con HTP severa (presión media en la arteria pulmonar 53mmHg). La RM demuestra signos de sobrecarga de presión en el ventrículo derecho (VD): hipertrofia y dilatación del VD, y aplanamiento e inversión del septo interventricular en sístole (flecha larga). Realce miocárdico en la inserción ventricular inferior (flecha corta). El análisis cuantitativo ventricular mostraba una disfunción sistólica grave biventricular. En controles posteriores se demostró una mejoría de la función del VD y de los signos de HTP tras instaurar un tratamiento vasodilatador con sildenafilo (ver también video 1, material adicional en la web).
La angio-RM muestra dilatación de la arteria pulmonar con reducción de los vasos periféricos, ectasia focal y tortuosidad arterial, aunque la TC es más eficaz. El estudio de flujo en la arteria pulmonar mediante las secuencias de contraste de fase aporta datos hemodinámicos como las velocidades pico y media, el flujo y el volumen/latido19.
La RM puede en determinados casos contribuir al diagnóstico etiológico de la HTP, identificando la semiología del tromboembolismo pulmonar crónico (vasos ocluidos, trombos intraluminales y defectos de perfusión bien definidos), o al diagnóstico diferencial con otras causas de fallo cardíaco derecho.
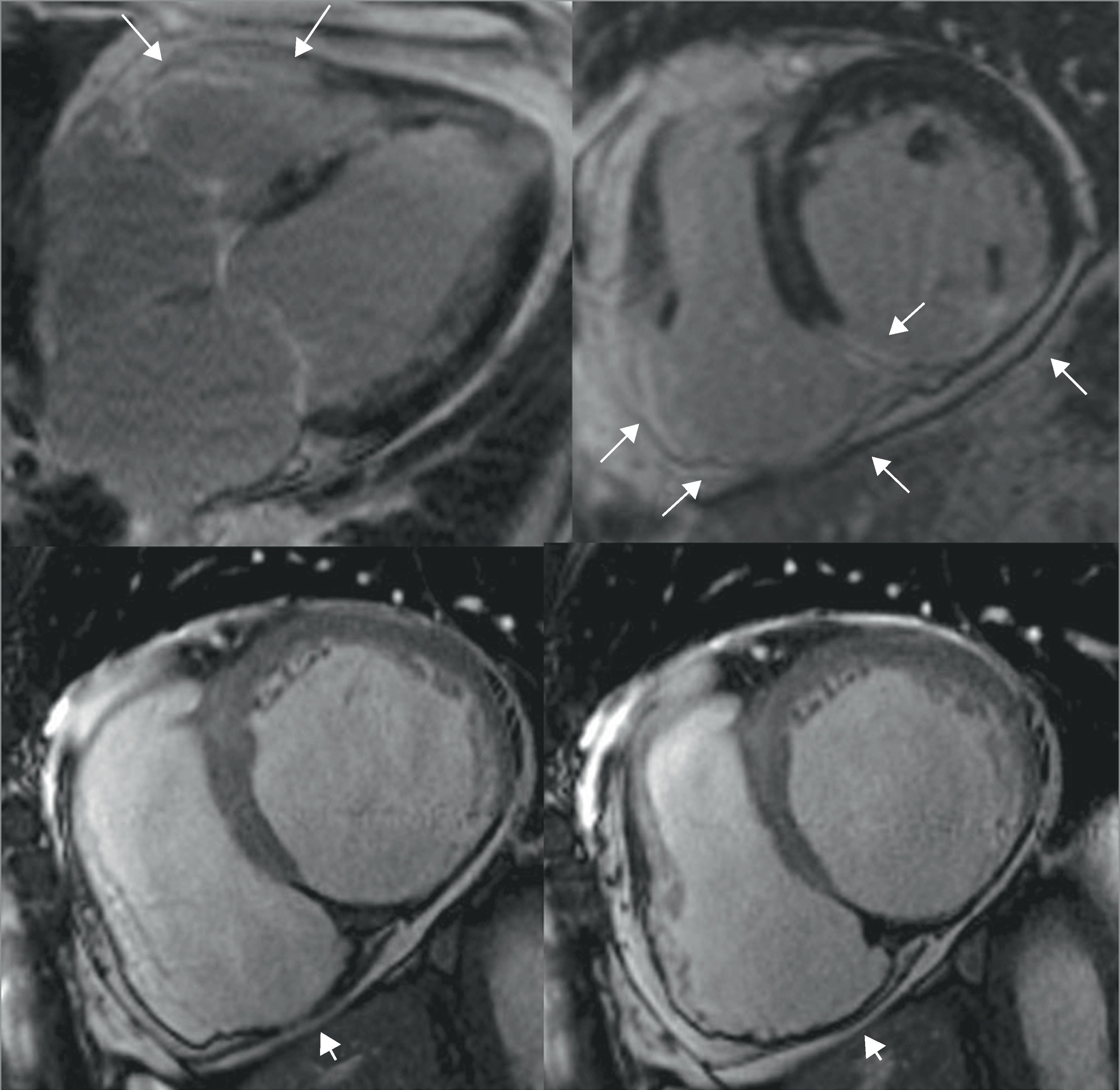
La sobrecarga de volumen ocurre en las insuficiencias valvulares derechas (pulmonar y tricúspide), y en los cortocircuitos izquierda-derecha, como la comunicación interauricular (CIA) y el drenaje venoso pulmonar anómalo (DVPA)12. Las consecuencias son similares a la sobrecarga de presión, aunque el VD tolera mejor una sobrecarga de volumen, y domina la dilatación sobre la hipertrofia12. Además de identificar los signos de sobrecarga del VD (dilatación, movimiento anómalo septal), el valor de la RM estriba en la identificación de causas subyacentes que hayan podido pasar desapercibidas, como puede ocurrir en los cortocircuitos cardíacos20,21 (fig. 5). La RM, aún con ciertas limitaciones técnicas, puede cuantificar el cortocircuito22, con el método volumétrico (diferencia del volumen/latido entre los ventrículos, válido en ausencia de insuficiencias valvulares) o mediante el cociente Qp/Qs23, cuantificando el flujo en la circulación pulmonar (Qp) y sistémica (Qs) con secuencias de contraste de fase.
Sobrecarga de volumen del ventrículo derecho (VD) debida a comunicación interauricular tipo ostium secundum: imagen en modo cine steady state in free precession (SSFP) 4 cámaras (4C) (izquierda), perfusión 4C (centro) y eco de gradiente 4C con banda de saturación sobre las cavidades izquierdas (derecha). Varón de 40 años con dilatación de las cavidades derechas identificada en ecocardiografía, sin encontrar la causa. El defecto septal atrial, apenas visible en las secuencias en modo cine convencionales (SSFP), se identifica con claridad (flechas) como un chorro hipointenso en la secuencia de perfusión miocárdica (debido a la diferencia de señal entre cavidades derechas e izquierdas) y en la secuencia en modo cine eco de gradiente con banda de saturación sobre las cavidades izquierdas (debido a la anulación de la señal de la sangre procedente de dichas cavidades). La RM muestra además signos de sobrecarga de volumen en el VD (dilatación sin hipertrofia), calculando un cociente flujo pulmonar/flujo arterial (Qp/Qs) de 1,6, indicativo de cortocircuito izquierda-derecha (ver también video 2, material adicional en la web).
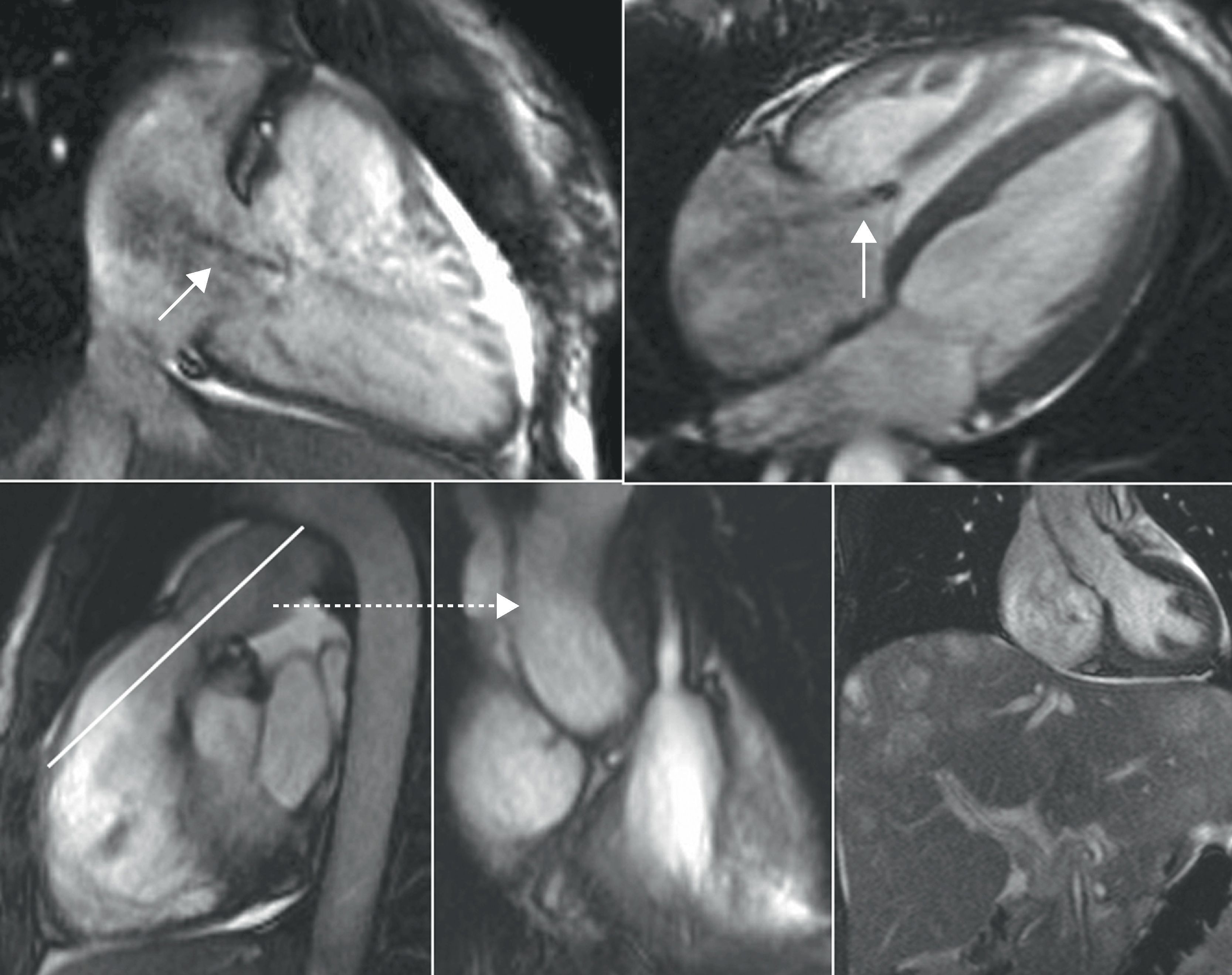
El corazón carcinoide ocurre en el 20% de los pacientes con síndrome carcinoide. Es un efecto paraneoplásico debido a las sustancias vasoactivas secretadas por las metástasis hepáticas que alcanzan el corazón derecho directamente antes de desactivarse y provocan lesiones valvulares, por engrosamiento y retracción24,25. La válvula tricúspide se afecta casi en todos los casos, con una grave regurgitación. La válvula pulmonar se afecta frecuentemente, con estenosis e insuficiencia. Se produce una gran sobrecarga de volumen y, en menor grado, de presión, siendo el fallo cardíaco derecho la causa de muerte en un tercio de los casos. La RM es una técnica excelente para demostrar las manifestaciones de esta entidad (fig. 6).
Afectación cardíaca en el síndrome carcinoide: imágenes en modo cine steady state in free precession (SSFP) 2 cámaras derechas (arriba izquierda), 4 cámaras (arriba derecha), tracto de salida del ventrículo derecho (abajo izquierda) y plano longitudinal a través de la válvula pulmonar (abajo centro), y TrueFisp coronal toraco-abdominal (abajo, derecha). Mujer de 45 años con síndrome carcinoide por metástasis hepáticas de un tumor carcinoide en el íleon. La RM muestra la dilatación de las cámaras derechas (sobre todo la aurícula) por sobrecarga del ventrículo derecho, insuficiencia tricúspide (flecha) y estenosis de la válvula pulmonar (ver también video 3, material adicional en la web).
EL VD es relativamente insensible a la isquemia porque realiza menor trabajo muscular y recibe un flujo coronario más favorable que el VI26. Un 30-50% de los infartos de la pared inferior del VI se asocian a un infarto del VD27, siendo raro el infarto aislado del VD (ocurre en casos de arteria coronaria derecha no dominante27). Antes del uso generalizado de la RM, el diagnóstico del infarto del VD se realizaba en el contexto clínico de un paciente con infarto inferior del VI, con datos clínicos o electrocardiográficos característicos, pero quedaban sin diagnosticar algunos casos.
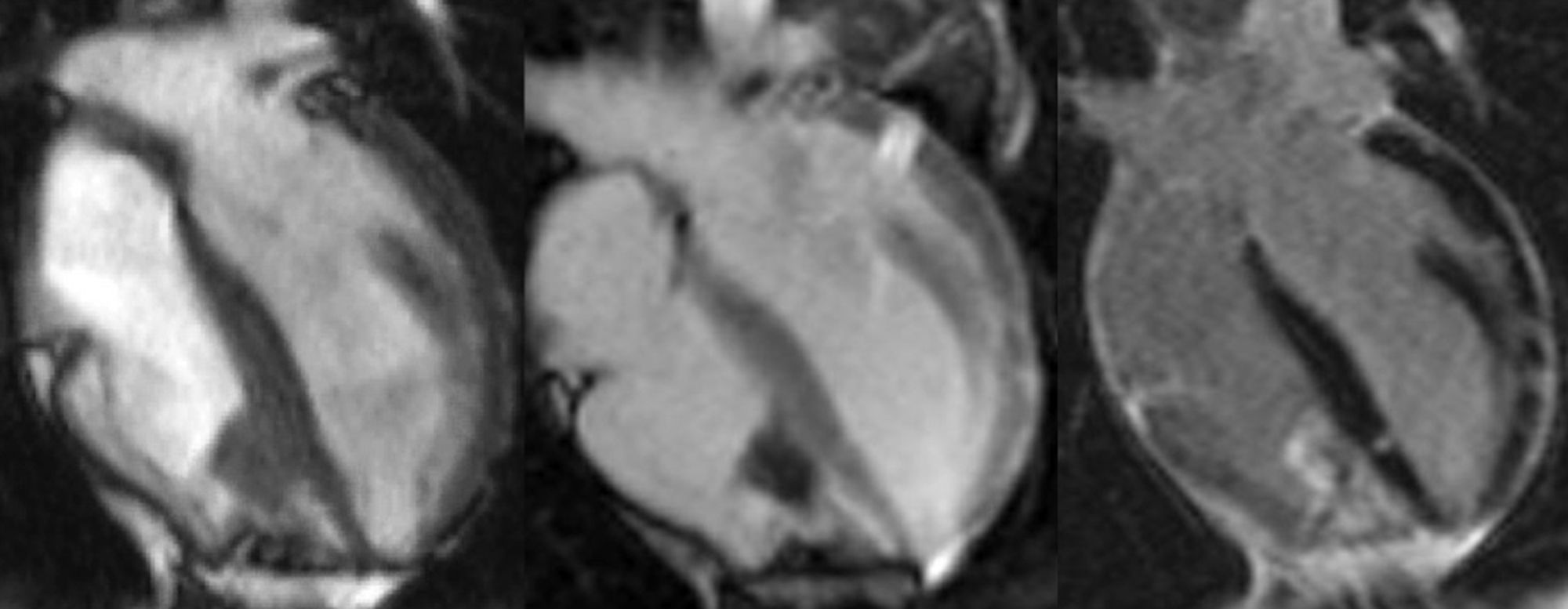
En la fase aguda su reconocimiento es importante28 porque conlleva una mayor mortalidad hospitalaria que el infarto del VI aislado2,29. Aunque suele ser silente, puede provocar arritmias y alteraciones hemodinámicas como la hipotensión, que requiere tratamiento con repleción de volumen. Superado el episodio agudo, el pronóstico a largo plazo es favorable, ya que el VD suele recuperar con más facilidad su función tras el infarto, manteniendo su viabilidad independientemente del estado de la arteria coronaria que lo irriga29. La RM es la técnica de elección para su diagnóstico30, identificando el realce miocárdico tardío de la pared, y las alteraciones en la contractilidad segmentaria (fig. 7).
Infarto del ventrículo derecho (VD): secuencias de realce miocárdico tardío (secuencia inversión recuperación tras la introducción de contraste) 4 cámaras (arriba izquierda) y eje corto (EC) basal (arriba derecha), e imágenes en modo cine steady state in free precession EC: en diástole (abajo izquierda) y sístole (abajo derecha). Varón de 65 años con antecedente de infarto inferior del ventrículo izquierdo (VI) hace 15 años, al que se le prescribió un estudio de RM para investigar la causa de la dilatación del VD identificada en la ecocardiografía. La RM demuestra un infarto no viable de la cara inferior del VI, asociado a un infarto inferior y lateral del VD, con discinesia (flechas cortas) y realce miocárdico de límites netos (flechas largas). El análisis cuantitativo ventricular indicó una disfunción sistólica biventricular (ver también video 4, material adicional en la web).
Todas las miocardiopatías, excepto la DAVD, afectan de manera primaria y preferente al VI, aunque en una proporción variable de casos ocurre afectación concomitante del VD. La RM juega un papel importante en la detección de la afectación del VD, en muchas ocasiones no sospechada por otras técnicas de imagen o métodos diagnósticos, y con implicaciones pronósticas y terapéuticas.
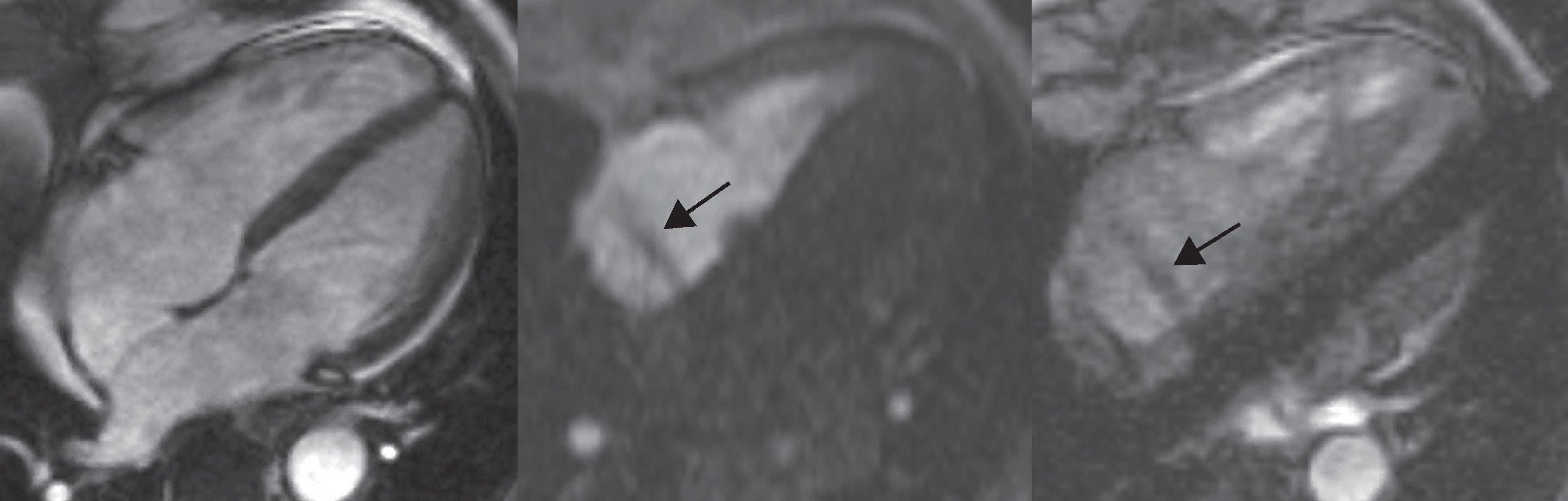
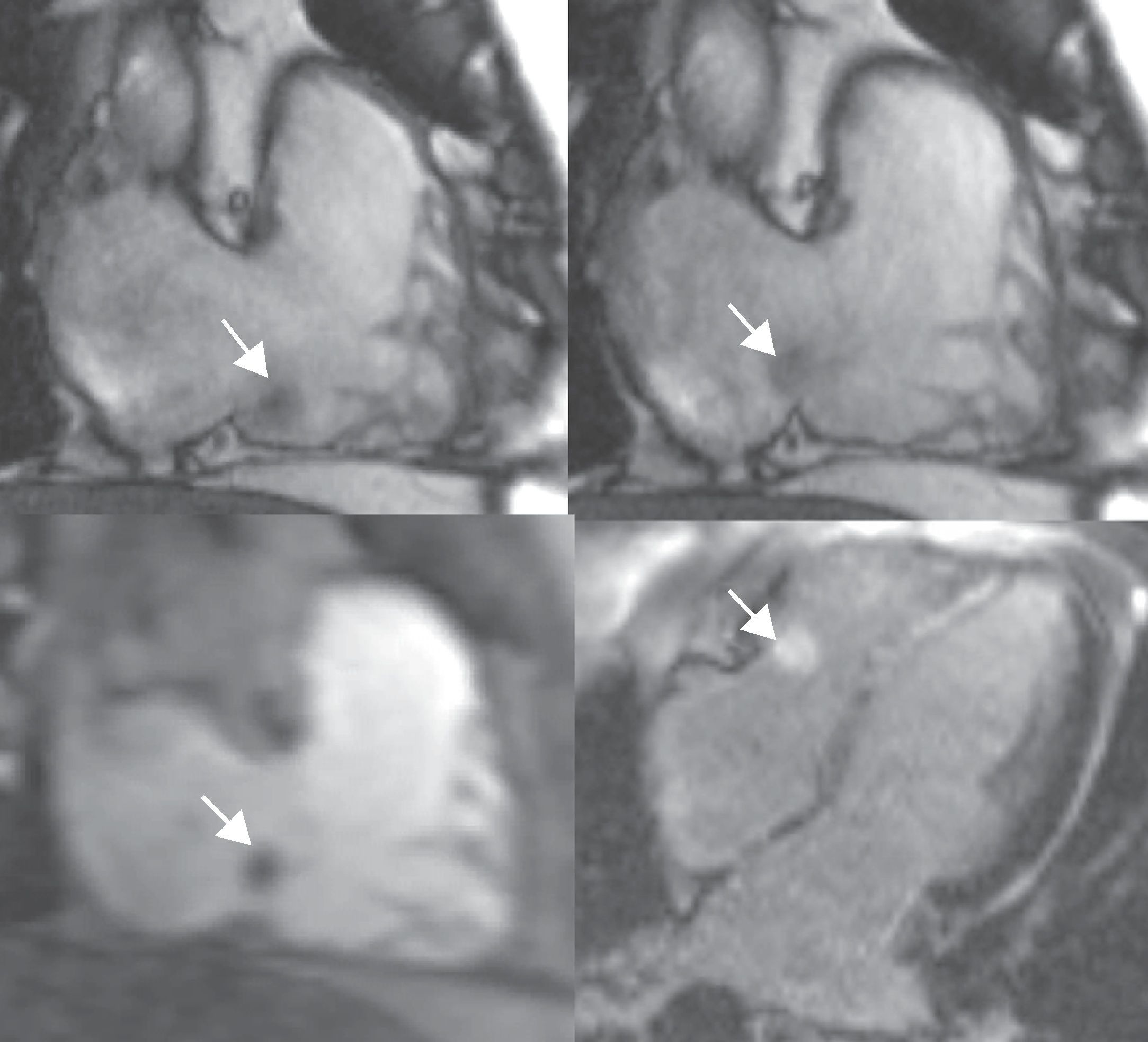
La DAVD, también denominada miocardiopatía arritmogénica del VD, es una cardiomiopatía genética caracterizada por un reemplazamiento fibrograso miocárdico con pérdida de miocitos31. Afecta al VD, de manera típica en el llamado «triángulo de la displasia» (apex, infundíbulo anterior y pared inferior del VD), pero también puede manifestarse en el VI en los casos más graves. La expresión de la enfermedad es muy variable: inicialmente es asintomática, con riesgo de muerte súbita, posteriormente provoca arritmias y anomalías morfológicas del VD, y, en una fase final, condiciona un fallo cardíaco biventricular (fig. 8). Se ha puesto énfasis en su diagnóstico por tratarse de una afección vinculada con la muerte súbita de sujetos jóvenes y aparentemente sanos, y potencialmente tratable.
Displasia arritmogénica del ventrículo derecho (DAVD): realce miocárdico tardío (secuencia inversión recuperación tras la introducción de contraste): 4 cámaras (4C) (arriba izquierda) y eje corto basal (arriba derecha), e imagen en modo cine steady state in free precession 4C: diástole (abajo izquierda) y sístole (abajo derecha). Varón de 16 años, que consultó por síncope, extrasístoles ventriculares frecuentes y onda T negativa de V1 a V4. La RM muestra un extenso realce miocárdico por fibrosis (flechas), con un patrón parcheado en la pared libre del ventrículo derecho (VD) y subepicárdico en la pared lateral del ventrículo izquierdo (afectación biventricular). Las secuencias en modo cine muestran un VD gravemente dilatado, con una disfunción sistólica grave. Se llegó al diagnóstico de DAVD, y se implantó al paciente un desfibrilador automático (ver también video 5, material adicional en la web).
El diagnóstico se basa en la demostración de las anomalías estructurales, funcionales y electrofisiológicas causadas por los cambios histológicos. El diagnóstico definitivo se establecería con una biopsia, aunque en la práctica se emplean los criterios propuestos por la Working Group Myocardial and Pericardial Disease of the European Society of Cardiology and of the Scientific Council on Cardiomyopathies of the International Society and Federation of Cardiology se le conozca como la Task Force,
en 199433 y revisados en 2002 y 201032, agrupados en cinco categorías: alteraciones estructurales o disfunción, caracterización tisular de la pared, anomalías en el electrocardiograma, arritmias e historia familiar. La RM es la técnica de imagen cardíaca de elección, aunque únicamente puede identificar anomalías del primer grupo: alteraciones regionales o globales de la contractilidad, dilatación y disfunción sistólica del VD. Una RM normal no excluye el diagnóstico de DAVD, sobre todo en sus fases iniciales.
Dentro de las alteraciones regionales de la contractilidad se pueden considerar dos variantes, ambas más evidentes en sístole. El aneurisma focal («bulging») es una deformidad de la pared libre, que puede resultar difícil de diferenciar de variantes del patrón normal de contractilidad2, especialmente en la pared libre junto a la inserción de la banda moderadora10, por lo que es un signo que debe interpretarse con cautela. El signo del acordeón se describe como un aspecto ondulante de la pared libre del tracto de salida del VD, más frecuente en los portadores de la mutación genética vinculada con la DAVD34.
Además se ha identificado una serie de rasgos característicos2,35: fibrosis y/o infiltración grasa de la pared, hipertrabeculación, hipertrofia de la pared y dilatación del tracto de salida. Aunque en un principio se concedió gran valor a la identificación de grasa en la pared libre del VD, actualmente está cuestionada por su baja sensibilidad (debida a artefactos de movimiento y a la escasa resolución espacial) y especificidad (se ha descrito en sujetos sanos2). La detección de fibrosis se basa en el realce miocárdico, con un patrón parcheado o difuso, no segmentario, y es un signo más específico, presente en más de la mitad de los pacientes que cumplen criterios de DAVD36.
El síndrome de Brugada, o taquicardia de TSVD, consiste también en arritmias originadas en el VD. Su diagnóstico es electrocardiográfico, pero se han descrito alteraciones en el VD, y pueden plantear problemas de diferenciación con la DAVD32.
La miocardiopatía hipertrófica (MCH) es una miocardiopatía genética caracterizada por una alteración del sarcómero cardíaco que produce un aumento de la masa ventricular. La RM se emplea para medir el grosor del miocardio, cuantificar la masa del VI, demostrar la captación de contraste intramiocárdica y estudiar la obstrucción del tracto de salida del VI.
La American Heart Association clasifica la MCH como una miocardiopatía limitada al VI. No obstante, existen evidencias que sugieren que se trata de un proceso más extenso, aunque la expresión en el VD es más limitada y se ha estudiado poco hasta el momento37,38. Hasta un 40% de pacientes con MCH pueden presentar engrosamiento de la pared del VD39, pero es infrecuente que presenten realce miocárdico39. En general, la afectación del VD es proporcional a la del VI, aunque se han descrito casos donde domina la afectación del VD38. En algunos casos, la hipertrofia provoca obstrucción del TSVD40 o afecta predominantemente a las bandas musculares.
Por otra parte, el VD puede afectarse en la hipertrofia fisiológica que se produce en atletas41,42, siendo característico el engrosamiento de la banda moderadora.
La miocardiopatía no compactada se caracteriza por la falta de compactación de la capa interna del miocardio debida a un fallo en la embriogénesis. De descripción reciente43, su identificación se ha facilitado con el uso rutinario de la RM. El curso clínico y la expresividad de la enfermedad son variables, existiendo cierta controversia sobre los criterios diagnósticos y el pronóstico.
Ha sido reconocida como una causa de fallo ventricular derecho, arritmias y embolismos. Afecta fundamentalmente al VI, pero puede existir una afectación biventricular44,45 (fig. 9) e incluso se han descrito casos de afectación aislada del VD46, de difícil diagnóstico, ya que el VD es trabeculado por naturaleza. El diagnóstico en RM se basa en el cociente miocardio no compactado/miocardio compactado47. Puede asociarse a disfunción ventricular y realce miocárdico en las trabéculas48.
Miocardio no compactado con afectación biventricular: imágenes en modo cinesteady state in free precession (SSFP) 4 cámaras (izquierda) y eje corto a nivel medioventricular (derecha arriba) y apical (derecha abajo). Hipertrabeculación en ambos ventrículos, de predominio apical. Paciente varón de 24 años con historia familiar de miocardio no compactado y con ligera disfunción sistólica del ventrículo izquierdo.
En la amiloidosis cardíaca se produce un depósito de amiloide en las cuatro cámaras cardíacas y en las válvulas que provoca una miocardiopatía restrictiva. La RM contribuye a su diagnóstico, identificando un engrosamiento mural y, sobre todo, un realce miocárdico caracterizado por un patrón intramiocárdico o subendocárdico. Es difícil ajustar el tiempo de inversión en las secuencias de IR49. Los hallazgos son más evidentes en el VI, aunque la afectación del VD es frecuente.
En la miocardiopatía dilatada idiopática, la dilatación del VD se ha identificado como un factor de mal pronóstico, independientemente de la FE del VI50. Asimismo, la disminución de la FE del VD en el contexto de una dilatación biventricular con disfunción sistólica del VI orienta a una miocardiopatía dilatada idiopática frente a una cardiopatía isquémica51.
La afectación cardíaca en el seno de una sarcoidosis sistémica es rara. Se caracteriza por la presencia de granulomas miocárdicos, que puede aparecer en ambos ventrículos.
Masas (tumorales y no tumorales)La RM es la técnica de elección para el estudio de las masas cardíacas debido a su resolución tisular y capacidad multiplanar 52,53.
La mayoría de las neoplasias cardíacas son tumores benignos. El mixoma es el más frecuente y, aunque muestra predilección por las aurículas, ocasionalmente ocurre en el VD. Asienta en la pared cardíaca por medio de un pedículo y suele tener un aspecto heterogéneo54. El fibroelastoma papilar es el tumor más frecuente de las válvulas cardíacas. Son masas de pequeño tamaño, vascularizadas, que siguen el movimiento valvular55. Éstas son características que dificultan su detección con una RM, incluso cuando han sido identificados fácilmente en la ecocardiografía (fig. 10).
Fibroelastoma papilar de la válvula tricúspide: imágenes en modo cinesteady state in free precession (SSFP) 2 cámaras derechas (2CD): en diástole (arriba izquierda) y sístole (arriba derecha), estudio de perfusión 2CD (abajo izquierda) y realce miocárdico tardío (secuencia inversión recuperación tras la introducción de contraste) (abajo derecha). Hallazgo incidental en la ecocardiografía. Las imágenes en modo cine demuestran con cierta dificultad una pequeña masa mal definida dependiente de la válvula tricúspide, con visible alternativamente en la aurícula o el ventrículo derechos, dependiendo de la fase cardíaca (flechas). En el estudio de perfusión se identifica fácilmente como un defecto de repleción (flecha). Presenta una intensa captación de contraste (flecha) (ver también video 6, material adicional en la web).
Los tumores malignos son poco frecuentes, aunque la incidencia de malignidad en las cavidades derechas es más elevada que en las izquierdas y, por lo tanto, esta localización es un signo de mal pronóstico. Los signos que sugieren malignidad son el patrón de crecimiento agresivo infiltrando estructuras vecinas, el derrame pleural o pericárdico, la afectación de más de una cámara cardíaca, el aspecto mal definido y la base de implantación amplia o no septal (fig. 11)55. La mayor parte de los tumores malignos son secundarios, ya sea por invasión directa, extensión intravascular (a lo largo de la cava inferior), diseminación hematógena o linfática. Los linfomas cardíacos son masas grandes con tendencia a afectar las cavidades derechas. Ocurren generalmente como parte de una afectación diseminada.
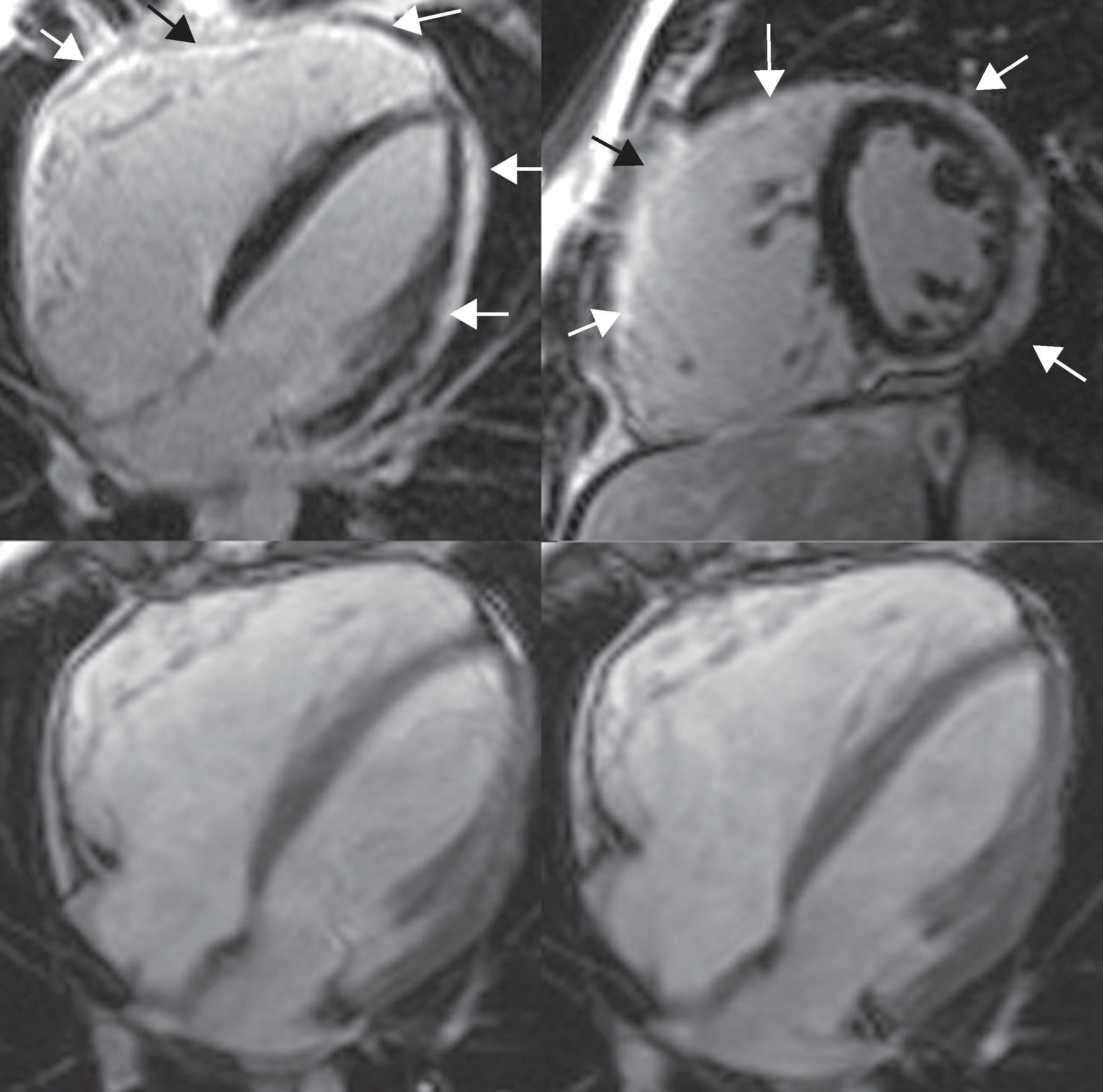
Metástasis cardíaca de hipernefroma: short time inversion recovery (STIR) 4 cámaras (4C) (arriba izquierda), imagen en modo cine steady state in free precession (SSFP) 2 cámaras derechas (2CD) (abajo izquierda), T1-spin-echo 4C pre (arriba centro) y poscontraste (abajo centro), y fixed long inversion recovery technique (FLIRT) post contraste 4C (arriba derecha) y 2CD (abajo derecha). Gran masa en el VD con infiltración de las paredes septal y libre, heterogénea y con realce también heterogéneo (ver también video 7, material adicional en la web).
Los trombos intracardíacos aparecen en RM como masas parcial o totalmente adheridas a la superficie endocárdica. Reconocerlos es importante por el riesgo de embolización55 y las implicaciones terapéuticas, ya que requieren tratamiento anticoagulante. Las secuencias de realce miocárdico precoz (FLIRT) y tardío (IR poscontraste) son útiles55, aunque en ocasiones es difícil diferenciarlos de la pared ventricular. Pueden plantear dificultades diagnósticas con las neoplasias, que generalmente captan contraste. Sin embargo, los trombos crónicos organizados pueden presentar realce55, y, por lo tanto, constituyen un reto diagnóstico (fig. 12). En el VD, los trombos suelen asociarse a estados de hipercoagulabilidad sistémicos como el síndrome antifosfolípido, la vasculitis trombogénica (Behçet), la colitis ulcerosa y las neoplasias. Se ha postulado la existencia de inflamación, tejido de granulación o incluso fibrosis endomiocárdica subyacente como factor inductor de la formación de trombos cardíacos56. Al contrario que en el VI, es poco habitual que se formen por alteraciones regionales que favorecen la estasia, ya que la incidencia de aneurismas posinfarto es baja.
Trombo organizado en el ventrículo derecho (VD): imagen en modo cine steady state in free precession (SSFP) 4 cámaras (izquierda), fixed long inversion recovery technique (FLIRT) inmediatamente tras introducción de contraste (centro) y realce miocárdico tardío (secuencia inversión recuperación tras la introducción de contraste) (derecha). Paciente de 35 años con síndrome de Behçet y antecedente de trombectomía en el VD. La RM muestra una masa adherida al septo apical del VD, con realce tardío en su periferia. Cambios postquirúrgicos en el ápex del VD.
Las indicaciones de estudio del VD mediante RM se pueden agrupar en cuatro categorías:
- 1)
Estudio de arritmias originadas en el VD y despistaje de DAVD (paciente sintomático o cribado de familiares). La RM no puede establecer o descartar el diagnóstico de DAVD, pero forma parte de los criterios diagnósticos.
- 2)
Estudio del VD dilatado. La ecocardiografía es la técnica que establece el diagnóstico, reservándose la RM para los casos no aclarados. El DVPA, no accesible habitualmente a la ecocardiografía, constituye una indicación de RM. Algunos casos de CIA o infarto del VD son identificados en la RM como causa de dilatación del VD.
- 3)
Estudio de la función del VD. La RM es la técnica de elección para el cálculo de volúmenes ventriculares, y la función del VD es un factor pronóstico importante en muchas cardiopatías.
- 4)
Estudio de masas del VD o imágenes dudosas en la ecocardiografía.
Finalmente, en otras ocasiones la RM identifica una afectación no sospechada del VD, en el contexto de una cardiopatía que afecta de manera primaria al VI.
La RM se perfila por lo tanto como la técnica de referencia en el estudio del VD debido a sus indudables ventajas, aunque presenta limitaciones en cuanto a su disponibilidad y tiempo de estudio y análisis requerido. La ecocardiografía sigue siendo una técnica de imagen de primera línea y el cateterismo cardíaco derecho aporta una información funcional y hemodinámica esencial en algunos casos (diagnóstico de HTP). Es previsible que en los próximos años la RM permita profundizar en el conocimiento de la afección del VD, adquiriendo un mayor protagonismo en el manejo de estos pacientes.
AutoríaResponsable de la integridad del estudio: ACA
Concepción del estudio: ACA, JALI, MAP
Diseño del estudio: ACA, EAA, TSY
Obtención de los datos: ACA, EAA
Análisis e interpretación de los datos: ACA, EAA, TSY, MAP
Búsqueda bibliográfica: ACA, JALI, MAP
Redacción del trabajo: ACA
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: EAA, TSY, MAP, JALI
Aprobación de la versión final: ACA, EAA, TSY, MAP, JALI
Los autores declaran no tener ningún conflicto de intereses.