Comparar 2 series de pacientes con cáncer de mama, una estadificadas mediante resonancia magnética (RM) preoperatoria y la otra con técnicas convencionales, y estudiar los cambios de tratamiento y el número de mastectomías y de reintervenciones por afectación de los bordes.
Material y métodosSe revisaron 600 pacientes divididas en 300 con RM preoperatoria (serie 1) y 300 sin RM (serie 2). Se valoraron: la edad, el estado menopáusico, el tamaño tumoral anatomopatológico, la multiplicidad y bilateralidad, el tratamiento quirúrgico y tipo de tratamiento, la administración de quimioterapia neoadyuvante y las reintervenciones por márgenes afectos. Las variables fueron comparadas con las pruebas t de Student y la Chi-cuadrado.
ResultadosLa edad media fue similar (51,5 y 51,8 años, p=0,71). El tamaño tumoral medio fue menor (p<0,001) en la serie 1 (16,9 vs 22,3mm). Se detectaron más tumores múltiples (p<0,001) en la serie 1 (28,7 vs 15,7%). La tasa de mastectomías en la serie 1 (25%) fue menor (p<0,001) que en la 2 (48%). Las técnicas de cirugía oncoplástica y bilaterales solo fueron realizadas en la serie 1. La quimioterapia neoadyuvante fue administrada más frecuentemente (p<0,001) en la serie 1 (30,7 vs 9,3%). La diferencia no fue significativa (p=0,095) en el número de reintervenciones por márgenes afectos (7,2% serie 1; 3,2% serie 2).
ConclusiónLas mastectomías disminuyen al emplear la RM, con disponibilidad de técnicas de cirugía oncoplástica y quimioterapia neoadyuvante. Pese al aumento de cirugías conservadoras en la serie con RM, no observamos un aumento significativo del número de reintervenciones por márgenes afectos, aunque existe una tendencia.
To compare two series of patients with breast cancer, one staged using preoperative MRI and the other staged using conventional techniques, analyzing the changes to treatment, the number of mastectomies, and the number of reinterventions due to involvement of the margins.
Material and methodsWe reviewed 600 patients divided into 300 patients with preoperative MRI (series 1) and 300 without preoperative MRI (series 2). We recorded the following variables: age, menopausal status, tumor size on pathological examination, multiplicity and bilaterality, surgical treatment and type of treatment, the administration of neoadjuvant chemotherapy, and reintervention for involved margins. We used Student's t-test and the chi-square test to compare the variables between the two series.
ResultsThe mean age of patients in the two series was similar (51.5 and 51.8 years, P=0.71). The mean size of the tumor was smaller in series 1 (16.9mm vs 22.3mm) (P<.001). More multiple tumors were detected in series 1 (28.7 vs 15.7%) (P<.001). The rate of mastectomies was lower in series 1 (25 vs 48%) (P<.001). Oncoplastic and bilateral surgeries were performed only in series 1. Neoadjuvant chemotherapy was administered more often in series 1 (30.7 vs 9.3%) (P<.001). The difference in the number of reinterventions for involved margins did not reach significance (7.2% in series 1 vs 3.2% in series 2) (P=.095).
ConclusionWhen MRI was used for staging, neoadjuvant chemotherapy and oncoplastic surgery were used more often and the mastectomy rate decreased. Despite the increase in conservative surgery in patients staged with MRI, the number of reinterventions for involved margins did not increase, although there was a trend towards significance.
La resonancia magnética (RM) es una técnica diagnóstica más sensible que las convencionales (mamografía y ecografía) para detectar el cáncer de mama, sobre todo en el caso del carcinoma infiltrante1–5. Sin embargo, la mamografía continúa siendo la técnica de elección para el cribado del cáncer de mama, con una sensibilidad global del 63-98%, que disminuye al 30-48% en pacientes jóvenes con mamas densas6. Por otro lado, la ecografía es más precisa que la mamografía para determinar el tamaño tumoral de los cánceres invasivos en pacientes con mamas densas7, aunque, la combinación de ambas técnicas no llega a alcanzar la precisión de la RM para establecer la extensión tumoral.
Son varios los estudios que han demostrado que la RM puede detectar más neoplasias multifocales y multicéntricas (10-30% de las pacientes diagnosticadas de cáncer de mama) y más tumores bilaterales (3-9%) que las técnicas convencionales2,3,7,8. Por consiguiente, la RM frecuentemente cambia el protocolo terapéutico en muchas de las pacientes con diagnóstico de cáncer de mama9–17. Sin embargo, la relevancia clínica de los hallazgos de la RM está hoy en discusión, y la técnica no está plenamente instaurada en el protocolo de todos los hospitales18–22. Detectar más tumores múltiples podría aumentar el número de mastectomías, lo que sería un retroceso considerando que la cirugía conservadora es el tratamiento habitual del cáncer de mama. Algunos ensayos clínicos han demostrado que la cirugía conservadora permite el control local de la enfermedad, además de un buen resultado estético, con una supervivencia muy similar a la de la mastectomía2,10.
En este estudio hemos comparado retrospectivamente 2 series de pacientes consecutivas con diagnóstico preoperatorio de cáncer de mama, en una de ellas la estadificación se hizo con RM y, en la otra, con las técnicas convencionales. Nuestro objetivo ha sido determinar los cambios de tratamiento entre ambos períodos y, en particular, valorar las diferencias en la tasa de mastectomías y de tumores con márgenes libres en la cirugía.
Material y métodosSe revisó una muestra de 600 mujeres separadas en dos series de 300, que habían sido diagnosticadas consecutivamente de cáncer de mama en nuestro centro hospitalario mediante biopsia percutánea. Este hospital no atiende una población proveniente de cribado poblacional, sino que es un centro fundamentalmente oncológico de segunda opinión. Tras consultar con el comité ético de investigación, el estudio no precisó de la aprobación por parte del comité de ética, ni consentimiento informado por parte de las pacientes.
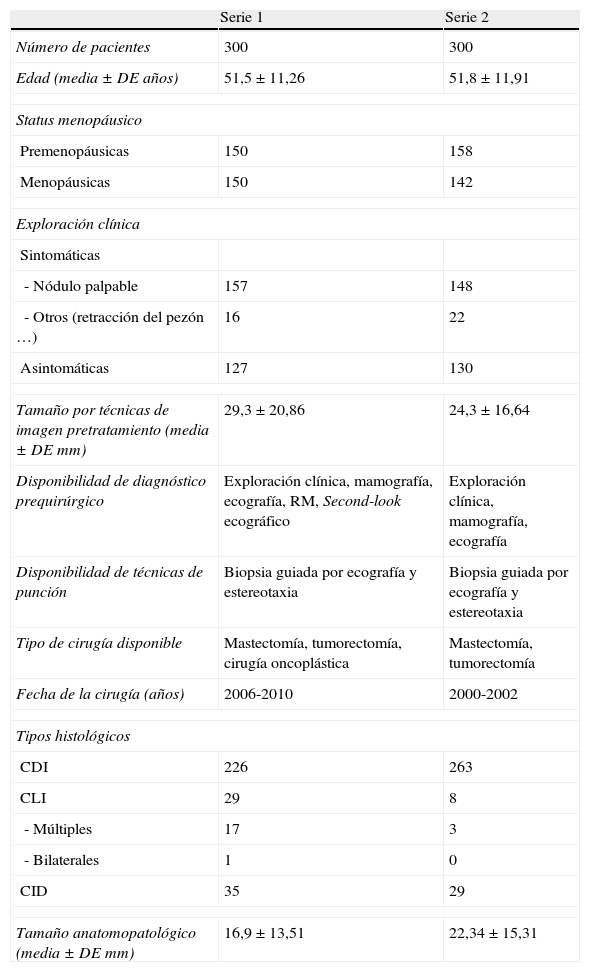
La descripción de ambas series se expone en la tabla 1. En la serie 1 se incluyeron 300 pacientes operadas entre abril de 2006 y junio de 2010, estadificadas con las técnicas convencionales (mamografía y ecografía) y con RM. En este período de tiempo se introdujeron las técnicas de cirugía oncoplástica en nuestro hospital. Por otro lado, en la serie 2 se incluyeron otras 300 pacientes operadas entre enero de 2000 y diciembre de 2002, que habían sido estadificadas solo con las técnicas convencionales puesto que la técnica de RM aún no había sido instaurada en el protocolo de nuestro centro.
Descripción de las series
| Serie 1 | Serie 2 | |
| Número de pacientes | 300 | 300 |
| Edad (media±DE años) | 51,5±11,26 | 51,8±11,91 |
| Status menopáusico | ||
| Premenopáusicas | 150 | 158 |
| Menopáusicas | 150 | 142 |
| Exploración clínica | ||
| Sintomáticas | ||
| - Nódulo palpable | 157 | 148 |
| - Otros (retracción del pezón …) | 16 | 22 |
| Asintomáticas | 127 | 130 |
| Tamaño por técnicas de imagen pretratamiento (media±DEmm) | 29,3±20,86 | 24,3±16,64 |
| Disponibilidad de diagnóstico prequirúrgico | Exploración clínica, mamografía, ecografía, RM, Second-look ecográfico | Exploración clínica, mamografía, ecografía |
| Disponibilidad de técnicas de punción | Biopsia guiada por ecografía y estereotaxia | Biopsia guiada por ecografía y estereotaxia |
| Tipo de cirugía disponible | Mastectomía, tumorectomía, cirugía oncoplástica | Mastectomía, tumorectomía |
| Fecha de la cirugía (años) | 2006-2010 | 2000-2002 |
| Tipos histológicos | ||
| CDI | 226 | 263 |
| CLI | 29 | 8 |
| - Múltiples | 17 | 3 |
| - Bilaterales | 1 | 0 |
| CID | 35 | 29 |
| Tamaño anatomopatológico (media±DEmm) | 16,9±13,51 | 22,34±15,31 |
CDI: carcinoma ductal infiltrante; CID: carcinoma intraductal; CLI: carcinoma lobulillar infiltrante; DE: desviación estándar.
Las técnicas de cirugía oncoplástica se realizaron en los casos de tumores en los que, por su localización, tamaño o multiplicidad, no era posible conservar la mama con las técnicas convencionales, sobre todo en aquellos casos de tumores grandes, con localizaciones atípicas o múltiples. No obstante, la cirugía oncoplástica se decidió individualizadamente, ya que estuvo influida, entre otros factores, por el tamaño de la mama y la preferencia de la paciente. En la serie 2 no se llevó a cabo este tipo de intervención, ya que en esos años no estaba instaurada en nuestro centro.
La RM de mama preoperatoria llevada a cabo en las pacientes de la serie 1 se hizo en un equipo de 1,5T (Symphony, Siemens, Erlangen, Alemania) con secuencias T2 STIR en el plano axial (TR 5600ms; TE 59ms, y grosor de corte de 2mm) y eco de gradiente potenciada en T1 en el plano coronal con saturación grasa (TR 4,93ms; TE 1,53ms; grosor de corte de 1,5mm; matriz 512×512; FOV de 340; 96 cortes por bloque, y banda de frecuencia de 320Hz/píxel). Se realizó una adquisición sin contraste, y 5 tras la administración intravenosa de 0,15mmol/kg de gadolinio (Magnevist®, Bayer, Alemania). El tiempo total de adquisición del estudio dinámico fue de 6,55 minutos.
Todas las lesiones detectadas en RM se clasificaron según las categorías BI-RADS. Las lesiones adicionales detectadas con la RM fueron estudiadas mediante ecografía dirigida (second-look) con un equipo dedicado (MyLab™ 60, Esaote, Florencia, Italia) y un transductor de multifrecuencia (7,5-13MHz). Se biopsiaron todas las lesiones visibles ecográficamente que habían sido clasificadas como categorías BI-RADS 3, 4 y 5 en la RM. Como no disponíamos de biopsia guiada por RM, las lesiones detectadas con RM pero no visibles en el second-look ecográfico se incluyeron dentro de la misma pieza quirúrgica si estaban próximas (a menos de 20mm), o fueron sometidas a controles evolutivos si estaban alejadas.
En las 2 series se realizó una biopsia intraoperatoria de la pieza quirúrgica en los casos de carcinomas infiltrantes, para disminuir el riesgo de márgenes afectos tras la intervención. En el caso de los tumores intraductales, durante la intervención quirúrgica se hizo una radiografía de la pieza, pero sin biopsia intraoperatoria.
Los parámetros evaluados en ambas series fueron la edad y el estado menopáusico (parámetros clínicos); el tamaño tumoral anatomopatológico, así como la multifocalidad, multicentricidad o bilateralidad (estadificación) en toda la serie de casos, especialmente en los carcinomas lobulillares infiltrantes (CLI); y, por último, el tratamiento quirúrgico, que consistió en tumorectomía, técnicas de cirugía oncoplástica, mastectomía o cirugía bilateral, la administración de quimioterapia neoadyuvante y la tasa de reintervenciones por márgenes afectos.
Los datos recogidos fueron analizados mediante el programa SPSS para Windows™ versión 15.0 (Chicago IL, EE. UU.). La distribución de las medias fue considerada normal ya que cuando el tamaño muestral es suficientemente grande (n>30), se asume normalidad a pesar de que la distribución de partida no sea normal (teorema del límite central). Se aplicó la prueba t de Student para la comparación de variables cuantitativas, como la edad y el tamaño anatomopatológico, y la prueba de Chi-cuadrado de Pearson para las variables cualitativas, considerando como valor estadísticamente significativo una p<0,05.
ResultadosParámetros clínicosNo se observaron diferencias estadísticamente significativas en la edad de las pacientes entre ambos grupos (p=0,717) ni en el estatus menopáusico (p=0,414).
Parámetros de estadificaciónLa media del tamaño tumoral anatomopatológico en la serie 1 (16,9 ± 13,51mm) fue significativamente menor que la de la serie 2 (22,34 ± 15,31mm) (p<0,001).
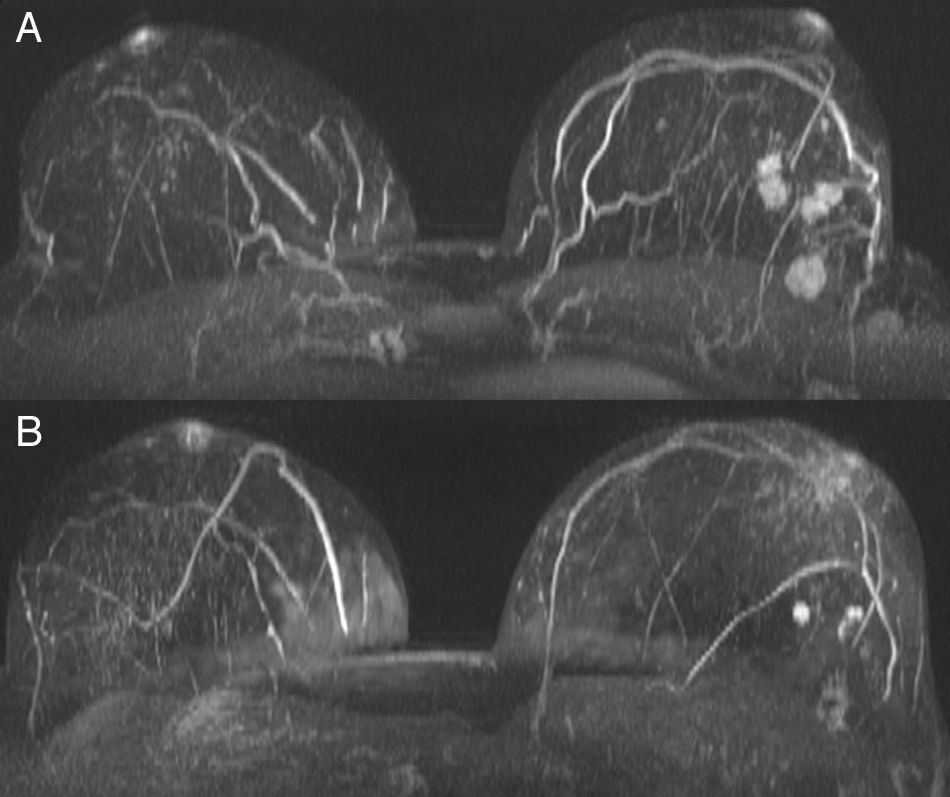
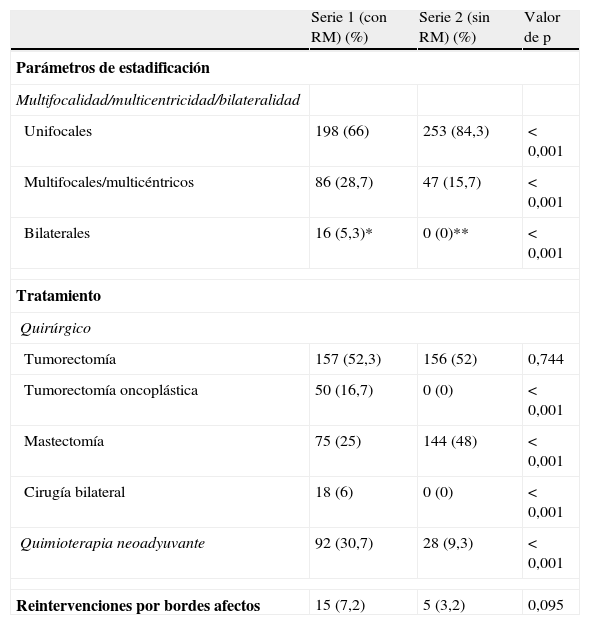
Las diferencias entre grupos también fueron estadísticamente significativas para la unifocalidad, multiplicidad (multifocales/multicéntricos) o bilateralidad (p<0,001). En la serie 1 hubo una mayor proporción de tumores múltiples (fig. 1), con un total de 86 pacientes (28,7%), frente a los 47 (15,7%) de la serie 2 (tabla 2). Se diagnosticaron tumores bilaterales únicamente en la serie 1 (16 casos, 5,3%). Sin embargo, 2 pacientes de la serie 2 desarrollaron un tumor contralateral durante el año siguiente a la cirugía, y otras 4 en un período menor a 5 años, de manera que un total de 6 pacientes (3%) desarrollaron un cáncer contralateral en menos de 10 años. Revisando concretamente los CLI en ambas series (39 casos), 20 (51,3%) resultaron ser tumores múltiples y 1 (2,6%) bilateral.
Tumor de mama multifocal localizado en el cuadrante supero-externo de la mama izquierda a) antes y b) después de la administración de quimioterapia neoadyuvante. Se realizó cirugía conservadora con las técnicas de cirugía oncoplástica. Reconstrucción en proyección de máxima intensidad axial; TR=4,93ms, TE=1,53ms.
Parámetros analizados
| Serie 1 (con RM) (%) | Serie 2 (sin RM) (%) | Valor de p | |
| Parámetros de estadificación | |||
| Multifocalidad/multicentricidad/bilateralidad | |||
| Unifocales | 198 (66) | 253 (84,3) | <0,001 |
| Multifocales/multicéntricos | 86 (28,7) | 47 (15,7) | <0,001 |
| Bilaterales | 16 (5,3)* | 0 (0)** | <0,001 |
| Tratamiento | |||
| Quirúrgico | |||
| Tumorectomía | 157 (52,3) | 156 (52) | 0,744 |
| Tumorectomía oncoplástica | 50 (16,7) | 0 (0) | <0,001 |
| Mastectomía | 75 (25) | 144 (48) | <0,001 |
| Cirugía bilateral | 18 (6) | 0 (0) | <0,001 |
| Quimioterapia neoadyuvante | 92 (30,7) | 28 (9,3) | <0,001 |
| Reintervenciones por bordes afectos | 15 (7,2) | 5 (3,2) | 0,095 |
* Una de estas pacientes presentó un carcinoma ductal infiltrante de 8 mm en el mismo acto quirúrgico del tumor principal en la mama contralateral, al efectuarse la simetrización mamaria (falso negativo del second-look ecográfico post-RM).
** Desarrollaron posteriormente un tumor contralateral 2 pacientes en el tiempo de 1 año posterior a la cirugía y 4 en un periodo menor a 5 años.
En la serie 1 se hicieron un total de 50 intervenciones oncoplásticas (16,7%) y 18 bilaterales (6%), frente a ninguna en la serie 2 (tabla 2). Por otro lado, las mastectomías en la serie 1 (75 casos, 25%) fueron significativamente menos que en la 2 (144 mastectomías, 48%) (p<0,001). Dos de las intervenciones bilaterales fueron electivas debido a que las pacientes tenían un tumor unilateral pero, al ser de alto riesgo, decidieron someterse a una cirugía bilateral.
La RM modificó el tratamiento en 91 pacientes (30,3%). En 89 pacientes (97,8%) la intervención fue mayor de la inicialmente planificada y menor en 2 (2,1%). En 68 de las 89 pacientes se pasó de una cirugía conservadora a una cirugía oncoplástica o mastectomía, y en 14, de una cirugía unilateral a una bilateral. En las 2 pacientes en las que debido a la RM se realizó una cirugía menor, se pasó de una mastectomía a una cirugía oncoplástica. El cambio del tratamiento debido a la RM fue erróneo en 4 de las 91 pacientes (4,4%) debido a falsos positivos de la RM. Solo encontramos un caso falso negativo del second-look ecográfico en las 10 pacientes en las que se vieron lesiones adicionales en la RM y la ecografía no fue capaz de detectarlas posteriormente. En este caso no hubo retraso diagnóstico, ya que el tumor se descubrió al realizar una simetrización de la mama contralateral en el mismo acto quirúrgico.
La quimioterapia neoadyuvante se empleó significativamente más en las pacientes de la serie 1 (92 casos, 30,7%) que en las de la serie 2 (28 pacientes, 9,3%) (p<0,001).
Por último, las diferencias no fueron significativas, aunque sí mostraron una tendencia a la significación (p=0,095), en el número de reintervenciones por márgenes afectos, con una tasa de 7,2% en la serie estadificada con RM frente al 3,2% de la estadificada con las técnicas convencionales.
DiscusiónEn este estudio hemos demostrado que el empleo de la RM conjuntamente con técnicas de cirugía oncoplástica y un mayor uso de la quimioterapia neoadyuvante ha llevado a un descenso de las mastectomías sin un aumento significativo del número de reintervenciones por márgenes afectos, a pesar de haber detectado un mayor número de tumores múltiples.
En nuestro estudio, el tamaño tumoral anatomopatológico fue significativamente menor en la serie estadificada con RM, a pesar de que el tamaño medido por RM en esta serie (29,3 ± 20,86mm) era mayor que el de la otra serie (24,3 ± 16,64mm). La diferencia de tamaño anatomopatológico puede deberse principalmente a que en la serie 1 se administró quimioterapia neoadyuvante en un mayor porcentaje de pacientes (30,7%) que en la serie 2 (9,3%). Este menor tamaño puede haber influido en la disminución de la tasa de mastectomías.
La RM de mama está considerada la técnica más sensible para detectar el cáncer infiltrante23, y puede ser de utilidad en las mujeres jóvenes con mamas densas24. La RM es capaz de detectar un mayor número de tumores múltiples (multifocalidad y multicentricidad) que las técnicas convencionales8. Ello implica que el planteamiento quirúrgico inicial deriva hacia una intervención más amplia hasta en un 30% de las pacientes estadificadas con las técnicas convencionales3,20,21. La RM puede detectar lesiones adicionales hasta en el 34% de los pacientes25,26. En nuestro estudio, la RM detectó un porcentaje mayor de tumores múltiples (28,7 vs 15,7% en la serie sin RM), y modificó la actuación quirúrgica en el 30,3% de las pacientes, aumentando casi siempre (97,8% de los casos) el grado de la intervención inicialmente planificada. El cambio del tratamiento debido a la RM fue erróneo en 4 de las 91 pacientes (4,4%). En estas 4 pacientes el cambio incorrecto del tratamiento fue debido a falsos positivos de la RM, bien porque detectó lesiones adicionales que finalmente resultaron benignas (se hizo una cirugía más amplia, pero no mastectomía), bien porque sobreestimó el tamaño.
Se estima que la probabilidad de desarrollar tumores sincrónicos bilaterales es de al menos el 2-3% en las pacientes diagnosticadas de cáncer de mama. Estos tumores pasan inadvertidos en la mamografía en el 75% de los casos7. La RM es capaz de detectarlos en el 3-9% de las pacientes diagnosticadas de un cáncer de mama3,7,20. Algunos estudios han demostrado que el subtipo histológico de CLI y la edad menor de 55 años aumentan el riesgo de aparición de tumores bilaterales27. Por tanto, puede ser recomendable hacer una RM preoperatoria a toda paciente diagnosticada de cáncer de mama y, especialmente, a pacientes jóvenes, con mamas densas o con diagnóstico histológico de CLI8. En nuestro estudio, se detectaron tumores sincrónicos bilaterales en el 5,3% de las pacientes estadificadas con RM y ninguno cuando se estadificaron solo con las técnicas convencionales. Sin embargo, 6 pacientes de esta serie desarrollaron posteriormente un cáncer en la mama contralateral, de modo que el 3% de las pacientes de esta serie desarrolló un cáncer de mama contralateral en un período menor a 10 años. En esta cuestión de la multiplicidad/multicentricidad y bilateralidad, hay que destacar que de los 39 casos de CLI, 20 (51,3%) eran tumores múltiples y 1 (2,6%) bilateral. Uno de los inconvenientes de la RM es que su especificidad no es muy alta, y detecta tanto lesiones benignas como malignas2,5. De hecho, aproximadamente un 20% de las lesiones adicionales detectadas por esta técnica son benignas11,25. Por esto, tras la RM es importante realizar un estudio de second-look ecográfico y revisar el estudio mamográfico dirigido a las lesiones adicionales. Ante la más mínima sospecha de malignidad, debe realizarse una biopsia guiada por ecografía, estereotaxia o por RM si el estudio ecográfico y mamográfico resultaran negativos25. Según algunos autores, entre el 10-14% de las lesiones adicionales detectadas por RM sin traducción en el second-look ecográfico son finalmente malignas1,28–31. En nuestro estudio, se diagnosticó un falso negativo del second-look ecográfico de entre 10 casos que no tuvieron traducción ecográfica. Se realizó second-look ecográfico a todas aquellas mujeres en las que la RM había puesto de manifiesto nuevos realces sospechosos que no habían sido previamente detectados mediante las técnicas convencionales, cambiando el tratamiento a realizar en el 30,3% de las pacientes. Todas estas lesiones fueron buscadas con una ecografía dirigida tras revisar las mamografías, y biopsiadas mediante guía ecográfica cuando eran visibles. Si no lo eran, se resecaron si estaban próximas al tumor principal, o se recomendó el seguimiento en el caso de que estuvieran alejadas porque no disponíamos de biopsia guiada por RM. Es muy importante realizar una biopsia de estas lesiones detectadas en la RM prequirúrgica, para evitar cirugías mayores por sobreestimación de lesiones2.
En relación con el tratamiento realizado, uno de los objetivos de la estadificación prequirúrgica es el de ajustar lo más posible el tamaño de la resección al del tumor. Las técnicas de cirugía oncoplástica son útiles para extirpar tumores grandes con localizaciones atípicas o múltiples en una sola pieza quirúrgica, lo que reduce el número de mastectomías. La RM es una técnica precisa para medir el tamaño tumoral2,12,21,29,30. Las técnicas convencionales tienden a infraestimarlo, sobre todo en aquellos de más de 2cm32. La infraestimación puede suponer una resección incompleta de la enfermedad y, con ello, un aumento de la tasa de reintervenciones por márgenes afectos o más recidivas tempranas33–35. Por el contrario, otros estudios han mostrado que la RM sobreestima el tamaño tumoral en el 2-39% de los tumores infiltrantes4,31.
Hay una cierta controversia en la bibliografía respecto al empleo de la RM preoperatoria, ya que puede aumentar el número de mastectomías. El uso de la RM preoperatoria es recomendado por una serie de estudios, mientras que otros lo rechazan3,9,15,16,18,19,22,36. Por otro lado, un ensayo clínico reciente (COMICE trial) ha evaluado la eficacia clínica de la RM, y no ha encontrado diferencias estadísticamente significativas entre la tasa de reintervenciones por recidivas locales en las pacientes estadificadas únicamente con las técnicas convencionales y aquellas estadificadas además con RM37. En nuestro estudio, el número de mastectomías fue significativamente menor en la serie de pacientes estadificadas con la RM (25%) que en la de pacientes estadificadas con las técnicas convencionales (48%). Por tanto, al ser la RM la técnica más sensible para la estadificación prequirúrgica, planteamos que pueda ser recomendable utilizarla en aquellas pacientes que van a ser sometidas a cirugía conservadora, para planificar adecuadamente la intervención quirúrgica y evitar recurrencias locales. Varios estudios han demostrado que, en determinados casos, hay que reintervenir por afectación de márgenes hasta a un tercio de las pacientes sometidas a cirugía conservadora38.
En nuestro estudio, a pesar de que aumentó la cirugía conservadora en la serie 1, no hemos observado diferencias estadísticamente significativas en la tasa de reintervenciones por márgenes afectos entre ambas series (7,2% en la serie 1 vs 3,2% en la 2), aunque existe una tendencia a la significación (p=0,095). Este porcentaje es claramente inferior en comparación con lo descrito en la bibliografía38,39. Estos resultados pueden estar favorecidos por la realización de biopsia intraoperatoria de los tumores infiltrantes y la radiografía intraoperatoria en los casos de tumores con microcalcificaciones40.
Nuestro estudio tiene varias limitaciones. En primer lugar, es un estudio retrospectivo y, por tanto, está sujeto a más sesgos. En segundo lugar, los tamaños tumorales anatomopatológicos y radiológicos en ambas series son diferentes, con tamaños tumorales anatomopatológicos mayores en la serie 2, en la cual se realizaron finalmente un número mayor de mastectomías, y tamaños radiológicos mayores en la serie 1, lo que justifica un mayor uso de la quimioterapia neoadyuvante en esta serie. En tercer lugar, el tipo de cirugía realizada en ambas series fue diferente. En la serie estadificada con RM se realizaron no solo tumorectomías convencionales y mastectomías, sino también técnicas de cirugía oncoplástica y cirugías bilaterales. Sin embargo, en la serie estadificada con las técnicas convencionales las intervenciones consistieron únicamente en tumorectomías convencionales y mastectomías. Por tanto, el número de mastectomías tan llamativo en esta serie (49%) pudo ser debido en parte a que no se llevaron a cabo las técnicas de cirugía oncoplástica, o a que se administró quimioterapia neoadyuvante en un porcentaje mucho menor de pacientes que en la serie 1 (9,3 vs 30,7%).
En conclusión, en nuestro estudio se demuestra un descenso del número total de mastectomías en la serie estadificada con las técnicas convencionales junto con la RM preoperatoria, aún habiéndose diagnosticado un mayor porcentaje de tumores multifocales y multicéntricos en esta serie. El empleo de técnicas de cirugía oncoplástica y los tratamientos de quimioterapia neoadyuvante han tenido un papel determinante en esta reducción del número de mastectomías. A pesar del incremento del número de las cirugías conservadoras realizadas, no observamos diferencias significativas en el número de reintervenciones por márgenes afectos aunque sí existe una tendencia a la significación. Por tanto, recomendamos el uso de la RM preoperatoria para la estadificación prequirúrgica del cáncer de mama, aunque serán necesarios nuevos estudios, ya sean prospectivos o retrospectivos para reforzar esta conclusión.
Autorías- 1.
Responsable de la integridad del estudio: L. Pina y A. García-Lallana.
- 2.
Concepción del estudio: L. Pina, F. Martínez-Regueira, N. Rodríguez-Spiteri y A. García-Lallana.
- 3.
Diseño del estudio: L. Pina, A. Elizalde y A. García-Lallana.
- 4.
Obtención de los datos: A. García-Lallana.
- 5.
Análisis e interpretación de los datos: I. Antón.
- 6.
Tratamiento estadístico: I. Antón.
- 7.
Búsqueda bibliográfica: R. Saiz-Mendiguren y A. García-Lallana.
- 8.
Redacción del trabajo: L. Pina y A. García-Lallana.
- 9.
Revisión crítica del manuscrito con aportaciones intelectualmente relevantes: L. Pina, A. García-Lallana, I. Antón y R. Saiz-Mendiguren.
- 10.
Aprobación de la versión final: L. Pina, A. García-Lallana, I. Antón, R. Saiz-Mendiguren, A. Elizalde, F. Martínez-Regueira y N. Rodríguez-Spiteri.
Los autores declaran no tener ningún conflicto de intereses.