Editado por: Dr. Tomás Ripollés González - Servicio de Radiodiagnóstico, Hospital Universitari Doctor Peset, València, España
Más datosLas técnicas de imagen desempeñan un papel fundamental en el diagnóstico inicial y seguimiento de la enfermedad inflamatoria intestinal. La ecografía intestinal tiene alta sensibilidad y especificidad en la sospecha de la enfermedad de Crohn, en la detección de actividad inflamatoria y permite el diagnóstico temprano de complicaciones intraabdominales, como estenosis, fístulas y abscesos; además, ha demostrado su utilidad en la monitorización del tratamiento y en la recurrencia posquirúrgica. El desarrollo técnico de los equipos de ecografía, la incorporación de avances tecnológicos como el contraste ecográfico o la elastografía y, sobre todo, una mayor experiencia, han impulsado su papel en la evaluación de la patología del tubo digestivo. La ecografía es particularmente atractiva gracias a su amplia disponibilidad, su inocuidad, bajo coste y buena reproducibilidad, ya que puede repetirse de forma fácil y bien tolerada por el paciente durante el seguimiento. Esta revisión resume el papel de la ecografía intestinal en la detección y seguimiento de pacientes con enfermedad inflamatoria intestinal.
Imaging techniques play a fundamental role in the initial diagnosis and follow-up of inflammatory bowel disease. Intestinal ultrasound has high sensitivity and specificity in patients with suspected Crohn's disease and in the detection of inflammatory activity. This technique enables the early diagnosis of intra-abdominal complications such as stenosis, fistulas, and abscesses. It has also proven useful in monitoring the response to treatment and in detecting postsurgical recurrence. Technical improvements in ultrasound scanners, technological advances such as ultrasound contrast agents and elastography, and above all increased experience have increased the role of ultrasound in the evaluation of the gastrointestinal tract. The features that make ultrasound especially attractive include its wide availability, its noninvasiveness and lack of ionizing radiation, its low cost, and its good reproducibility, which is important because it is easy to repeat the study and the study is well tolerated during follow-up. This review summarizes the role of intestinal ultrasound in the detection and follow-up of inflammatory bowel disease.
El término enfermedad inflamatoria intestinal (EII) incluye la enfermedad de Crohn (EC) y la colitis ulcerosa (CU), procesos cuya principal característica es la cronicidad y presentar un curso clínico en brotes. La EII alcanza su punto máximo de incidencia en la segunda y tercera década de la vida, pero puede ocurrir a cualquier edad1 y aproximadamente un 10% de los casos se diagnostican de colitis indeterminada porque comparten características de las dos entidades.
La CU se caracteriza porque la enfermedad se limita a la capa mucosa del colon de forma continua y regular, desde el recto, en sentido proximal con una extensión variable. Sin embargo, la inflamación es transmural y segmentaria en la EC, alternando tramos intestinales sanos y patológicos. Aunque la enfermedad puede localizarse en cualquier tramo del tubo digestivo, el íleon terminal es la localización más frecuente y se encuentra afectado hasta en un 70% de los pacientes2.
La colonoscopia es la prueba de referencia en el caso de la CU, pero para pacientes con EC tan solo permite valorar la actividad inflamatoria y la extensión de la enfermedad en el colon y los últimos centímetros del íleon terminal y, además, no valora adecuadamente las complicaciones transmurales. Está descrito que hasta en un 20% de los casos la colonoscopia es incompleta, debido a la gravedad de la enfermedad o a la presencia de estenosis, o bien porque se extiende a segmentos inaccesibles situados proximalmente al íleon terminal1.
El objetivo de este artículo es proporcionar una descripción general extensa del papel real de la ecografía intestinal para la detección de la EII y sus complicaciones, analizando su uso en la monitorización de pacientes con EII.
Ecografía en la enfermedad de CrohnComo hemos comentado, la EC es una enfermedad transmural y la endoscopia no la valora adecuadamente dado que tan solo permite la visualización de la mucosa. Por este motivo, se recomienda la realización de una técnica seccional de imagen que complemente la colonoscopia1. Aunque la ecografía, la tomografía computarizada (TC) y la resonancia magnética (RM) no detectan lesiones sutiles de la mucosa, pueden evaluar adecuadamente la afectación transmural, la extensión extraparietal de la enfermedad y la presencia de complicaciones. Por estas razones, estas técnicas han asumido una posición central en el diagnóstico y control de pacientes con EC3. De esta manera, diversas revisiones sistemáticas, metaanálisis y las últimas guías de consenso de la European Crohn's and Colitis Organisation (ECCO) y la European Society of Gastrointestinal and Abdominal Radiology (ESGAR) han demostrado que las tres técnicas seccionales tienen una precisión diagnóstica comparable para la evaluación inicial de la EC, la valoración de la gravedad y la actividad de la enfermedad, así como para la detección de sus principales complicaciones: estenosis, fístulas y abscesos3–5.
La EC es una enfermedad inflamatoria crónica caracterizada por cursar en forma de brotes, alternando períodos de recaída y remisión. La enfermedad tiene una amplia gama de manifestaciones clínicas, de las cuales el dolor abdominal y la diarrea son las más frecuentes3,6. Dada la naturaleza recurrente de la enfermedad, para asegurar un manejo óptimo es recomendable la reevaluación frecuente. Además, una proporción significativa de pacientes son diagnosticados a temprana edad, con una incidencia máxima entre los 15 y 25 años7. La necesidad de una evaluación repetida con técnicas de imagen junto con la prevalencia en pacientes jóvenes hace que sea necesario el uso de técnicas seccionales libres de radiación, por lo que la RM y la ecografía se han propuesto como las dos técnicas de referencia en la práctica clínica diaria. Ambas se han utilizado en los últimos años y han demostrado tener similar rentabilidad diagnóstica y ser adecuadas en el manejo del paciente con EC, y cada una de ellas puede ser usada en diferentes momentos de la enfermedad3.
La descripción de la técnica ecográfica y la semiología de los hallazgos ecográficos se describen en detalle en un artículo publicado previamente8.
Ventajas y limitacionesLa ecografía tiene varias ventajas sobre la RM y la TC, ya que no utiliza radiación ionizante, es barata y accesible, muy bien tolerada por los pacientes, no necesita una preparación oral específica y además tiene el potencial de una mayor resolución espacial (con el uso de transductores de alta frecuencia). La excelente tolerancia de la ecografía permite repetirla las veces que sea necesario, lo cual es especialmente importante en la monitorización del tratamiento, ya que la probabilidad de conseguir el objetivo (curación mucosa) es mayor cuanto más se ajuste el tratamiento en función de los hallazgos de esos controles9.
Como en otras técnicas diagnósticas, el rendimiento de la ecografía es dependiente de operador y en sus resultados influye la calidad del ecógrafo, la experiencia del ecografista, las sondas empleadas y el hábito constitucional del paciente4,10–14. Sin embargo, en un estudio donde se evaluó la variabilidad interobservador de la ecografía intestinal se encontró un buen grado de acuerdo en la medida del grosor de la pared intestinal, del grado Doppler color, la presencia de adenopatías y en la detección de estenosis, factores importantes en el diagnóstico de la enfermedad y en la valoración de la actividad inflamatoria14.
Diagnóstico inicialLos resultados publicados muestran que la ecografía es una técnica precisa en la aproximación inicial de pacientes con síntomas intestinales sospechosos de EC. En las revisiones sistemáticas publicadas, la ecografía tiene una sensibilidad del 85-97% y una especificidad del 83-97% para el diagnóstico de EC4,5,15–18. Estos resultados son similares a los obtenidos en los metaanálisis realizados de RM. Además, los estudios que han comparado ambas técnicas, en su mayoría han mostrado un rendimiento similar11,19,20, aunque en el estudio METRIC, que es el metodológicamente más adecuado21, la RM se mostró un 10% superior a la ecografía en determinar la extensión en el intestino delgado. Debido a su alto valor predictivo negativo, la ecografía podría aceptarse como una herramienta de primera línea para diagnosticar o excluir la EC del intestino delgado en pacientes adultos y en niños (fig. 1). En particular, podría ser la técnica de imagen preferida en los niños donde otros procedimientos de imagen son a veces más complejos de realizar. Por otra parte, la ecografía junto con la ileocolonoscopia es la estrategia que ha demostrado mayor rentabilidad diagnóstica y menor coste en la sospecha de EC22.
El diagnóstico de EC se basa principalmente en la medición del grosor de la pared intestinal. Un grosor de 3mm o más debe usarse como valor de corte para la detección de la EC cuando se prefiere una alta sensibilidad, mientras un grosor igual o superior a 4mm se debe elegir si se prefiere una alta especificidad23.
La sensibilidad varía en función de la localización de la enfermedad, con valores más altos para áreas anatómicas de fácil acceso para la ecografía, como el íleon terminal y el colon izquierdo, mientras que la precisión es menor para el recto, los tramos de intestino proximales (yeyuno) o los localizados en la pelvis profunda4,19,21,24,25. La precisión diagnóstica también depende de la gravedad de la enfermedad, que es mayor cuanto más graves son las lesiones inflamatorias.
Las guías de la ECCO/ESGAR respaldan el uso de la ecografía intestinal y la RM para el estudio de extensión y localización3. La RM muestra mejor concordancia con los hallazgos quirúrgicos en la valoración de la longitud del segmento afectado, subestimando la ecografía la extensión, especialmente cuando el segmento es muy largo12.
Hallazgos ecográficos fundamentalesLa ecografía se puede utilizar para demostrar los hallazgos patológicos y complicaciones de la EC y contribuye a clasificar a cada paciente en uno de los tres subtipos evolutivos (inflamatorio, fistulizante o estenosante), lo que puede ayudar a guiar el tratamiento adecuado. Los hallazgos podemos separarlos en murales, extramurales y complicaciones transmurales.
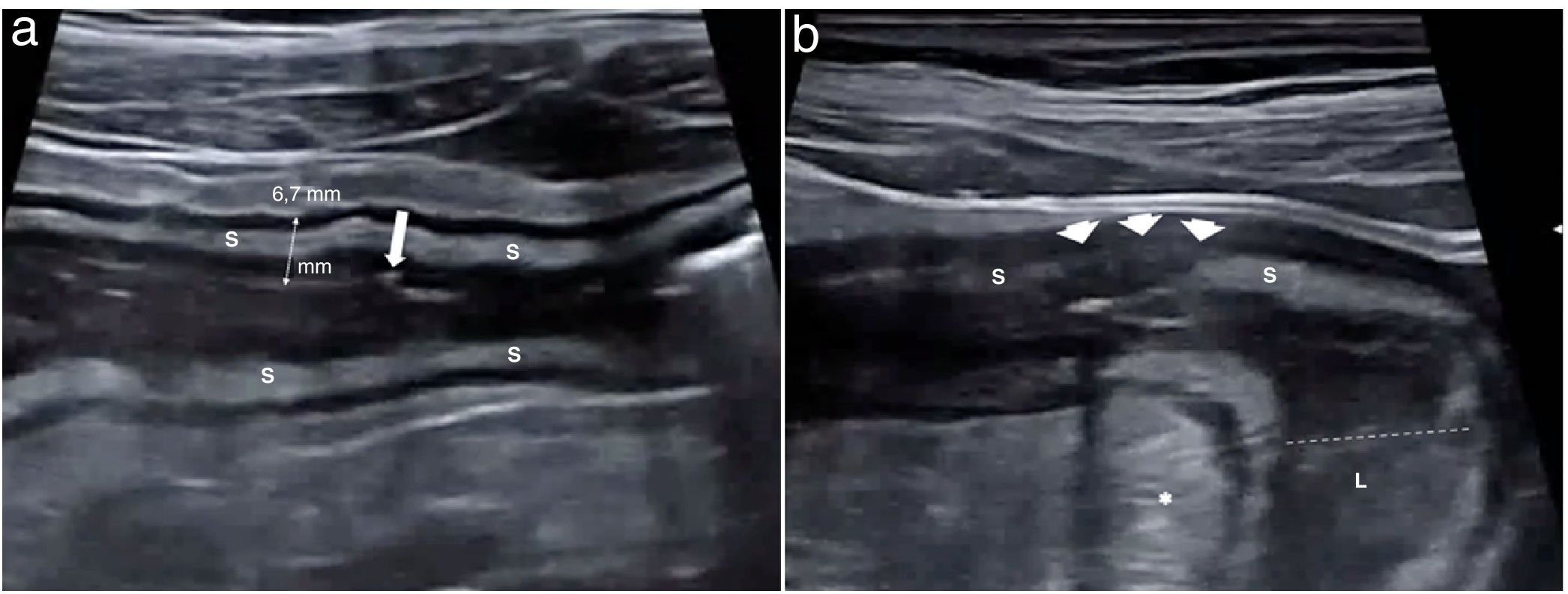
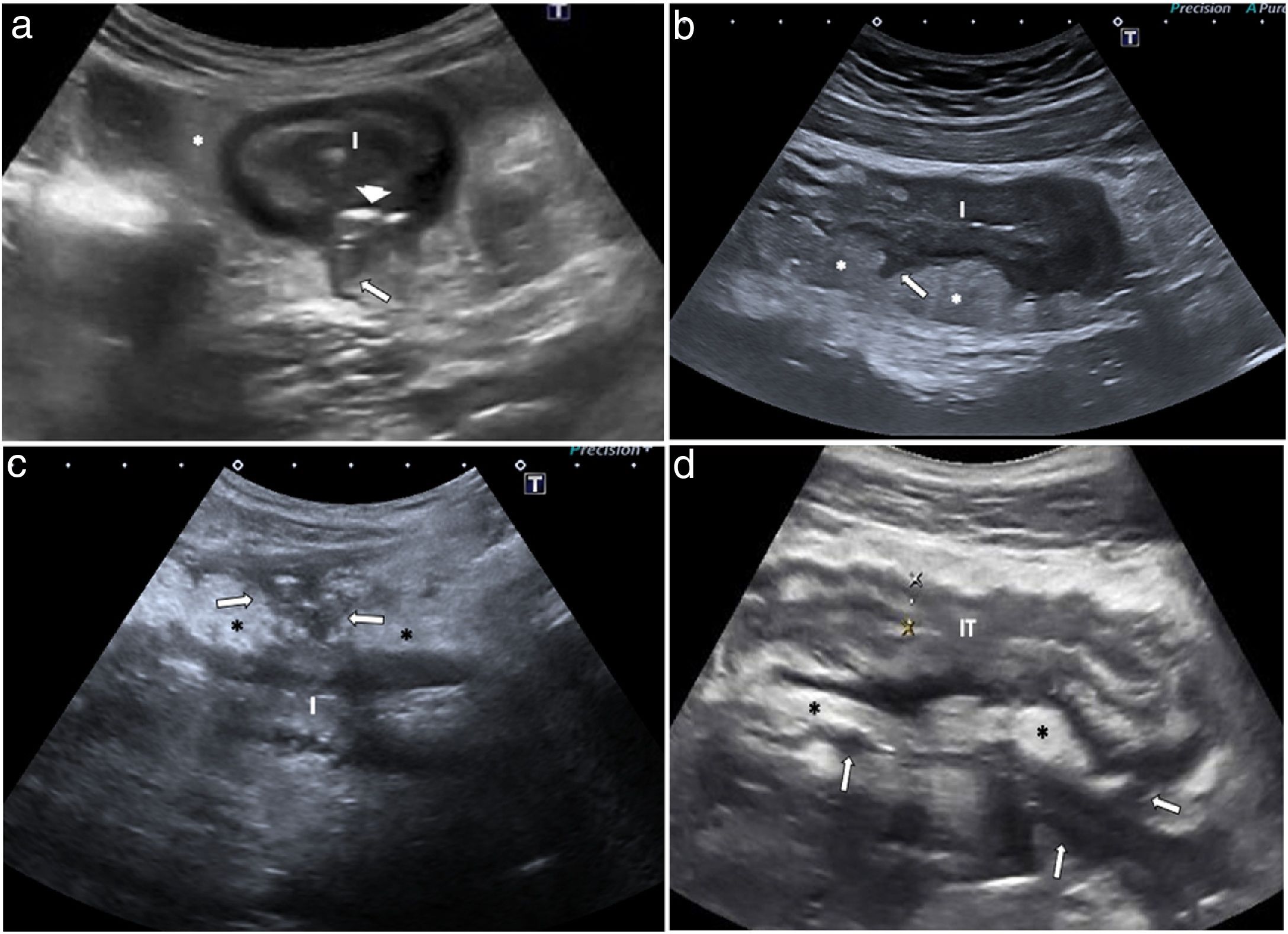
Hallazgos muralesEngrosamiento parietalEl grosor parietal es el parámetro ecográfico más sólido para el diagnóstico y la evaluación de la actividad de la enfermedad, hallazgo que además presenta un acuerdo interobservador alto14,24. Se debe medir preferentemente en la pared anterior del asa, siguiendo un corte longitudinal, evitando pliegues mucosos (fig. 2 a). El engrosamiento mural en la EC es generalmente moderado, acompañado de rigidez del asa afectada y disminución o ausencia de peristaltismo. El grosor de la pared intestinal de pacientes con enfermedad activa es significativamente mayor que el grosor de los que tienen enfermedad inactiva25.
a) Enfermedad de Crohn ileal con engrosamiento de la pared de 6,7mm con conservación de la estructura de capas. La tercera capa o submucosa (S) es prominente. Se identifica una imagen ecogénica lineal en la muscularis mucosae (flecha) que corresponde a una úlcera superficial. b) Alteración de la ecoestructura de la pared. Segmento de íleon de un paciente con EC con marcada actividad inflamatoria. Se observa una alteración focal de la estructura en capas, con submucosa hipoecoica (S) interrumpida de forma abrupta (puntas de flecha). Algunos estudios han demostrado correlación de este hallazgo con la presencia de úlceras profundas en la endoscopia o pieza quirúrgica. También se identifica proliferación fibrograsa (*) y dilatación de la luz proximal (línea de puntos) a la zona de mayor afectación (L), lo que indica la existencia de una estenosis.
En la EC sin complicaciones se conserva la apariencia estratificada. A veces, hay un aumento significativo del grosor de la submucosa ecogénica sobre las otras capas. La pérdida focal o extensa de la estratificación puede presentarse en casos de enfermedad aguda grave, posiblemente asociada a la presencia de ulceraciones que reflejaría una mayor actividad de la enfermedad (fig. 2 b). De hecho, se ha encontrado correlación entre la pérdida de estratificación y la actividad endoscópica de la enfermedad o con mayor riesgo de necesidad de cirugía26,27. Sin embargo, en ocasiones puede observarse en enfermedad quiescente muy avanzada, especialmente del colon izquierdo (fibrosis grave)12.
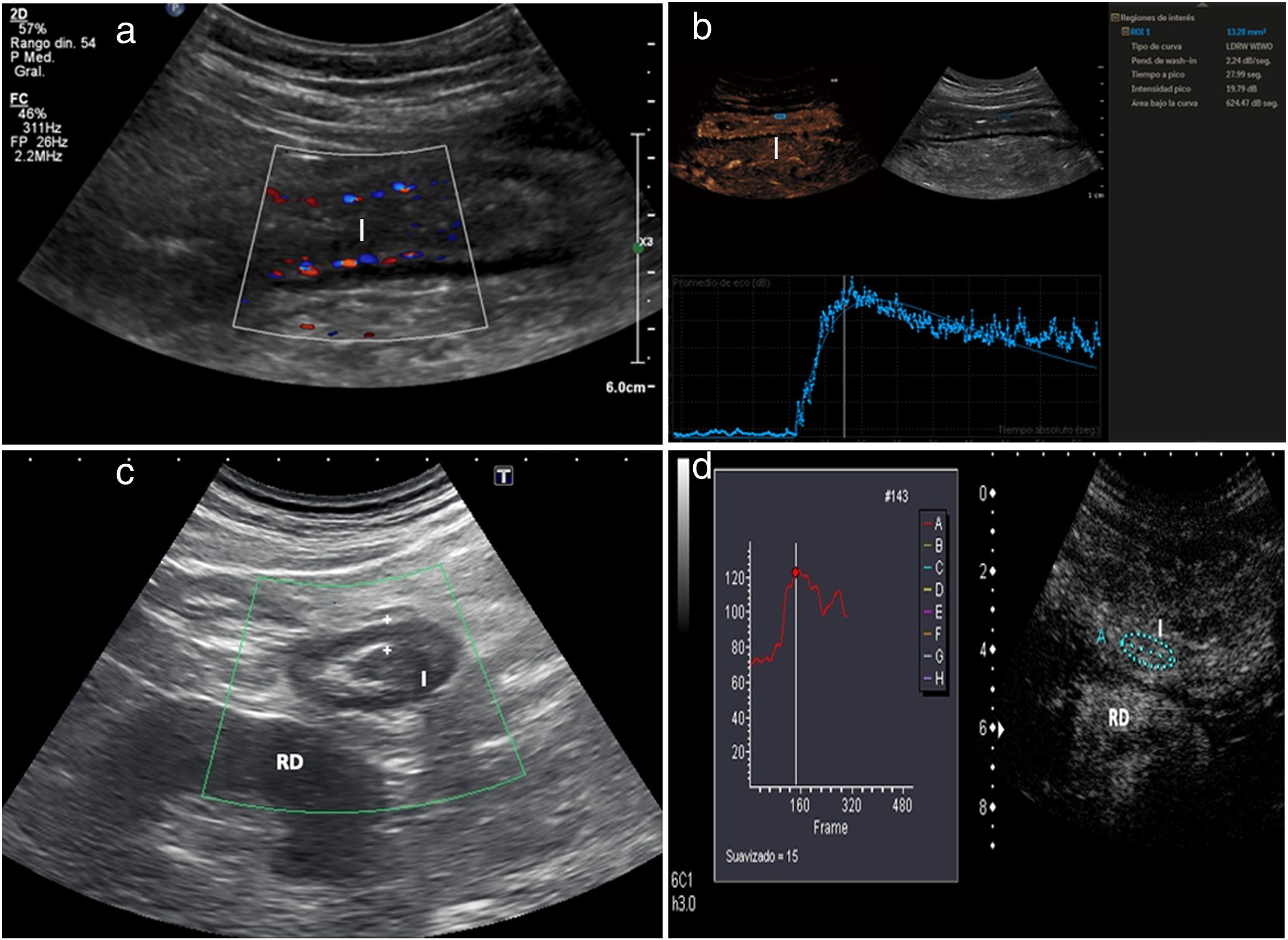
Hiperemia con Doppler colorLa hiperemia parietal detectada con la ecografía Doppler color es otro hallazgo de actividad inflamatoria8. La vascularización parietal aumentada (Doppler color de grado 2 o 3 de la escala de Limberg modificada) se correlaciona con la actividad histológica, endoscópica y clínica28–35. En una serie publicada recientemente, una hiperemia de grado 2-3 mostró una especificidad diagnóstica mayor del 90% para enfermedad endoscópica grave y un valor predictivo positivo del 97% para la presencia de úlceras en la endoscopia (fig. 3 a)31. Por otra parte, la persistencia de hiperemia parietal podría asociarse a mayor riesgo de brote de la enfermedad33.
a) Paciente con íleon engrosado (I) y abundante señal Doppler color mural (grado 2); estos hallazgos sugieren enfermedad activa. b) Tras inyección de contraste se aprecia realce de la pared del íleon (I) de predominio submucoso. ROI (region of interest) localizada en la pared posterior del asa. La curva tiempo-intensidad muestra un pico de intensidad de 19,79dB (una intensidad> 18dB se relaciona con enfermedad activa). El estudio con contraste sugiere enfermedad activa y está de acuerdo con el grosor y la interpretación del Doppler color. La colonoscopia mostró abundantes úlceras murales. c) Paciente con enfermedad de Crohn, previamente intervenido, con engrosamiento de la pared del íleon neoterminal (I) y ausencia de señal Doppler color (grado 0). La actividad ecográfica es indeterminada, porque el grosor sugiere enfermedad activa, pero el Doppler color no lo confirma. Riñón derecho (RD). d) Tras inyección de contraste ecográfico existe un intenso realce. La ROI está en la pared intestinal. La curva de tiempo-intensidad muestra un incremento del realce del 65% (un incremento> 46% se considera enfermedad activa). La colonoscopia mostró signos de recurrencia grave (Rutgeerts 3). Nota: las mediciones cuantitativas obtenidas con los paquetes de software de los diferentes ecógrafos comerciales no son intercambiables.
La ecografía con contraste o CEUS aumenta la sensibilidad del Doppler color en la detección del incremento de la vascularización parietal, superando sus limitaciones, incluso en la valoración de las asas intestinales profundas. Varios estudios han demostrado que el realce parietal es significativamente mejor que el grosor o el Doppler color en la valoración de la actividad de la enfermedad, utilizando la endoscopia como prueba de referencia25,31 (fig. 3 b). Es especialmente útil en pacientes con engrosamiento patológico de la pared en los que no hay hiperemia parietal en el estudio Doppler31. Diferentes estudios y metaanálisis han demostrado que tiene una alta precisión en la detección de actividad endoscópica, con una sensibilidad del 87-97% y una especificidad del 67-91% en la diferenciación entre actividad y remisión endoscópica16,17,25,31,36. Sin embargo, el uso de contraste tiene limitaciones en la práctica clínica habitual, y la principal es la heterogeneidad en las curvas de cuantificación entre los distintos equipos23. Por ejemplo, en unos equipos se considera enfermedad activa un incremento del pico de intensidad mayor del 46%25, mientras que en otros la actividad se mide mediante el pico de intensidad, más de 15dB indica actividad y más de 18dB, actividad moderada37.
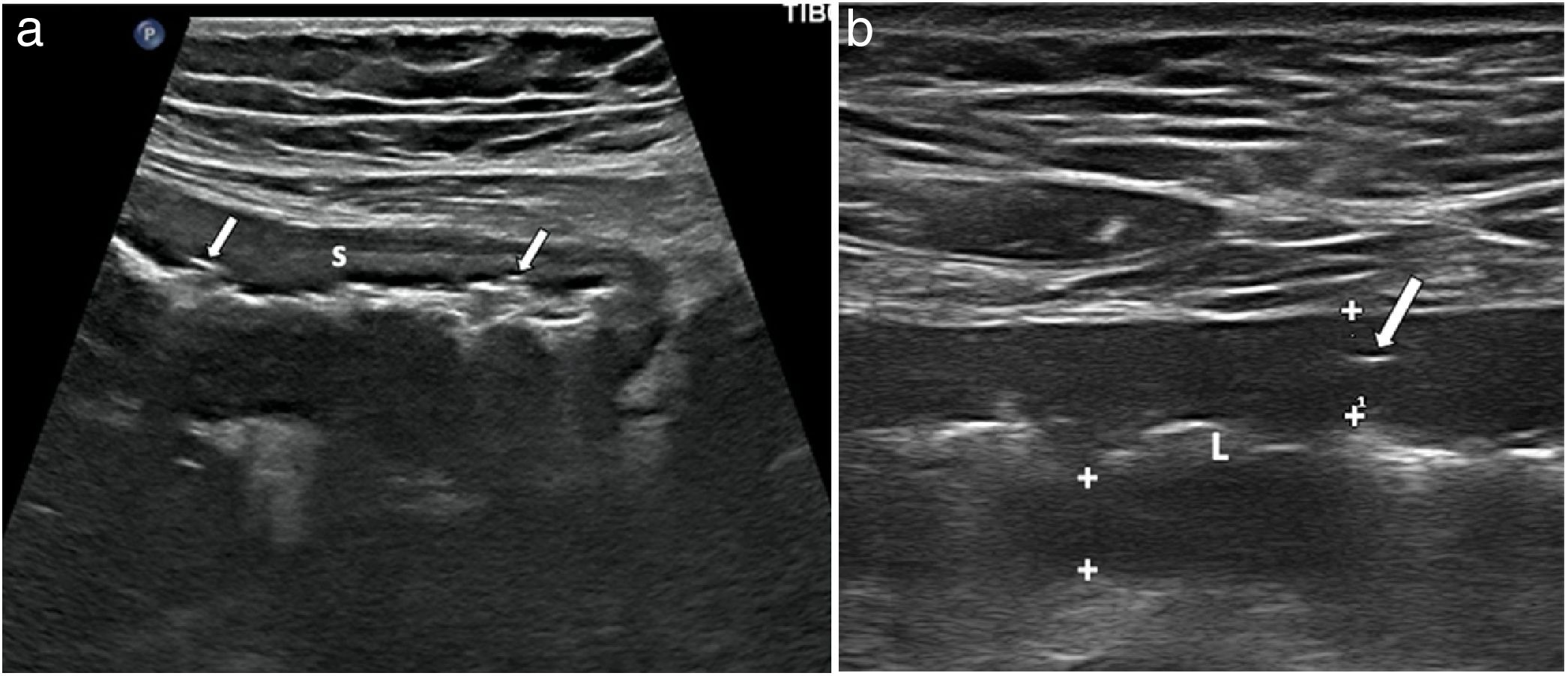
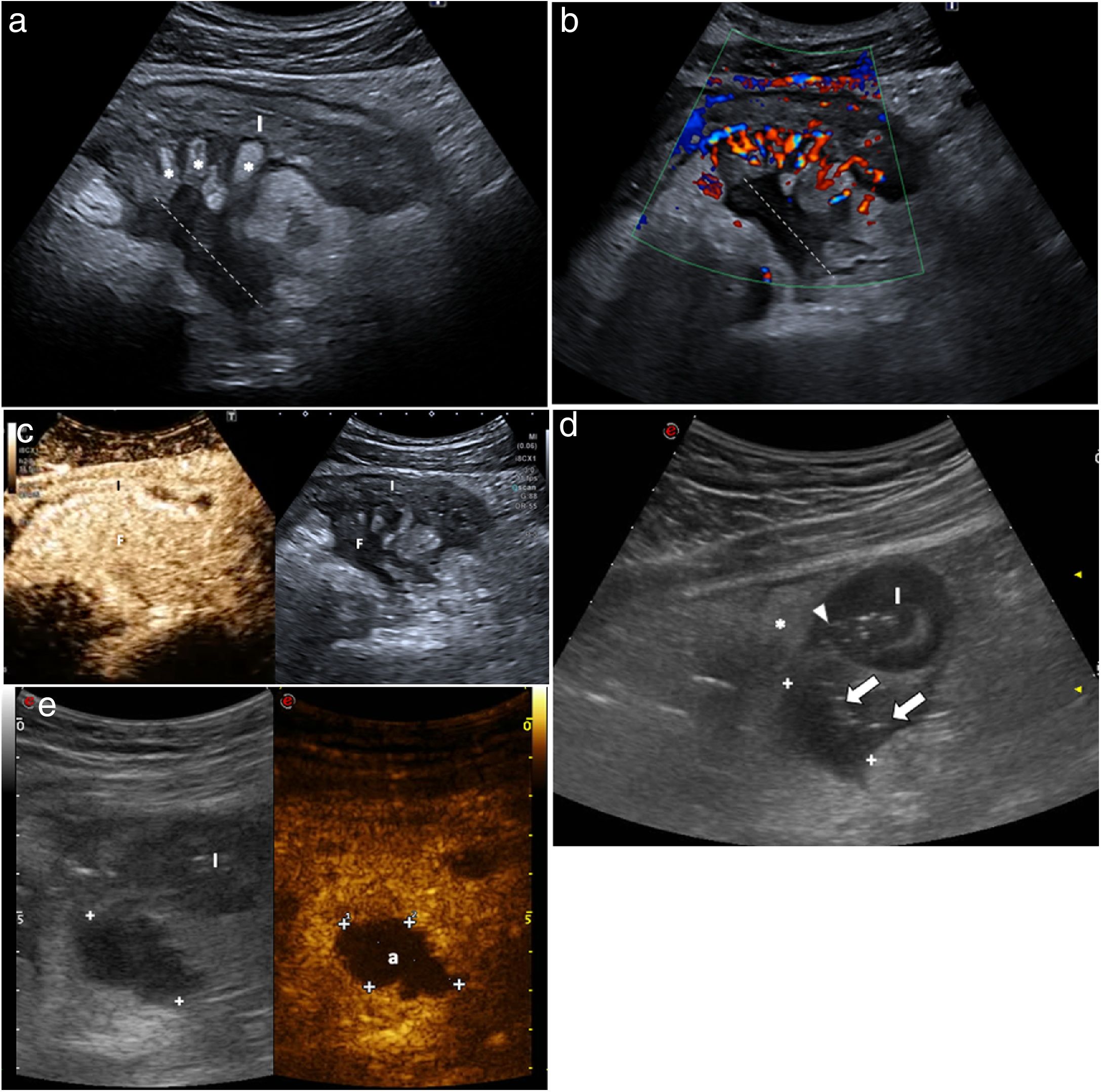
Úlceras muralesSe reconocen como irregularidades de la capa interna de la pared o como imágenes hiperecogénicas que profundizan en la pared en grado variable (fig. 4). La capacidad diagnóstica de la ecografía para la detección de úlceras podría ser incluso superior a la de la RM como demuestran dos series publicadas recientemente, que reflejan una precisión diagnóstica del 81-96%, comparándola con la combinación de colonoscopia y RM o con piezas quirúrgicas19,38.
a) Corte longitudinal de segmento de íleon terminal que muestra engrosamiento de la pared, sobre todo submucosa (S) e irregularidad en la superficie de la luz, en el que se aprecian dos focos hiperecogénicos milimétricos en el espesor de la muscularis mucosae (flechas), que corresponden a úlceras superficiales. b) Corte longitudinal de íleon, con transductor lineal, que muestra pared hipoecoica (grosor de la pared, entre marcas), con imagen ecogénica lineal en su interior por úlcera profunda (flecha). L: luz intestinal central ecogénica.
Se caracteriza por la presencia de un aumento homogéneo de la ecogenicidad de la grasa que rodea un segmento intestinal afectado (figs. 2 y 5). Este hallazgo se ha asociado a la presencia de fístulas y al engrosamiento patológico de la pared39. Sin embargo, es un hallazgo que puede persistir en pacientes en remisión39.
Se puede ver un aumento del flujo de los vasos mesentéricos que irrigan la pared con el Doppler color o después de la inyección de contraste, descrito como el “signo del peine”. La identificación de hiperemia mesentérica es inespecífica para cualquier proceso inflamatorio intestinal, pero en el contexto de la EC es un marcador de segmentos intestinales con inflamación activa.
Ganglios linfáticosEs un hallazgo que se identifica aproximadamente hasta en un 25% de pacientes con EC40,41. Sin embargo, su presencia y número es más frecuente en la infancia, en el inicio de la enfermedad, así como en pacientes con fístulas y abscesos. Por otra parte, estas adenopatías pueden desaparecer tras el tratamiento40.
Tractos sinusales y fisurasA medida que la enfermedad progresa, la inflamación causada por la EC puede extenderse profundamente en la pared intestinal. Los tractos murales hiperecoicos, que representan ulceraciones lineales, atraviesan la pared intestinal y se extienden más allá de la superficie externa haciéndose extramurales. Inicialmente se ven como sutiles irregularidades hipoecoicas (fisuras) en el margen externo del asa o serosa (fig. 5)41–43. Las fisuras pueden extenderse formando tractos hiper- o hipoecoicos a través del mesenterio, y se conocen como tractos sinusales (sinus tracts) cuando terminan de forma ciega en el mesenterio (fig. 5)44–46. Las fisuras y los tractos sinusales reflejan inflamación transmural grave y son probablemente el resultado de microperforaciones.
Imágenes ecográficas de fisuras en 4 pacientes con enfermedad de Crohn, un hallazgo que refleja inflamación transmural grave. a) Irregularidad hipoecoica de la superficie serosa (flecha) del íleon, e imágenes ecogénicas en la capa muscular por úlceras profundas (cabeza de flecha). Proliferación fibrograsa (*). b) Irregularidad hipoecoica (flecha) de la pared posterior del íleon (I) engrosado, que además muestra pérdida de la estructura en capas de la pared. c) Tractos hipoecoicos ciegos con burbujas de gas (flechas) anteriores a un asa ileal engrosada (I). d) Íleon terminal engrosado (IT) con múltiples tractos hipoecoicos irregulares (flechas) en profundidad atravesando la grasa mesentérica inflamada (*).
El fenotipo inflamatorio es el más frecuente en la presentación de la enfermedad, pero hasta un tercio de los pacientes con EC desarrollan una enfermedad penetrante durante su vida47. Las fístulas son uno de los hallazgos característicos de la enfermedad, derivan de las fisuras murales y tractos sinusales.
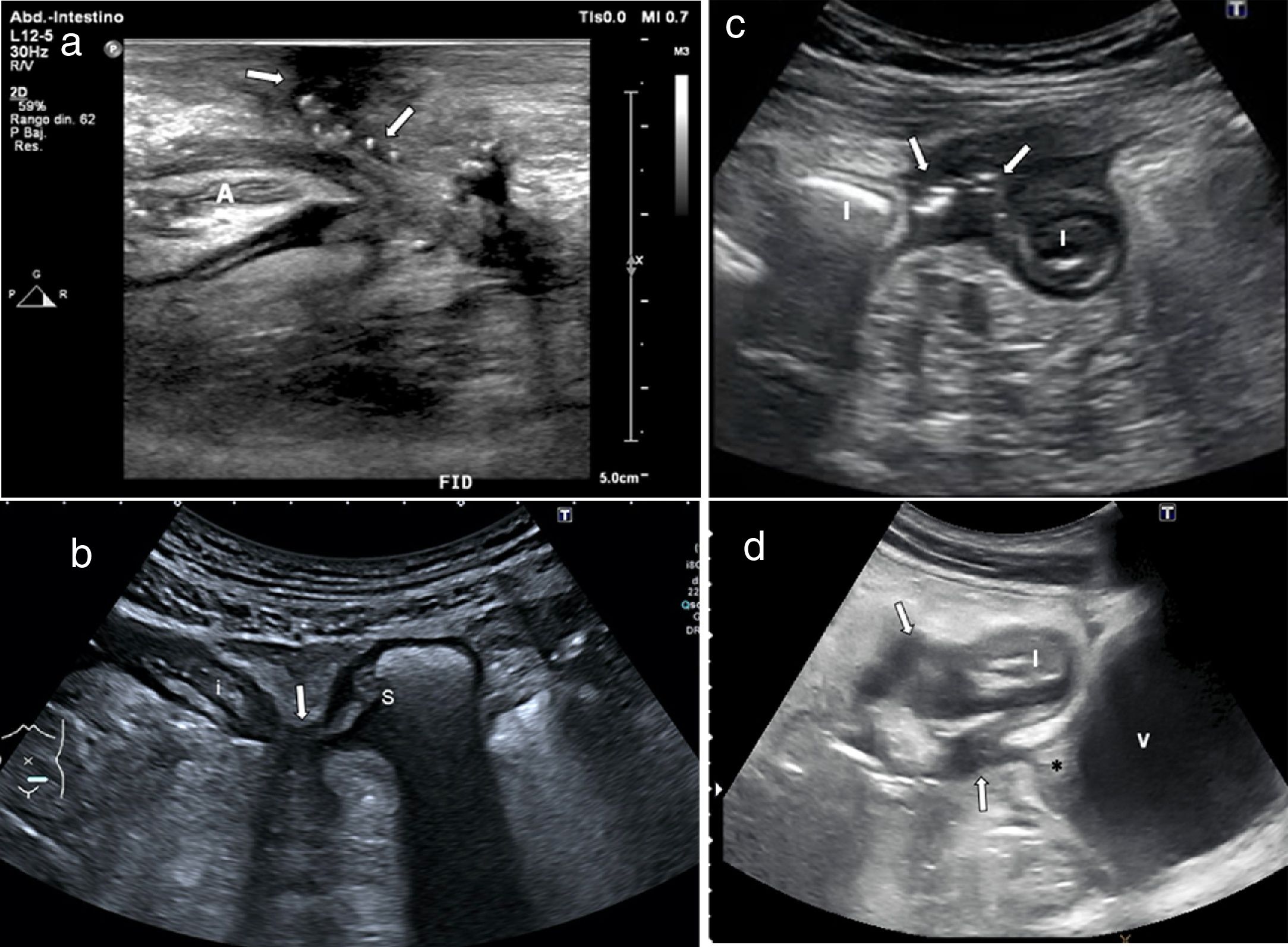
Las fístulas conectan estructuras epitelizadas entre sí y pueden ocurrir entre asas de intestino delgado (enteroentéricas), entre intestino delgado y colon (enterocólicas) o entre intestino y piel (enterocutáneas). Menos frecuentemente afectan a otros órganos como la vejiga (enterovesicales), vagina (enterovaginales) o uréter11,40,41,47,48. Las fístulas se identifican como trayectos hipoecoicos que se extienden desde las asas a otros segmentos intestinales u otros órganos, pero si tienen gas pueden mostrar focos ecogénicos con o sin movimiento dentro del trayecto (fig. 6).
Imágenes de fístulas de 4 pacientes con enfermedad de Crohn. a) Fístula enterocutánea: engrosamiento de la pared del asa anastomótica (A) en la fosa ilíaca derecha (FID) en un paciente con cirugía previa, con trayecto fistuloso desde la anastomosis hacia la superficie cutánea con burbujas de gas en el trayecto (flechas). b) Fístula enteroenteral: corte axial de dos asas intestinales (I) con engrosamiento de la pared y trayecto fistuloso con burbujas de gas entre ambas (flechas). c) Fístula enterosigmoidea entre íleon (i) y sigma (S), con acercamiento y retracción de ambas estructuras (flecha). d) Fístula enterovesical: corte transversal de íleon engrosado (I) contactando con la vejiga (V), con múltiples trayectos fistulosos hipoecoicos (flecha), uno de ellos dirigido hacia la cúpula vesical que muestra engrosamiento y retracción de la pared (*).
La sensibilidad de la ecografía para el diagnóstico de las fístulas es del 67-87%, similar a la de la TC o la RM, con una especificidad entre el 90% y el 100%4,24,49. Las últimas guías de consenso de la ECCO y la ESGAR para el diagnóstico y monitorización de la EII recomiendan la ecografía intestinal como una de las técnicas de imagen para evaluar las complicaciones fistulizantes3.
Masas inflamatorias (flemón y absceso)Las masas inflamatorias, tanto flemones como abscesos, pueden asociarse a un trayecto fistuloso. Los abscesos se presentan ecográficamente como masas hipo o anecoicas, con refuerzo posterior, con paredes gruesas bien definidas y pueden contener gas. Los flemones se aprecian como masas hipoecoicas con márgenes mal delimitados y sin pared identificable6,11,41,43,48. Sin embargo, los abscesos y los flemones pueden tener una apariencia similar en ecografía en modo B. La diferenciación entre ambas entidades es importante para decidir el tratamiento médico (antibióticos asociados o no a drenaje percutáneo) o quirúrgico. También ayuda en la introducción de tratamientos específicos de la enfermedad; por ejemplo, antes del inicio de un tratamiento biológico hay que descartar la presencia de abscesos por el riesgo de complicaciones sépticas.
El uso del contraste ecográfico los diferencia con seguridad, ya que el flemón muestra un realce difuso de la lesión mientras que en los abscesos se ve una porción central avascular y el realce es periférico (fig. 7)50. El uso de contraste no aumenta la detección de masas inflamatorias, pero mejora la especificidad del diagnóstico de absceso, evitando los casos falsos positivos y, además, define con mayor precisión su tamaño50. Por todo ello, cuando se detecte ecográficamente una masa inflamatoria, debería ser evaluada con contraste ecográfico. El contraste también podría ser útil en el control evolutivo de la resolución del absceso23,24.
Utilidad del contraste en la diferenciación entre flemón (a, b y c) y absceso (d y e). a) Flemón mesentérico. Se observa engrosamiento de un asa ileal (I) y una masa inflamatoria hipoecoica mesentérica (línea de puntos). Nótese la grasa ecogénica inflamada (*) interrumpida por tractos hipoecoicos que representan fisuras. b) La ecografía Doppler color muestra hiperemia de grado 3, con aumento de los vasos parietales y mesentéricos (signo del peine). La masa inflamatoria no muestra vasos macroscópicos, lo que sugiere que se trata de un absceso. c) Tras la inyección de contraste ecográfico se observa realce homogéneo de la masa que indica que se trata de un flemón. Proliferación fibrograsa (*). d) Absceso abdominal. Corte transversal de asa intestinal engrosada (I) con úlceras profundas (cabeza de flecha) que atraviesan la pared. Existe una masa hipoecoica (entre marcas) con pequeñas burbujas de gas en su interior (flechas). Proliferación fibrograsa (*). e) Tras la administración de contraste intravenoso no existe realce en la masa (entre marcas), lo que permite un diagnóstico seguro de absceso (a). Flemón y absceso frecuentemente solapan su aspecto hipoecoico en el estudio ecográfico en modo B, por lo que para su diferenciación es imprescindible el uso del contraste intravenoso.
La sensibilidad de la ecografía para el diagnóstico de abscesos abdominales varía entre el 81% y el 100%, con especificidades del 92-94%, similares a las de la TC y la RM, aunque ciertas áreas anatómicas, como la pelvis, son difíciles de evaluar por ecografía por la profundidad y la presencia de gas que puede ocultar las lesiones23,23,49. La ecografía puede usarse como método de imagen inicial y restringir la utilización de la TC o la RM para resolver dudas diagnósticas o en centros sin la experiencia adecuada en ecografía.
EstenosisDiversas revisiones sistemáticas y documentos de posicionamiento establecen que la ecografía, la TC y la RM tienen alta sensibilidad y especificidad para el diagnóstico de estenosis de intestino delgado y colon, con rentabilidad diagnóstica similar3,4,51. En una revisión sistemática publicada recientemente, la sensibilidad de la ecografía fue del 80% (intervalo de confianza [IC] del 95%, 75,2-84,2%) y la especificidad del 95% (IC 95%, 89,7-99,8%)24. La capacidad diagnóstica de la ecografía para la detección de estenosis aumenta si empleamos contraste oral (250-500ml de polietilenglicol), técnica conocida con el acrónimo SICUS (Small Intestine Contrast Ultrasonography). La sensibilidad diagnóstica se incrementa un 10% para estenosis únicas y un 20% cuando hay dos estenosis24.
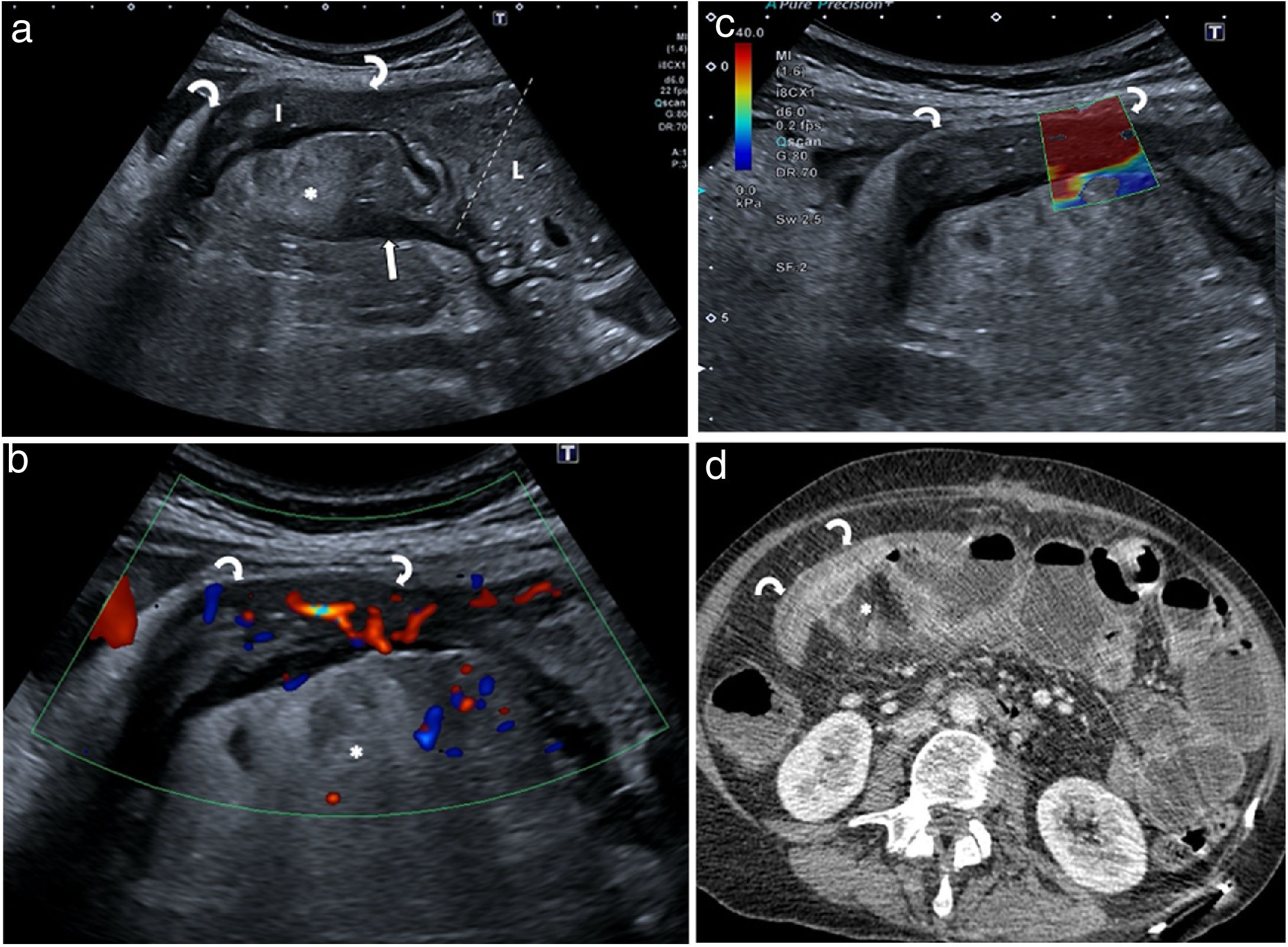
Si la exploración se realiza sin contraste oral, la estenosis se visualiza como un segmento intestinal aperistáltico con pared engrosada y rígida, estrechamiento de la luz, y con un segmento proximal dilatado, que puede ser fijo, adinámico o con movimientos hiperperistálticos (fig. 8)12,13.
Obstrucción intestinal por estenosis. a) Segmento intestinal (I) de paredes engrosadas estenótico (flechas curvas) con dilatación de la luz intestinal (L) del asa previa (entre marcas). Fisura ciega mesentérica (flecha). Proliferación fibrograsa (*). b) Estudio en Doppler color que muestra hiperemia de grado 2, lo que sugiere estenosis inflamatoria. c) El examen de elastografía de la estenosis identifica predominio de color rojo que indica componente fibroso. d) Tomografía computarizada con contraste intravenoso donde se visualiza buena correlación con la imagen ecográfica. El resultado del estudio de la pieza quirúrgica indicó estenosis mixta, con alto grado de inflamación y fibrosis.
La mayor parte de las estenosis son mixtas, y solo un pequeño porcentaje son inflamatorias o fibróticas puras52. Varios estudios han demostrado que la desestructuración de las capas y una hiperemia moderada-grave con Doppler color o CEUS se correlacionan con mayor grado de inflamación en la histología de las piezas quirúrgicas23,24,30,53–56. Los parámetros del realce que tienen mayor correlación con el grado de inflamación serían un mayor pico de máxima intensidad de brillo o un mayor porcentaje de realce; y con el grado de fibrosis, un tiempo hasta el pico alargado23,24. La ausencia de signos de actividad inflamatoria en una estenosis que provoca dilatación intestinal sugiere fibrosis.
La elastografía es una nueva técnica que permite valorar la rigidez del tejido mediante programas específicos incluidos en los equipos ecográficos. Una revisión sistemática reciente ha mostrado correlación entre el grado de rigidez de la pared de la estenosis medida por elastografía y el grado de fibrosis histológico57.
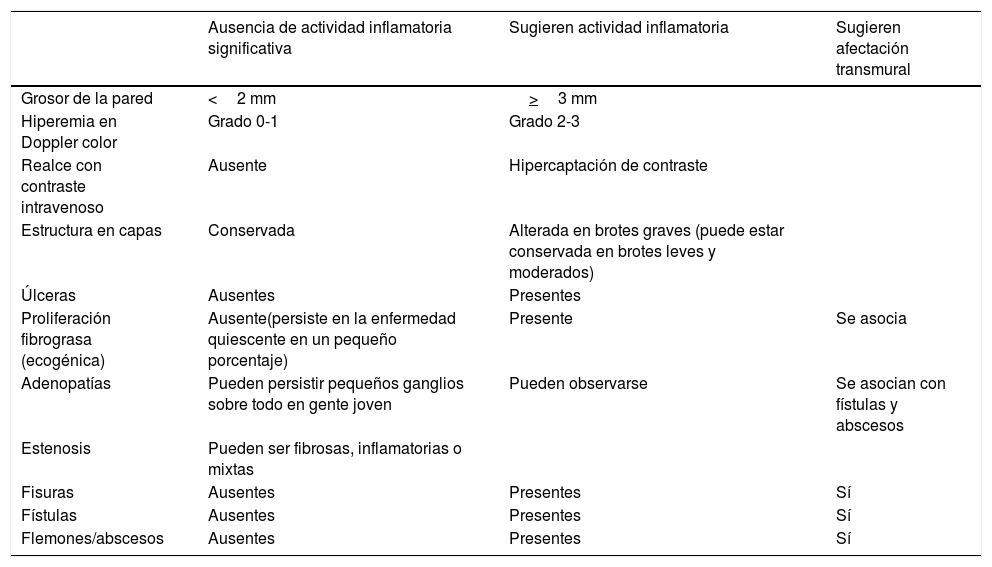
Actividad inflamatoriaSu evaluación es importante para planificar y monitorizar la eficacia del tratamiento médico. En la tabla 1 se describen los parámetros ecográficos utilizados para evaluar la actividad de la enfermedad.
Parámetros ecográficos de actividad inflamatoria en la enfermedad de Crohn
| Ausencia de actividad inflamatoria significativa | Sugieren actividad inflamatoria | Sugieren afectación transmural | |
|---|---|---|---|
| Grosor de la pared | <2 mm | >3 mm | |
| Hiperemia en Doppler color | Grado 0-1 | Grado 2-3 | |
| Realce con contraste intravenoso | Ausente | Hipercaptación de contraste | |
| Estructura en capas | Conservada | Alterada en brotes graves (puede estar conservada en brotes leves y moderados) | |
| Úlceras | Ausentes | Presentes | |
| Proliferación fibrograsa (ecogénica) | Ausente(persiste en la enfermedad quiescente en un pequeño porcentaje) | Presente | Se asocia |
| Adenopatías | Pueden persistir pequeños ganglios sobre todo en gente joven | Pueden observarse | Se asocian con fístulas y abscesos |
| Estenosis | Pueden ser fibrosas, inflamatorias o mixtas | ||
| Fisuras | Ausentes | Presentes | Sí |
| Fístulas | Ausentes | Presentes | Sí |
| Flemones/abscesos | Ausentes | Presentes | Sí |
El manejo del paciente en la EC con respecto al tratamiento ha cambiado del simple control de los síntomas a la medición de datos objetivos de actividad inflamatoria, debido a que los síntomas clínicos por sí solos no son sensibles ni específicos para determinar la gravedad de las lesiones en la EC.
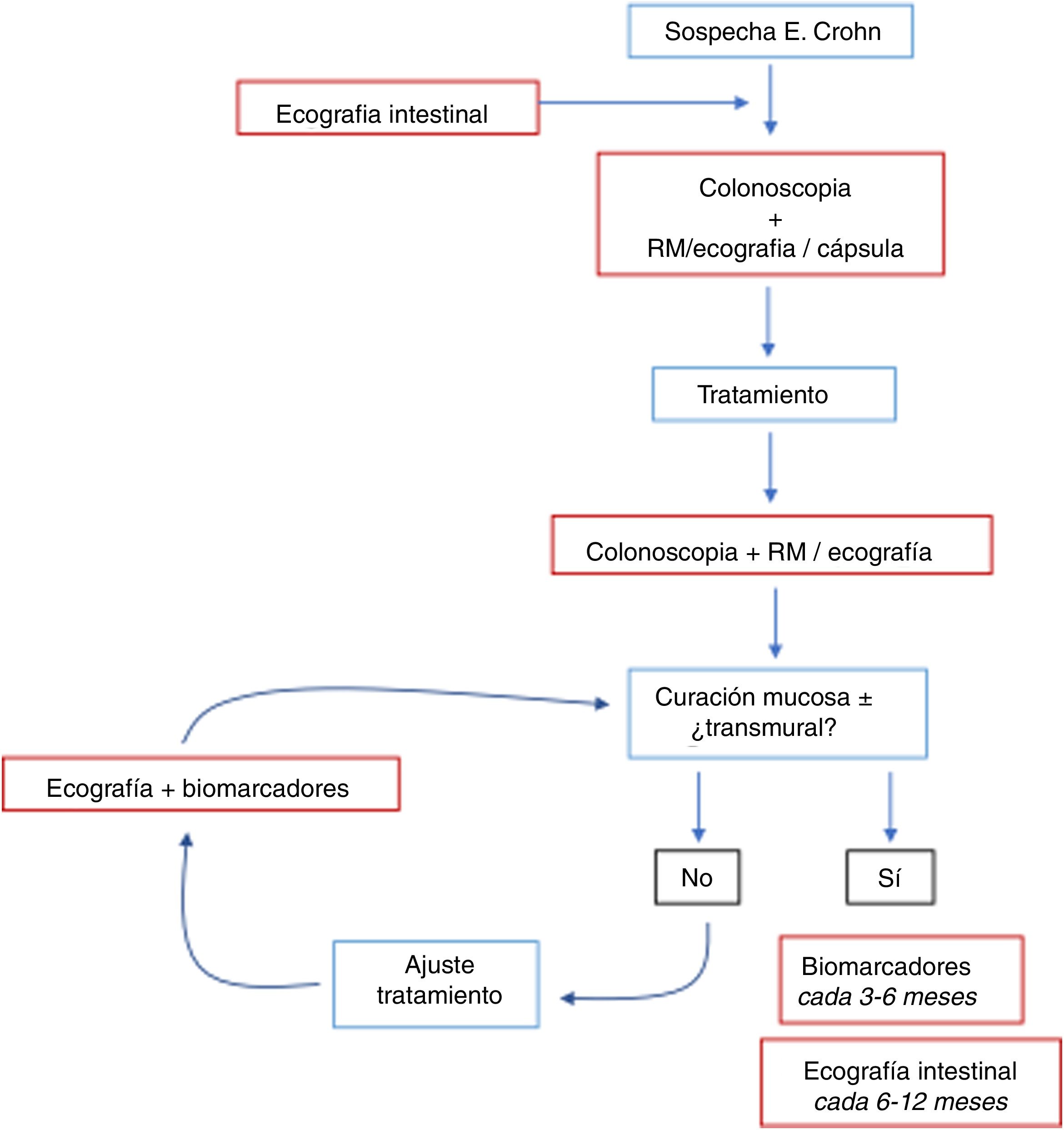
Se recomienda evaluar la respuesta inicial (con ecografía o RM) dentro de los primeros 6 meses tras el inicio del tratamiento (fig. 1)3. El principal trabajo que demuestra la utilidad de la ecografía en la monitorización de la EC es el estudio TRUST, multicéntrico y prospectivo, en el que se siguió a 234 pacientes con actividad tras la instauración de un tratamiento durante 12 meses. Prácticamente todos los parámetros evaluados (grosor, pérdida de la estratificación, proliferación fibrograsa, señal Doppler, adenopatías o estenosis) experimentaron mejoría al tercer mes de tratamiento40. Los cambios ecográficos para evaluar la respuesta pueden ser incluso más precoces, habiéndose descrito ya en controles ecográficos realizados a las 232,58 o las 4 semanas59 tras iniciar el tratamiento.
Se ha sugerido que la evaluación de la eficacia de un tratamiento debe basarse en la curación de la mucosa, con ausencia de ulceraciones en la endoscopia, ya que se asocia con una evolución de la enfermedad más favorable60. La normalización de los parámetros ecográficos se correlaciona estrechamente con la curación de la mucosa en pacientes con EC tratados con terapia biológica (fig. 9)61,62.
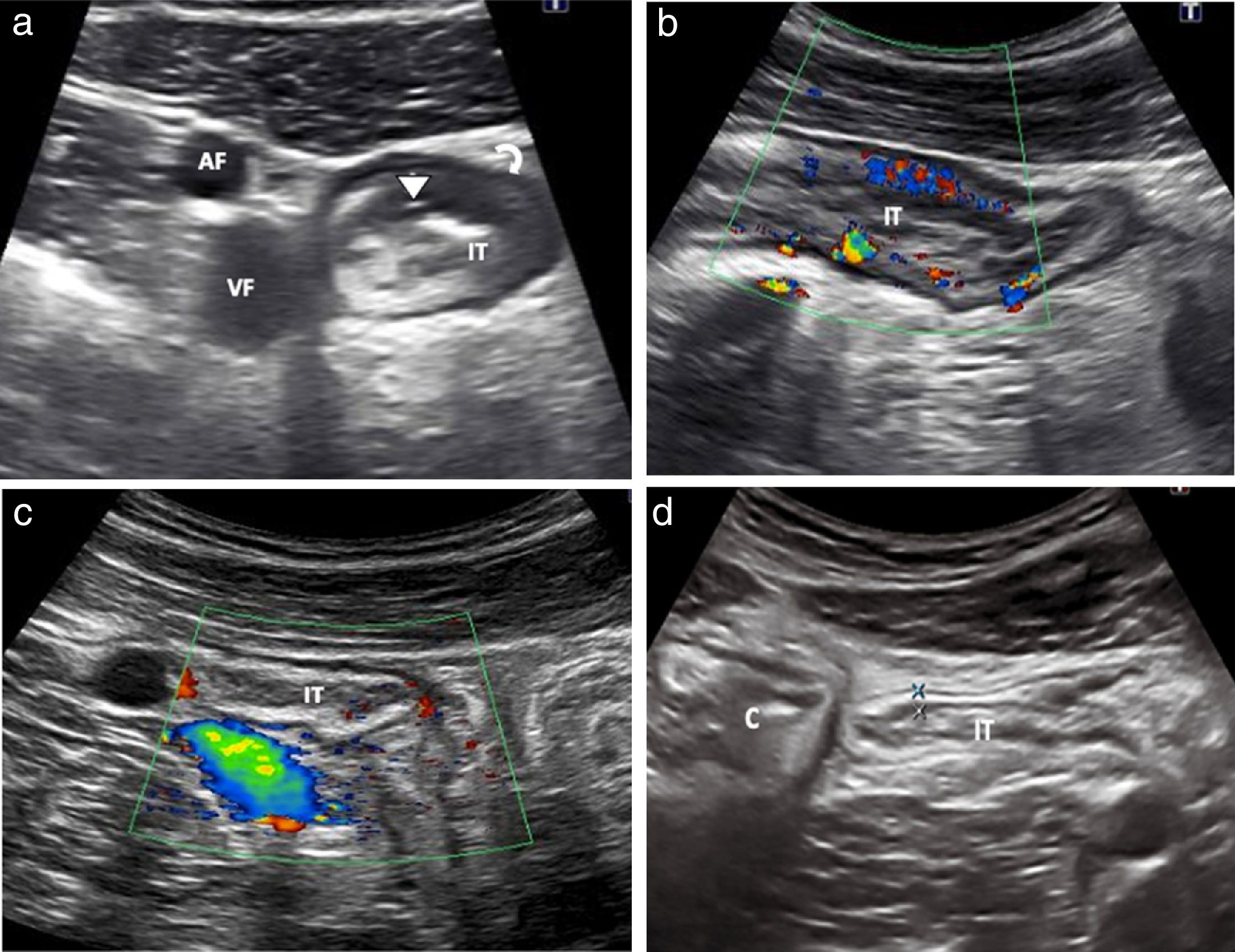
Paciente con enfermedad de Crohn asintomático en tratamiento con inmunosupresores. a) la ecografía de control rutinaria objetiva un engrosamiento del íleon terminal, presencia de úlceras (cabeza de flecha) y pérdida focal de la estructura de las capas (flecha curva). (AF y VF arteria y vena femoral). b) El estudio Doppler color muestra hiperemia de grado 3. Ante estos hallazgos, el paciente comienza con anti-TNF (adalimumab). c) Ecografía a las 12 semanas del inicio del adalimumab que demuestra una disminución del grosor de la pared de íleon terminal con vascularización parietal normal (grado 0). d) Control a los 12 meses de inicio del tratamiento. Normalización de los hallazgos, con pared de grosor normal y ausencia de vascularización (no mostrado). Íleon terminal (IT). Ciego (C).
Por otra parte, los hallazgos ecográficos tienen valor pronóstico. Se ha demostrado que la evolución ecográfica tras iniciar un tratamiento se correlaciona con los resultados clínicos a medio y largo plazo en la EC. Una serie reciente que incluyó 51 pacientes con EC que iniciaban tratamiento con anti-TNF mostró que los cambios ecográficos a las 12 semanas fueron capaces de predecir la respuesta ecográfica y el resultado clínico al año. En este estudio, la mejoría clínica a las 52 semanas fue significativamente más frecuente en los pacientes que presentaban mejoría de los parámetros ecográficos en la semana 12 frente a los que no mejoraron (85% vs. 28%; p<0,0001)34. También la desaparición completa de las lesiones (curación transmural) en ecografía al año de tratamiento se asocia con menos probabilidades de requerir cambio de terapia o cirugía dentro del siguiente año34,61.
La ecografía es tan precisa como la RM en la monitorización de la EC, más barata y accesible. La comparación de ecografía y RM en la precisión diagnóstica para evaluar la curación transmural ha mostrado un alto acuerdo entre ambas técnicas (k=0,90)63.
Recurrencia posquirúrgicaLa incidencia de recurrencia tras la cirugía en la EC sin tratamiento es elevada (65-90%). Típicamente aparece en la anastomosis o en el íleon neoterminal64. La gravedad de las lesiones mucosas está muy relacionada con la aparición de recurrencia clínica y con el pronóstico, por lo que su detección temprana condiciona cambios terapéuticos importantes o un seguimiento más estrecho63,64. La técnica de elección para la evaluación inicial es la ileocolonoscopia, y se propone realizarla precozmente a los 6-12 meses tras la cirugía64 utilizando el índice de Rutgeerts (iR) para la clasificación de las lesiones endoscópicas. Sin embargo, no está bien determinado cuándo realizar la siguiente ileocolonoscopia, por lo que se ha propuesto utilizar la ecografía junto a la calprotectina como métodos no invasivos alternativos durante el seguimiento de la enfermedad65.
La sensibilidad y especificidad globales de la ecografía para la detección de recurrencia es del 94% y 84%, respectivamente66–68. El grosor de la pared es el principal parámetro estudiado y en general se considera como signo de recurrencia un grosor igual o superior a 3mm de la pared de la anastomosis o del íleon neoterminal. El uso de contraste oral mejora la sensibilidad, aunque disminuyendo la especificidad (sensibilidad=0,99 y especificidad=0,74)66. Por otra parte, el valor de corte que mejor predice la presencia de recurrencia grave (iR ≥ 3) es el grosor de 5mm o más, con sensibilidad del 83,8% y especificidad del 97,7%69. Otros signos asociados a formas graves de enfermedad son: presencia de complicaciones (fístulas, abscesos), estenosis con dilatación proximal, proliferación fibrograsa ecogénica, hiperemia en Doppler color o realce parietal con el contraste67–69.
Colitis ulcerosaLas indicaciones de la ecografía en la colitis ulcerosa (CU) son mucho más reducidas que en la EC por varios motivos: mayor correlación entre las manifestaciones clínicas y la actividad endoscópica de la enfermedad, adecuada correlación de la actividad endoscópica con la calprotectina fecal70 y mejor accesibilidad a la evaluación endoscópica donde existen índices endoscópicos validados3, razones que explican que en el control de la respuesta al tratamiento de la CU no sean necesarias las pruebas de imagen71.
Las guías ECCO no recomiendan la evaluación sistemática del intestino delgado en pacientes con CU, solo la consideran cuando existen dudas diagnósticas con la EC, como en casos de preservación rectal, síntomas atípicos o ileítis por reflujo3. La ecografía ha demostrado gran correlación con los hallazgos endoscópicos en la valoración de la extensión de la enfermedad en un brote de CU. En pacientes en los que la enfermedad se inicia con un brote grave y se les realiza una exploración endoscópica limitada del colon por la presencia de lesiones graves o bien cuando se sospeche progresión proximal de la enfermedad, la ecografía puede determinar la extensión con una fiabilidad diagnóstica similar a la colonoscopia72,73.
Los hallazgos ecográficos más característicos son: engrosamiento simétrico y continuo de la pared intestinal, irregularidad de la superficie mucosa, edema submucoso, pérdida de las haustraciones e hiperemia parietal73–75. El grosor para el diagnóstico de CU es de 3mm en niños73 y de 4mm en adultos (fig. 10), y existe una alta correlación entre la actividad endoscópica y los hallazgos ecográficos74,75, siendo el grosor de la pared y la hiperemia parietal los parámetros más útiles72–75. Debido a que la enfermedad no es transmural, la afectación de la grasa mesentérica y la pérdida de la ecoestructura de la pared intestinal son menos frecuentes2, aunque pueden verse en brotes graves de la enfermedad45.
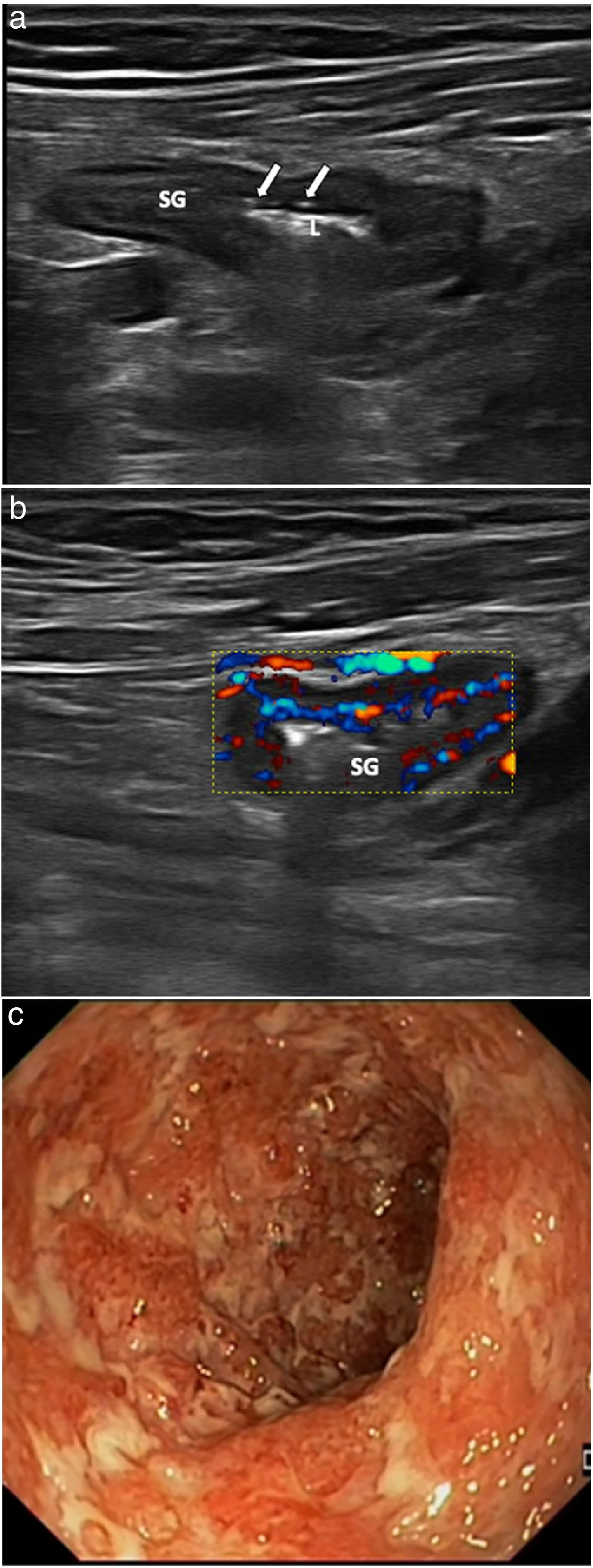
Paciente con un brote grave de colitis ulcerosa. Ecografía con transductor lineal. a) Corte longitudinal de sigma (SG) con imágenes de úlceras mucosas (flechas). Luz intestinal (L). b) Ecografía Doppler color que muestra marcada hiperemia. c) Correlación endoscópica del mismo paciente con múltiples úlceras profundas, que corresponde a una actividad endoscópica grave (índice de Mayo 3).
La ecografía es una técnica de imagen que ayuda al diagnóstico por su inmediatez y contribuye a la monitorización de la EII, especialmente de la EC, ayudando en la toma de decisiones clínicas. Tiene una rentabilidad próxima a la de la RM, pero es más barata, más accesible y mejor tolerada, y es un complemento de la endoscopia en el manejo de la enfermedad. Sin embargo, su difusión e implantación en los servicios de radiología o en las unidades de EII es limitada, por lo que es esencial la promoción y formación en la técnica para su incorporación a la práctica clínica habitual de forma generalizada.
En esta época de concienciación sobre la importancia de evitar la radiación y reducir los costes creemos que, según lo recomendado por el consenso ECCO-ESGAR y dadas sus múltiples ventajas, la ecografía debe considerarse una prueba de primera línea en la evaluación de pacientes con EC en todas las situaciones clínicas (tabla 2).
Indicaciones de la ecografía intestinal en la enfermedad de Crohn
| Actuales | Detección de inflamación en sospecha de enfermedad de Crohn (Diagnóstico) |
|---|---|
| Evaluación de la extensión (colon/intestino delgado) | |
| Diagnóstico de recurrencia posquirúrgica | |
| Monitorización de la actividad con valoración de la respuesta | |
| Detección de complicaciones:• Fisuras o fístulas• Abscesos• Estenosis | |
| Detección en tiempo real de brote en enfermedad de Crohn conocida | |
| Futuro | Diferenciación estenosis fibrótica versus inflamatoria (elastografía, contraste i.v.) |
| Predicción de recaída o necesidad de cirugía |
Los autores declaran no tener ningún conflicto de intereses.