INTRODUCCIÓN
Los osteoclastos son bien conocidos por su importante papel como células reabsortivas que intervienen en el remodelado óseo1. Estas células multinucleadas de origen hematopoyético2-5 se forman a partir de la fusión de precursores mononucleares, bajo la influencia de factores secretados por células estromales6. Los factores estimuladores de la formación de osteoclastos son, entre otros, la hormona paratiroidea (PTH), el colecalciferol (1*25 (OH)2D3), las interleucinas 1 (IL-1), 6 (IL-6), 11 (IL-11), el factor de necrosis tumoral (TNF) y las prostaglandinas (PG).
Los osteoclastos son células poco abundantes, entre 2 ó 3 por µm3, exceptuando en las zonas donde hay un remodelado óseo activo7. Además, se encuentran fuertemente adheridos a la matriz, presentan un gran tamaño y un alto contenido en enzimas proteolíticas, lo que las convierte en células frágiles y difíciles de cultivar en el laboratorio. Esto, sumado a la inexistencia de líneas celulares inmortales, ha provocado que durante años se haya trabajado para desarrollar un método eficaz con el que llevar a cabo experimentos in vitro utilizando estas células.
Diversos investigadores han desarrollado métodos de cultivo a partir de huesos de ratones, gallinas o conejos postnatales, en los que es posible obtener un alto número de osteoclastos8. En nuestro laboratorio de la Unitat de Recerca de Fisiopatologia Ossia i Articular (URFOA) hemos desarrollado un ensayo de reabsorción ósea utilizando el método de Boyde et al9,10 modificado para adaptarlo al cultivo de osteoclastos humanos. La principal dificultad cuando se trabaja con muestras humanas es que el número de osteoclastos que pueden obtenerse es menor que cuando se utilizan animales. A esto debemos añadirle que las muestras provienen de individuos de edad avanzada, en los que el remodelado óseo está claramente disminuido, y por tanto el número de células es menor. Es por ello que nuestro método se basa principalmente en la obtención de células osteoclásticas a partir de precursores de médula ósea.
MATERIAL Y MÉTODOS
CULTIVO CELULAR
Para el aislamiento de las células se utilizan fragmentos de hueso esponjoso residual procedente de pacientes sometidos a remplazo ortopédico. Se elimina el tejido cortical de las muestras y se lava con alfa-modified Eagle's medium (alfa-MEM) suplementado con un 10% de suero bovino fetal (FCS) y antibióticos. Los osteoclastos adheridos al tejido óseo y los precursores de la médula ósea se disocian por separación mecánica, lavando vigorosamente los fragmentos de hueso con una jeringuilla o una pipeta. Se lavan las células por centrifugación dos veces, 5 minutos a 1.000 rpm. Se cuentan y se ponen a cultivar sobre láminas de dentina. Se utilizan láminas de dentina humana de un grosor entre 300-450 µm, en las que los restos de materia orgánica se han eliminado por ultrasonidos. La suspensión celular se deposita sobre las láminas durante 150 minutos, que es el tiempo necesario para que se peguen las células adherentes. Se retira el medio y se pone medio fresco suplementado con un 10% de FCS y 1,25 (OH)2D3. El medio se cambia periódicamente y se dejan crecer las células durante tres semanas.
RECUENTO CELULAR
Para realizar la observación y el recuento de las células se utiliza un microscopio electrónico de barrido ambiental (ESEM) (Electroscan 2020, Boston, USA). Para ello, se retira el medio de cultivo y se lavan las células con PBS. Las células se fijan durante 5 minutos con paraformaldehído al 4%. Una vez contados los osteoclastos, las láminas de dentina se sonican para despegar las células, en un baño de ultrasonidos con agua oxigenada. La dentina se recubre de oro para obtener las imágenes de las lagunas de reabsorción por microscopía de barrido convencional (MEB) (Jeol JSM 6400, Japón), que luego serán analizadas con un analizador de imágenes.
RESULTADOS
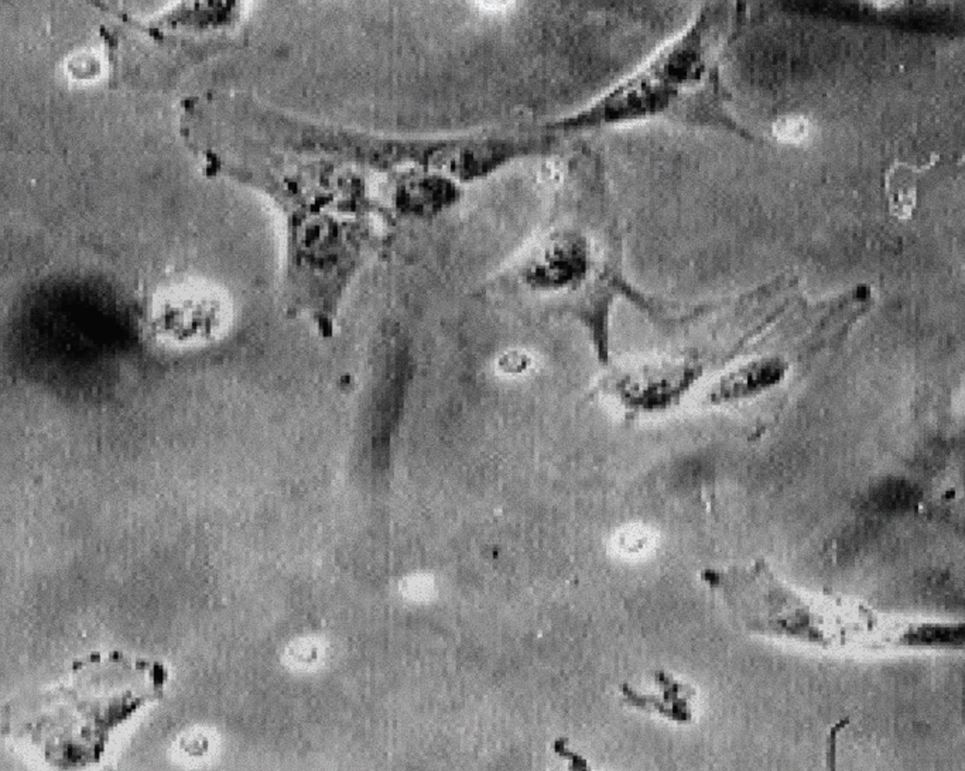
Los resultados obtenidos tras la utilización del método descrito permiten, después de siete días de cultivo, la observación de células multinucleadas, que presentan una membrana citoplasmática con bordes ondulados, típicos de estas células. En la figura 1 se muestran osteoclastos vistos por microscopía óptica. Los núcleos se disponen en grupos, algunos quedando en el centro del citoplasma celular y otros junto a la membrana plasmática. Estas células son positivas para la fosfatasa ácida tartrato resistente (TRAP).
Figura 1. Osteoclastos observados con microscopia óptica a 32X.
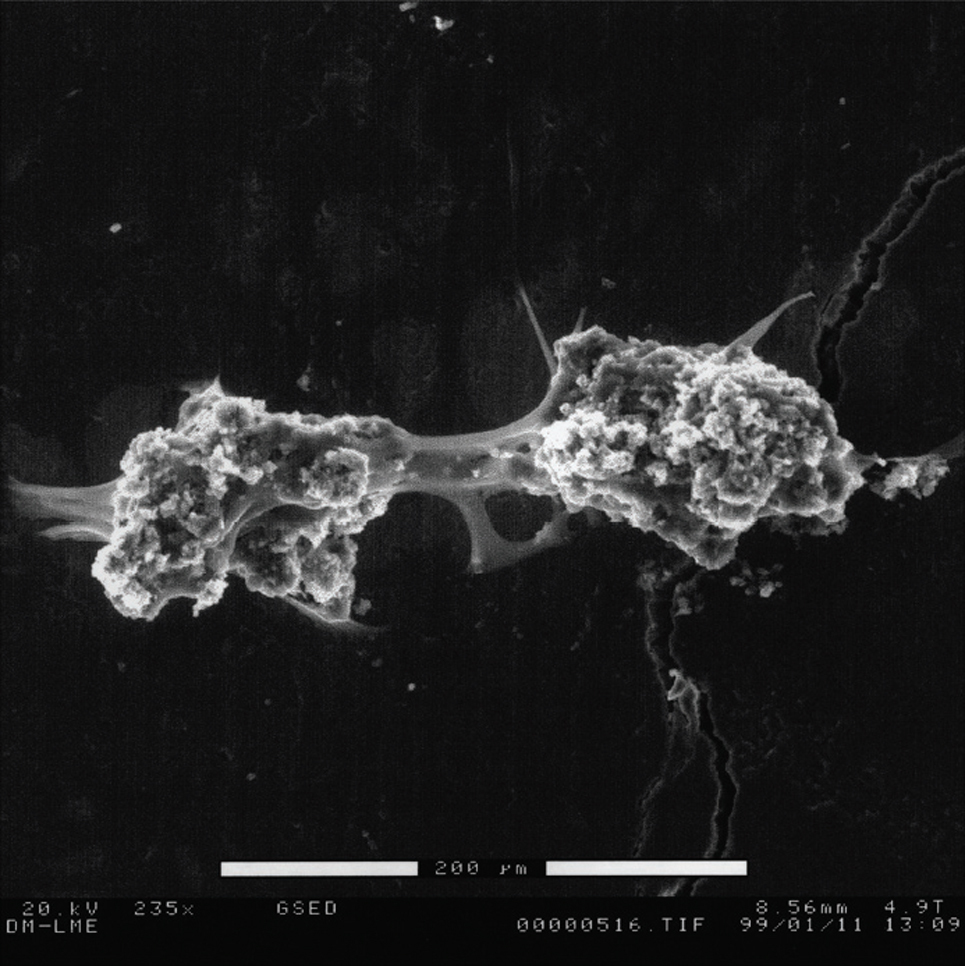
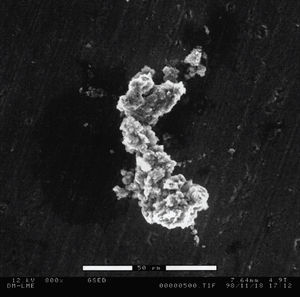
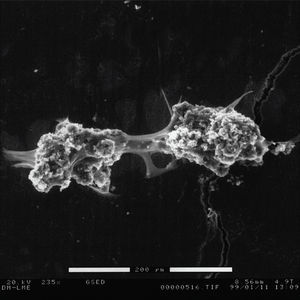
En los cultivos mantenidos durante 21 días y procesados para microscopía electrónica de barrido se pueden observar células de gran tamaño. En la figura 2 podemos observar también con ESEM un osteoclasto con su correspondiente laguna de reabsorción. En la figura 3 se aprecia la unión de dos células, fusión que da lugar a estas células multinucleadas. Cuando sonicamos las láminas de dentina con hidróxido peróxido para despegar las células podemos observar las lagunas excavadas por los osteoclastos como resultado de su actividad reabsortiva, como se muestra en la figura 4.
Figura 2. Osteoclasto observado a 800X, con ESEM sobre la lámina de dentina. Por debajo de la célula se puede apreciar la laguna de reabsorción excavada por la misma.
Figura 3. Osteoclastos adheridos a la dentina, después de 21 días de cultivo, observados al microscopio de barrido ambiental (ESEM) a 225X. Se observa como ambas células se encuentran en contacto por los podosomas.
Figura 4. Lagunas de reabsorción sobre la lámina de dentina, una vez despegadas las células, observadas al microscopio electrónico de barrido (MAB) a 100X.
DISCUSION
En la investigación con osteoclastos uno de los mayores avances ha sido el método de cultivo desarrollado por Boyde et al9,10 para realizar estudios de reabsorción sobre sustratos mineralizados a partir de osteoclastos aislados. Este método ha sido utilizado con éxito para evaluar el efecto de las hormonas, citocinas y pH sobre la actividad osteoclástica11-14. Este método de aislamiento presenta varias ventajas: en primer lugar es un método relativamente sencillo, en el que se limitan las manipulaciones del cultivo; y en segundo lugar permite obtener células osteoclásticas maduras con actividad reabsortiva a partir de muestras humanas, en las que el número de células que se pueden obtener es significativamente menor que cuando se utilizan muestras de animales, sobre todo si se trabaja con individuos fetales o postnatales de pocos días.
La utilización del microscopio electrónico de barrido para identificar y evaluar las lagunas de reabsorción ha permitido mejorar los resultados visuales, ya que pueden obtenerse unas imágenes de gran calidad. Aun así, presenta el problema de la preparación de las muestras, que resulta largo y engorroso. El tratamiento de las muestras para poder ser procesadas requiere al menos dos días. Si además se quiere realizar un contaje celular previo y obtener imágenes de las células utilizando la misma muestra el tiempo se alarga, y corremos el riesgo de estropear e incluso quebrar las láminas de dentina, que son extremadamente frágiles. Para obviar este hecho y mejorar la técnica hemos puesto a punto, por primera vez, la utilización del ESEM para la observación de estas células.
La utilización del mismo, Elestroscan 2020, permite la observación de las muestras fijando los cultivos únicamente con paraformaldehído y observar las células a una presión de cámara prácticamente igual a la ambiental, lo que permite que las células mantengan su morfología intacta. De esta forma se minimizan los procesos de preparación de la muestra previos a su observación, tales como la deshidratación, fijación, punto crítico y recubrimientos conductores que se requieren en microscopía convencional, los cuales son procesos largos y tediosos. Y por último, permite el recuento del número de células y la evaluación de las zonas reabsorbidas sobre la misma lámina de dentina en un tiempo relativamente corto.
En conclusión, creemos que este es un buen método para la realización de ensayos de reabsorción y para poder evaluar la actividad de los osteoclastos humanos in vitro, aplicándolo al estudio de enfermedades que afectan al metabolismo óseo.
Este trabajo ha sido financiado por el Fondo de Investigación Sanitaria, proyecto número 98/0412.
NOTICIAS
8º CONGRESO SEIOMM
26-28 de septiembre de 2001. Ciutadella, Menorca
Información general
Presidente Comité Organizador Local: Dr. Pau Lluch Mesquida
Secretaría Técnica: Rosa Diez
Secretaría SEIOMM
Passeig Marítim, 25-29. 08003 BARCELONA
Tel. 93 248 31 24 Fax: 93 221 62 92 email:85382@imas.imim.es