Los bifosfonatos (BF) constituyen en la actualidad un grupo de fármacos de la máxima utilidad en el campo de las enfermedades metabólicas óseas. En las últimas décadas se ha confirmado su utilidad en el tratamiento de la enfermedad de Paget, el mieloma, las hipercalcemias tumorales y las osteoporosis1.
Se van obteniendo diferentes compuestos derivados a la par que su completo potencial terapéutico y mecanismo de acción antirresortivo está siendo estudiado.
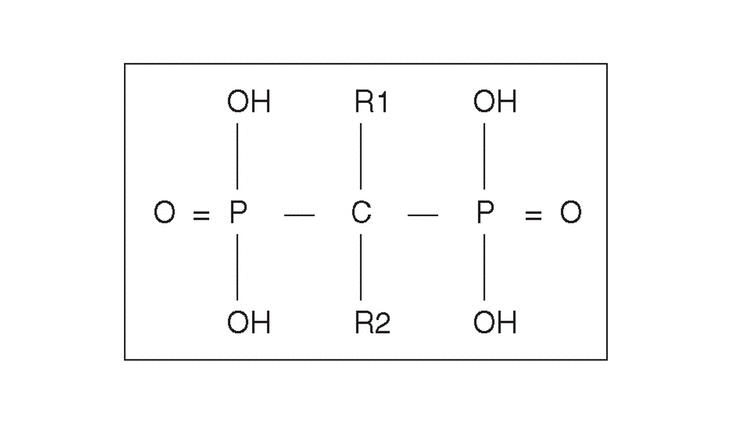
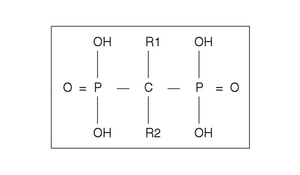
Desde el punto de vista farmacológico, los BF son compuestos que se caracterizan por una baja absorción intestinal (1%-5% de la dosis), pero con una altamente selectiva captación y retención a nivel óseo. Se estima que aproximadamente el 80% es eliminado por el riñón y el 20% captado por el hueso. Su vida media plasmática es de sólo una hora, pero su permanencia, una vez captado por el hueso es de años. Son fármacos que inhiben la resorción ósea y que contienen dos grupos fosfonados unidos a un átomo de carbón, en una estructura «P-C-P» (en vez de oxígeno, como ocurre en el pirofosfato) (fig. 1)2. Su mecanismo de acción fue inicialmente relacionado con sus efectos fisicoquímicos sobre los cristales de hidroxiapatita, pero en los últimos años se han confirmado efectos a nivel celular de gran trascendencia.
Figura 1. Estructura química genérica de los bifosfonatos. El grupo P-C-P es esencial para la actividad biológica. La cadena lateral R2 es responsable de la potencia del preparado. La presencia de un grupo OH en R1 incrementa la ligazón con la hidroxiapatita.
La introducción clínica de estos compuestos se realiza a partir de la demostración de que los polifosfatos eran capaces de inhibir la cristalización de las sales de calcio y por tanto reblandecer las aguas.
Posteriormente se describió que un polifosfato natural pirofosfato inorgánico presente en el suero y la orina era capaz de ligar el calcio, formando nuevos cristales y por tanto prevenir la calcificación. Años después Fleisch y Neuman (1961) postularon que el pirofosfato podría ser el agente que previene en condiciones normales la calcificación de los tejidos blandos y también regulara la mineralización ósea3.
Sin embargo, estos compuestos de pirofosfatos eran hidrolizados (fosfatasa) a nivel intestinal siendo por tanto inactivos cuando se administraban por vía oral, lo que obligaba a su administración por vía intravenosa.
En investigaciones posteriores los BF se confirmaron como activos por vía oral, con gran afinidad por el tejido óseo, e incluso capaces de inhibir la disolución de los cristales de hidroxipatita además de prevenir las calcificaciones patológicas. Los BF una vez ingeridos debido a su gran afinidad por el calcio son rápidamente aclarados de la sangre y selectivamente absorbidos por las superficies minerales óseas, en donde pueden permanecer hasta que son liberados y «engullidos» por los osteoclastos. La concentración de BP es significativamente importante tras su liberación ósea en dichas áreas que sufren el efecto del medio ácido localizado entre el osteoclasto y el hueso. El BP una vez captado por pinocitosis y/o fagocitosis se localiza fundamentalmente en vacuolas intracelulares así como en otros compartimentos del citoplasma, en las mitocondrias y en el núcleo. Esta internalización de los BF va a ser responsable de los efectos sobre el reclutamiento, la diferenciación y la capacidad resortiva de los osteoclastos. Cuando se impide su captación intracelular con otro fármaco (calcitonina) se puede impedir el efecto deletéreo de los BP en cultivos de osteoclastos4,5. Recientemente se ha documentado que los BP pueden ocasionar la pérdida de cistoesqueleto de los osteoclastos, con desaparición del anillo de actina, una proteína necesaria para que esta célula pueda polarizarse y formar un anillo de sellamiento sobre la superficie ósea y empezar así la disolución ósea6. Otros autores han demostrado la pérdida del borde rugoso de la zona apical adyacente al hueso en la que se segregan enzimas hidrolíticos y protones que potencian esta destrucción ósea localizada7,8. También se ha demostrado la inducción de la apoptosis in vitro e in vivo producida por los BP (clodronato, pamidronato y resedronato); se trata de la muerte celular con contracción celular y fragmentación nuclear, objetiva-da en cultivos de macrófagos J774 y de células de mieloma humano9.
Los BP podrían también actuar inhibiendo enzimas intracelulares involucradas en la ligazón del pirofosfato y de otros sustratos que contienen fosfatos. El alendronato inhibe las tirosin-fosfatasa y el tiludronato las fosfatasas, lo que podría disminuir la actividad resortiva del osteoclasto10. Este último fármaco tiene también capacidad de inhibir la bomba de protones del osteoclasto, necesario para la acidificación de la zona de sellado.
Los osteoblastos podrían estar implicados en la acción de los BP. Es posible que estos fármacos eviten la liberación de factores estimuladores de los osteoclastos o bien, a través de la producción de factores inhibidores aún no identificados, por los osteoblastos11,12.
La capacidad antirresortiva de los BF en la osteoporosis ocasiona un incremento de la masa ósea y disminución de las fracturas y va a depender de varios factores. Por un lado, se ha demostrado que disminuyen la frecuencia de la activación de las unidades de remodelado óseo, a la vez que potencian la mineralización de las osteonas. Así, aunque hay una similitud antirresortiva en todos estos compuestos, se han obtenido diferentes compuestos de BF para el tratamiento de las diferentes enfermedades, en lo que indudablemente han influido los ensayos clínicos y la vía de administración. Basta con señalar como el pamidronato intravenoso es útil en las hipercalcemias tumorales, mientras que el alendronato y el etidronato están más indicados en el tratamiento de la osteoporosis. Existen también diferencias en los BP en relación con su segundo efecto sobre el hueso, es decir, su capacidad de inhibir también la mineralización y causar osteomalacia. Así, el etidronato es capaz de inhibir la resorción y la mineralización a la misma concentración y en igual proporción (1:1), lo que ha significado su no aprobación como terapia de la osteoporosis en algunos países13. En comparación la dosis de alendronato que inhibe la mineralización es 1.000 veces menor que la que puede frenar la resorción ósea.
La introducción de estos nuevos compuestos ha permitido establecer una relación entre la estructura química y su actividad biológica. Aunque la secuencia P-C-P es responsable de su fuerte afinidad por el esqueleto y es necesaria para inhibir la resorción ósea, las modificaciones en las cadenas laterales R1 y R2 originan compuestos con diferentes características (fig. 1). Las sustituciones realizadas en R1 pueden servir para incrementar su potencia en la prevención del crecimiento y disolución de los cristales, de hidroxiapatita como ocurre con el etidronato mediante un grupo hidroxilo en R1, lo que conforma una estructura tridentada quelante de los iones de calcio14.
Las modificaciones en la cadena lateral R2 son determinantes en gran parte de la potencia de la resorción ósea del compuesto, como ha demostrado con compuestos como el pamidronato y el alendronato, del orden de 10-100 veces más potentes pero con la característica de contener un nitrógeno en su secuencia. La introducción de un nitrógeno terciario ha producido nuevos compuestos del tipo de ibandronato y del olpadronato, que son aún más potentes inhibiendo la resorción ósea, y llegado a potencias inhibitorias de la resorción del orden de 10.000 o más, en relación al etidronato, en nuevos compuestos que contienen un átomo de nitrógeno en un anillo heterocíclico, como el zoledronato y el risendronato entre otros, cuya eficacia clínica está siendo evaluada en ensayos clínicos15.
El análisis de la relación entre estructura y potencia antirresortiva ha permitido establecer que la capacidad de los BP para inhibir la resorción ósea depende fundamentalmente de dos propiedades de la molécula: a) la acción de anclaje de los dos grupos fosfonados que junto con el grupo hidroxilo en posición R1 dan una mayor ligazón a la superficie ósea y b) la conformación estructural y tridimensional de la cadena lateral en R2, que influencia la capacidad para interaccionar con otras moléculas específicas y determina su actividad biológica.
Una vez dentro del osteoclasto, los BP pueden interferir diferentes procesos en los que participan compuestos afines al pirofosfato, lo que ha permitido clasificarlos en dos grupos en función de estos mecanismos16.
El primer grupo de BP se caracteriza químicamente por no contener un grupo N en su secuencia (clodronato, etidronato y tiludronato) y pueden ser metabolizados en el interior del osteoclasto e incorporados a análogos no hidrolizables de ATP. La acumulación de estos metabolitos frenaría la función osteoclástica y podría ocasionar la muerte celular. En estudios realizados en amebas (Dictoyostelium discoideum) se ha confirmado que estos BP dan lugar a la formación de análogos citotóxicos del adenosin-trifosfato que contienen P-C-P en los grupos fosfatos beta y gamma del ATP lo que lleva a inhibir la resorción ósea y causar la apoptosis del osteoclasto17. Las enzimas responsables de la incorporación de estos BP de cadena corta en estas moléculas han sido identificadas como aminoacil RNAt sintetasas. Los BP con cadenas largas, que contienen N en la cadena lateral R2 no pueden ser metabolizados, por impedir esta estructura su ligazón al sitio activo de la enzima.
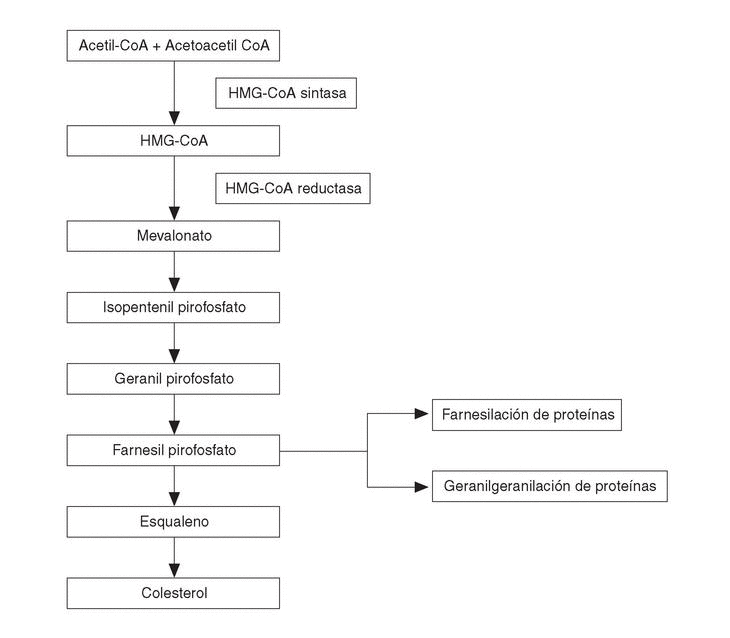
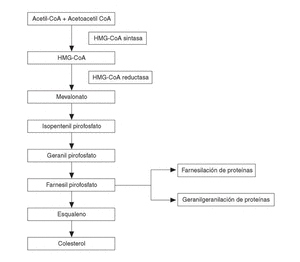
El segundo grupo de BP sería el de aquellos que contienen un grupo nitrógeno en su cadena lateral R2 (alendronato, pamidronato, residronato); éstos no son metabolizados y son más potentes inhibidores de la resorción ósea. Su mecanismo de acción sería a través de interferir con la vía del mevalonato (fig. 2). Esta vía metabólica es la que lleva a la producción de colesterol en el organismo, produciéndose en su metabolismo intermedio dos compuestos como el farnesildifosfato y el geranilgeranildifosfato, que a su vez son necesarios para la prenilación de pequeñas moléculas GTPasas, del tipo de Ras, Rho y Rac.
Figura 2. Esquema simplificado de la vía metabólica del mevalonato. Los bifosfonatos con grupo nitrógeno actúan sobre la vía biosintética del mevalonato, inhibiendo la síntesis de farnesil difosfato y su derivado el geranil geranil difosfato, que son intermediarios esenciales, puesto que los grupos lipídicos isoprenoides de estos compuestos son transferidos al extremo carboxilado de proteínas ligantes GTP (Ras, Rho y Rac) necesarios para la función osteoclástica.
Todos los átomos de carbono del colesterol endógeno derivan del acetil CoA, pero aún no son bien conocidos todos los detalles enzimáticos y mecanísticos. Desde el punto de vista de los BP, se acepta que la prenilación de estas pequeñas GTPasas (el grupo lipídico prenilado sirve de anclaje y participa en las interacciones proteínas-proteínas) es importante, dada su participación en la regulación de la función, morfología y estructura citoesquelética, así como en la rugosidad de las membranas, transporte de las vesículas y apoptosis de los osteoclastos. Los BP que contienen N actuarían frenando la resorción ósea a través de inhibir la vía del mevalonato, posiblemente disminuyendo la síntesis de geranilgeranildifosfato y de farnesildifosfato y por tanto impidiendo la prenilación de estas pequeñas proteínas (Ras, Rho y Rac) involucradas en la biología osteoclástica18. Sin embargo, hay que señalar que los lugares exactos en la vía del mevalonato en la que estos compuestos inciden están pendientes de ser identificados. La inhibición de la escualeno sintasa ha demostrado ser intensa con el ibandronato y más débil con el alendronato y pamidronato. Es posible incluso que BP como el alendronato y el pamidronato puedan inhibir enzimas involucradas a niveles por encima del colesterol, en parte por comportarse como sustratos análogos del isoprenoide difosfato (necesario para la correcta función de proteínas involucradas en la función celular).
En resumen, se están sentando las bases para dilucidar el mecanismo de acción a nivel molecular de los BP, estableciéndose la relación estructura-actividad y un mejor conocimiento de sus efectos bioquímicos y acciones en diferentes enfermedades metabólicas óseas.