INTRODUCCIÓN
La vitamina D3 se obtiene básicamente de la piel donde se sintetiza bajo la influencia de los rayos ultravioleta solares, y posteriormente sufre una hidroxilación en el hígado para convertirse en 25-hidroxi-vitamina D3 (25-OHD3). Ambos metabolitos, vitamina D3 y 25-OHD3, entre otros, se utilizan como fármacos en la prevención y en el tratamiento del déficit de vitamina D. Está poco estudiada la dosis y el tiempo que se precisa para normalizar los niveles séricos de 25-OHD3 en pacientes con déficit de vitamina D. La dosis de vitamina D3 o colecalciferol habitualmente utilizada es de 800 UI al día, aunque algunos autores la consideran insuficiente para corregir el déficit de vitamina D. No está estandarizada la dosis diaria necesaria de 25-OHD3 o calcidiol, y además son muy escasos los estudios comparativos entre ambos metabolitos. En el presente trabajo nos propusimos dos objetivos:
1) Valorar la eficacia de una pauta de calcidiol para corregir en poco tiempo (un mes) el déficit sanguíneo de vitamina D y compensar el hiperparatiroidismo secundario en pacientes con déficit de vitamina D.
2) Comparar la eficacia de un tratamiento con calcidiol o con colecalciferol para mantener normales los niveles séricos de vitamina D y mantener compensado el hiperparatiroidismo secundario en pacientes con niveles ya previamente normalizados de 25-OHD3.
MATERIALES Y MÉTODOS
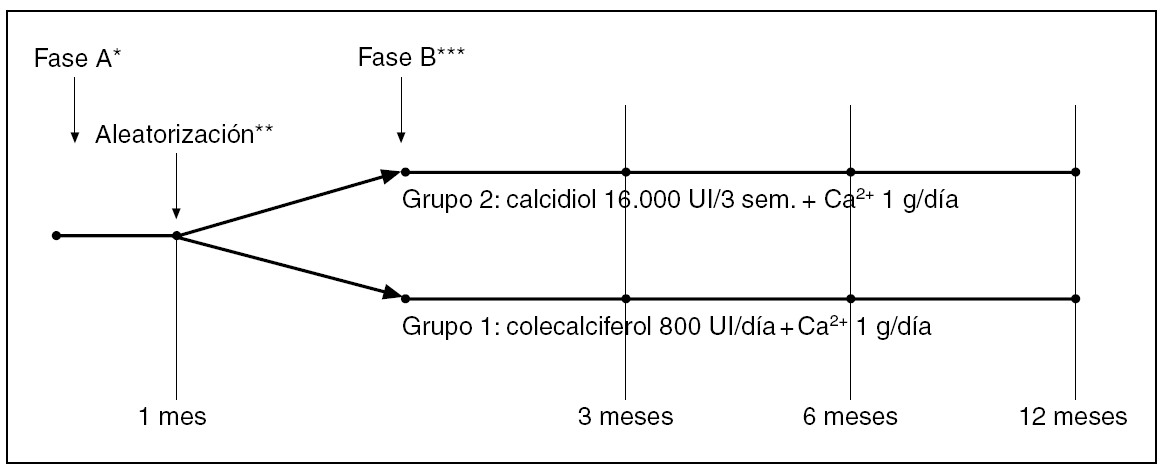
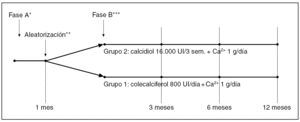
Estudio prospectivo que incluye dos fases (A y B) (fig. 1). En la fase A, de normalización de niveles séricos de 25-OHD3, se incluyeron de forma consecutiva todos los individuos mayores de 18 años que presentaban déficit de vitamina D, sin insuficiencia renal, procedentes de una consulta ambulatoria de reumatología. Los pacientes consultaban por diversas enfermedades del aparato locomotor y presentaban en todos los casos una escasa exposición solar, que hizo sospechar la presencia de hipovitaminosis D. Se consideró déficit de vitamina D la existencia de unos niveles séricos de 25-OHD3 inferiores a 25 ng/ml. Se valoró la presencia de hiperparatiroidismo secundario considerando como tal unas concentraciones de hormona paratiroidea intacta (PTHi) sérica superiores a 65 pg/ml, y excluyendo a los pacientes con insuficiencia renal (creatinina superior a 1,3 mg/dl en mujeres y creatinina superior a 1,5 mg/dl en varones, cifras a partir de las cuales se considera que se puede desencadenar hiperparatiroidismo secundario1). Todos los pacientes realizaron un tratamiento con calcidiol 16.000 UI por vía oral en dosis única semanal y durante 4 semanas, que se asoció a un aporte diario mínimo de 1g de Ca++. Esta pauta terapéutica se decidió en base a su eficacia que demostramos en un estudio piloto previo2. Se valoró el porcentaje de pacientes que normalizaron los niveles de PTHi y de 25-OHD3. El reclutamiento se realizó entre enero del 2001 y enero de 2005. De todos los pacientes se recogieron edad y sexo, y se determinaron, al inicio y al final del tratamiento: calcio (Ca), fósforo (P), creatinina, fosfatasa alcalina (FA), 25-OHD3 y PTHi en sangre y calciuria de 24 horas en orina. Al concluir este tratamiento se realizó la fase B de mantenimiento de niveles séricos de 25-OHD3, de un año de duración y diseñada como ensayo terapéutico aleatorizado abierto en el que se incluyeron todos los pacientes que habían corregido niveles de vitamina D en la fase anterior. Se valoró el porcentaje de pacientes que mantenían los niveles de PTHi y de 25-OHD3. No hubo enmascaramiento de los tratamientos excepto para el responsable de efectuar las determinaciones analíticas, y los pacientes se distribuyeron aleatoriamente según su número de historia clínica par o impar en dos grupos: a) grupo 1: 800 UI de colecalciferol oral junto a un aporte de calcio no inferior a 1 g al día (habitualmente 1 g de aporte farmacológico además del aporte de la dieta) y b) grupo 2: calcidiol 16.000 UI oral, una dosis cada tres semanas, junto al mismo aporte de calcio diariamente. A los 3, 6 y 12 meses se realizaron controles analíticos. Decidimos esta dosis de calcidiol cada tres semanas, ya que se corresponde a la suma de la dosis diaria aconsejada de colecalciferol durante este período. A lo largo del estudio los pacientes que no seguían correctamente el tratamiento eran retirados del mismo. También fueron retirados si presentaban concentraciones séricas de 25-OHD3 superiores a 110 ng/ ml, hipercalcemia u otros signos de hipervitaminosis D. Las determinaciones de Ca, P y FA se realizaron en un autoanalizador de bioquímica Hitachi 717 (Roche Diagnostics, Mannheim, Alemania) con los reactivos de la propia casa comercial, siendo sus valores de referencia: Ca 8,4-10,2 mg/dl, P 2,7-4,5 mg/dl y FA 35-104 U/l. Se consideraron normales unas concentraciones de 25-OHD3 (radioinmunoensayo, DIA Sorin, Minnesota, EE.UU.) entre 25-95 ng/ ml, cifra que supone X ± 3 desviaciones estándar (DE) (98 percentil) de la normalidad de nuestro laboratorio. La PTHi se determinó por radioinmunoensayo (Nichols Institute, California, EE. UU.), siendo los valores de referencia entre 10-65 pg/ ml. Los pacientes fueron informados y dieron su consentimiento para participar en el estudio.
Fig. 1. Esquema terapéutico del estudio.*Normalización de niveles de 25-OHD3. **Aleatorización par impar según el número de historia clínica. ***Mantenimiento de niveles de 25-OHD3.
ANÁLISIS ESTADÍSTICO
El análisis estadístico se realizó por protocolo de tratamiento, utilizando el paquete estadístico SPSS 13.0. Las variables cualitativas se expresan en porcentajes, mientras que las cuantitativas se expresan en forma de -x [DE]. Para el análisis de las variables cualitativas se utilizó la distribución de Chi cuadrado y para las variables cuantitativas la comparación entre las medias, utilizando la distribución «t» de Student cuando se comparaban dos grupos y el análisis de la varianza de un factor cuando se comparaban más de dos grupos. Se consideraron significativas las diferencias con una p # 0,05.
RESULTADOS
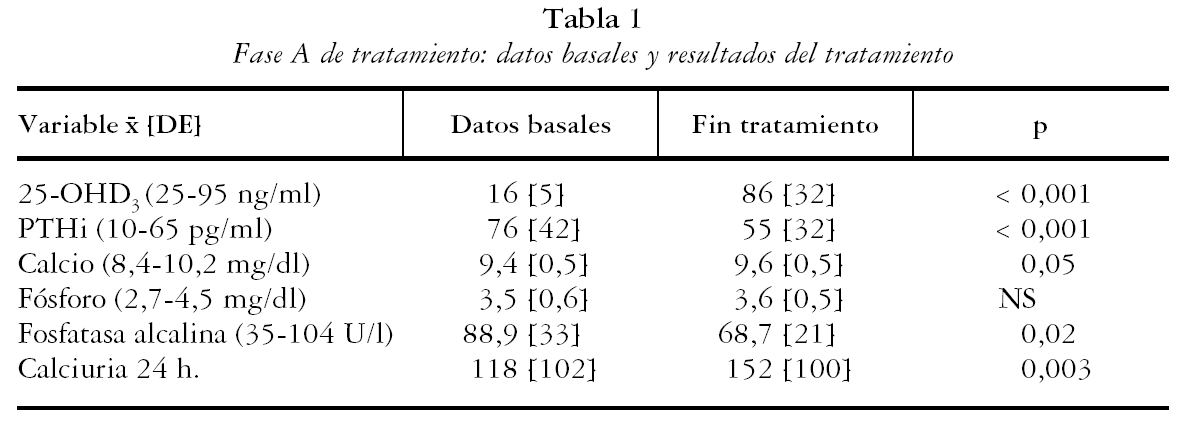
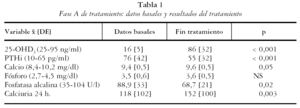
En el período de estudio se incluyeron 129 individuos con déficit de vitamina D, 20 hombres y 109 mujeres (85%), con una edad de 72,4 [10] años (27-92 años). El diagnóstico de los pacientes era: osteoporosis 73%, artritis reumatoide u otro reumatismo inflamatorio 19%, artrosis 3% y otros diagnósticos un 5%. El valor medio de 25-OHD3 basal fue de 16 [5] ng/ml y el de la PTHi 76 [42]. El 52% de los pacientes presentaba hiperparatiroidismo secundario. El resto de los datos basales de los pacientes se detallan en la tabla 1.
RESULTADOS DE LA FASE A DE NORMALIZACIÓN DE NIVELES DE 25-OHD3
Al mes del tratamiento la concentración de 25-OHD3 del grupo fue de 86 [32] ng/ml (p = < 0,001) y 124 pacientes (96%) normalizaron los niveles séricos de vitamina D (tabla 1). La PTHi disminuyó de forma significativa en el grupo (55 [32] pg/ml; p = < 0,001) y el hiperparatiroidismo secundario se observó en 15 pacientes (12%). En el 38% de los casos (47 de 124) se alcanzaron concentraciones de 25-OHD3 superiores al rango de la normalidad, con discreta hipercalcemia (Ca máximo 10,4) en 10 pacientes (8%), y sin otros signos ni síntomas de toxicidad. En la tabla 1 se observan las concentraciones medias de Ca, P, FA y calciuria al concluir el tratamiento, que comportó una discreta pero significativa disminución de FA (p = 0,02) y un aumento de la calciuria de 24 horas (p= 0,003). Los 5 pacientes (4%) que no normalizaron niveles 25-OHD3 fueron retirados del estudio.
RESULTADOS DE LA FASE B DE MANTENIMIENTO DE NIVELES DE 25-OHD3
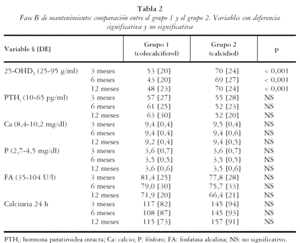
Los 124 pacientes que presentaban niveles de 25-OHD3 normales, y en función del sistema de aleatorización del estudio, se distribuyeron en 53 pacientes en el grupo 1 (colecalciferol) y 71 pacientes en el grupo 2 (calcidiol). Los dos grupos eran homogéneos en cuanto a edad (73 [8] grupo 1 frente a 72 [11] grupo 2; p = NS), sexo (mujeres 89% frente a 83%; p = NS), enfermedad basal (p= NS) y niveles séricos de 25-OHD3 (17 [5] frente a 16 [5]; p = NS), PTHi (78 [44] frente a 74 [41]; p = NS), Ca (9,5 [0,5] frente a 9,4 [0,5]; p = NS), P (3,7 [0,6] frente a 3,5 [0,6]; p = NS), FA (92,3 [37] frente a 86,1 [29]; p = NS) y calciuria (110 [117] frente a 122 [84]; p = NS). Al final del seguimiento se excluyeron del estudio 27 pacientes en cada grupo, lo que representa el 51% del gupo 1 y el 38% del grupo 2. Las causas de exclusión fueron: violación de protocolo, exitus y pérdidas de seguimiento.
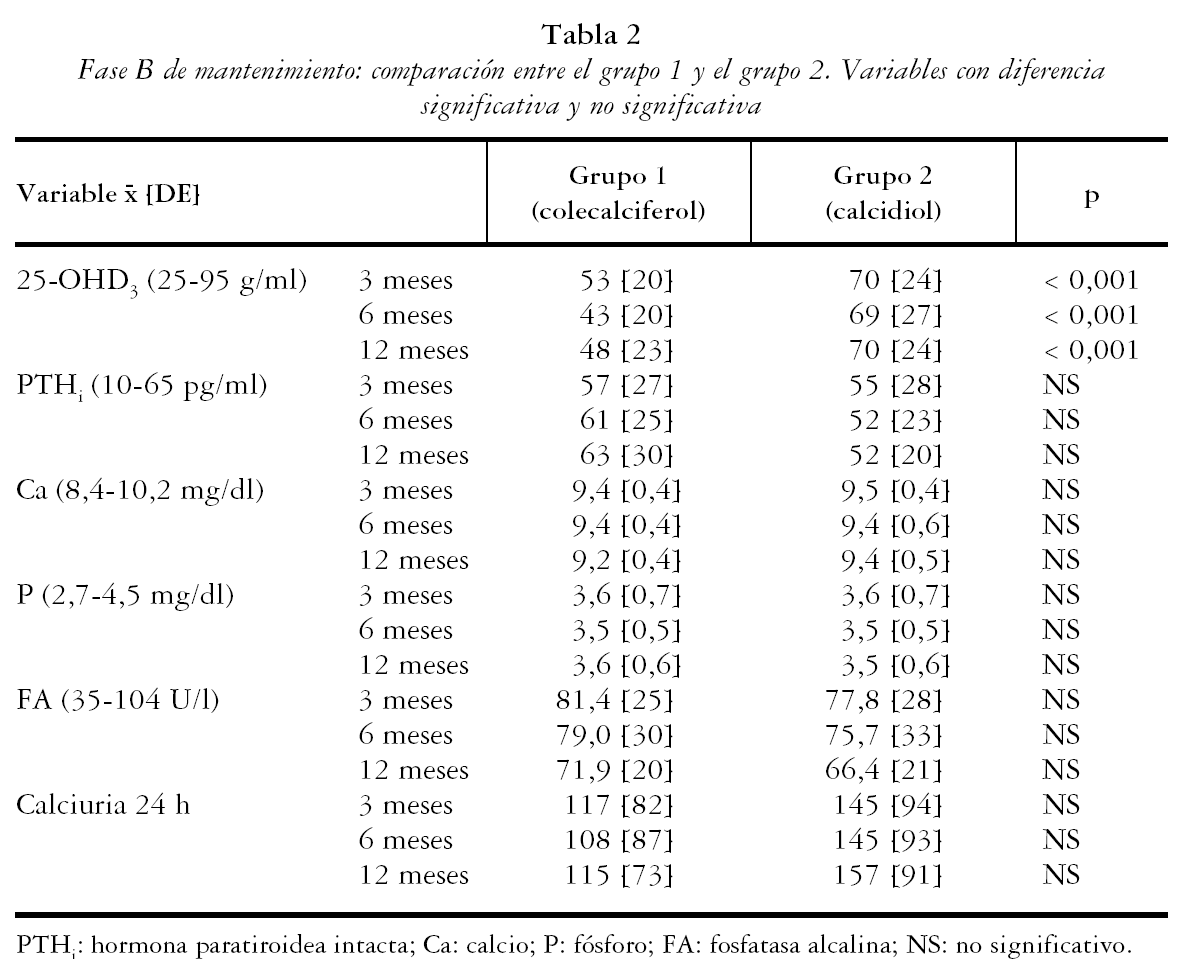
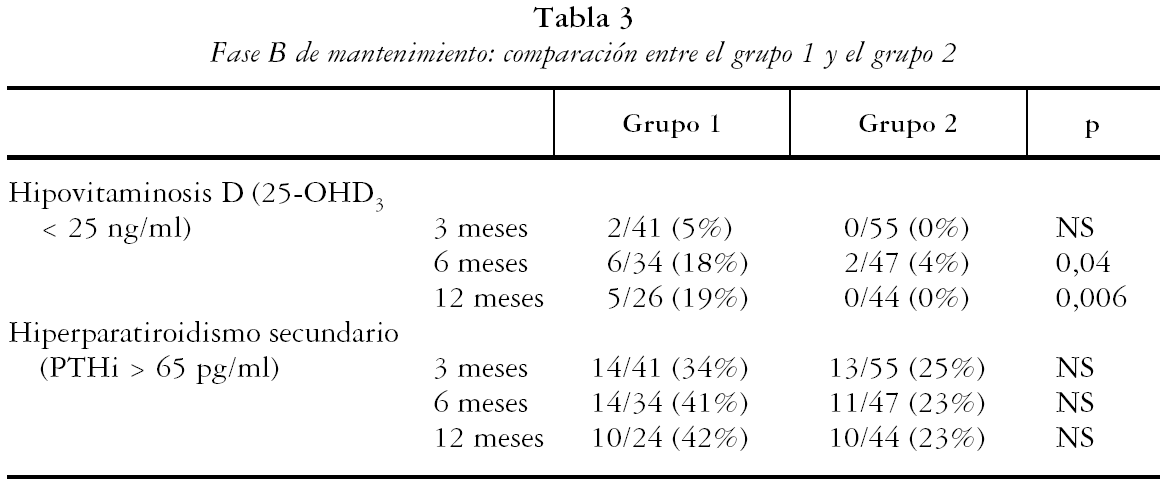
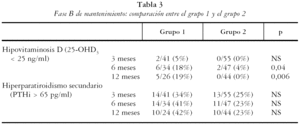
En la tabla 2 se muestran los resultados de los pacientes que continuaron en el estudio. Los valores medios de 25-OHD3 en el grupo 1 respecto del 2 fueron de: a los 3 meses 53 [20] frente a 70 [24]; p < 0,001, a los 6 meses 43 [20] frente a 69 [27]; p < 0,001 y a los 12 meses 48 [23] frente a 70 [24]; p < 0,001 respectivamente. Las concentraciones de PTHi fueron algo inferiores en el grupo 2 de tratamiento, pero sin alcanzar diferencias significativas, mientras que las de P, Ca, FA y calciuria fueron normales y semejantes en los tres controles, en ambos grupos de tratamiento (p = NS). El porcentaje de pacientes que mantenían niveles adecuados de 25-OHD3 (tabla 3) fue semejante entre ambos grupos en el primer control, pero con colecalciferol (grupo 1) un mayor porcentaje de individuos mostró niveles inferiores a 25 ng/ml, tanto a los 6 meses (6/34 [18%] frente a 2/47 [4%], p = 0,04) como a los 12 meses (5/26 [19%] frente a 0/44 [0%]; p = 0,006). El porcentaje de pacientes con hiperparatiroidismo secundario del grupo 1 respecto del 2 fue de: a los 3 meses 34% frente a 25% (NS), a los 6 meses 41% frente a 23% (NS), a los 12 meses 42% frente a 22% (NS).
DISCUSIÓN
En nuestro estudio, y utilizando una pauta de tratamiento con calcidiol, con un total de 64.000 UI administradas, se consigue que en un mes el 96% de pacientes compense el déficit de vitamina D, sin efectos secundarios valorables, y que un 92,5% de ellos consiga niveles de 25-OHD3 por encima de 40 ng/ml. Por debajo de esta concentración existe un nivel subóptimo de vitamina D con grados variables de hiperparatiroidismo3,4, y por ello diversos autores consideran que éste sería el nivel sérico de 25-OHD3 mínimo deseable. Para conseguir este objetivo utilizando vitamina D2 se requieren dosis de 10.000 UI diarias y tres meses de tratamiento5, y utilizando el tratamiento clásico con 800 UI al día de colecalciferol se precisan 18 ± 6 meses para alcanzar niveles séricos de 25-OHD3 superiores a 18 ng/ml6. Una tercera parte de los pacientes después del mes de tratamiento con calcidiol mostraron nieveles séricos de 25-OHD3 superiores a los 95 ng/ml considerados normales, aunque no se acompañaron de síntomas ni signos de toxicidad, ni motivaron la retirada del tratamiento. A la vista de nuestros resultados nos parece que la pauta que hemos utilizado es sumamente eficaz y segura para compensar en poco tiempo el déficit de vitamina D. El otro aspecto a considerar es la capacidad del tratamiento sustitutivo para mantener normalizados los niveles séricos de 25-OHD3. En nuestro estudio ambas dosis utilizadas se mostraron útiles para mantener dentro de la normalidad los niveles de 25-OHD3 en los pacientes que siguieron el protocolo, aunque calcidiol consigue mantener niveles séricos más elevados. El calcidiol es un metabolito con actividad biológica directa7, y su administración oral, única o mantenida, determina un rápido incremento, dosisdependiente, de los niveles séricos de 25-OHD38, requiriéndose además dosis menores que con la administración de vitamina D2 o D38,9, incluso 10 veces inferiores según algunos autores9. Estos datos apoyarían que este metabolito tiene un potencial terapéutico superior en la prevención y tratamiento de la deficiencia de vitamina D. En los ensayos terapéuticos clásicos sobre vitamina D se ha descrito que dosis de 700-800 UI de colecalciferol al día han sido suficientes para mantener niveles de 25-OHD3 alrededor de 40 ng/ml en ancianos sanos10,11, pero estos estudios también presentan sus limitaciones, pues no es bien conocido el grado de deficiencia vitamínica del grupo estudiado. En el ensayo sobre prevención primaria de fracturas del grupo de Chapuy10 se determinaron niveles séricos de 25-OHD3 sólo en 142 ancianas de las 3.270 participantes, y se asumió que el resultado obtenido (14,5 ± 10 ng/ml, rango de normalidad 15-50 ng/ml) era representativo de la deficiencia basal del grupo. En el estudio que Dawson-Hughes11 et al realizaron con el mismo objetivo, el grupo de 389 ancianos incluidos tenía unos valores de 25-OHD3 basales de 33 ng/ml, y con 700 UI de colecalciferol estos niveles aumentaron 11,8 ± 11,6 ng/ml en el control a tres años; discreto aumento e insuficiente para normalizar las concentraciones séricas en caso de deficiencia más severa, como también se deduce de otros estudios12,13, donde la utilización de 800 UI al día de colecalciferol consigue sólo aumentar en 8 ng/ml las concentraciones de 25-OHD3 basales. Para otros autores de nuestro país la dosis de 800 UI al día de colecalciferol sería insuficiente para mantener unas concentraciones sanguíneas de 25-OHD3 adecuadas14, tanto en pacientes que reciben únicamente este metabolito como en los que han recibido una dosis inicial de 80.000 UI de calcidiol, en un modelo de tratamiento semejante al utilizado en nuestro estudio. De todas formas los mismos autores no descartan la coexistencia de un cumplimiento deficiente del tratamiento, circunstancia que se ha intentado evitar en nuestro estudio retirando los pacientes ante la sospecha de cualquier trasgresión del mismo. Es un hecho descrito la alta tasa de abandonos que se observa con el tratamiento de calcio y vitamina D15-17, y sobre todo en ancianos, tal como ocurre en nuestro estudio. En este sentido el análisis por protocolo que hemos realizado ha permitido demostrar la eficacia de ambos tratamientos cuando éstos son seguidos correctamente. Sin embargo, no podemos obviar que la alta tasa de abandonos observada limita la utilidad práctica de ambos tratamientos; si bien, el calcidiol se mostró en nuestro estudio sensiblemente superior en términos de adherencia al colecalciferol.
Existe discrepancia sobre la capacidad del tratamiento con Ca y vitamina D para la prevención primaria o secundaria de fracturas, eficacia demostrada en los estudios iniciales como el de Chapuy10, y contrariamente no en otros más recientes como el RECORD17. Ambos estudios, realizados con gran número de participantes (3.270 y 5.292 respectivamente) presentan las mismas limitaciones, como no conocer realmente la dotación de vitamina D basal de los individuos estudiados (sólo se determinaron concentraciones séricas de 25-OHD3 en un 4,3 y un 1,1% de individuos respectivamente), y desconocer si las pautas de 700-800 UI de colecalciferol al día fueron capaces de normalizar los niveles séricos de 25-OHD3. Probablemente serán precisos estudios con determinaciones de 25-OHD3 en grandes poblaciones, que nos permitan deducir las dosis necesarias para mantener unos niveles séricos óptimos de vitamina D, como premisa previa a valorar el efecto protector de la vitamina D sobre las fracturas óseas.
En conclusión, en nuestro estudio hemos demostrado que una pauta de 16.000 UI de calcidiol semanal, durante 4 semanas, es sumamente eficaz y segura para normalizar los niveles séricos de 25-OHD3 y de PTHi en pacientes con déficit de vitamina D. El calcidiol y el colecalciferol son metabolitos eficaces para mantener niveles de vitamina D en los pacientes que cumplen correctamente el tratamiento, aunque el calcidiol consigue niveles séricos más elevados. La eficacia de estos tratamientos está limitada por la baja adherencia a los mismos.
AGRADECIMIENTOS
A las Sras. M.a Elena Fernández y Cristina Aymerich, diplomadas en Enfermería, por la colaboración en la realización de este estudio.
Correspondencia: M. Larrosa Padró.
Unidad de Reumatología.
Hospital de Sabadell. Institut Universitary Parc Taulí (UAB).
Parc Taulí s/n.
08208 Sabadell. Barcelona. España.
Correo electrónico: mlarrosa@cspt.es