INTRODUCCION
La diabetes mellitus, cuarta causa de muerte en los países desarrollados, constituye una amenaza creciente para la salud mundial. En 2003, la Federación Internacional de Diabetes calculó que 194 millones de personas eran diabéticas en la población mundial. Se calcula que para el año 2025 esta cifra aumentará hasta alcanzar los 333 millones (el 6% de la población mundial vivirá con diabetes).
La diabetes mellitus describe un desorden metabólico multifactorial caracterizado por una hiperglucemia crónica consecuencia de defectos en la secreción y/o en las acciones de la insulina. Puesto que la deficiente acción de la insulina se asocia a alteraciones en el metabolismo de carbohidratos, grasas y proteínas en los tejidos en los que actúa, los efectos a largo plazo de la diabetes mellitus incluyen disfunciones de varios órganos: retinopatía (32-42% de los pacientes con diabetes tipos 1 y 2, respectivamente); nefropatía (12-14% en diabéticos tipos 1 y 2), que puede conducir al fallo renal; neuropatía (13-24% de los diabéticos tipos 1 y 2); y alteraciones cardiovasculares1.
La mayoría de los casos de diabetes corresponden al tipo 1, y es consecuencia de la destrucción de las células beta de los islotes pancreáticos, asociada a mecanismos proinflamatorios que desencadenan un proceso autoinmune. La diabetes tipo 2 se atribuye a defectos en la secreción de insulina y a la resistencia a esta hormona. La insulino-resistencia es una condición necesaria pero no suficiente para desarrollar este tipo de diabetes, ya que se precisan otros factores (ambientales y genéticos) que amplifiquen o modulen su aparición. Así, la obesidad, el envejecimiento y otros factores relacionados con el estilo de vida y la alimentación están íntimamente relacionados con la diabetes tipo 22. Mientras que la prevalencia media en España de este tipo de diabetes está entre el 5 y el 10% (incluyendo las diferencias entre sexos y grupos de edad), por encima de los 70 años la prevalencia alcanza al 25% de la población3.
Sustancias como el ácido nicotínico, los glucocorticoides, la hormona tiroidea, los agonistas α y β-adrenérgicos y el interferón-α, pueden inducir diabetes e hiperglucemia a través de la alteración de la secreción de insulina2.
DIABETES MELLITUS Y OSTEOPOROSIS
La osteoporosis es una enfermedad caracterizada por una densidad de masa ósea (DMO) baja y por un deterioro estructural del tejido óseo; factores ambos que provocan un incremento en la fragilidad del hueso y su mayor susceptibilidad a las fracturas, especialmente en la cadera y en la columna vertebral4. En la osteoporosis existe una alteración del remodelado óseo debida a dos causas fundamentales, que normalmente aparecen asociadas: a) un aumento de las unidades de remodelado óseo, y b) un predominio de la resorción sobre la formación ósea5,6.
La osteoporosis es una patología multifactorial cuyo origen se asocia a la edad y a la menopausia (osteoporosis primaria), al tratamiento prolongado con ciertos fármacos (por ejemplo, glucocorticoides) o a otros factores de riesgo, entre los que se encuentran algunos síndromes endocrinos. En esta última categoría se encuadraría la diabetes tipo 1, en la que la osteopenia es un hallazgo frecuente (el 50% de los adolescentes diabéticos tienen una menor DMO cortical y trabecular de antebrazo), que puede evolucionar a osteoporosis a largo plazo7.La pérdida de masa ósea en estos pacientes se asocia a la edad temprana de diagnóstico de la diabetes, a la duración de la enfermedad, al deficiente control glucémico y a las dosis elevadas de insulina8,9. Numerosos estudios caso-control llevados a cabo en estos pacientes han demostrado un riesgo de fracturas óseas, sobre todo de cadera, significativamente mayor en individuos diabéticos que en no diabéticos10. En el caso de mujeres postmenopáusicas, esta diferencia se eleva a un riesgo entre 7 y 12 veces mayor en diabéticas11,12.
En pacientes con diabetes tipo 2 se han encontrado densidades óseas tanto por encima como por debajo de la DMO media; por lo que la relación de esta enfermedad con la osteoporosis es menos clara. Estas variaciones se han atribuido a la heterogeneidad de las poblaciones estudiadas (por ejemplo, asociación de mayor o menor grado de obesidad) y/o a las diferentes metodologías utilizadas13,14. En el único caso en que se ha observado un aumento claro del riesgo de fracturas en la diabetes tipo 2 corresponde a las fracturas del pie. Este hecho se ha relacionado con el pie de Charcot una neuropatía periférica severa característica de la diabetes asociada a osteopenia focal y con otras complicaciones de la diabetes independientes de la calidad ósea, como la obesidad15,16.
Aunque los factores que definen los grupos de riesgo de osteoporosis en la población general (edad, genética, estado hormonal, hábitos alimenticios, etc.) se aplican a los pacientes diabéticos, en éstos aparecen factores específicos asociados a la pérdida de masa ósea y al riesgo de fracturas tales como: un mal control glucémico; complicaciones de la diabetes (por ejemplo, neuropatía, retinopatía, hipotensión); y otras dolencias asociadas a esta enfermedad (por ejemplo, enfermedad de Grave, celiaquía, amenorrea y pubertad retrasada)8.
FACTORES IMPLICADOS EN LA OSTEOPOROSIS ASOCIADA A DIABETES MELLITUS
Como se ha indicado anteriormente, el mal control metabólico en la diabetes tipo 1 puede dar lugar a diversos efectos deletéreos para el esqueleto: a) disminución en la tasa de formación ósea durante la pubertad; b) osteopenia/osteoporosis y aumento del riesgo de fracturas en la etapa adulta; y c) disminución de la calidad del hueso regenerado tras la fractura. Además,se pueden dar malformaciones esqueléticas durante la gestación en caso de diabetes materna, debido a defectos en la formación ósea (por ejemplo, hipoplasia focal femoral, aplasia radial)17. En cualquier caso, la osteopenia en los pacientes con diabetes tipo 1 se recupera a medio plazo con insulinoterapia y un adecuado control glucémico.
Aunque la relación entre la diabetes tipo 1 y la osteoporosis se conoce bien desde el punto de vista epidemiológico, no son tan bien conocidos los mecanismos fisiopatológicos subyacentes. En este sentido, una variedad de factores endocrinos y/o locales parecen ejercer acciones sobre el metabolismo óseo en el estado diabético.
LA INSULINA
A nivel celular, se han detectado receptores para insulina en los osteoblastos18. Diversos estudios animales demuestran que la insulina estimula el metabolismo óseo independientemente de otros factores de crecimiento, hormonas o citoquinas19.
El tratamiento con insulina en animales diabéticos normaliza la DMO y los marcadores de remodelado óseo20. Asimismo, el déficit de insulina parece desempeñar un papel importante en la osteopenia asociada a la diabetes en humanos. Un estudio llevado a cabo en pacientes con diabetes tipo 1 ha demostrado una normalización de la DMO, asociada a una disminución de marcadores de remodelado óseo, tras 7 años de administración de insulina21. En otro estudio llevado a cabo en sujetos de edad avanzada y diabetes tipo 2, se encontró una correlación entre las concentraciones elevadas de glucosa y de insulina en plasma con una elevada DMO, asociada a una disminución en el porcentaje de fracturas22.
Por otra parte, el tratamiento con insulina se ha asociado al incremento del riesgo de fractura de cadera en sujetos diabéticos. De hecho, la duración del tratamiento con insulina podría ser un buen predictor de este riesgo de fracturas, especialmente en mujeres con diabetes tipo 2. Esto podría estar relacionado con el hecho de que la administración periódica de insulina conlleva un mayor riesgo de episodios de hipoglucemia y de caídas asociadas23.
EL FACTOR SIMILAR A LA INSULINA TIPO 1
El factor similar a la insulina tipo 1 (IGF-1) a través de su receptor regula tanto el crecimiento como la diferenciación en células de estirpe osteoblástica. Así, este factor estimula la proliferación y la diferenciación de los precursores osteoblásticos, y potencia la síntesis de colágeno tipo 1, disminuye su degradación y aumenta la mineralización en los osteoblastos maduros. El IGF-1 queda atrapado en la matriz ósea, siendo liberado en la fase de resorción, de modo similar a otros factores locales moduladores del remodelado óseo24.
Éste péptido se ha relacionado con la patogenia de la pérdida de masa ósea asociada a la diabetes. Así, las ratas diabéticas poseen bajos niveles circulantes de este factor25; de modo similar a los observados en pacientes con diabetes tipo 1 y osteoporosis del cuello femoral26. Además, estos pacientes presentan niveles séricos disminuidos de la proteína ligadora del IGF-1 tipo 3 (IGFBP-3) y aumentados los de IGFBP-1. Sin embargo, en un grupo de pacientes con diabetes tipo 2, que presentan una DMO disminuida (aunque mayor que en los de tipo 1), se han encontrado niveles séricos normales de IGF-1 y disminuidos los de IGFBP-3, pero ligeramente aumentados los de IGFBP-1. Los niveles de IGFBP-5 parecen ser similares en ambos tipos de diabéticos, aunque muy por debajo de los de los controles no diabéticos24. Por otro lado, el tratamiento con IGF-1 recupera el crecimiento óseo normal en ratas diabéticas27. No obstante, la administración de este factor en dos estudios independientes, durante 28 días y 6 meses, respectivamente, a mujeres postmenopáusicas no tuvo como resultado un aumento de la DMO, aunque sí de algunos marcadores de formación ósea28.
LA AMILINA
La amilina es un péptido de 37 aminoácidos cosecretado con la insulina por las células b pancreáticas. Este péptido regula la ingesta y absorción de nutrientes por distintos mecanismos: inhibiendo el apetito, ralentizando el vaciado gástrico, regulando la secreción enzimática y de ácido en el estómago, e inhibiendo la secreción de glucagón estimulada por nutrientes29.
Este factor estimula la proliferación de osteoblastos in vitro y actúa, probablemente a través del receptor de la calcitonina, reduciendo el desarrollo y la actividad de los osteoclastos, así como la resorción ósea30. La amilina produce efectos positivos sobre la masa ósea en roedores. Así, la administración sistémica diaria de este péptido durante 4 semanas se asocia a un incremento del 70% del volumen óseo trabecular de la tibia de ratones adultos. El péptido relacionado con la amilina, la adrenomedulina, secretada por los islotes pancreáticos, es anabólico para los osteoblastos. Los efectos proliferativos de ambos péptidos parecen dependientes del receptor del IGF-I31.
La amilina se ha detectado en el suero de pacientes con diabetes tipo 2 (pero no en los de tipo 1). En ratas diabéticas tratadas con amilina, insulina o ambas, la DMO recupera valores normales tras 40 días de tratamiento. Este efecto se asocia a la normalización de la osteocalcina circulante y de la excreción urinaria de deoxipiridinolina (aunque este último efecto se observó sólo con la combinación de ambos péptidos)32.
LA LEPTINA
La leptina es una hormona polipeptídica de 116 aminoácidos producida principalmente por las células del tejido adiposo blanco. Además de su papel anorexígeno y regulador del balance energético, sus receptores están distribuidos por células y tejidos del organismo, donde modula diferentes ejes endocrinos: actúa sobre el desarrollo sexual y la reproducción; sobre la función gastrointestinal; modula la hematopoyesis; y estimula la angiogénesis. La leptina lleva a cabo sus acciones sobre el hueso a través de dos mecanismos: a) directo, estimulando la formación y el crecimiento óseo e inhibiendo la resorción ósea y b) indirecto, inhibiendo a través del hipotálamo la formación ósea y probablemente también la resorción ósea33. La leptina inhibe la expresión del ligando del receptor activador del factor nuclear-kB (RANKL) e induce la de osteoprotegerina (OPG), receptor señuelo del RANKL, impidiendo así su unión al RANK en los osteoclastos y sus precursores estromales34,35. Además, la leptina posee receptores en condrocitos, en los que induce su proliferación y diferenciación; un efecto que podría ser directo o a través del IGF-1. Sin embargo, la leptina es capaz de estimular el crecimiento óseo, independientemente de este factor33.
En mujeres posmenopáusicas con fracturas vertebrales, los niveles séricos de leptina se encuentran disminuidos. Así, se ha propuesto que la leptina protege al hueso de la fractura aumentando la resistencia ósea y su grosor cortical36. Esta proteína podría estar implicada en la mayor osteogénesis observada en individuos obesos o en pacientes con diabetes tipo 2.
LA PREPTINA
La preptina es una hormona peptídica de 34 aminoácidos, correspondiente a la secuencia 69-102 del pro-IGF-2, que incrementa la secreción de insulina mediada por glucosa. Recientemente, esta hormona ha sido aislada de vesículas secretoras de insulina y amilina en las células β de los islotes pancreáticos37. La preptina ejerce acciones anabólicas en los osteoblastos in vitro pero no afecta a la actividad osteoclástica. In vivo, la administración local de esta hormona incrementa la formación de hueso en ratones macho adultos38.
LAS HORMONAS INTESTINALES
Se conoce la existencia de un ritmo circadiano (independiente del sexo o la edad de los sujetos) que afecta a los marcadores del remodelado óseo, con niveles diurnos bajos y nocturnos elevados39. Estas variaciones se atribuyen al estado nutricional. Así, el ayuno prolongado inhibe predominantemente la resorción ósea, que a su vez aumenta significativamente en el período nocturno40. En individuos obesos, la frecuencia en la ingestión de alimentos puede tener como resultado una prolongada supresión del remodelado óseo y un aumento de la DMO; de hecho, la misma dieta, pero fraccionada, produce un aumento neto de la masa ósea41.
En los últimos años, se ha comenzado a explorar el papel de las incretinas intestinales, particularmente el péptido similar al glucagón GLP-1 y el GLP-2 derivados del proglucagón, en la respuesta aguda postprandial de la resorción ósea. Se ha sugerido la existencia de un eje entero-óseo por el que la acción de estas hormonas canalizaría nutrientes hacia el tejido óseo42. El GLP-1 posee una potente actividad insulinotrópica y propiedades antidiabéticas independientes de los niveles de insulina circulante. Además, tiene acciones directas sobre el metabolismo de la glucosa en tejidos extrapancreáticos (hígado, músculo esquelético y tejido adiposo) participantes en la homeostasis de la glucosa. Un estudio reciente realizado en sujetos sanos ha demostrado una reducción significativa del telopéptido C-terminal del colágeno tipo 1, un marcador de resorción ósea, tras la administración subcutánea de GLP-1 en el transcurso de una sobrecarga intravenosa de glucosa43.
El GLP-2, un péptido modulador del crecimiento epitelial y del transporte de glucosa en el intestino, parece ejercer efectos directos sobre el remodelado óseo. Así, se han publicado aumentos moderados de DMO tanto en la cadera como en las vértebras de pacientes con síndrome de «intestino corto» (short-bowel)44. Es posible que este efecto anabólico óseo esté relacionado con mecanismos neuroendocrinos aún sin identificar, ya que se han detectado receptores para GLP-2 en el sistema nervioso central y en los ganglios mientéricos. De cualquier modo, dosis farmacológicas de GLP-2 parecen disminuir la resorción ósea sin cambios en la formación, inclinando así el balance del remodelado óseo hacia esta última45. Esta observación plantea nuevos retos terapéuticos en las patologías asociadas a un aumento del remodelado óseo.
FACTORES VASCULARES
Una de las complicaciones más conocidas de la diabetes es la microangiopatía. Teniendo en cuenta la relación entre vascularización y formación ósea, la alteración de la primera podría estar relacionada con una pérdida de masa ósea asociada al estado diabético. De hecho, en un estudio prospectivo llevado a cabo en pacientes no diabéticos con osteoporosis, se asociaron los bajos niveles de riego sanguíneo en las extremidades inferiores con la disminución de la DMO46. Sin embargo, los resultados en este sentido en la diabetes son contradictorios. En un estudio realizado con ratas Cohen diabéticas no obesas, se ha demostrado que el desarrollo de osteoporosis precede al de la microangiopatía; por lo que ésta podría ser más un efecto que una causa de la osteoporosis47.
LA VITAMINA D
En ratas BB (Bio-Breeding) diabéticas, existe una disminución en la absorción duodenal de calcio48. En este sentido, se han observado anomalías en el metabolismo de la vitamina D en animales diabéticos, con una supresión del 1,25 (OH)2D3 y la consecuente alteración en el remodelado óseo. Además, se han hallado niveles disminuidos de vitamina D en niños y adolescentes diabéticos con mal control glucémico. Así mismo, la hiperglucemia parece impedir la respuesta de las células óseas (osteoblastos y osteoclastos) al 1,25 (OH)2D3 en pacientes con diabetes tipo 249. Por otro lado, la glucosuria produce por diuresis osmótica un exceso de excreción urinaria de calcio7. Estos efectos conducen a una situación de balance negativo de calcio, lo que podría contribuir a un aumento de la resorción ósea en la diabetes.
Se han detectado receptores para el 1,25 (OH)2D3 en las células β del páncreas, y la deficiencia en esta vitamina parece asociarse a una disminución de la secreción de insulina50. Ratones diabéticos no obesos por autoinmunidad (NOD) tratados con vitamina D tienen una menor insulinitis, lo que podría representar una menor respuesta autoinmune19. En este sentido, un estudio europeo ha demostrado que la administración de vitamina D en la etapa juvenil disminuye la incidencia de diabetes tipo 151.
CONCLUSIONES
Actualmente, parece demostrado que la diabetes mellitus tipo 1, que implica la destrucción de las células β pancreáticas, conlleva una pérdida significativa de masa ósea, que puede conducir a osteoporosis a largo plazo. Este efecto parece remitir con el control de la glucemia mediante una dieta adecuada y la administración de insulina.
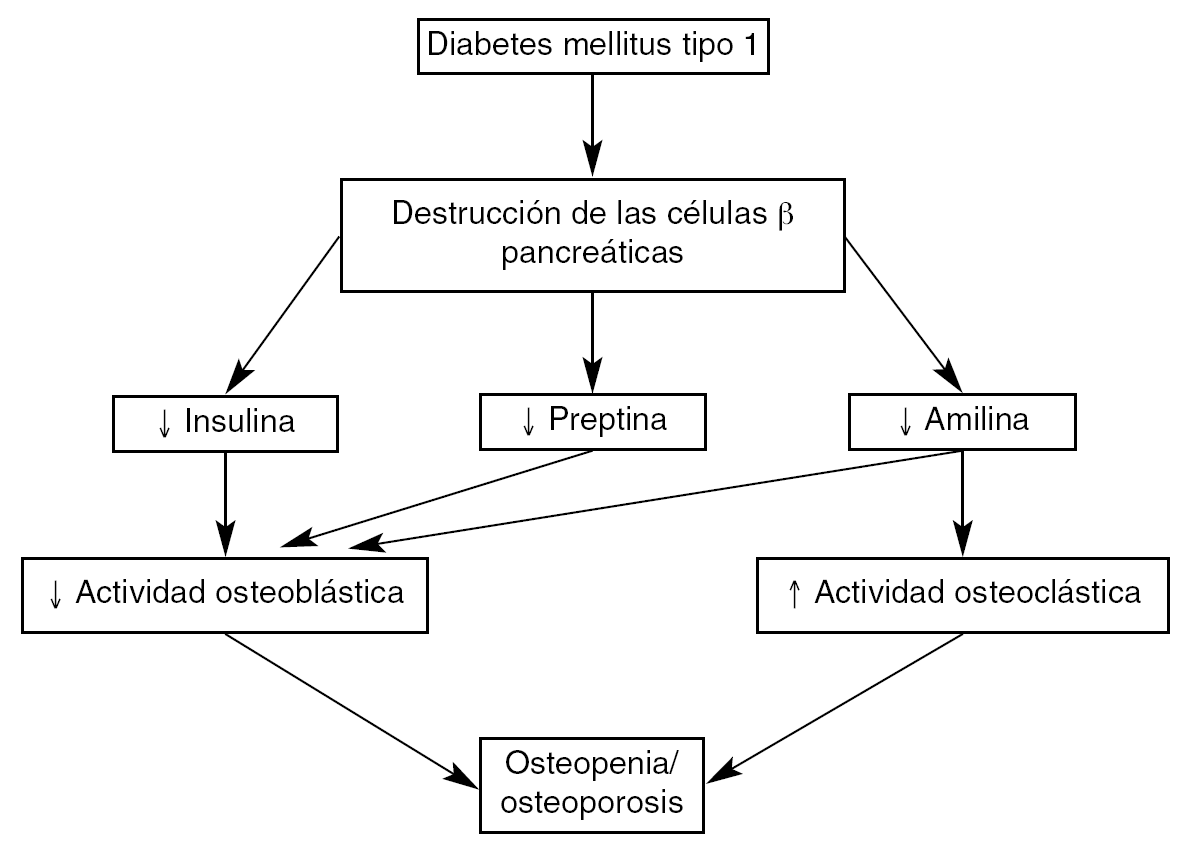
Existen una serie de factores polipeptídicos pancreáticos asociados a la alteración del metabolismo óseo en la diabetes tipo 1. Estos factores, la insulina, la amilina y la preptina, poseen receptores específicos en las células óseas y aumentan la actividad osteoblástica. La administración de insulina normaliza los valores de DMO en los diabéticos tipo 1. La figura 1 resume la posible interacción de la insulina y de otros péptidos relacionados citados con la pérdida de masa ósea en esta situación.
Fig. 1. Mediadores moleculares pancreáticos posiblemente implicados en la pérdida de masa ósea asociada a diabetes mellitus tipo 1.
En la diabetes tipo 2, por el contrario, no existen datos concluyentes que la relacionen con una disminución en la DMO. La amilina, que inhibe la resorción ósea, se ha detectado en el suero de pacientes con diabetes tipo 2, pero no en los de tipo 1, por lo que este factor podría ser un elemento de diferenciación entre ambos tipos de diabetes y su relación con la osteoporosis.
Existen otros factores locales o sistémicos que podrían contribuir a la pérdida de masa ósea en la diabetes, aunque en la actualidad no se ha establecido una relación de causa-efecto. Entre estos factores se encuentran el IGF-1 y sus proteínas ligadoras, cuyo verdadero papel en este sentido está aún por caracterizar. La leptina, sintetizada por el tejido adiposo, podría estar implicada en la aparente protección frente a la osteoporosis de pacientes con diabetes tipo 2. De las incretinas intestinales, el GLP-2 podría ser conservador de la masa ósea y utilizarse en el futuro para el tratamiento de la diabetes por sus propiedades insulinotrópicas. Otros factores no proteicos asociados a la diabetes que podrían afectar a la pérdida de masa ósea serían el aumento de la excreción de calcio y el déficit de vitamina D observado en niños y adolescentes diabéticos.
Correspondencia:
D. Lozano.
Laboratorio de Metabolismo Mineral y Óseo.
Fundación Jiménez Díaz (Grupo Capio).
28040 Madrid.
Correo electrónico: Dlozano@fjd.es