INTRODUCCION
La osteoporosis es una enfermedad en la que la resorción ósea es mayor que la formación, lo que conduce a una pérdida de la masa y la estructura óseas. El consumo de tabaco es un reconocido factor de riesgo de osteoporosis1, aunque los mecanismos por los que este actúa siguen siendo objeto de estudio. Uno de los posibles mecanismos podría ser la alteración de los niveles séricos de osteoprotegerina (OPG), una citoquina que regula el remodelado óseo. La OPG regula la osteoclastogénesis y la resorción ósea actuando como receptor señuelo del ligando del receptor activador del factor de necrosis NFkb (RANKL)2. La OPG es sintetizada por muchos tipos de células, entre los cuales se encuentran los osteoblastos2. El tabaco podría afectar los niveles plasmáticos de OPG por varios mecanismos: indirectamente, a través de alteraciones en el metabolismo de las hormonas sexuales y el eje parathormona (PTH)-vitamina D3, o por una acción directa de la nicotina en la expresión del gen de la OPG en las células óseas4.
Los niveles plasmáticos de OPG aumentan con la edad en varones5,6 y en mujeres posmenopáusicas sanas6, y se encuentran más elevados en mujeres posmenopáusicas osteoporóticas6. Además, los niveles de OPG se correlacionan con los marcadores bioquímicos de remodelado óseo7, con la densidad mineral ósea7,8 y con las fracturas vertebrales9. Por otro lado, los niveles de OPG se han asociado con los factores de riesgo cardiovascular10.
Algunos estudios han evaluado los efectos del hábito tabáquico sobre los niveles plasmáticos de OPG y se han obtenido resultados dispares8,10-12. El objetivo de este estudio es determinar los efectos del hábito tabáquico sobre los niveles plasmáticos de OPG en un grupo de jóvenes voluntarios sanos.
MATERIALES Y MÉTODOS
Se ha realizado un estudio transversal en voluntarios jóvenes sanos, que se dividieron en dos grupos: fumadores y no fumadores. El grupo de no fumadores estaba compuesto por voluntarios que nunca habían fumado. Los participantes se reclutaron entre los empleados de nuestro hospital. El periodo de reclutamiento fue de un año. Los criterios de inclusión para los fumadores fueron: fumar al menos 15 cigarrillos al día, edad inferior a 45 años en varones y tener menstruaciones regulares en mujeres. Para los no fumadores, los criterios fueron los mismos en cuanto a edad y estado premenopáusico, a lo que se añadió no haber fumado nunca. Los criterios de exclusión fueron: existencia de algún factor de riesgo cardiovascular a excepción del tabaquismo en el grupo de fumadores, consumo de alcohol superior a 60 g/día y evidencia de cualquier enfermedad que pudiera afectar el metabolismo mineral u óseo como la insuficiencia renal crónica, la insuficiencia hepática, la malabsorción o las enfermedades endocrinas. Todos los participantes firmaron un consentimiento informado.
Se recogieron datos antropométricos, consumo de alcohol, hábitos nutricionales e ingesta de calcio13 por cuestionario. La obtención de muestras de sangre y orina se realizó en ayunas, a primera hora de la mañana y tras, al menos, 7 horas de descanso nocturno. La primera orina de la mañana fue despreciada, recogiéndose la muestra dos horas después (second void). En las mujeres, el análisis se realizó entre los días 3 y 7 de la fecha de la última regla para minimizar las variaciones hormonales sujetas al ciclo hormonal. Los niveles plasmáticos de OPG se determinaron por enzimainmunoensayo (ELISA) (Biomedica, Viena, Austria). La calcemia se midió por reacción de compleximetría mediante un autoanalizador (Olympus AU 510, Merck, Madrid, España). Los niveles plasmáticos de estrona, 25 hidroxivitamina D (25 D), 1,25 dihidroxivitamina D (1,25 D) y osteocalcina fueron analizados por radioinmunoensayo (Diagnostic Systems Laboratories INC, Nuclear Iberica, Madrid, España, para la estrona; INCSTAR, DiaSORIN, Madrid, España, para la 25 D, 1,25 D y osteocalcina). Las concentraciones de parathormona intacta (PTHi) y 17-beta estradiol fueron determinadas por quimioluminiscencia (Centaur® assays, Bayer Diagnostics, Barcelona, España). Finalmente, las determinaciones de N-telopéptido urinario y de fosfatasa ácida resistente al tartrato se realizaron por ELISA (Osteomark®, Ostex International, Seattle, EE. UU.; y Merck SA, Madrid, España, respectivamente). Las variaciones intra e interensayo para la OPG fueron inferiores al 10 y al 12%, respectivamente.
El análisis estadístico se realizó con el programa estadístico SPSS, versión 13.0 para Windows. Se consideró significativo un valor de p < 0,05. Los resultados se expresan como media ± desviación estándar. Se aplicó la prueba de la t de Student o de la U de Mann-Whitney para la comparación entre grupos. Se realizó una regresión lineal multivariante para identificar los posibles factores que pudieran influir en los niveles de OPG y una correlación de Spearman entre los niveles de OPG y el número de cigarrillos fumados diariamente y el índice acumulado calculado con paquetes/año.
RESULTADOS
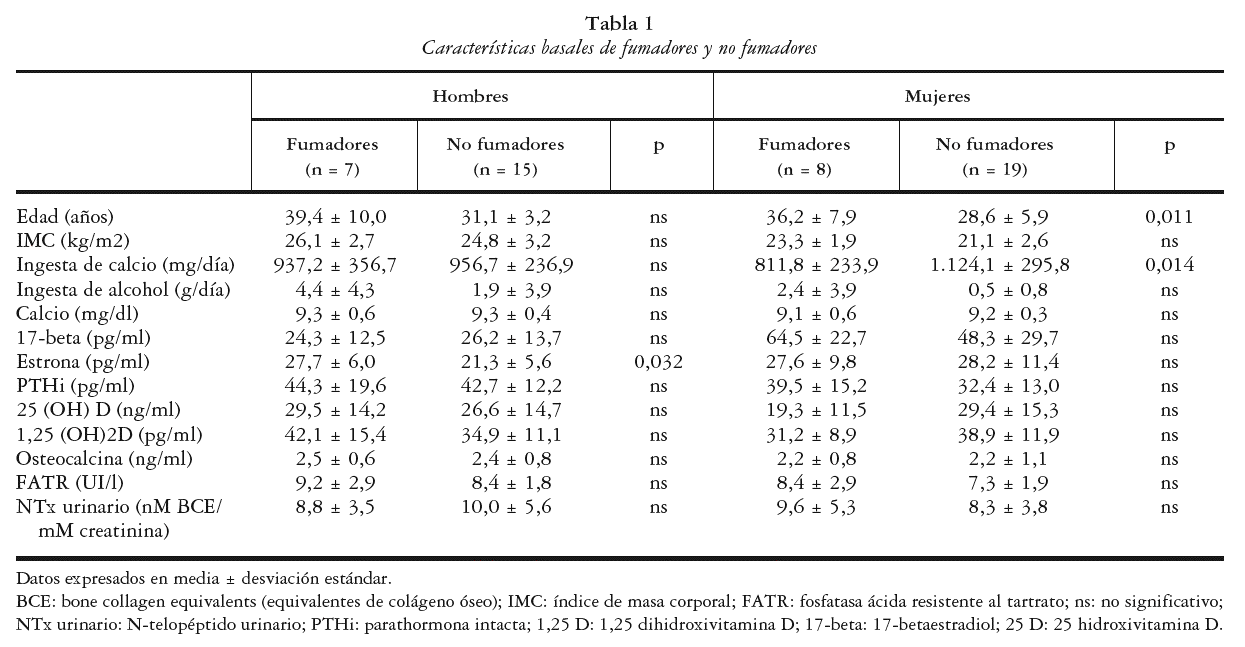
Se incluyeron 49 voluntarios (15 fumadores y 34 no fumadores). De éstos, 22 eran varones (7 fumadores y 15 no fumadores) y 27 mujeres (8 fumadoras y 19 no fumadoras). Ambos grupos fueron comparables excepto en edad, que era mayor en los fumadores (36,2 ± 8,6 frente a 30,9 ± 5,6 años; p = 0,018). En el análisis separado por sexos, en los varones, ambos grupos fueron comparables a excepción de los niveles plasmáticos de estrona, que eran más elevados en fumadores (27,67 ± 6,0 pg/ml en fumadores frente a 21,27 ± 5,6 pg/ml en no fumadores; p = 0,032). En las mujeres, las fumadoras eran de mayor edad (36,25 ± 7,9 frente a 28,63 ± 5,96 años; p = 0,011) y tenían una menor ingesta de calcio (811,81 ± 233,9 frente a 1.124,14 ± 295,8 mg/día; p = 0,014) que las no fumadoras (tabla 1).
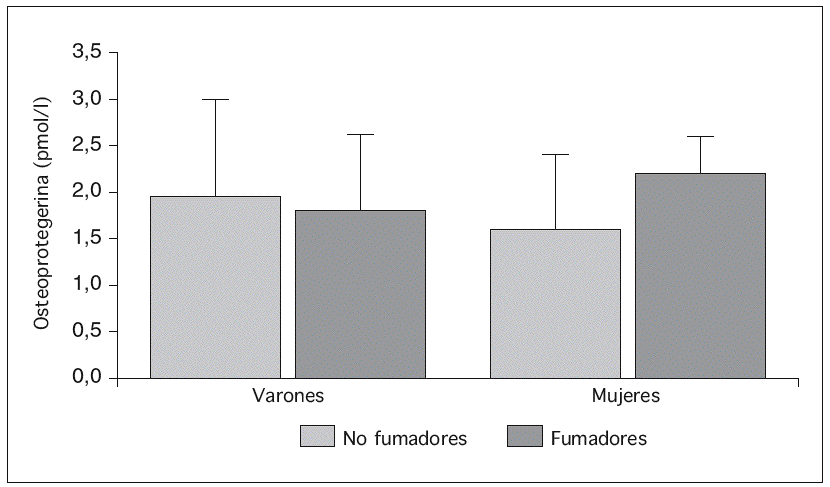
No se encontraron diferencias en los niveles plasmáticos de OPG entre fumadores y no fumadores (1,91 ± 0,6 frente a 1,17 ± 1,0; p = no significativo [ns]). Tras ajustar por las diferencias existentes en edad, persistía la falta de significación. Tampoco se encontraron diferencias al realizar el análisis separado por sexos (1,92 ± 0,7 frente a 1,94 ± 1,0 pmol/l en varones y 2,14 ± 0,5 frente a 1,64 ± 0,8 pmol/l en mujeres; p = ns para varones y p = ns para mujeres) (fig. 1). Tras ajustar por las diferencias existentes en los niveles de estrona en varones y por la edad y el consumo de calcio en mujeres, las diferencias continuaron siendo no significativas.
Fig. 1. Niveles plasmáticos de osteoprotegerina en fumadores y no fumadores. No existen diferencias significativas entre fumadores y no fumadores, ni en hombres ni en mujeres (p = 0,96 en varones y p = 0,11 en mujeres).
Una regresión lineal multivariante no pudo identificar ningún factor que influyera en los niveles plasmáticos de OPG. Finalmente, tampoco se encontró ninguna correlación entre los niveles de OPG y el número de cigarrillos fumados al día o el número de paquetes/año.
DISCUSION
En este estudio no se ha encontrado que el hábito tabáquico influya en los niveles plasmáticos de OPG. En las comparaciones entre grupos, los varones fumadores tenían mayores niveles de estrona que los no fumadores. Ello es consistente con observaciones previas3,14. Las mujeres fumadoras tenían menores niveles de 25 D que las no fumadoras, aunque las diferencias no alcanzaron la significación. Esta falta de significación contrasta con los resultados obtenidos por nuestro grupo en mujeres premenopáusicas3 y por otros autores en mujeres posmenopáusicas15, lo que puede explicarse por el pequeño número de voluntarias incluidas en este estudio.
Existen algunos factores que pueden afectar los niveles plasmáticos de OPG, como la edad, la diabetes mellitus, las infecciones crónicas, los factores de riesgo cardiovascular, los niveles plasmáticos de calcio y de PTHi y la administración de tratamiento hormonal en mujeres y de corticoesteroides en varones16. En este estudio todos los participantes eran voluntarios sanos, sin evidencia de enfermedad infecciosa, tenían valores de glucemia inferiores a 100 mg/dl, normocolesterolemia y eran normotensos. Los varones no recibían tratamiento con corticoesteroides ni las mujeres tomaban contracepción oral. Además, aunque parece que los niveles plasmáticos de OPG no varían según la fase del periodo menstrual17, en las mujeres la analítica se realizó siempre entre los días 3 y 7 tras la fecha de la última regla para minimizar posibles variaciones sujetas al ciclo hormonal. Las únicas diferencias detectadas entre fumadores y no fumadores fueron los niveles de estrona en varones y la edad y la ingesta diaria de calcio en mujeres. Consecuentemente, los resultados se ajustaron por estas diferencias.
Un reciente estudio in vitro mostró que la expresión de OPG en los osteoblastos se altera por la nicotina4. En este estudio, la nicotina, en combinación con lipopolisacárido (LPS), disminuye la producción de OPG por los osteoblastos y estimula la formación de células osteoclásticas-like a través de diferentes vías. Los estudios clínicos que han valorado la influencia del tabaco en las concentraciones de OPG han obtenido resultados dispares. Dada la posible asociación entre la OPG y el riesgo cardiovascular, algunos de estos estudios se diseñaron para identificar esta asociación10-12. En el primero de ellos, fumar se asoció a un incremento en los niveles plasmáticos de OPG10. En el segundo, tanto el hábito tabáquico como unas concentraciones más elevadas de OPG fueron más frecuentes en un grupo de mujeres con artritis reumatoide, pero, al igual que en nuestro trabajo, no se encontró ninguna correlación entre los niveles de OPG y el hábito de fumar11. Finalmente, el tercer estudio no encontró diferencias en los niveles de OPG entre fumadores y no fumadores12. No obstante, los resultados de estos estudios deben interpretarse con cautela, dado que no fueron diseñados específicamente para evaluar el efecto del tabaco sobre la OPG. En otro estudio, Abrahamsen et al8 tampoco encuentran ninguna relación entre el hábito tabáquico y los niveles de OPG en un grupo de 188 gemelas de 19 a 64 años de edad, de las que un 25% (48 casos) eran fumadoras. Estos resultados están en consonancia con los aportados en este estudio. Finalmente, otros dos estudios más recientes tampoco concuerdan en sus resultados. En uno de ellos, en una larga serie de pacientes en los que se estudió la relación de la OPG con la placa aórtica y el calcio en la arteria coronaria, fumar se asoció con niveles plasmáticos de OPG más elevados18, mientras que en el otro, en pacientes afectados de periodontitis, divididos en dos grupos de 35 fumadores y 35 no fumadores pareados por edad y sexo, se encontró que los fumadores tenían disminuidos los niveles de OPG, y que tanto el número de cigarrillos fumados diariamente como los paquetes/año tenían una correlación inversa con el hábito tabáquico19, hecho que en este trabajo no se ha podido demostrar.
Una potencial limitación de nuestro estudio es saber hasta qué punto los niveles circulantes de OPG reflejan cambios locales en el microambiente óseo2. Otra importante limitación es el pequeño número de participantes en el estudio, lo cual puede reducir el poder estadístico para detectar diferencias entre grupos. No obstante, aunque en mujeres existe una pequeña diferencia no significativa, el no encontrar un valor de p, los resultados claramente no significativos en varones y la falta de asociación entre el hábito tabáquico, tanto en cigarrillos/día como en dosis acumulada, y la OPG apoyan nuestros hallazgos. A pesar de todo ello, no se puede excluir definitivamente que un bajo poder estadístico sea una explicación para los resultados negativos. Si el tabaco ejerce algún efecto sobre los niveles de OPG, este debe ser de poca magnitud, por lo que los efectos tóxicos del tabaco sobre el hueso no pueden explicarse simplemente por su impacto sobre el sistema RANK-RANKL-OPG. Futuros estudios con un mayor número de participantes ayudarán a esclarecer este punto.
En conclusión, el consumo de tabaco en jóvenes voluntarios sanos no parece influir en los niveles plasmáticos de OPG o bien sólo tiene un limitado efecto sobre ellos.