HORMONA DECRECIMIENTO Y METABOLISMO DEL HUESO
La hormona delcrecimiento (GH) realiza múltiples funciones en el hombre.Influye en el metabolismo de carbohidratos, lípidos yproteínas; favorece la secreción y acción deotras hormonas e interactúa con el sistema inmune. Su papelprincipal lo desempeña sobre el esqueleto, y es la hormonadecisiva en el crecimiento óseo longitudinal en la infanciay adolescencia, debido a su capacidad de estimular elcartílago epifisario. Sobre él actúa tantodirecta como indirectamente a través de la producciónsistémica y local de factores de crecimiento similares a lainsulina (IGF).
El remodelado óseo es unproceso dinámico y continuo, regulado por el balance entrela resorción, causada por los osteoclastos, y laformación, regulada por los osteoblastos, que se desarrollaininterrumpidamente a lo largo de la vida de un individuo. La GHparticipa activamente en este ciclo fisiológico del huesojunto con las hormonas calciotropas y sexuales, así como unagran variedad de citocinas (interleucinas, factor de necrosistumoral) y prostaglandinas locales. Se confirma, por tanto, unefecto independiente del eje GH/IGF-I sobre el mantenimiento delcontenido mineral óseo (CMO) y de la fisiologíanormal del hueso adulto1-4.
El crecimiento y desarrollofetal, así como durante los primeros días de vida,son posibles en ausencia de GH. Posteriormente se establece unagradual dependencia de la GH en el crecimientopostnatal.
La acciónanabólica de la GH en el hueso está bien demostrada,tanto en las consecuencias de talla baja y retraso en lamaduración ósea de los niños condéficit de GH, hereditario o adquirido, como en el aumentode masa ósea cortical en enfermos con acromegalia. El primertrabajo que demostró la importancia de la GH en laformación ósea del esqueleto adulto se llevó acabo en 1969 en modelos animales5, hallazgosreproducidos posteriormente in vivo e invitro.
La expresión dereceptores de GH (GHR) en los osteoblastos indica que la GHestimula la formación ósea directamente. Favorece laproliferación y diferenciación de las célulasprogenitoras de los osteoblastos y de los precondrocitos delcartílago epifisario, seguida de la expansión clonalde las células, causada por la producción local ysistémica de IGF-I inducidas por la GH («teoríadel efecto dual»), aunque también se ha comprobado quela propia IGF-I estimula a las célulasprogenitoras1,6.
La GH está implicadaindirectamente en la formación ósea, lo que vienecondicionado por una serie de hechos4. Los efectosanabólicos de la GH sobre el metabolismo proteico llevanconsigo un incremento de la fuerza y de la masa muscular, con laconsiguiente mejoría de la capacidad física ycardíaca así como beneficios en la integridadesquelética. Así mismo, la GH potencia lasecreción gonadal de esteroides sexuales, que a su vezestán implicados en la fisiología ósea.Además, en osteoblastos humanos, el 17-ß-estradiol promueve la proliferación estimulada por GH yaumenta la expresión de los GHR.
Sobre el metabolismo mineral,se han confirmado varias acciones7. En laacromegalia8, se objetiva una elevación de losniveles circulantes de la 1,25 dihidroxivitamina D3, noextrapolable a individuos normales, mientras que laadministración terapéutica mantenida de GH-humanarecombinante (GH-rh) se asocia con alteraciones transitorias de losniveles circulantes de vitamina D. El aumento de este metabolito,junto con una sensibilización del epitelio intestinal a lavitamina D en presencia de cantidades normales de GH, favorece elaumento de la absorción gastrointestinal de calcio yfósforo, hecho que se produce en los niños condéficit de GH tras el tratamiento con GH-h. Además,la GH incrementa el transporte tubular de fosfatos, asociado a unaumento paradójico en la excreción urinaria deAMP-cí-clico por una mayor sensibilización deltúbulo renal a la hormona paratiroidea (PTH), GHdependiente9.
Como a otros niveles, muchas delas acciones de la GH son mediadas a través del IGF-I, quese produce tanto en el hígado como en otros tejidosperiféricos, entre ellos el hueso1,3,10. Sesintetiza a este nivel por los osteoblastos, actuando de formaautocrina y paracrina en la regulación de los mecanismoscelulares implicados en la formación y resorciónóseas. El IGF-I es uno de los factores de crecimientomás abundantes en el hueso. La fracción óseaprocede de la misma producción local y de la fraccióncirculante, y se desconoce la contribución exacta de cadauna de ellas en el remodelado óseo. La producción deIGF-I se halla bajo el control de diferentes factores nutricionalesy hormonales, de los que la GH es uno de sus principalesreguladores, aunque también participan en la síntesislos estrógenos, los andrógenos, la PTH, la 1,25dihidroxivitamina D3, el cortisol y otros factores decrecimiento.
La bioactividad de los IGF enel tejido óseo está modulada por variasIGFBP1 (se conocen seis subtipos), principalmente laIGFBP-3, la -4 y la -5. La IGFBP-4 es un potente inhibidor de lasacciones de las IGF mientras la IGFBP-5 es un estimulador de laproliferación celular ósea inducida por la IGF-I. Portanto, parte del efecto de la GH está mediado através de la regulación de la producción localde IGFBP en los osteoblastos. Es sabido que el tratamiento con GHincrementa los niveles de IGFBP-3 y -5, aunque no se ha objetivadoefecto de la GH sobre la expresión de IGFBP-3 enosteoblastos humanos.
El mecanismo de accióndel IGF-I en el hueso se ha aclarado parcialmente a partir deestudios en cultivos celulares. El IGF-I es un mitógeno decélulas osteoblásticas que, además, estimulala síntesis de la matriz ósea e inhibe ladegradación del colágeno. No obstante, tambiénactiva la formación y la función de lascélulas osteoclásticas y, por tanto, laresorción ósea.
Pero el efecto sobre lososteoclastos se lleva a cabo a través de los osteoblastos.Estudios experimentales y la observación clínica deque el déficit de IGF-I determina un grave retrasointrauterino y posterior retraso de crecimiento postnatal,demuestra claramente que la expresión normal, tanto de laIGF-I como de su receptor, desempeñan un papelcrítico en el crecimiento normal y desarrollotisular.
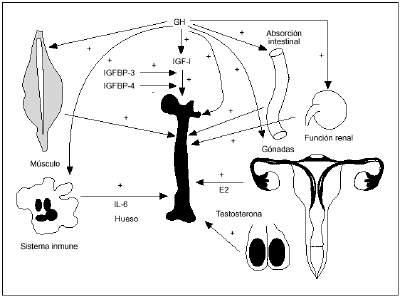
Se ha demostrado que en elfeed-back negativo del eje GH/IGF-I en el tejidoesquelético intervienen tres mecanismos diferentes: la IGF-Ihepática que inhibe la secreción de GH hipofisaria yla IGF-I ósea que inhibe, tanto la secreción de GHhipofisaria como la acción local de la GH, al reducir ladisponibilidad de los GHR11. En la expresión delos GHR de los osteoblastos influyen también las hormonassexuales y los glucocorticoides (fig. 1).
Figura1. Relaciones entre hormona del crecimiento (GH), factores decrecimiento similares a la insulina-I (IGF-I) y hueso. Tomada deMarcus28. IL-6: interleucina-6.
Otro posible mecanismo deregulación de la GH sobre el remodelado óseo y lamasa ósea es mediante la modulación de laresorción. Este hecho se ha comprobado en el aumento delnúmero de osteoclastos inducido por la GH en lametáfisis de tibia proximal de ratashipofisectomizadas12. La GH estimula la resorciónósea a través de acciones directas e indirectas sobrela diferenciación de osteoclastos y activaciónindirecta de osteoclastos maduros. La interleucina-6 (IL-6)liberada por los osteoblastos participa en la resorción alactivar los osteoclastos inmaduros, y hay evidencia in vitrode que la GH podría estimular los niveles de ARN mensajerode IL-6.
La administración de GHa sujetos normales ha confirmado un aumento del remodeladoóseo, con incremento, tanto de los parámetrosbioquímicos de resorción (hidroxiprolina, calciuria,telopéptido de colágeno tipo I, piridinolina ydeoxipiridinolina) como de los de formación (fosfatasaalcalina, osteocalcina, propéptidos de colágeno tipoI)13. Los estudios con IGF-I han confirmado efectossimilares a la GH.
Diferentes trabajosepidemiológicos han demostrado correlación entre losniveles séricos de IGF-I y la densidad mineral ósea(DMO) en adultos sanos14,15, relación que secomplica por variaciones entre la IGF-I, la edad y el estadofísico.
ACROMEGALIA Y HUESO
La acromegalia activa se asociacon un incremento del recambio óseo16. La masaósea y el metabolismo mineral se encuentran frecuentementealterados en esta patología caracterizada por unhipersomato-tropismo. En estudios realizados enacromegálicos, se ha comprobado que los marcadoresbioquímicos de formación y resorciónestán aumentados respecto a los controles, y que laconcentración sérica de osteocalcina se correlacionapositivamente con las concentraciones de GH e IGF-I, nodemostrándose en todos6.
El tratamiento exitoso de laenfermedad logra normalizar dichos marcadores17. Enocasiones, puede encontrarse una hiperfosforemia, reflejo delefecto de la GH sobre el túbulo renal y normocalcemia en lamayoría de ellos. El efecto neto de aumento del metabolismoóseo en la acromegalia no tratada puede verse oscurecido porfactores como el hipogonadismo asociado18. Tanto losestudios histomorfométricos, como las técnicasdiagnósticas de medición de la masa ósea, comola absorciometría radiológica de energía dual(DEXA), demuestran un aumento de la masa ósea a nivel delhueso cortical inducido por un mayor depósitosubperióstico, mientras que el hueso trabecular apenas se veafectado, salvo si se confirma un hipogonadismoconcomitante19.
DÉFICIT DE HORMONA DELCRECIMIENTO Y HUESO
Está suficientementedemostrado que el tratamiento con GH biosintética enniños con déficit de GH congénito o adquiridomejora significativamente la velocidad de crecimiento y la tallafinal de éstos. Se han utilizado los parámetrosbioquímicos de formación ósea (osteocalcina,fosfatasa alcalina, procolágeno III) como predictores derespuesta terapéutica. Se aprecia una osteopenia relativaantes de iniciar el tratamiento con GH-rh. Una vez tratados, esdifícil demostrar un efecto en la DMO, dado que el esqueletogana CMO a medida que crece y avanza la edad ósea.Además es difícil de valorar bien el CMO si no seajusta por edad y tamañoóseo1,2.
Recientemente se ha aprobado eltratamiento hormonal sustitutivo en adultos con déficit deGH. En un 75% de ellos se ha demostrado osteopenia-osteoporosis debajo remodelado2,19, que inicialmente fue comprobado enadultos con comienzo del defecto de GH en la infancia. En unestudio realizado por Kaufman20, se comparó elCMO de éstos respecto a sujetos controles,demostrándose que el CMO en columna lumbar era un 9%-19% yen antebrazo un 20%-30% menor que los controles. Estos hechospodrían ser explicados por una inadecuada adquisiciónde masa ósea durante la infancia y el período decrecimiento, y el menor "pico de masa ósea"explicaría el reducido CMO. La causa principal de este menorpico de masa ósea sería un tratamiento con GHsubóptimo, dado que los enfermos incluidos en dicho estudiofueron tratados cuando la disponibilidad de la GH era limitada ylas dosis usadas y la duración del tratamiento menores queen la práctica pediátrica actual. En enfermos conhipopituitarismo en la infancia, la inducción y el momentode la pubertad son también importantes para laobtención de un pico de masa ósea adecuado. Se hasugerido que la sustitución con GH-rh deberíamantenerse hasta alcanzar el pico de masa ósea que lecorresponde, independientemente de la talla final21,aunque hasta ahora no hay estudios que lo confirmen.
Los sujetos con un defecto deGH adquirido en la edad adulta presentan una mayor prevalencia deosteoporosis (OSP) (por debajo de 2,5 desviaciones estándar[DE] según el z-score) en múltiples estudiosrealizados en su mayoría con DEXA, así como un mayorriesgo de fracturas vertebrales osteoporóticas respecto alos controles1,2,22.
El tratamiento sustitutivo conGH-rh en adultos induce un aumento de los parámetros deresorción y formación óseosdosis-dependientes, siendo máximo al cabo de tres o seismeses respectivamente. Tras dos años de tratamiento, losniveles persisten elevados, lo que sugiere una tasa de remodeladoóseo incrementada. Las concentraciones de PTH y de 1,25dihidroxivitamina D3 son variables en los estudiosrealizados, ya que aumentan o no se alteran. También se haobjetivado una hipercalcemia, secundaria a una mayor disponibilidadde la vitamina D3, al favorecer la GH la actividad de la1* - hidroxilasa o bien por una mayormovilización del calcio esquelético.
Los primeros ensayos realizadoscon GH-rh en adultos no mostraban efectos beneficiosos sobre elhueso, ya que la duración del tratamiento era escasa (tres aseis meses)23 y el ciclo de remodelado óseo duraunos tres o cuatro meses. Incluso en algún trabajo seobservó un descenso de la DMO al cabo de seis meses desustitución hormonal24, que sejustificaría por el aumento de la actividad remodeladora delhueso nuevo no mineralizado.
Algunos autores han propuestoasociar bifosfonatos al tratamiento con GH en enfermos conosteopenia intensa durante las fases iniciales. Sin embargo, si laresorción ósea es un requisito indispensable para laformación, es posible que la resorción inducida porGH sea crucial para promover la reconstrucción de nuevohueso. La ganancia neta en masa ósea comienza a ser aparentea partir de los 18 meses de terapia, demostrándose unincremento de la DMO en columna vertebral (en alrededor de un3%-5%) y cuello femoral25. Es más marcado enaquellos enfermos cuyo valor z-score pretratamiento es <-1 DE que en aquéllos con DMO en límites normales. Larespuesta del hueso cortical es más lenta que la deltrabecular, demostrándose en un estudio un incrementocontinuo del CMO en hueso cortical de antebrazo 13 mesesdespués de interrumpir eltratamiento26.
En la respuesta al tratamientosustitutivo hay diferencias según el sexo. Los varonespresentan unos parámetros de remodelado más elevadosy las mujeres con mayor DMO, lo que sugiere que lainteracción entre GH y estrógenos induce un balanceóseo más positivo1. En el incremento demasa ósea también influyen favorablemente los cambiosen peso y composición corporales, con aumento de masa magra,y un mayor ejercicio físico y fuerza muscular por mejortolerancia al esfuerzo, característicos del tratamiento conGH-rh1,2.
Se necesitan másestudios y experiencia en la sustitución hormonal de GH enadultos. Un objetivo importante será demostrar en un futurouna reducción en la presentación de fracturasasociadas al tratamiento a largo plazo.
HORMONA DEL CRECIMIENTO YOSTEOPOROSIS
La OSP es la enfermedadmetabólica más frecuente y se debe a undesacomplamiento entre la resorción y formaciónóseas, con pérdida de la masa ósea yalteraciones de la microarquitectura del tejido óseo. Lascausas de la OSP son múltiples y multifactoriales. Lapérdida de masa ósea relacionada con la edad secaracteriza por un adelgazamiento de las trabéculasóseas que conduce a un incremento en la incidencia defracturas. En estudios histomorfométricos se muestra que laedad se asocia con una disminución en la cantidad de matrizósea sintetizada y en la capacidad proliferativa de losprecursores osteoblásticos.
Se ha comprobado que lasecreción de GH e IFG-I disminuye con laedad13,27-29. Los niveles circulantes de IGF-I y deIGFBP-3 son significativamente menores en la OSP que en controles.Nicolas et al30 estudiaron un grupo de 66 muestrasbiópsicas de hueso cortical de varones y mujeres, yencontraron una reducción del 60% en el contenidoóseo de IGF-I así como una reducción del 25%en el factor de crecimiento ß entre lasegunda y sexta década de la vida. Además hay unarelación inversa entre IGF-I y edad, mientras que se haencontrado una correlación entre los valores locales deIGF-I y los parámetros bioquímicos ehistomorfométricos de formación y resorciónósea, así como con el volumen de hueso trabecular.Estos datos sugieren que la disminución del eje GH/IGF-I enhueso debe desempeñar un papel en el mecanismo celular de laOSP senil.
El potencial efecto estimulantede la formación ósea, tanto de GH como de IGF-I, esel aspecto más interesante que los diferencia de losfármacos utilizados hasta ahora en el tratamiento de la OSP,que actúan preferentemente inhibiendo la resorciónósea31.
La mayoría de losestudios experimentales con GH-rh en OSP son de escasaduración. Aloia et al32, en un estudio de dosaños, compararon el efecto de la GH y calcitonina frente ala calcitonina sola en 14 mujeres osteoporóticas.Demostró que el tratamiento combinado aumentaba el CMO totalen un 2,3% al año, mientras que la calcitonina noproducía ningún cambio. Los autores no midiereon losniveles circulantes de IGF-I, lo que impide conocer las dosismás adecuadas de GH mientras las deficienciasmetodológicas del estudio limitan la eficacia de losresultados. Marcus et al33 observaron el efecto de laadministración de GH-rh durante seis días a 16sujetos sanos, y comprobaron un incremento en los niveles de IGF-Iy de los marcadores de remodelado óseo.
Desde entonces se han publiadomúltiples ensayos clínicos empleando diferentes dosisy duración de GH-rh, obteniéndose resultadosvariables, aunque en ninguno se alcanzaron cambios significativosde la DMO31. Este hecho se podría explicar poruna pérdida de la eficiencia remodeladora a partir de los 65años, ya que la respuesta formadora de hueso es menor que laresorción. Holloway et al34 realizaron un ensayorandomizado y con placebo en 84 postmenopáusicas, con ciclosde dos meses de tratamiento de siete días con GH-rh,seguidos de cinco días con calcitonina (frente a susrespectivos placebos), durante un período de dosaños. El seguimiento de la DMO se llevó a cabo a losdos y tres años. La GH aumentó las concentraciones deIGF-I a niveles del rango juvenil. En los grupos de terapiacombinada (GH + calcitonina o GH + placebo) la DMO de columna lumbar a los dos añoshabía aumentado un 2,7% y 1,7% respectivamente mientras nose observaron cambios significativos en el cuello de fémur.Tampoco hubo respuesta significativa en la DMO a los tresaños en 62 mujeres examinadas.
Basándonos en estaexperiencia acumulativa, es difícil en el momento actualjustificar el tratamiento con GH-rh de la OSP senil ypostmenopáusica, a dosis tolerables, ya sea en monoterapia oasociada a fármacos antirresortivos. El escaso incremento dela DMO lumbar o a nivel femoral, y, menos aún, la no probadareducción de fracturas no justifican el empleo de unfármaco caro y de administración parenteral(vía subcutánea diaria), frente al efectosuficientemente demostrado de los actuales fármacos. Lasdosis empleadas de GH-rh se aproximan a los límitesmáximos tolerados, por lo que resulta improbable que unajuste de dosis convierta este tratamiento en una opciónmás atractiva31,35.
Sin embargo, otras estrategiasbasadas en el eje somatotropo merecen un comentario. Laadministración de hormona liberadora de GH (GHRH) oanálogos de la GHRH permitiría una liberaciónmás fisiológica y pulsátil de GH yposiblemente una mejor respuesta del hueso36. Laadministración por vía oral de un secretagogo de laGH es otra atractiva opción37.
Otra posibilidad es eltratamiento con IGF-I recombinante38,39,basándose en los estudios que demuestran niveles disminuidosde este factor de crecimiento en ancianos y su potencial efectoestimulante osteoblástico. Estudios clínicos a cortoplazo han demostrado que la administración de IGF-I adeterminadas dosis tiene un efecto positivo sobre laformación ósea sin aumentar la resorción, peroaún quedan por conocer los posibles efectos a largo plazo deeste tratamiento con IGF-I.
Una forma de evitar lasacciones extraóseas de este factor de crecimientosería su estimulación selectiva ósea y esto seconsigue mediante la administración intermitente dePTH40. El tratamiento prolongado con PTH41,actuando a través de una estimulación de laproducción de IGF-I en el hueso, ha demostrado tener unefecto positivo sobre el aumento de masa ósea, asícomo en la disminución de fracturas. En definitiva, IGF-I esuna opción potencial para el tratamiento de la OSP, aunqueson necesarios estudios clínicos a largo plazo y unaselección adecuada de los enfermos29.
INFORME
FACTOR DEIMPACTO BIBLIOGRÁFICO DE LAS REVISTAS DE OSTEOLOGÍA1998
NOTA DELCOMITÉ EDITORIAL
Con objeto de facilitar lavaloración de los trabajos científicos en laliteratura mundial dedicada a enfermedades metabólicasóseas, se incluye este baremo, actualizado a1998.
Factordeimpacto | |
| Journal Bone MineralResearch | 6.479 |
| Bone | 3.272 |
| OsteoporosisInternational | 2.475 |
| Calcified TissueInternational | 1.810 |
| Maturitas | 1.489 |
| Mineral ElectrolyteMetabolism | 1.025 |