INTRODUCCIÓN
Delmas et al1 estudiaron los efectos de la selección de estudios en la elaboración de metaanálisis para evidenciar la relación entre el incremento de la densidad mineral ósea (DMO) y la reducción del riesgo de fracturas, realizando una crítica a la elección de los artículos a incluir en el metaanálisis. Hochberg et al2 diseñaron un metaanálisis en el que se deja de incluir sin justificación pacientes del estudio FIT, concretamente los estudios de Black et al3 y Cummings et al4.
Por otro lado, un metaanálisis de Cranney et al5 sobre la eficacia de alendronato prescinde de estos mismos estudios citados3,4 para valorar la eficacia de dicho fármaco en fracturas no vertebrales (FNV). Además Wehren et al6 se sirven de los resultados de este metaanálisis para comparar la eficacia de distintos tratamientos para la osteoporosis, obteniendo datos erróneos, dado el sesgo de partida.
Boonen et al7 han publicado un metaanálisis del efecto de los tratamientos para la osteoporosis en FNV en el que hacen una crítica al estudio de Cranney et al5 mencionado anteriormente.
Dada la cantidad de metaanálisis realizados con bifosfonatos para el tratamiento de la osteoporosis, las diferencias de metodología seguida para su elaboración y el uso de los resultados de los mismos, se planteó la recogida y análisis de éstos con el objeto de realizar una revisión sistemática de los mismos para conocer cuántos hay, para qué bifosfonatos y cuál es la calidad metodológica de cada uno de ellos.
Disponer de esta información supondrá tener la máxima evidencia de calidad que guíe la práctica clínica en el manejo de la osteoporosis en mujeres posmenopáusicas.
El planteamiento para abordar esta tarea ha sido la realización de una revisión sistemática, para lo que se ha seguido la metodología propuesta por la Cochrane.
METODOLOGÍA
Se incluyeron en la revisión los metaanálisis de ensayos clínicos controlados y aleatorizados con mujeres posmenopáusicas que presentaban osteoporosis. Al menos uno de los medicamentos evaluados debía ser un bifosfonato a cualquiera de las dosis posibles, indicado de forma preventiva o como tratamiento. Se permitió la administración de calcio y/o vitamina D concomitante. No se incluyeron estudios de pacientes con osteoporosis inducida por glucocorticoides o como consecuencia de metástasis asociadas a procesos tumorales. Se rechazaron también estudios sobre enfermedad de Paget o con paciente pediátrico. Las medidas de resultados valoradas fueron reducción de fracturas vertebrales (FV), FNV o de cadera.
Se realizó una búsqueda en noviembre de 2005 en MEDLINE, EMBASE y en la Base de datos Cochrane de revisiones sistemáticas para los años 1995-2005. Se restringió el idioma al inglés y español. La búsqueda se basó en las siguientes palabras clave: risedronic acid, alendronate, etidronic acid, ibandronic, diphosphonates, biphosphonates, osteoporosis postmenopausal, bone density, fractures y meta analysis.
Se obtuvieron un total de 59 estudios en EMBASE, 203 en MEDLINE y 26 en la Cochrane mediante las estrategias de búsqueda electrónica descritas anteriormente. Se evaluaron los resúmenes que se obtuvieron para una potencial elegibilidad de los mismos, basada en los criterios de inclusión. Se recuperó la publicación completa de todos los resúmenes que parecieron cumplir con los criterios de inclusión. En total se recuperaron 28 estudios de los obtenidos en EMBASE, 32 obtenidos a través de MEDLINE, un total de 12 estudios se encontraron en ambas bases de datos consultadas y 2 en la Cochrane, coincidentes ambos con estudios encontrados en las otras dos bases consultadas. Esta primera selección a partir de la lectura del resumen se hizo por un investigador, en función de los criterios establecidos en el protocolo de revisión.
Dos investigadores por separado decidieron los artículos a excluir de la revisión, recogiéndose los motivos por los que no se incluyeron. En caso de discrepancia se valoró conjuntamente e intervino un tercer investigador cuando fue necesario. Cada estudio se evaluó por dos investigadores. No se recibió especial entrenamiento para la evaluación de los estudios. En todos los artículos incluidos en la revisión, se evaluó la calidad siguiendo la plantilla facilitada por la red CASPe para la evaluación de metaanálisis, donde con 10 preguntas se evalúa la calidad teniendo en cuenta si se ha definido claramente el tema de la revisión, si se han introducido todos aquellos estudios relevantes, si se ha evaluado la calidad de los mismos, si se precisan con claridad los resultados y si éstos son aplicables. Tras establecer la calidad de los estudios incluidos se pusieron en común y se discutieron las diferencias.
RESULTADOS
DESCRIPCIÓN DE ESTUDIOS
Se revisaron un total de 50 estudios; se excluyeron 37. Los motivos de exclusión de artículos se han clasificado en dos grupos.
1. No metaanálisis: revisiones de la literatura8-30 (n = 23), estudios de evaluación económica31 (n= 1), artículos metodológicos32,33 (n = 2), pooled análisis6,34,35 (n = 3), estudio prospectivo observacional36 (n = 1).
2. Metaanálisis: los objetivos no contestaban a la pregunta planteada en la revisión1,2,37-39 (n = 5), estudios duplicados (n = 2)40,41.
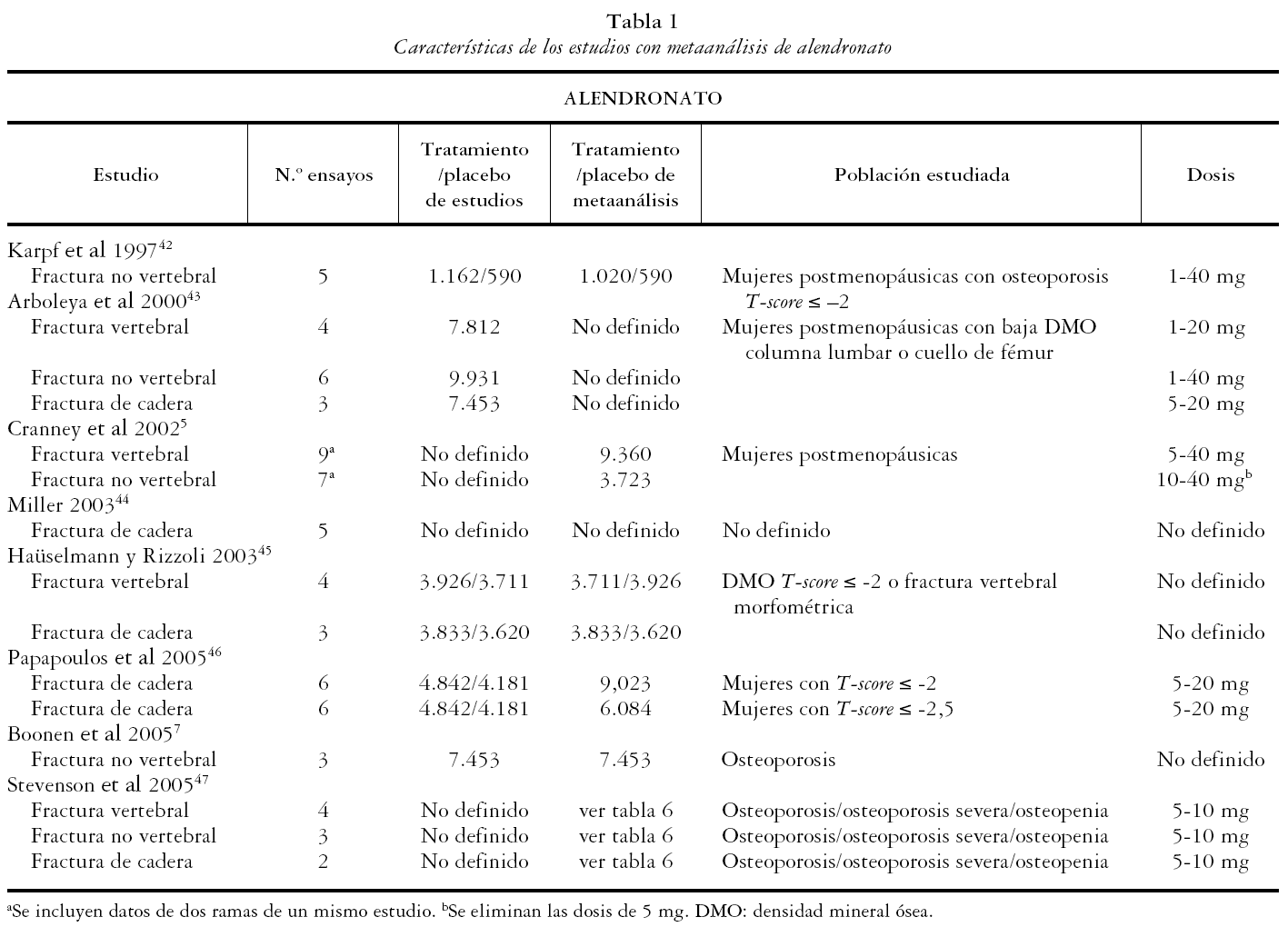
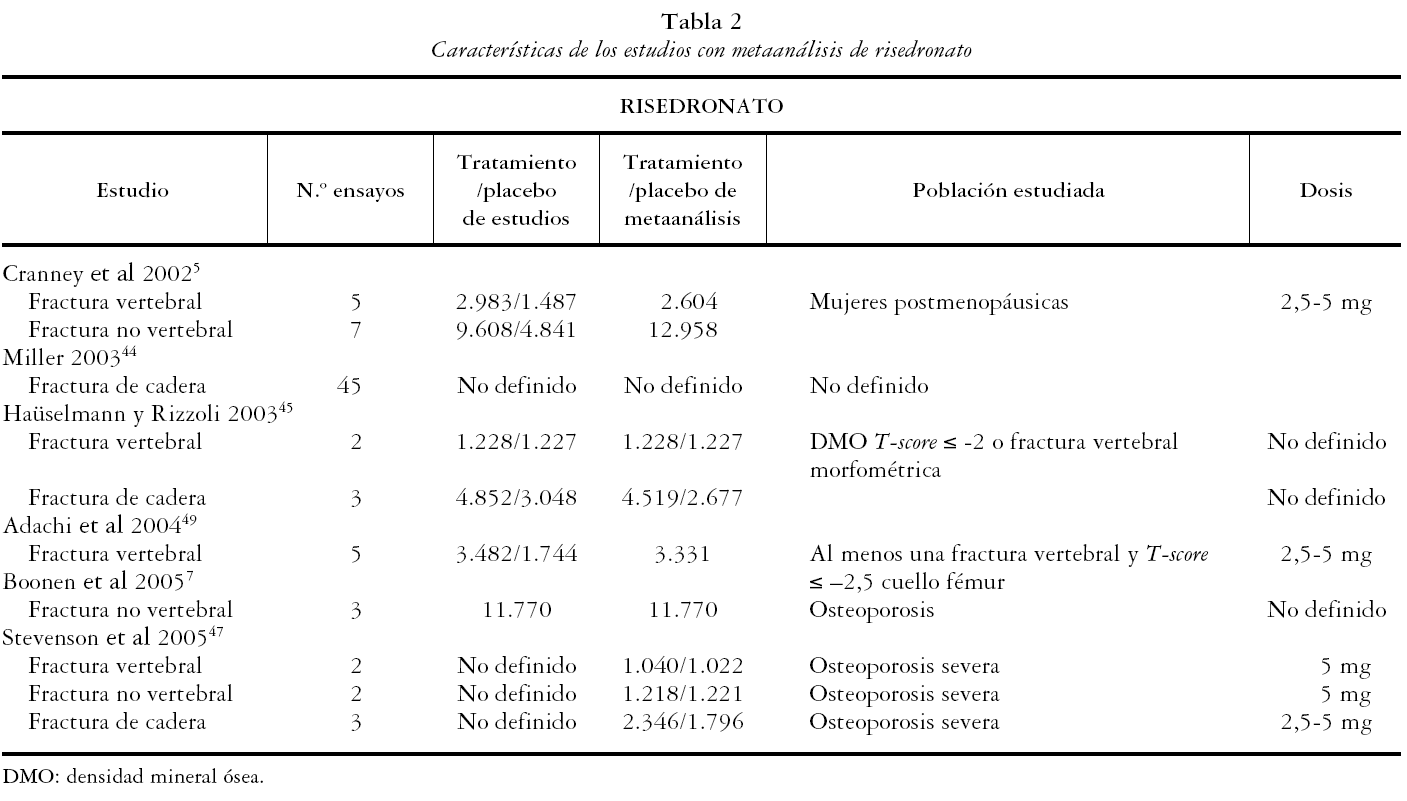
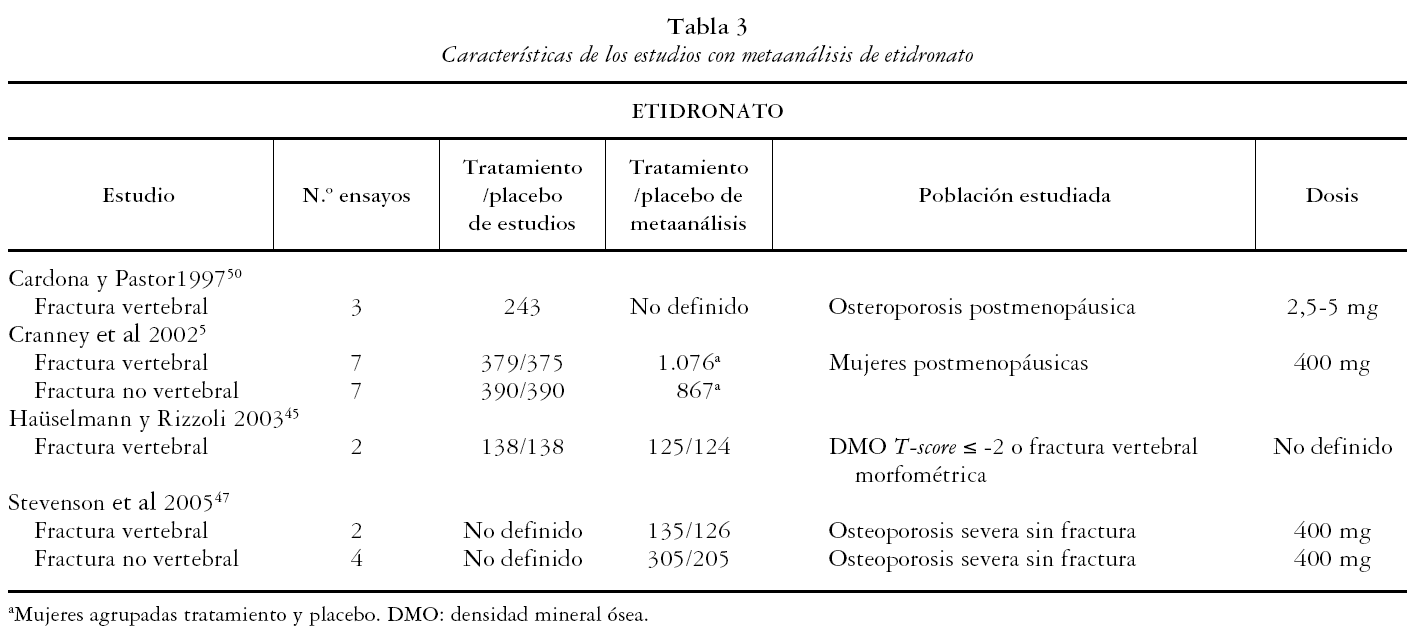
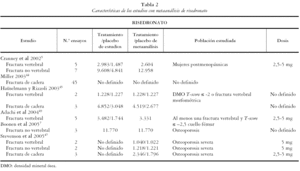
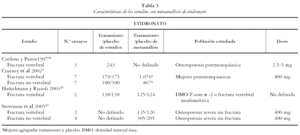
Los 13 estudios restantes5,7,42-52 fueron incluidos para una revisión detallada. Todos ellos son metaanálisis de ensayos clínicos randomizados en los que la población de estudio son mujeres posmenopáusicas, con osteoporosis severa, osteoporosis sin fractura u osteopenia. Las medidas de resultado principales evaluadas en los metaanálisis incluidos fueron la DMO, FV, FNV y de cadera.
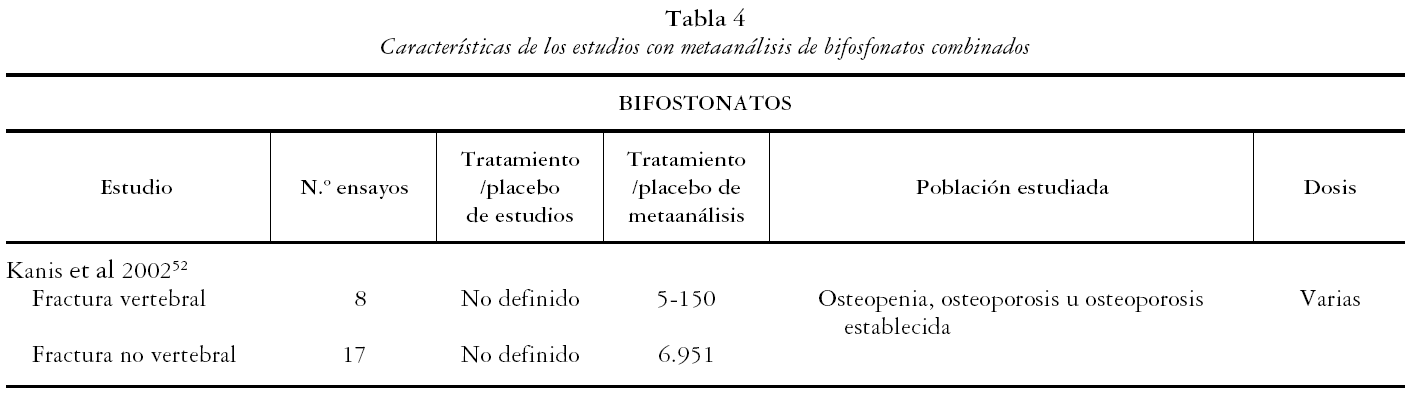
Los 13 estudios recogen un total de 19 metaanálisis, 8 de alendronato, 6 de risedronato y 4 de etidronato, de acuerdo al bifosfonato evaluado, y uno de bifosfonatos combinados. A su vez se presentan 33 metaanálisis según la variable evaluada: 13 de FV, 11 de FNV y 9 de cadera.
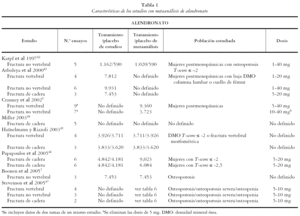
En las tablas 1, 2, 3 y 4 se muestran las principales características de los estudios para cada uno de los metaanálisis realizados en los artículos incluidos. Se recogen las variables de resultado medidas, el número de pacientes de los estudios y el número de pacientes incluidos en el metaanálisis, las características de los sujetos y las dosis administradas.
Para alendronato las dosis utilizadas van desde 1 hasta 40 mg al día y la población de estudio son mujeres posmenopáusicas con osteopenia, con osteoporosis u osteoporosis severa. Las dosis utilizadas para risedronato van desde 2,5 a 5 mg al día y la población de estudio son mujeres posmenopáusicas con osteopenia, con osteoporosis sin fractura o con osteoporosis severa. Para etidronato las dosis utilizadas son de 400 mg.
CALIDAD METODOLÓGICA
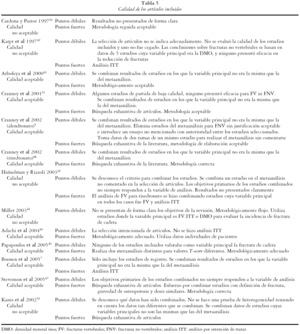
Se evaluó la calidad de las publicaciones incluidas. En la tabla 5 se recoge la valoración de cada uno de los estudios y sus principales puntos fuertes y débiles.
Se consideraron en su conjunto de "calidad no aceptable" 5 estudios: Karpf et al42, Cardona y Pastor50, Kanis et al52, Haüselman y Rizzoli45 y Miller44.
Entre las limitaciones presentadas por los metaanálisis de baja calidad destaca la falta de revisión sistemática de la literatura y la selección de artículos en Karpf et al42 y Miller44. En el primero las conclusiones sobre FNV se basan en datos de estudios en los que la reducción de las mismas no era el objetivo del estudio, y además los ensayos clínicos de los que parte no todos son considerados de calidad. Otra limitación es que no se presenta de forma clara el tema de la revisión: población de estudio, intervención y resultados evaluados.
La limitación básica de Cardona y Pastor50 es que éste es un estudio antiguo, los estudios incluidos presentan gran heterogeneidad y los criterios de inclusión y tiempo de seguimiento son muy variables. No se presentan de forma clara los resultados del metaanálisis.
En Hauselman y Rizzoli45 no se indican las bases bibliográficas consultadas y se desconoce si los datos en la revisión eran combinables. No se presentan de forma clara los resultados del metaanálisis, ya que éstos sólo se indican gráficamente.
Por último Kanis et al52 se ha considerado de calidad no aceptable por combinar estudios de muy diferentes características, ya que combina resultados de diferentes bifosfonatos.
Del total de los 13 metaanálisis que presentaban resultados, 7 se consideraron de "calidad aceptable".
En general, y aunque se pueden citar determinadas carencias metodológicas para cada uno de los estudios considerados de calidad aceptable, la metodología seguida en cuanto a búsqueda de artículos, evaluación de los mismos, análisis de heterogeneidad y sensibilidad y presentación de resultados es en todos adecuada. A continuación se comentan las principales limitaciones y características de éstos.
El estudio de Arboleya et al43 para la evaluación de la eficacia de alendronato es metodológicamente muy correcto: con búsqueda bibliográfica y evaluación de artículos correcta, población bien definida, test de homogeneidad y resultados bien presentados. Los riesgos relativos de cada estudio han sido calculados por intención de tratar, salvo en fracturas de cadera en el estudio de Liberman et al53.
El artículo de Cranney et al51, que evalúa etidronato, es metodológicamente correcto. Sin embargo, algunos de los estudios que incluye en el metaanálisis no son de calidad adecuada; en uno de ellos el análisis no se hizo por intención de tratar, 7 no fueron doble ciego y algunos presentan pérdidas de seguimiento elevadas.
El artículo de Cranney et al5, que evalúa alendronato, es metodológicamente correcto. Presenta algunos aspectos limitantes a destacar. En comparación con otros estudios, éste es el único que presenta separados los resultados del estudio de Liberman et al53, tanto para FV como FNV. En el metaanálisis de FV los datos de Black et al3 y Cummings et al4 no se han calculado por intención de tratar. En el de FNV se añade un artículo no referenciado y no se incluyen los datos de Black3 y Cummings et al4, mientras que otros metaanálisis sí lo hacen.
El artículo de Cranney et al48, que evalúa risedronato, es metodológicamente correcto. El sistema de búsqueda de artículos fue adecuado a través de una revisión sistemática en las fuentes más habituales, pero destaca como limitación que 7 de los ensayos incluidos presentaron pérdidas de seguimiento mayores al 20%.
En el de Papapoulos et al46, que evalúa la eficacia de alendronato para la prevención de fracturas de cadera, no se menciona el método de selección ni de evaluación de artículos. Aparte de esto se trata de un metaanálisis metodológicamente correcto, con test de homogeneidad, análisis de sensibilidad y presentación de resultados correcta, haciéndose una distinción de la población de mujeres según el grado de osteoporosis.
El de Adachi et al49 se ha considerado de calidad, aunque presenta alguna limitación. No se realizó una búsqueda sistemática de la literatura, sino que se cogieron los estudios de registro de risedronato; tampoco se procedió a la evaluación de la calidad de los mismos, aunque ésta se puede presuponer al ser los de registro. Por el contrario, se evaluó apropiadamente la homogeneidad de los tratamientos y las características basales de los sujetos incluidos en el metaanálisis. Se realizó un análisis con datos de pacientes individuales y se llevó a cabo una evaluación del tiempo transcurrido hasta la primera fractura.
El artículo de Stevenson et al47 es metodológicamente correcto en la elaboración de los metaanálisis. Evalúa alendronato, risedronato y etidronato. Realiza una búsqueda exhaustiva de artículos y combina estudios con definición de fractura, gravedad de osteoporosis y dosis similares. No hace análisis por intención de tratar al evaluar subgrupos.
El estudio Boonen et al7, que evalúa la eficacia de alendronato y risedronato en la prevención de FNV, tiene una calidad aceptable, aunque sólo utiliza los estudios de registro para realizar el metaanálisis. Realiza un análisis por intención de tratar.
DESCRIPCIÓN DE LOS RESULTADOS DE LOS METAANÁLISIS DE CALIDAD ACEPTABLE
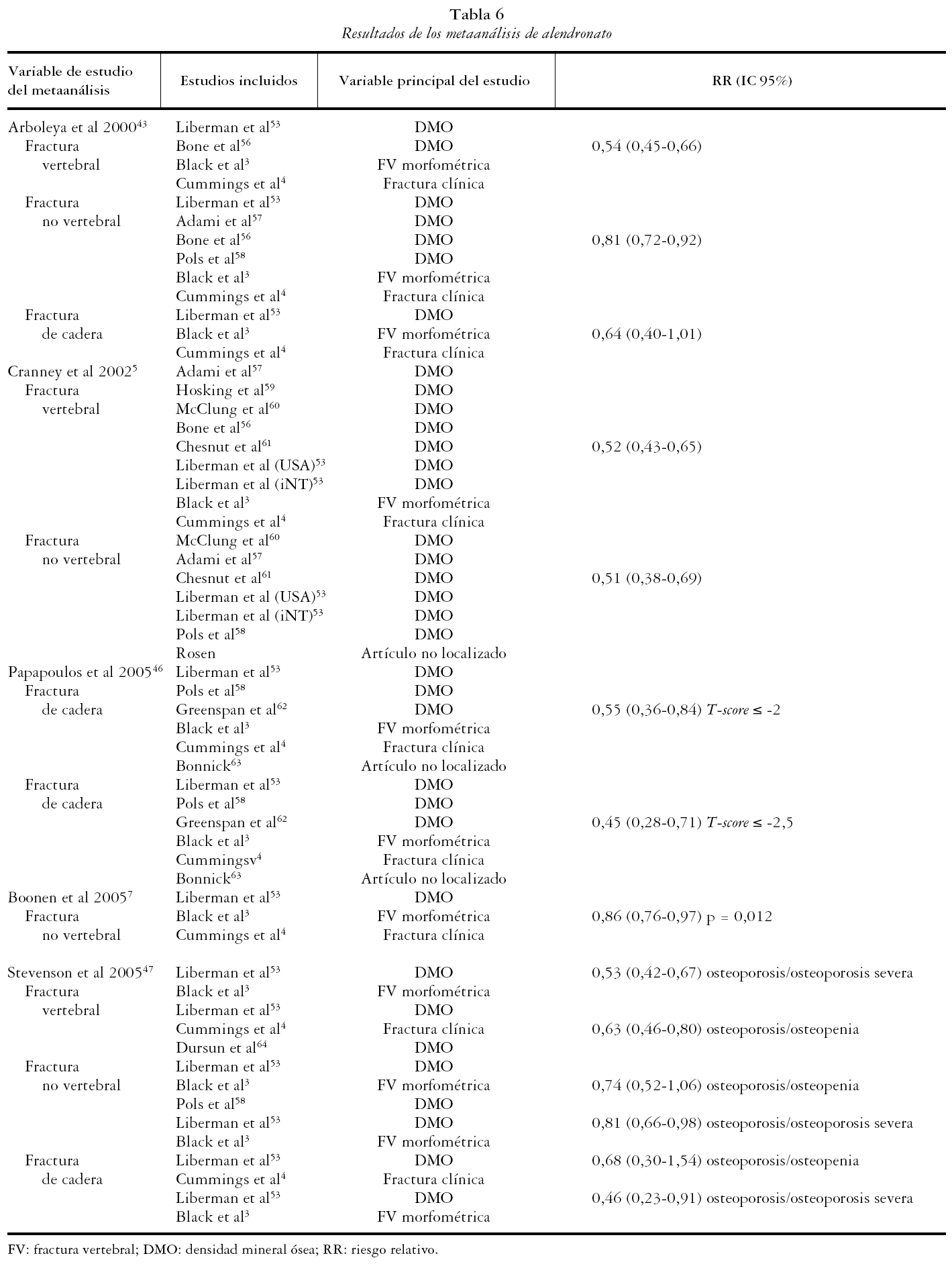
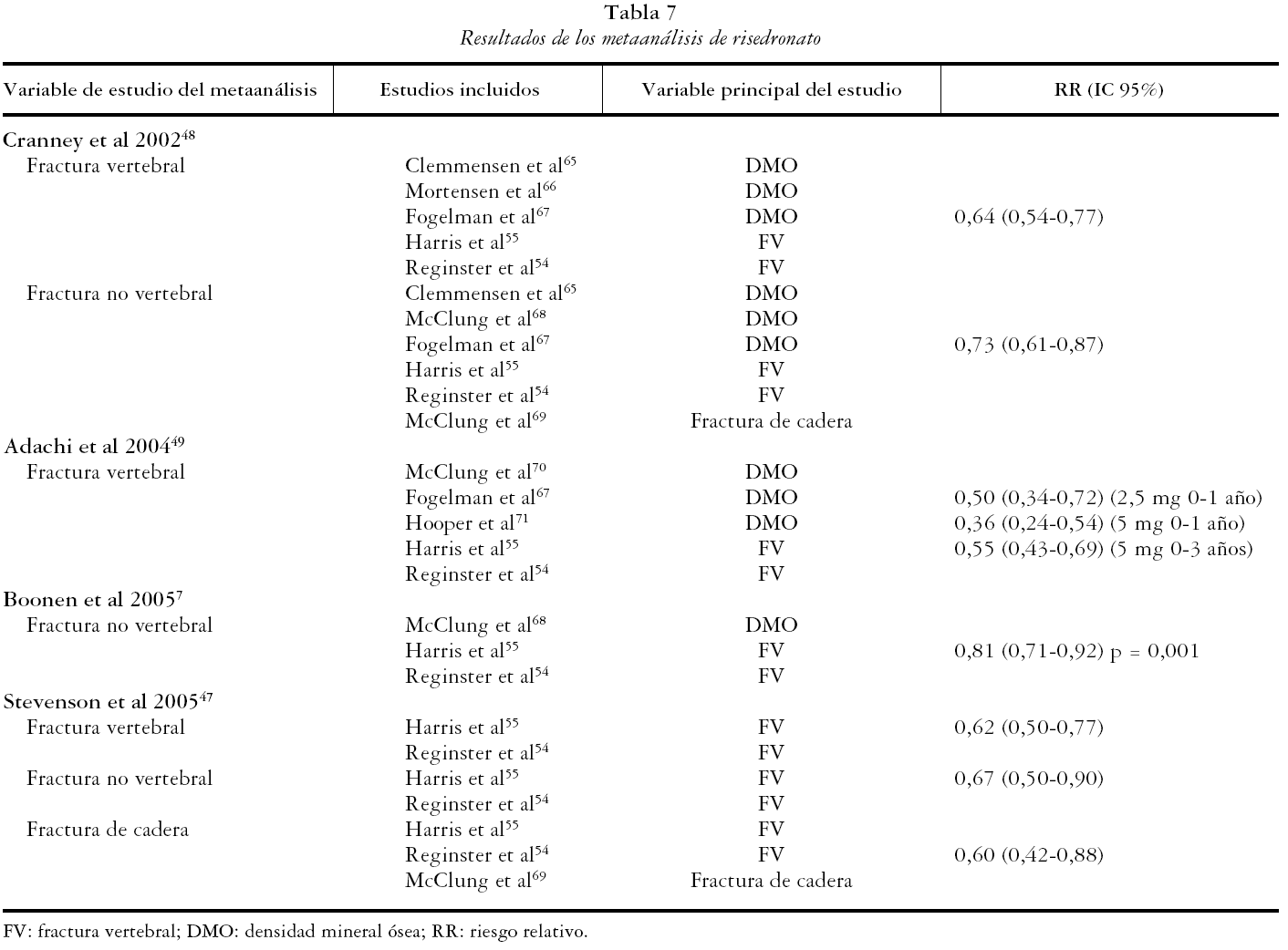
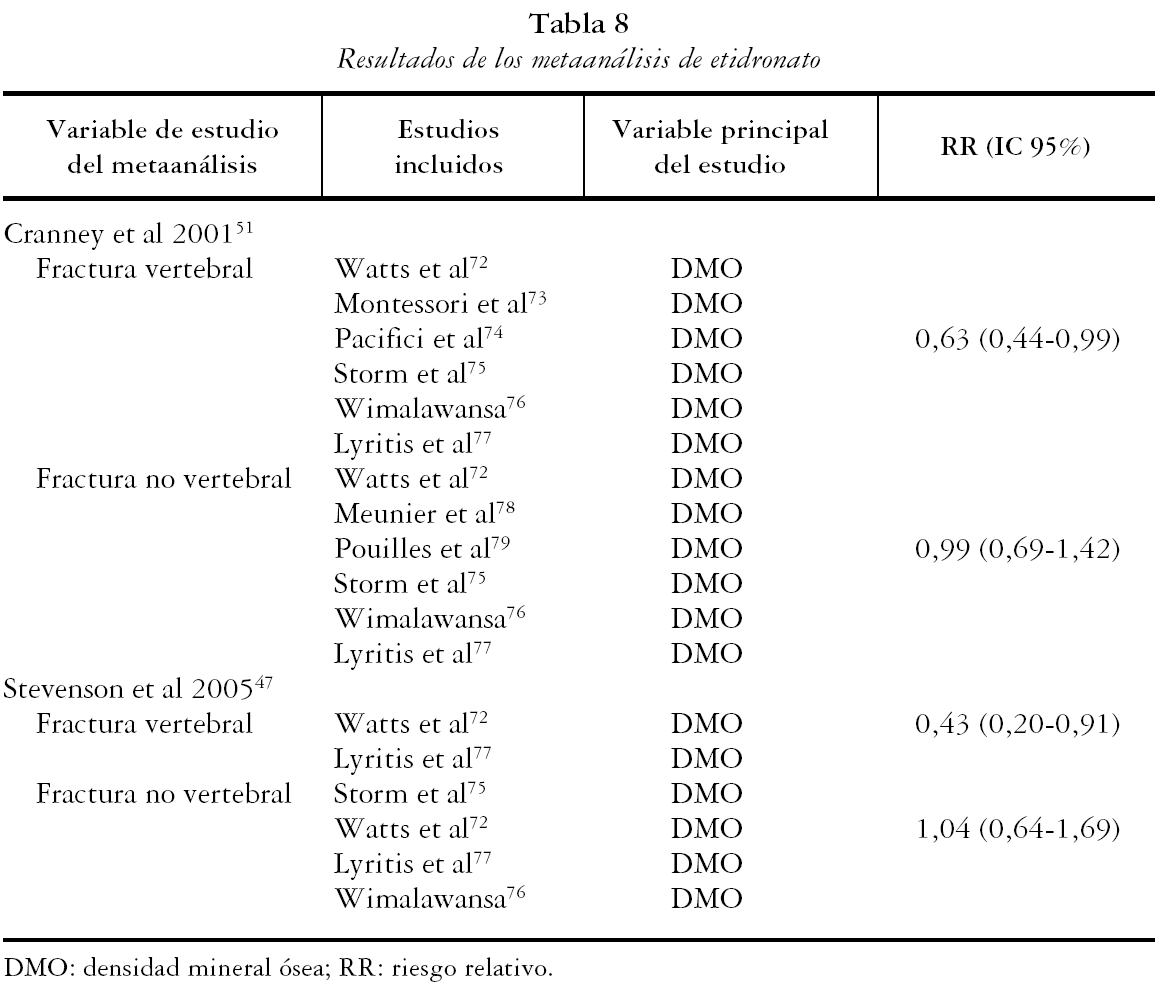
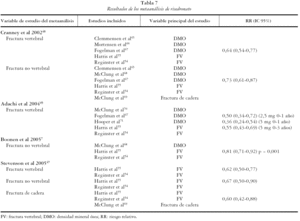
Las tablas 6, 7 y 8 recogen los resultados de los metaanálisis considerados de calidad.
ALENDRONATO
Se obtuvieron los resultados de 5 artículos en los que se realizaba al menos un metaanálisis para alendronato. En dichos artículos se presentaron 11 metaanálisis que consideraron como variable de estudio las FV (3), FNV (4) y las de cadera (4).
Fracturas vertebrales
En los metaanálisis de Arboleya et al43 y Cranney et al5, el alendronato resultó ser eficaz presentando un riesgo relativo (RR) global combinado similar de 0,54 (IC 95%: 0,45-0,66) y de 0,52 (IC 95%: 0,43-0,65) respectivamente. El primero incluye 4 estudios y el segundo un total de 9, dos de ellos de prevención y el resto de tratamiento. Al valorar sólo los estudios de tratamiento el RR es de 0,53 (0,31-0,65). Los resultados de Stevenson et al47 sugieren que la disminución del RR de FV para el alendronato a dosis de 5-10 mg es mayor en mujeres con osteoporosis severa (RR 0,53, IC 95%: 0,42-0,67), siendo el RR en mujeres con osteopenia de 0,60 (IC 95%: 0,46-0,80).
Fracturas no vertebrales
Tres metaanálisis, el de Arboleya et al43, de Cranney et al5 y de Boonen et al7, demuestran la eficacia de alendronato en la reducción de FNV presentando un RR de 0,81 (IC 95%: 0,72-0,92), 0,51 (IC 95%: 0,38-0,69) y 0,86 (IC 95%: 0,76-0,97). Según los resultados de Stevenson et al47, el alendronato mostró un RR de FNV en mujeres con osteoporosis u osteopenia de 0,74 (IC 95 %: 0,52), 1,06 y de 0,81 (IC 95%: 0,66 - 0,98) en mujeres con osteoporosis severa a dosis de 10 mg.
Fracturas de cadera
La eficacia en la prevención de fracturas de cadera se evalúa en 4 metaanálisis. En el de Arboleya et al43 se obtuvo un RR de 0,64 (IC 95%: 0,40-1,01) para todas las dosis combinadas. Los resultados de Papapoulos et al46 muestran resultados para dos subgrupos según los valores de T-score, siendo más eficaz la disminución del riesgo de fracturas de cadera en mujeres con enfermedad más avanzada, RR de 0,45 (IC 95%: 0,28 - 0,71) (T ≤ -2,5) frente a 0,55 (IC 95%: 0,36-0,84) (T ≤ -2). Stevenson et al47 en su metaanálisis obtiene un RR de 0,68 (IC 95%: 0,30-1,54) para mujeres con osteoporosis u osteopenia y de 0,46 (IC 95%: 0,23-0,91) para mujeres con osteoporosis u osteoporosis severa.
RISEDRONATO
Se obtuvieron los resultados de 4 artículos en los que se realizaba al menos un metaanálisis para risedronato. En éstos se presentaron 7 metaanálisis que consideraron como variable de estudio las FV (3), FNV (3) y de cadera (1).
Fracturas vertebrales
El risedronato se presenta eficaz en la reducción de FV en el metaanálisis de Cranney et al48 con un RR de 0,64 (IC 95%: 0,540,77). En el de Adachi et al49, que hace un análisis a partir de datos individuales de pacientes y se realizan por separado metaanálisis por dosis, duración del tratamiento y grado de osteoporosis, la mayor eficacia se obtiene en mujeres con osteoporosis severa (al menos una FV y T-score <-2,5), RR de 0,36 (IC 95%: 0,24-0,54) con dosis de 5 mg/día durante un año y de 0,55 (IC 95%: 0,43-0,69) con la misma dosis durante tres años. En el de Stevenson et al47 se obtiene para risedronato un RR en mujeres con osteoporosis severa de 0,62 (IC 95%: 0,50-0,77).
Fracturas no vertebrales
Los metaanálisis de Boonen et al7 y Cranney et al48 presentan un RR de 0,81 (95% IC: 0,71-0,92) y 0,73 (95% IC: 0,61-0,87) respectivamente. Boonen et al7 incluyen los tres estudios que sirvieron de base de registro y Cranney et al48 incluyen hasta 6 estudios de tratamiento y otro más de prevención. Los valores de RR individuales de cada uno de los estudios incluidos son diferentes entre ambos metaanálisis. En el de Stevenson et al47 el risedronato a dosis de 5 mg día presenta un RR en mujeres con osteoporosis severa de 0,67 (IC 95%: 0,50-0,90).
Fracturas de cadera
La eficacia de risedronato en la prevención de fracturas de cadera se evalúa en el metaanálisis de Stevenson et al47. Se obtuvo un RR de 0,60 (IC 95%: 0,42-0,88).
ETIDRONATO
Se obtuvieron los resultados de dos artículos en los que se realizaba al menos un metaanálisis para etidronato. En dichos artículos se presentaron 4 metaanálisis que consideraron como variable de estudio las FV (2) y FNV (2).
Fracturas vertebrales
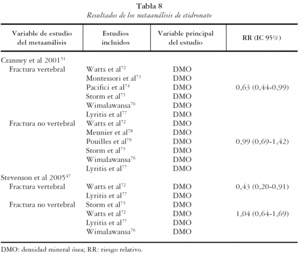
Cranney et al51 presentan un RR de 0,63 (IC 95%: 0,44-0,99) a partir de 6 estudios y Stevenson et al47 de 0,43 (IC 95%: 0,20-0,91), a partir de dos.
Fracturas no vertebrales
Cranney et al51 presentan un RR de 0,99 (IC 95%: 0,69-1,42), a partir de 6 estudios y Stevenson et al47 de 1,04 (95% IC: 0,64-1,69), a partir de los estudios considerados de mayor calidad.
DISCUSIÓN
En general, ninguno de los metaanálisis que aquí se presentan combinan estudios cuya variable principal coincida con el objetivo de estudio del metaanálisis. En el caso de Papapoulos et al46, ninguno de los estudios presentaba como variable principal la reducción de incidencia de fracturas de cadera, ocurriendo lo mismo para los de etidronato, en los que los objetivos primarios de todos los estudios incluidos fue la DMO. Sólo el metaanálisis de Stevenson et al47, en el que se evalúa la eficacia de risedronato para FV, combina datos de estudios que compartían la variable principal de análisis con la del metaanálisis (Reginster et al54 y Harris et al55).
El de Boonen et al7 es el único metaanálisis en el que se indica que el análisis de los datos se hizo por intención de tratar; en el de Arboleya et al43, aunque no se indica, en el metaanálisis de FV y FNV, el análisis fue también por intención de tratar. Tan sólo Adachi et al49 realizaron el metaanálisis a partir de datos individuales de pacientes y se llevó a cabo una evaluación del tiempo transcurrido hasta la primera fractura.
El alendronato ha demostrado su eficacia en la reducción de FV con riesgos relativos similares entre todos los metaanálisis evaluados. También ha resultado ser eficaz en la reducción de FNV, aunque en este caso los riesgos relativos difieren entre los distintos estudios. De los metaanálisis de mejor calidad que evalúan su eficacia sobre FNV, el de Bonnen et al7, que realiza un análisis por intención de tratar, presenta un RR similar a Stevenson et al47. El de Cranney et al5 presenta un RR inferior, pero los datos utilizados de los estudios que incluye no se han calculado por intención de tratar y además se han eliminado del análisis los estudios FIT (Black et al3 y Cummings et al4) que otros metaanálisis sí incluyen, obteniendo resultados muy diferentes y poniéndose en duda los obtenidos por Cranney et al5. El alendronato resulta ser eficaz en la reducción de fracturas de cadera en tres de los cuatro metaanálisis que aquí se presentan, sin embargo, ninguno de los estudios empleados analizaron como objetivo primario dicha variable.
El risedronato ha demostrado su eficacia en la reducción de FV con riesgos relativos similares en los trabajos de Cranney et al48 y Stevenson et al47 y superiores a los obtenidos por Adachi et al49, en el que se hace un metaanálisis a partir de datos individuales de pacientes en lugar de utilizar datos agregados. El de Stevenson et al47 es el único metaanálisis que combina estudios cuyo objetivo primario coincide con la variable de estudio del metaanálisis realizado. La eficacia en FNV ha sido demostrada en tres metaanálisis, destacando que en Boonen et al7 el metaanálisis se hizo a partir de un análisis de los datos por intención de tratar.
El risedronato es eficaz en la reducción de fracturas de cadera, como muestra el metaanálisis de Stevenson et al47. Este metaanálisis incluye el único estudio empleado en todos los metaanálisis evaluados que tenía como objetivo primario la reducción de fracturas de cadera.
Los dos metaanálisis que aquí se presentan para etidronato, si bien metodológicamente son aceptables, el análisis de eficacia de éste en la reducción del riesgo de FV y FNV se hace a partir de estudios de calidad variable, en los cuales ninguno consideró alguna de estas variables como objetivo principal de estudio y en ninguno de ellos el etidronato resultó ser eficaz en la reducción de incidencia de éstas.
CONCLUSIONES
Existen pruebas sólidas para apoyar el uso de risedronato y alendronato en la reducción de FV y FNV, no habiendo demostrado ninguno superioridad de eficacia frente al otro. Por el contrario, la eficacia sobre fracturas de cadera, si bien ha sido demostrada con varios metaanálisis para alendronato y risedronato, éste último es el único que ha constatado su eficacia a través de un ensayo clínico diseñado para ello.
Los resultados obtenidos entre los diferentes metaanálisis, a pesar de pequeñas diferencias en la metodología seguida, han presentado resultados similares. Sin embargo, no todos los resultados presentados en los metaanálisis evaluados en esta revisión pueden ser considerados de evidencia científica similar.
Idealmente sólo aquellos estudios que tienen como objetivo primario el mismo que la variable de análisis del metaanálisis deberían ser incluidos en éste. Entendida la dificultad, dado que pocos estudios podrían ser entonces incluidos bajo este criterio, debe tenerse en cuenta este aspecto a la hora de valorar la aplicación a la práctica clínica del resultado derivado del metaanálisis.
Los metaanálisis basados en datos individuales de pacientes son considerados metodológicamente más correctos que aquellos que se basan en análisis de datos agregados obtenidos a partir de la literatura. Además permiten un análisis de tiempo al evento.
Asumidas estas dos limitaciones comentadas, la gran mayoría de los metaanálisis no cumplen con estas premisas. No obstante, hay otros dos aspectos metodológicos que deberían ser seguidos, puesto que no implican la dificultad de las dos anteriores; realizar un metaanálisis a partir de un análisis por intención de tratar e incluir todos los estudios relevantes que se hayan de considerar.
AGRADECIMIENTOS
Nuestros agradecimientos al departamento de documentación de Sanofi-Aventis por las búsquedas bibliográficas realizadas y por la recuperación de artículos. A Health Outcomes Research Europe, por su colaboración en la recuperación de artículos, evaluación de los mismos y extracción de los datos para la elaboración de este informe de evidencia. Esta revisión ha contado con el apoyo de Sanofi-Aventis.
Correspondencia: A. de Castro
General Castaños, 13.
28004 Madrid. España.
Correo electrónico: antonio4591@terra.es