INTRODUCCION
El descubrimiento del sistema RANK/RANKL/OPG* y su acción en la biología del osteoclasto ha abierto un nuevo camino en el estudio y conocimiento de la patogénesis y el tratamiento de las enfermedades metabólicas óseas1-3. Haciendo una breve descripción, las células de estirpe osteoblásticas producen el factor diferenciador de osteoclasto ODF (RANKL), que se une al receptor de superficie del osteoclasto (RANK receptor activator of NF-KB) estimulando así el reclutamiento y diferenciación de los precursores de los osteoclastos (OC) y su activación, e inhibiendo la apoptosis4. La osteoprotegerina OPG, también de origen osteoblástico, se une al RANKL, impidiendo así su unión con el receptor osteoclástico RANK. De esta forma, la OPG se destaca como un factor regulador óseo, al actuar como competidor del RANK e inhibir la actividad osteoclástica5,6.
*RANK: receptor activador del factor nuclear kB. RANKL: ligando del RANK. OPG: osteoprotegerina.
En condiciones normales existe un balance entre OPG y RANKL que mantiene el remodelado óseo6. Cuando se produce un desequilibrio entre ellos por disminución de OPG, el remodelado óseo aumenta por no-inhibición de los OC, lo que lleva a una desmineralización ósea7. Es lo que parece ocurrir en la osteoporosis inducida por corticoides8 y en la pérdida acelerada de masa ósea por déficit estrogénico9. En cambio, una expresión significativamente elevada de RANKL y/o una hipersensibilidad a sus efectos parece desempeñar un papel importante en la patogenia de la enfermedad de Paget ósea10.
Así pues, todos los datos existentes en la actualidad apuntan a que estos tres elementos constituyen el sistema efector último de la biología del osteoclasto, siendo su principal determinante la proporción RANKL/ OPG; por tanto, los agentes que regulan este balance podrán ser moduladores indirectos de la diferenciación, activación y apoptosis osteoclástica, ejerciendo así un importante papel en el remodelado óseo.
El déficit de estrógenos es la principal causa de pérdida ósea en las mujeres postmenopáusicas11, incrementando tanto la activación como la formación de OC. En este aumento de la osteoclastogénesis actúan múltiples citoquinas resortivas (IL-1, IL-6, TNF-α, M-CSF y PGE2), cuya producción está incrementada por la falta de estrógenos, y algunas de las cuales (PGE2) estimulan la producción de RANKL e inhibe la producción de OPG12. A esta acción se le une la activación de los osteoclastos maduros y el descenso de la apoptosis. Todos estos efectos revierten por la administración de estrógenos.
Los estrógenos estimulan la producción de OPG de forma indirecta, incrementando la producción de TGF-β tanto por los osteoblastos como por los osteoclastos13,14, y directamente por acción sobre los osteoblastos maduros9. La administración exógena de OPG a mujeres postmenopáusicas reduce el recambio óseo15, por lo que se podría considerar el sistema OPG/RANKL como un importante mediador paracrino del efecto antirresortivo de los estrógenos16.
Hay autores que encuentran un aumento en los niveles de OPG sérica con la edad en ambos sexos17, así como en las mujeres postmenopáusicas osteoporóticas respecto a las de normal masa ósea18, sugiriendo que se trata de una respuesta compensatoria al aumento de la resorción ósea que en estos grupos tiene lugar. Sin embargo, otros autores no reportan los cambios relacionados con la edad19.
En el presente estudio hemos querido valorar los niveles de OPG sérica en mujeres pertenecientes a distintos grupos de edad, con y sin osteoporosis densitométrica, así como en pacientes con fractura de Colles y de cadera.
MATERIAL Y MÉTODOS
En el estudio hemos incluido a 80 mujeres que han sido agrupadas según edad, menopausia, densidad mineral ósea y existencia de fracturas tal y como sigue:
A. Grupo de mujeres premenopáusicas sanas (N = 15).
B. Grupo de mujeres postmenopáusicas no osteoporóticas (N = 15).
C. Grupo de mujeres postmenopáusicas osteoporóticas sin tratamiento (N = 15).
D. Grupo de mujeres osteoporóticas con fractura de Colles (N = 12).
E. Grupo de mujeres ancianas con fractura de cadera (N = 15).
F. Grupo de mujeres ancianas sin fractura de cadera (N = 8).
Ninguna de ellas padecía enfermedades que causaran alteraciones del metabolismo óseo (diabetes mellitus, alteraciones paratiroideas o tiroideas, enfermedades renales, artritis reumatoides, etc,...). Así mismo se excluyó a aquellas mujeres que tomasen fármacos tales como estrógenos, progesterona, glucocorticoides, difosfonatos, calcitonina o vitamina D.
A todas se les especificó en la Historia Clínica la existencia o no de fracturas de Colles o de cadera.
DENSITOMETRIA OSEA
A todas las mujeres se les realizó densitometría ósea (DEXA, Hologic QDR-1000) para valorar su densidad mineral ósea (DMO) en columna lumbar (L2-L4). Las fracturas vertebrales en la zona fueron descartadas por radiografía lateral lumbar. El diagnóstico de osteoporosis se basó en los criterios establecidos por la OMS (puntuación T menor de 2,5) aplicados a la medición de columna y tomando como referencia los valores de normalidad obtenidos en la población española20. El coeficiente de variación in vivo del densitómetro empleado es de 1,4% para la medición de columna.
NIVELES SÉRICOS DE OPG
Las muestras de sangre se obtuvieron a primera hora de la mañana en ayunas, y los sueros obtenidos por centrifugado fueron almacenados en congelador a 20 ºC hasta su análisis. Se determinó los valores séricos de OPG mediante la técnica ELISA, con un kit comercial Human Osteoprotegerin ELISA (BioVendor Laboratory Medicine Inc, Brno, República Checa). Las concentraciones séricas de OPG fueron dadas en U/l y sus valores obtenidos en base a una curva realizada con muestras estándares determinadas por el fabricante.
ANALISIS ESTADISTICO
El análisis de los datos se realizó con el paquete estadístico SPSS, versión 11.0. Los datos son expresados como media ± error típico.
Cuando las variables comparadas fueron normales se aplicó el test de ANOVA. Para las variables no gaussianas se utilizaron pruebas no paramétricas (Kruskall-Wallis). El nivel de significación estadística considerado fue de p < 0,05.
Para las correlaciones entre las distintas variables se aplicaron los coeficientes de Speermann (variables no gaussianas) y de Pearson (variables normales).
Se realizó un análisis multivariante para determinar el valor predictivo de las distintas variables estudiadas sobre los niveles séricos de OPG.
La influencia de la OPG sobre una baja masa ósea fue determinada mediante regresión logística binaria.
RESULTADOS
En la tabla 1 se recogen las características de edad, datos antropométricos, densidad mineral ósea a nivel de columna lumbar y los valores séricos de OPG de los distintos grupos estudiados.
Los niveles séricos de OPG en los distintos grupos estudiados muestran diferencias estadísticamente significativas (p < 0,0001) (tabla 1).
Las mujeres con osteoporosis postmenopaúsica (grupo C) presentan niveles más bajos de OPG que el grupo de mujeres controles de edad comparable (grupo B) (21,49 ± 8,53 U/l frente a 32,83 ± 7,80 U/l; p = 0,04), no siendo esta diferencia estadísticamente significativa cuando comparamos a las mujeres osteoporóticas seniles con fractura de cadera (grupo E) con las mujeres sanas de la misma edad sin fractura (grupo F) (104,31 ± 11,45 U/l frente a 127,7 ± 22,35 U/l).
No encontramos diferencias en los niveles séricos de OPG entre las mujeres premenopáusicas (grupo A) y postmenopaúsicas sanas (grupo B) (tabla 1).
Las pacientes con fractura de Colles presentaban unos niveles séricos de OPG significativamente superiores a los de las mujeres osteoporóticas postmenopaúsicas sin fractura (grupo C) (p = 0,026), siendo la densidad mineral ósea entre ambos grupos similar (tabla 1).
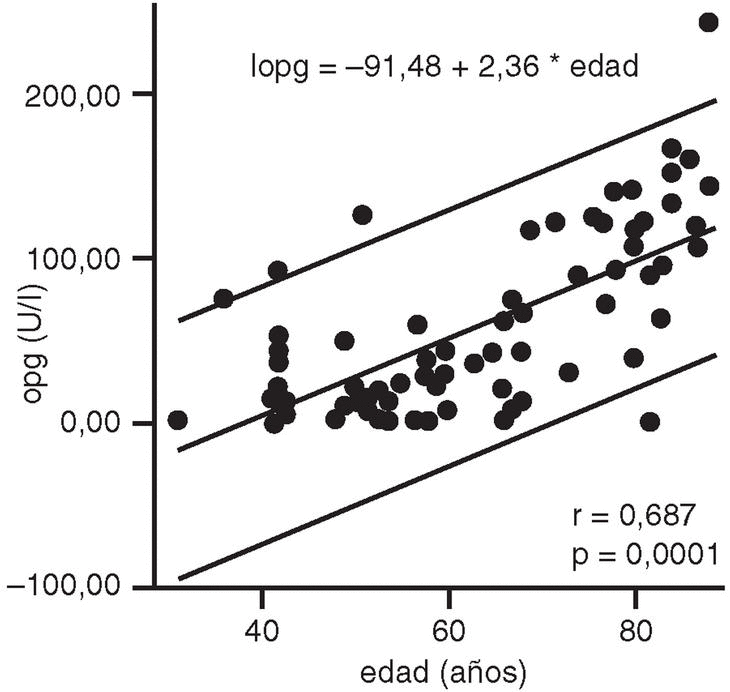
Los niveles séricos de OPG se correlacionaron significativamente con la edad (r = 0,687; p = 0,0001) (fig. 1), la talla (r = 0,401; p = 0,0001), la DMO (r = 0,348; p = 0,002) (fig. 2) y la T-score (r = 0,241; p = 0,031).
Fig. 1. Correlación entre los niveles de OPG séricos y la edad. Regresión lineal con intervalo de predicción individual al 95%.
Fig. 2. Correlación entre los niveles de OPG y la DMO (L2-L4). Regresión lineal con intervalo de predicción individual al 95%.
En el análisis multivariante observamos una asociación entre los niveles séricos de OPG con la edad, con una OR de 1.165 (IC 95%: 1.081,1.255; p = 0,0001) y la baja masa ósea (T-score < 1 SD) (OR: 1.011 (IC 95%: 1.001,1.021; p = 0,035). Esta última asociación persistió cuando los valores de OPG se ajustaron por la edad, siendo entonces la OR de 0,98 (IC 95%: 0,964,0,999; p = 0,035).
DISCUSION
La OPG está destacando con un papel cada vez más importante en el campo del metabolismo óseo y la osteoporosis. Desde su descubrimiento en 1997, los estudios in vitro para conocer su acción se han ido prodigando; sin embargo, aún existen pocos trabajos, y con resultados contradictorios, que investiguen sus repercusiones clínicas y las posibles variaciones en los distintos grupos poblacionales. Es esto último lo que hemos querido observar en este estudio, centrándonos en la mujer adulta por ser éste el grupo poblacional más afectado por la osteoporosis.
Nuestros resultados corroboran aquellos estudios que reportan un incremento y una relación directa de los niveles séricos de OPG con la edad en ambos sexos18,21,22. La explicación más generalizada y que nosotros compartimos es que se trata de un mecanismo protector del esqueleto para compensar la resorción ósea que tiene lugar con la edad.
No hemos observado diferencias en los niveles de OPG sérica al comparar los grupos de mujeres pre y postmenopaúsicas, datos similares a los obtenidos por Seck et al23 en muestras óseas. Estos datos nos han llamado la atención, dado que hay autores como Rogers et al24 que señalan una asociación positiva entre los niveles circulantes de estradiol y los de OPG, indicando que ésta última podría ser un mediador de la acción estrogénica sobre el hueso, si bien en este trabajo sólo estudiaron a mujeres postmenopáusicas.
Existe controversia sobre si los niveles séricos de OPG están aumentados o disminuidos en la osteoporosis postmenopaúsica. Nuestros resultados muestran unos niveles de OPG sérica significativamente inferiores en mujeres con osteoporosis postmenopaúsica respecto a mujeres sanas de la misma edad. Dado que uno de los mecanismos que se aceptan como responsable de la osteoporosis en la etapa postmenopaúsica es una mayor actividad del remodelado óseo, nuestros hallazgos podrían indicar que las mujeres postmenopáusicas que llegan a padecer osteoporosis tienen una mayor tasa de resorción ósea que no es compensada suficientemente por los niveles de OPG, y que la cuantificación de esta proteína podría ayudar a predecir el grupo de mujeres postmenopaúsicas con mayor riesgo de desarrollar la enfermedad.
Estos resultados están en consonancia con los trabajos de algunos autores7,25 que señalan el desarrollo de osteoporosis en los ratones con déficit de OPG/OCIF (Factor inhibidor de la osteoclastogénesis), así como con los que demuestran que la administración exógena de esta proteína a animales deficientes de estrógenos protege contra la osteoporosis26, y son contrarios a los resultados observados por quienes explican que el aumento de los niveles de OPG encontrados en las pacientes osteoporóticas se deben a un mecanismo compensatorio en respuesta a la mayor resorción ósea, que resulta en una pérdida de masa ósea de las mujeres osteoporóticas18,27.
Los resultados de OPG sérica obtenidos en el grupo de mujeres con osteoporosis postmenopáusica no se reproducen en las mujeres de mayor edad; es decir, las mujeres con osteoporosis senil presentan unos niveles de OPG sérica comparables a los de las mujeres sanas de su misma edad, lo cual indicaría que, en esta etapa de la vida, una mayor actividad metabólica ósea no es la principal responsable del desarrollo de osteoporosis.
Otro aspecto que consideramos de gran importancia son los resultados obtenidos en los niveles de OPG cuando comparamos el grupo de pacientes con fractura de Colles y las mujeres osteoporóticas no fracturadas. Hemos encontrado que las pacientes con fractura presentan uno niveles séricos de OPG significativamente superiores a los de las mujeres osteoporóticas sin fractura, siendo la DMO de columna similar y la edad comparable en ambos grupos. Este incremento de la OPG podría tratarse de un mecanismo homeostático para evitar la pérdida ósea. En este sentido se ha señalado que uno de los factores que lleva a un aumento del riesgo de fractura, independientemente de la masa ósea, y que condicionaría una disminución de la calidad ósea, es el recambio óseo acelerado que padecen algunas pacientes28,29. De esta manera, las mujeres con fractura de Colles podrían presentar altos niveles de OPG, en respuesta a un intento de compensación de la alta actividad de remodelado óseo. No consideramos que pudiera tratarse de un reflejo de la mayor actividad metabólica ósea, secundaria a la formación del callo de fractura, ya que había transcurrido un mínimo de 3 meses desde el episodio de fractura hasta que fueron extraídas las muestras de sangre. Estos resultados no han podido ser comprobados en pacientes con fractura de cadera; pensamos que podría deberse al pequeño tamaño muestral del grupo, y a otros múltiples factores asociados a la fractura en el anciano, tales como la mayor tendencia a la caída.
Algunos autores han analizado la asociación entre fractura y niveles de OPG, y sus resultados son diferentes; así Browner et al22 no encuentran asociación entre ambas variables, teniendo en cuenta que su grupo de estudio tenía una banda de edad entre 65 y 85 años; este grupo se encuentra más próximo a nuestras mujeres seniles, en las que tampoco encontramos diferencias en los niveles de OPG atendiendo a la presencia o no de fractura.
En nuestro estudio no hemos evaluado las fracturas vertebrales (salvo en zona lumbar para validar la densitometría). Fahrleitner et al30 observan que los niveles más bajos de OPG se asocian significativamente a una mayor prevalencia de fracturas vertebrales; si bien se estudia a mujeres sometidas a trasplantes, y en el momento en el que se determinan los niveles de OPG las pacientes están siendo sometidas a altos niveles de tratamiento inmunosupresor que pudiera ser el que condicionara estos bajos niveles de OPG en un momento puntual.
Hemos encontrado una asociación entre los niveles séricos de OPG y una baja masa ósea, lo cual se mantuvo tras el ajuste de los niveles de OPG por la edad. Esta débil asociación puede ser explicada por que la masa ósea de un adulto depende del pico de masa ósea y de la tasa de pérdida ósea, y ambos vienen determinados por una gran variedad de factores genéticos y ambientales, y no por una sola citoquina. Estos resultados nuevamente nos indican que la OPG puede ser la expresión del intento compensador de la mayor actividad osteoclástica que lleva a una menor masa ósea; coinciden con la mayor parte de los estudios, aunque algunos autores encuentran una relación positiva entre los niveles séricos de OPG y la DMO24, si bien esta relación sólo la observan en
la medición de fémur proximal y no en la de columna. Browner et al no encuentran ningún tipo de relación entre estas dos variables22.
En conclusión, nuestros resultados muestran unos niveles de OPG que aumentan con la edad; niveles que están disminuidos en las mujeres postmenopáusicas con osteoporosis, pero no en las seniles, y que se encuentran elevados en el grupo de pacientes osteoporóticas postmenopaúsicas con fractura de Colles. Estos niveles séricos de OPG se asocian, aunque de forma débil, a una baja masa ósea. No obstante, estos resultados muestran los niveles circulantes de OPG y no reflejan la actividad de esta proteína dentro del microambiente óseo. Además, se sabe que los niveles séricos de OPG son la suma de la sintetizada por las células del esqueleto y por otras células del organismo, y es regulada por una gran variedad de hormonas y citoquinas. También es conocido que la actividad biológica de la OPG está relacionada no sólo con ella misma, sino también con su ligando RANKL, que en este estudio no ha sido valorado. Por ello, los resultados hay que interpretarlos con cautela, y será necesario realizar estudios en grupos con tamaños muestrales mayores, donde podamos valorar todas estas posibles variables.