INTRODUCCIÓN
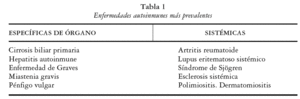
Las enfermedades autoinmunes1 constituyen un heterogéneo grupo de entidades con una base patogénica común: la ruptura del estado de tolerancia hacia los componentes autólogos. Se clasifican en específicas o en sistémicas (tabla 1). En las primeras se afecta únicamente un órgano o un tipo celular completo de un órgano determinado, y se observan autoanticuerpos selectivos. En las segundas se afectan múltiples órganos y sistemas corporales y se evidencia una hiperactividad de los linfocitos B y una gran variedad de autoanticuerpos.
Tradicionalmente, las enfermedades autoinmunes de naturaleza sistémica han ejercido una especial fascinación sobre el clínico. Su diagnóstico supone un reto, las manifestaciones son polimorfas y habitualmente se requiere de una actuación multidisciplinar para lograr su control. En los últimos años el interés se ha visto realzado por la introducción de nuevos fármacos y técnicas terapéuticas que han posibilitado un notable descenso de la morbilidad y de la mortalidad dependientes de la actividad de la enfermedad de base. Paralelamente ha aumentado la concienciación respecto a la importancia de la comorbilidad generada por las infecciones, la arteriosclerosis y la osteoporosis2,3.
Las fracturas osteoporóticas lastran de forma notable la calidad de vida de los pacientes con enfermedades autoinmunes sistémicas, entidades especialmente proclives a favorecer la pérdida ósea (tabla 2)4. El tratamiento con glucocorticoides es un factor muy importante en la génesis de la osteoporosis de estos enfermos, pero no el único. Los términos osteoporosis por glucocorticoides y osteoporosis en las enfermedades autoinmunes sistémicas no son totalmente intercambiables.
La aproximación al riesgo de fractura del paciente debe realizarse con una óptica multifactorial. Además de considerar el efecto de la terapéutica (glucocorticoides) debe tenerse en cuenta el papel que potencialmente pueden jugar los factores relacionados con la propia enfermedad (actividad inflamatoria, inmovilidad, alteraciones hormonales en el eje hipotálamo-hipófiso-suprarrenal, desnutrición) y los factores intrínsecos al individuo (edad, sexo, estado hormonal, índice de masa corporal, base genética)5.
En esta revisión se analiza la etiología y la trascendencia clínica de la osteoporosis en las distintas enfermedades autoinmunes sistémicas, y se exponen unas medidas que pueden resultar útiles en la práctica asistencial para minimizar la pérdida ósea.
ARTRITIS REUMATOIDE
Es una enfermedad sistémica, aunque predominantemente articular, que compromete, fundamentalmente, las pequeñas articulaciones de las manos y de los pies, de forma simétrica6. Tiene una alta prevalencia: afecta a alrededor del 0,5% de la población. Puede presentarse a cualquier edad aunque su máxima incidencia se sitúa entre los 40 y los 60 años. Predomina en la mujer en una proporción de 3:1. Es la enfermedad autoinmune de la que se dispone de mayor información respecto al metabolismo óseo.
Se ha confirmado la hipótesis7,8 de que los osteoclastos son las células responsables de los tres tipos de lesiones óseas que acontecen en la artritis reumatoide (AR): las erosiones, la pérdida yuxtarticular y la pérdida generalizada (osteoporosis).
Se conoce que la remodelación ósea está sometida a complejos factores reguladores, tanto locales (citocinas, factores de crecimiento y óxido nítrico entre otros) como sistémicos (hormonas sexuales, vitamina D y hormona paratiroidea entre otros), que mantienen un equilibrio entre la destrucción y la formación de tejido. El efector final de la gran mayoría de los mecanismos reguladores es el sistema constituido por la osteoprotegerina (OPG) y el ligando del receptor activador del factor nuclear kappa-B (RANKL)9,10. La OPG es una glicoproteína producida por los osteoblastos y las células estromales, cuya función principal es la de estimular la apoptosis de los osteoclastos y bloquear su formación y activación. El RANKL, producido también por los osteoblastos, tiene funciones antagónicas a las de la OPG, es decir, inhibe la apoptosis de los osteoclastos y estimula su formación y activación, al unirse a los preosteoclastos mediante un receptor denominado RANK.
El sistema RANK/RANKL/OPG constituye el componente fundamental para la regulación de la biología ósea tanto en las situaciones normales como en las enfermedades. El nivel relativo del RANKL respecto de la OPG constituye el principal determinante de la actividad de los osteoclastos11,12.
Al analizarse la interfase entre el pannus y el hueso en las zonas de erosión se observa la presencia de células multinucleadas que corresponden a osteoclastos4, en conjunción con fibroblastos y macrófagos, y se constata expresión de RANKL13. En modelos animales de AR se ha demostrado que los fibroblastos sinoviales expresan RANKL, que induciría la diferenciación de osteoclastos a partir de macrófagos14; en el tejido sinovial normal, por el contrario, no se ha evidenciado la expresión de RANKL15. Por otro lado, cabe considerar que los linfocitos T activados tienen capacidad de expresar RANKL y, con ello, contribuir a la destrucción ósea16,17.
Especialmente interesante resulta la observación18 de que en pacientes con AR de inicio, el valor circulante basal de OPG: RANKL y el valor medio de la VSG en el primer año, actúan como determinantes independientes de la aparición futura (5 años) de erosiones óseas; la progresión de la destrucción radiológica es mayor en los pacientes con valores altos de VSG y bajos de OPG:RANKL.
Así pues, la especial propensión de la sinovial inflamada en la AR a inducir resorción ósea probablemente está relacionada con su capacidad de producir diversos factores que pueden provocar, de forma directa o indirecta, la activación y la diferenciación de los osteoclastos, como la IL-6, la IL-11, la IL-17 y, fundamentalmente, la IL-1, el TNFa y el RANKL; la sinergia entre estos tres últimos factores resulta especialmente relevante19,20.
Está establecido que los pacientes con AR presentan una menor densidad mineral ósea (DMO) que la población general21 y un superior riesgo de fractura22,23. Mediante estudios longitudinales se ha puesto de manifiesto que la pérdida ósea sistémica acontece fundamentalmente en las fases iniciales de la enfermedad y que se relaciona estrechamente con los valores de los reactantes de fase aguda24,25.
En la AR, además del fenómeno inflamatorio, se observan alteraciones hormonales26,27, inmovilidad28 y déficit de vitamina D29 por reclusión en domicilio; estos factores también contribuyen, en mayor o menor medida, a la pérdida ósea.
El efecto nocivo de los glucocorticoides es incuestionable, especialmente si se administran a dosis medias o altas; no obstante, cabe contemplar también un potencial efecto beneficioso en tanto que su uso contribuye a disminuir la actividad inflamatoria de la enfermedad de base24. En cuanto al metotrexato, parece que puede afirmarse que a dosis bajas no induce pérdida ósea adicional8,30,31.
En la tabla 3 se exponen los principales determinantes de la pérdida ósea que acontece en la AR.
La prevalencia de la osteoporosis, definida a partir de criterios densitométricos, depende de las características de la población estudiada. En un estudio noruego de base poblacional6 en el que se evaluaron mujeres pre y posmenopáusicas, la prevalencia de osteoporosis fue de 16,8% en columna lumbar y de 14,7% en cuello femoral; en un estudio de nuestro grupo32 sobre mujeres posmenopáusicas tratadas con dosis bajas de glucocorticoides, la prevalencia de osteoporosis fue de 38% en columna lumbar y de 34% en cuello femoral.
En varones, la información disponible es inferior, aunque se conoce que la frecuencia de osteoporosis es menor33. En un trabajo reciente de nuestro grupo34, en el que se evaluaron a 189 varones con AR controlados en un hospital universitario, se situó en el 13% en la columna lumbar, en el 12% en el cuello femoral y en 21% al considerar ambas localizaciones.
Dada la edad en que suele iniciarse la AR, muchas mujeres sufren el impacto de la enfermedad sobre el hueso cuando aún no han llegado a la menopausia. Apenas existen datos acerca del estado de la DMO y de la prevalencia de la osteoporosis en las mujeres premenopáusicas con AR. No se ha realizado ningún estudio específicamente diseñado para resolver esta incógnita. En el trabajo de Haugeberg et al6, el 30% de las mujeres evaluadas eran premenopáusicas y la frecuencia de osteoporosis se situó en el 7%. Cabe considerar que se trata de un estudio de base poblacional, con lo que probablemente la gravedad de la enfermedad sea sensiblemente inferior a la de las pacientes controladas en los hospitales.
La frecuencia de las deformidades vertebrales, en pacientes tratadas con glucocorticoides a dosis bajas35, se acerca al 25% y la de las fracturas vertebrales clínicas, al 10%. En ocasiones, la fragilidad ósea se traduce en forma de fracturas de ramas isquiopubianas y de tibia o peroné36,37; en estos casos, el diagnóstico diferencial con un brote álgico de la enfermedad de base puede resultar difícil.
Cabe considerar que los pacientes con una AR avanzada38, presentan alteraciones sinoviales y musculoligamentosas de las extremidades que determinan un aumento del riesgo de caída y una disfunción de los mecanismos protectores frente al impacto.
Los conocimientos actuales avalan que la abolición de la actividad inflamatoria resulta capital a la hora de abordar el problema de la osteoporosis en los pacientes con una AR. En este sentido, en estudios preliminares se ha puesto de manifiesto el efecto beneficioso sobre el hueso que se deriva de la utilización de las terapias biológicas39-41. Por otro lado parece interesante investigar el potencial de los bisfofonatos de nueva generación y del denosumab, un fármaco con actividad anti-RANKL, como fármacos inhibidores de la aparición de erosiones42-44.
Los pacientes con artritis idiopática juvenil (AIJ), un grupo de enfermedades de etiología desconocida, de inicio en la infancia, que cursan con manifestaciones inflamatorias articulares y sistémicas y que dan lugar a diversas formas de expresión clínica45, constituyen una población de alto riesgo de desarrollar osteoporosis y fracturas, especialmente si reciben tratamiento con glucocorticoides46,47. Su descripción escapa a los objetivos de esta revisión en tanto que corresponde su control al ámbito de la reumatología pediátrica. Cabe indicar, no obstante, que en adultos con AIJ activa48,49, se ha descrito una alta frecuencia de osteoporosis, lo que reafirma el efecto nocivo de la enfermedad.
LUPUS ERITEMATOSO SISTÉMICO
Constituye el paradigma de las enfermedades autoinmunes sistémicas50. Los pacientes presentan manifestaciones clínicas articulares, cutáneas, renales, hematológicas, neurológicas, pulmonares y vasculares. Presenta un franco predominio femenino (9:1) y suele iniciarse entre la segunda y la cuarta décadas de la vida.
Las mujeres con lupus eritematoso sistémico (LES) presentan una menor DMO que la población general51-54 y un riesgo aumentado de fractura55; la gran mayoría de las mujeres incluidas en los estudios son premenopáusicas. En varones, estas circunstancias no están aclaradas56.
Los factores que se han invocado57 en la etiopatogenia de la pérdida ósea que se observa en el lupus eritematoso sistémico (tabla 4) son el tratamiento glucocorticoideo, el hiperparatiroidismo secundario a la insuficiencia renal, la actividad y la duración de la enfermedad, y la existencia de una hipovitaminosis D relacionada esencialmente con una voluntaria ausencia de exposición solar (filtros extremos, evitación de la irradiación ultravioleta) dada la fotosensibilidad de la enfermedad lúpica.
La prevalencia de las fracturas vertebrales oscila entre un 10%58 y un 20%59. Se ha comunicado que no existe una clara relación entre el estado de la DMO y la prevalencia de las fracturas54.
Especialmente relevante resulta el hecho de que se haya demostrado60 que en mujeres jóvenes existe una asociación entre la presencia de una DMO disminuida y un aumento del índice de placa arterioesclerótica en la arteria carótida; además, la existencia de una DMO baja parece asociarse a la presencia de calcificaciones en las arterias coronarias. Ello abre una interesantísima vía de investigación: dos de los más importantes procesos comórbidos que afectan a las pacientes con LES, la arterioesclerosis y la osteoporosis, podrían tener una etiopatogenia común, la inflamación mantenida. En otro sentido, parece también probado61 que las pacientes con un mayor daño orgánico son las que presentan una menor DMO.
SINDROME DE SJÖGREN
Se define62 por la asociación de queratoconjuntivitis seca y xerostomía (síndrome de Sjögren primario). Cuando esta entidad se asocia a otras enfermedades autoinumnes (AR, LES, esclerosis sistémica y cirrosis biliar primaria, fundamentalmente), se emplea para denominarla el término síndrome de Sjögren secundario. Predomina en las mujeres (9:1) y aparece, fundamentalmente, entre la cuarta y la quinta décadas de la vida. Las manifestaciones clínicas son consecuencia de la hipofunción de la atrofia de las glándulas (lacrimales, salivares mayores y menores, páncreas) como consecuencia de una infiltración linfocítica. Puede existir también un compromiso visceral (afección renal, pulmonar, digestiva y neurológica).
No se han realizado estudios en los que se evalúe el estado de la DMO y la frecuencia de fracturas en pacientes con síndrome de Sjögren primario. Tampoco se ha analizado si la presencia de un síndrome de Sjögren puede influir en el determinismo de la masa ósea de las pacientes con AR o con LES.
En cambio, en los últimos años han aparecido diversas publicaciones en la literatura6365 en las que se alerta acerca de la necesidad de mantener un alto índice de sospecha de osteomalacia en pacientes afectos de síndrome de Sjögren que presenten una acidosis tubular renal.
ESCLEROSIS SISTÉMICA
La esclerosis sistémica (esclerodermia) es una enfermedad que se caracteriza por la presencia de un depósito excesivo de los componentes del tejido conectivo, expresado en forma de fibrosis, y por alteraciones estructurales del lecho vascular66. Afecta fundamentalmente a la piel y a órganos internos como el tubo digestivo, el pulmón, el riñón y el corazón. Presenta predominio femenino (3-5:1) y es una enfermedad infrecuente, con una incidencia de 4 a 10 nuevos casos por millón de habitantes y año.
Parece probado que las pacientes con esclerodermia presentan una menor DMO que la población general67,68. No existen datos acerca de las fracturas.
Souza et al69 en un trabajo reciente han observado una prevalencia inusitadamente alta de osteoporosis, tanto en la columna lumbar (32,5%) como en el cuello femoral (51,1%) al evaluar a un grupo de 47 mujeres posmenopáusicas. Como dato especialmente interesante, los autores observaron unos valores de masa grasa y de masa magra en las pacientes significativamente inferiores a los del grupo control; en las mujeres con esclerodermia se observó una correlación entre la masa magra y la DMO. Previamente67, ya se había comunicado una marcada asociación entre el índice de masa corporal y la DMO en mujeres pre y posmenopáusicas con esclerodermia.
La información disponible aún es escasa70. No obstante, muy probablemente habrá que considerar la esclerosis sistémica un factor de riesgo para el desarrollo de osteoporosis.
POLIMIOSITIS. DERMATOMIOSITIS
Las miopatías inflamatorias idiopáticas71 agrupan un heterogéneo grupo de entidades de etiología desconocida que presentan en común la presencia de debilidad muscular y de infiltrados inflamatorios en el músculo estriado. La polimiositis y la dermatomiositis constituyen las entidades más representativas. Son entidades extraordinariamente infrecuentes, con una prevalencia estimada de 5 casos por millón de habitantes. No existe un claro predominio de un género sobre el otro.
Se ha demostrado72 que la presencia de osteoporosis constituye uno de los determinantes de la distorsión de la calidad de vida que presentan los pacientes con miopatías inflamatorias idiopáticas. No obstante, no se ha publicado ningún estudio en el que se compare el estado de la DMO en estos pacientes y en la población general. Los escasos datos disponibles hacen referencia a población infantil y juvenil7375; en estos grupos de edad, la existencia de una marcada pérdida ósea parece incuestionable75.
TRATAMIENTO
En los últimos años se han realizado grandes esfuerzos para uniformizar en lo posible el manejo clínico de los pacientes con enfermedades autoinmunes sistémicas, tanto en cuanto a la estrategia terapéutica para conseguir la remisión del proceso de base, como en los instrumentos de medida de la respuesta clínica. Ello se ha puesto especialmente de manifiesto en la AR. Se ha obtenido mucha información con esta forma de actuación. En la actualidad el nivel de incertidumbre ante un paciente afecto de esta enfermedad es mucho menor que el que se tenía hace únicamente cinco años.
Desafortunadamente, el grado de conocimiento acerca de cómo deben controlarse los procesos comórbidos es mucho menor. Sólo en el tema de la infección la información disponible es sólida. Queda mucho por hacer en el ámbito de la prevención y el tratamiento de la arterioesclerosis y de la osteoporosis, dos enfermedades que causan buena parte de la morbimortalidad de los pacientes con enfermedades autoinmunes sistémicas.
La problemática de la pérdida ósea suele abordarse a partir de las guías de práctica clínica para el manejo de la osteoporosis inducida por glucocorticoides. Este enfoque probablemente no es el más adecuado pero sirve para aproximarse al problema, ya que buena parte de los ensayos clínicos realizados han incluido un número relevante de pacientes afectos de enfermedades autoinmunes sistémicas.
Las pautas de actuación que se exponen a continuación intentan aunar la experiencia del autor en el control clínico de los pacientes afectos de enfermedades autoinmunes sistémicas con las directrices expuestas por diversas autoridades sanitarias76-80 en el ámbito de la osteoporosis por glucocorticoides.
CONSIDERACIONES GENERALES
Deberá controlarse al máximo la actividad de la enfermedad de base. Necesariamente deben aplicarse en cada visita las medidas instrumentales que permitan conocer la actividad que presenta el paciente. La inducción de la remisión debe ser el norte que guíe la práctica clínica.
Se instaurará tratamiento con glucocorticoides sólo cuando sea estrictamente necesario y siempre con la mínima dosis efectiva. La monitorización del paciente debe ser estrecha. En cada control debe reevaluarse la dosis que se está prescribiendo y confirmar que el paciente la sigue necesitando.
MEDIDAS NO FARMACOLOGICAS
Es preciso advertir al enfermo que debe mantener unos hábitos de vida saludables para el hueso. Se le indicará que deje de fumar y que modere la ingesta enólica. Se fomentará la práctica regular de ejercicio físico. Si se evidencia que se está instaurando una miopatía, se programarán ejercicios específicos de potenciación de la musculatura cuadricipital que puedan limitarla.
Deberán corregirse las posibles insuficiencias nutricionales que puedan observarse; especialmente deberá asegurarse que el paciente ingiera 1.500 mg de calcio al día. Se expondrá al paciente la necesidad de restringir al máximo la ingesta de sodio y se le informará de que debe evitar la realización de actividades que comporten una solicitación excesiva de la columna vertebral; en pacientes de edad avanzada, se actuará de forma integral sobre el riesgo de caída.
MEDIDAS FARMACOLOGICAS
Alendronato81-84, risedronato85-87 y etidronato88-90 son los fármacos que han demostrado de forma fehaciente capacidad de aumentar la DMO y de reducir el riesgo de fractura vertebral en pacientes tratados con glucocorticoides. No existen estudios metodológicamente rigurosos que hayan testado la eficacia de las distintas opciones farmacológicas en pacientes afectos de una enfermedad en concreto.
ACTUACIÓN EN LA PRÁCTICA ASISTENCIAL
El hecho de que no exista un consenso claro no parece justificar la no intervención en el ámbito de la prevención y el tratamiento de la osteoporosis de los pacientes afectos de una enfermedad autoinmune sistémica. Tampoco parece justificable no intervenir por el hecho de no aumentar el número de fármacos, de por sí ya muy alto, que recibe el paciente. Es indiscutible que una explicación razonada de los motivos por los que se prescribe el tratamiento, determina un alto grado de cumplimiento91.
Conceptualmente, podrían contemplarse tres escenarios: a) el paciente afecto de una enfermedad autoinmune sistémica al que se prescribe por primera vez terapéutica glucocorticoidea, b) el enfermo que ha recibido tratamiento con glucocorticoides durante un periodo de tiempo prolongado y c) el paciente al que nunca se le han administrado estos fármacos, circunstancia que prácticamente sólo se da en la AR.
En todos lo casos se aplicarán las medidas no farmacológicas descritas con anterioridad. Para conseguir que el paciente tome 1.500 mg/día de calcio, suele ser necesario recurrir a los suplementos farmacológicos. Asimismo, es necesario prescribir vitamina D92, a dosis de 400 UI/día, en los pacientes de edades inferiores a 60-65 años y a dosis de 800 UI/día en los enfermos de edad superior. Estas medidas, aplicadas a lo largo de un año, podrían ser suficientes si previamente se hubiera planificado que la duración del tratamiento con glucocorticoides va a ser inferior a 3 meses, circunstancia poco habitual.
Si se presupone que la terapéutica glucocorticoidea va a durar más de tres meses, o con independencia de la presunción inicial, se prolonga más allá de este tiempo, es aconsejable añadir sistemáticamente un tratamiento antirresortivo, en especial si la dosis diaria es superior a 7,5 mg de prednisona o equivalentes. Por las evidencias existentes, los bisfosfonatos citados constituyen la terapéutica de elección. Esta pauta de actuación también debería aplicarse en aquellos casos en que el clínico contacta por primera vez con un paciente que crónicamente ha recibido glucocorticoides y al que nunca se ha prescrito un tratamiento encaminado a disminuir la pérdida ósea.
Es aconsejable practicar una densitometría antes de iniciar la terapéutica glucocorticoidea o en los primeros días tras su instauración; asimismo, se debería realizar en el primer contacto con el paciente afecto de una enfermedad autoinmune sistémica que ha seguido un tratamiento glucocorticoideo prolongado. Cabe tener presente que en la toma de decisiones la densitometría no juega un papel tan relevante como en el ámbito de la osteoporosis posmenopáusica. La relación DMOriesgo de fractura no es aquí tan estrecha, fundamentalmente como consecuencia de la acción nociva de los glucocorticoides sobre la calidad del hueso. No obstante, el estado de la masa ósea puede matizar la pauta de intervención. Así, aunque la terapéutica glucocorticoidea no fuera a durar más de tres meses, ante una DMO inicial baja, podría contemplarse la posibilidad de instaurar tratamiento con bisfosfonatos. O a la inversa, si la DMO de partida fuera estrictamente normal, a pesar de que la duración prevista del tratamiento con glucocorticoides fuera superior a tres meses, podría considerarse la posibilidad de intervenir sólo con la aplicación de las medidas no farmacológicas y con la administración de calcio y vitamina D, especialmente si los glucocorticoides no van a administrarse a dosis altas.
Con independencia de la opción elegida, una vez transcurrido un año de tratamiento, se debería practicar una nueva evaluación densitométrica. Si el paciente sigue recibiendo glucocorticoides y se observa ganancia ósea o una pérdida no superior al 3%, se continuará con el tratamiento instaurado; si por el contrario, la pérdida es superior a esa cifra, se considerará la posibilidad de cambiar la opción inicial. Se aconseja seguir practicando una densitometría de control cada año o a lo sumo cada dos años mientras el paciente esté sometido a terapéutica glucocorticoidea, y plantearse ante cada resultado la conveniencia o no de cambiar el tratamiento. Probablemente también deba contemplarse la posibilidad de un cambio si a lo largo del seguimiento aparece una fractura de naturaleza osteoporótica.
Si el enfermo ya no recibe glucocorticoides, el manejo ulterior se decidirá a partir de los resultados obtenidos en la densitometría de control, pero ya utilizando los mismos criterios que cada clínico aplique en los pacientes que no están sometidos a tratamiento glucocorticoideo.
En los pacientes con una enfermedad de larga duración y que nunca hayan recibido tratamiento con glucocorticoides, es aconsejable practicar una evaluación densitométrica al menos en una ocasión, especialmente en las mujeres posmenopáusicas y en los enfermos de edad avanzada. En virtud de los resultados observados, se decidirá la estrategia ulterior.
La dificultad de acceso a la densitometría no debería ser un factor limitante de la intervención. En este contexto, tratar únicamente teniendo en cuenta los factores de riesgo es una actuación perfectamente válida.
La idea de ofrecer osteoprotección debe impregnar la actuación del clínico que controla pacientes con una enfermedad autoinmune sistémica. Es nuess enfermos con la finalidad de conseguir incrementar el actual grado de intervención93. roblema de la osteoporosis en esto