INTRODUCCION
El aumento progresivo de la incidencia de osteoporosis, paralela al envejecimiento demográfico sanitario en España, su morbilidad y mortalidad, así como su importante impacto sanitario y económico, ha llevado a la SEIOMM a desarrollar una Guía de Práctica Clínica sobre Osteoporosis Postmenopáusica como un primer paso, dirigido al grupo poblacional más afectado. La SEIOMM ha constituido un Grupo de Trabajo para elaborar dicha guía siguiendo la metodología de la Medicina Basada en la Evidencia (MBE) es decir, en pruebas.
La presente Guía de Práctica Clínica pretende ofrecer un marco indicativo sobre el cual se puedan desarrollar, por los grupos de profesionales interesados, protocolos de actuación adaptados a cada ámbito asistencial. Quiere ello decir que se deben valorar sus recomendaciones como derivadas de la revisión de las pruebas científicas, pero que las decisiones clínicas deberán integrar, además, la experiencia de los profesionales, el escenario asistencial en que se apliquen, así como los valores y preferencias de las pacientes. Pueden haber, por tanto, decisiones clínicas diferentes a las aquí recomendadas que constituyan también pautas de actuación perfectamente válidas.
ANTECEDENTES
La osteoporosis es la enfermedad metabólica ósea más prevalente. Afecta a un 35% de mujeres españolas mayores de 50 años, porcentaje que se eleva a un 52% en las mayores de 70 años. Una de cada cinco mujeres mayores de 50 años tiene al menos una fractura vertebral, que se asocia a deterioro de la calidad de vida y a riesgo aumentado de otras fracturas. La incidencia anual de fractura de fémur en mujeres mayores de 50 años es de 3 por 1.000. La incidencia de fractura de antebrazo es de casi el doble. En la actualidad, el riesgo de padecer una fractura de fémur en lo que le resta de vida es, para una mujer española de 50 años, de entre un 12% y un 16%. La presencia de fracturas, especialmente la de fémur, produce un aumento de la mortalidad con relación a las pacientes sin fracturas.
METODOLOGIA
Durante dos años se ha elaborado el contenido de la Guía en las siguientes etapas: a) reunión de un grupo de expertos en osteoporosis para plantear las preguntas relevantes; b) creación de un equipo de revisión sistemática formado por un experto en MBE y dos becarios, encargados de la búsqueda, revisión estandarizada, análisis crítico y tabulación de los artículos relevantes; c) reuniones de expertos clínicos para organizar las evidencias jerarquizadas en recomendaciones clínicas; d) redacción de un borrador de la Guía, y d) debate público del mismo en un foro abierto a todos los miembros de la SEIOMM y otros especialistas.
En el proceso de debate han intervenido, además de los médicos de diferentes especialidades, representantes de Agencias de Evaluación, representantes del Ministerio de Sanidad y Consumo y de la Agencia Española del Medicamento. Además han participado, en representación de los pacientes y de la sociedad civil, representantes de la Federación Española de Derecho Farmacéutico, Asociación Nacional de Informadores de la Salud y de la entidad que agrupa a los pacientes de osteoporosis, la Fundación Hispana de Osteoporosis y Enfermedades Metabólicas Óseas. Todos ellos han realizado las aportaciones al documento que han considerado oportunas.
La Guía ha sido revisada por un experto en economía de la salud que ha realizado las consideraciones farmaco-económicas.
El Grupo de Trabajo ha aceptado la revisión sistemática realizada en la principal Guía de Práctica Clínica (GPC) basada en la metodología MBE que se ha publicado, la del Real Colegio de Médicos Británico, hasta diciembre de 1995. Se ha revisado sistemáticamente, por el equipo de revisión, la base de datos MEDLINE desde el 1 de enero de 1996 hasta el 1 de enero de 2000, así como la Cochrane Library Best Evidence y los artículos recomendados por el Grupo de Trabajo. Se ha realizado una búsqueda complementaria, con estrategia similar, por parte de todo el Grupo de Trabajo desde el 1 de enero de 2000 hasta el 15 de mayo de 2001. Se han aceptado artículos considerados relevantes publicados en los meses posteriores hasta el cierre de debate público sobre el borrador.
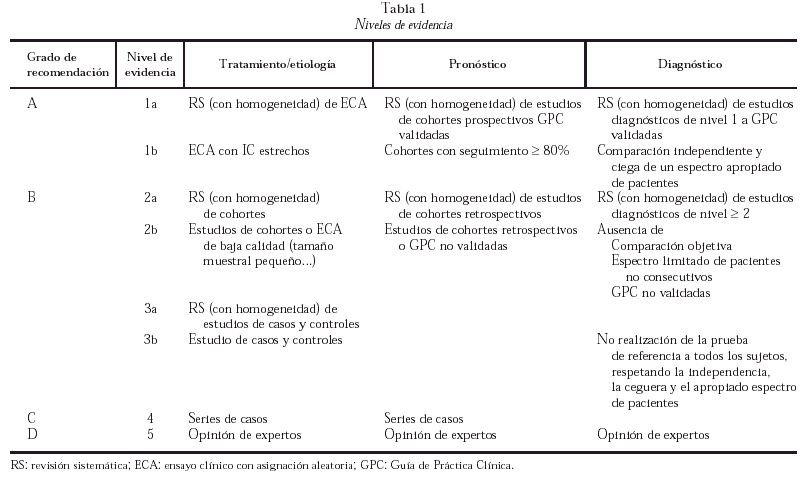
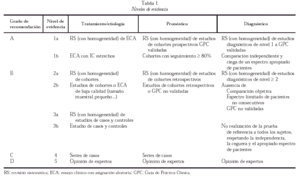
Las evidencias se han clasificado, de acuerdo a las recomendaciones del Centro de Medicina Basada en la Evidencia de Oxford, en nivel 1 a 5, otorgando sub-niveles a y b a los tres primeros (tabla 1). Las recomendaciones se han clasificado en cuatro grados de evidencia:
Grado A: basado en revisiones sistemáticas de ensayos clínicos aleatorizados (ECA) o al menos, un ECA bien diseñado. Estudios de cohortes prospectivos para factores pronósticos.
Grado B: estudios sistemáticos de cohortes, de casos y controles, ECA de baja calidad.
Grado C: series de casos, estudios de cohortes de baja calidad.
Grado D: opinión de expertos sin criterios de valoración explícitos.
La estrategia se detalla explícitamente en la versión a texto completo de la presente Guía.
DEFINICION DE OSTEOPOROSIS
Por consenso, la osteoporosis se define como una enfermedad esquelética caracterizada por una resistencia ósea disminuida que predispone a una persona a un riesgo aumentado de fractura. La resistencia ósea refleja fundamentalmente la integración de densidad y calidad óseas. La densidad ósea viene expresada como gramos de mineral por área o volumen, y en un individuo determinado viene determinada por el pico de masa ósea y por la cantidad de pérdida ósea. La calidad ósea se refiere a la arquitectura, recambio, cúmulo de lesiones (es decir, microfracturas) y mineralización. La fractura ocurre cuando una fuerza inductora de rotura, como un traumatismo, se aplica sobre un hueso osteoporótico. Por lo tanto, la osteoporosis es un factor significativo de riesgo de fractura, si bien se debe distinguir entre factores de riesgo que afectan al metabolismo óseo y factores de riesgo de fractura. Se ha establecido una definición diagnóstica basada en la densitometría que se detalla más adelante.
FACTORES DE RIESGO
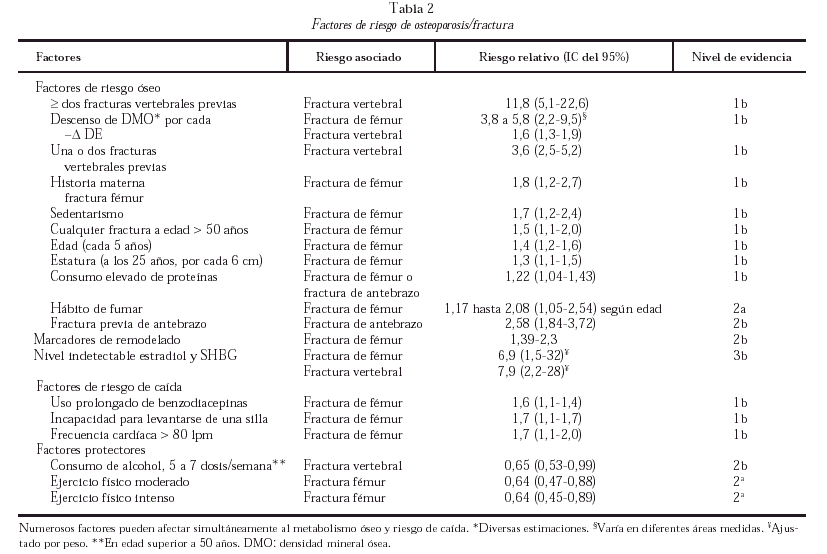
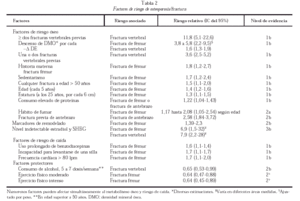
Se ha demostrado que numerosos factores se asocian a riesgo elevado de fractura vertebral o de fémur (tabla 2). En general son extraóseos (relacionados con riesgo de caídas o traumatismo) y óseos (relacionados con la resistencia ósea). Hay evidencia consistente de la asociación entre descenso de la densidad mineral ósea (DMO) y riesgo de fractura. Se están estudiando activamente factores genéticos asociados a riesgo de fractura y hay varios polimorfismos genéticos asociados de forma moderada a valores disminuidos de DMO.
El sobrepeso es un factor protector de padecer osteoporosis y del riesgo de fracturas.
También se asocia con osteoporosis y riesgo de fractura un gran número de enfermedades. Entre éstas, bien por su alta prevalencia, o por el alto riesgo de osteoporosis asociada, tienen especial relevancia en la mujer postmenopáusica el hiperparatiroidismo y el tratamiento con corticoides.
EVALUACION DIAGNOSTICA
Todo caso de osteoporosis debe ser sometido a anamnesis, exploración física y analítica básica que excluya otra patología subyacente. El diagnóstico de osteoporosis se establece con la realización de una densitometría ósea. El método utilizado más ampliamente es la absorciometría radiológica de doble energía (DXA), validado como predictor de riesgo de fractura. Por convención, la DXA se acepta como patrón oro. Las zonas de medición más habituales son la columna lumbar y el cuello de fémur. La Organización Mundial de la Salud (OMS) ha establecido una definición densitométrica de osteoporosis, considerando su existencia cuando el paciente presenta un valor de DMO en índice T, en columna lumbar o en cuello de fémur, inferior a 2,5 desviaciones estándar. Asimismo ha establecido otras categorías de diagnóstico que se exponen en la tabla 3.
El valor de DMO lumbar por DXA (Hologic), en mujeres españolas, que representa el pico de masa ósea (referencia para el índice T) es 1,040 ± 0,104 g/cm2 (media ± DE). Este valor de DMO en cuello femoral por DXA (Hologic), es 0,840 ± 0,109 g/cm2. Los valores equivalentes en equipos de otros fabricantes se pueden
calcular mediante fórmulas de conversión.
Otras técnicas de medición de la densidad ósea, como ultrasonidos, tomografía axial computarizada o radiología digitalizada han obtenido valores predictivos similares de riesgo de fractura, si bien su uso está más limitado o por razones técnicas, por peor reproducibilidad o por menor experiencia clínica. En general la predicción de riesgo de fractura de determinada región esquelética mejora al medirla directamente. Por cada desviación estándar de descenso de la densidad ósea, por diferentes técnicas, el riesgo relativo asociado de fractura oscila entre 1,3 y 3,9 (nivel de evidencia 2b). Los marcadores bioquímicos de remodelado óseo, especialmente los de resorción, en pacientes ancianos, se asocian a incremento de riesgo relativo de fractura, para diversos marcadores, de entre 1,39 y 2,3 (nivel de evidencia 2b).
Dado el coeficiente de variabilidad de las exploraciones DXA en columna lumbar y cuello de fémur, parece razonable realizar las mediciones cada dos años. En la tabla 4 se resumen las indicaciones de este Grupo de Trabajo para la realización de una densitometría ósea en mujeres postmenopáusicas.
CRIBADO DE OSTEOPOROSIS
La estrategia más recomendable es la búsqueda selectiva de casos. Con ella, se pueden detectar casos en los que el médico puede aplicar los diferentes algoritmos de intervención. La confirmación diagnóstica se establecerá por la presencia de fracturas o, en su ausencia, por técnicas densitométricas. No se recomienda el cribado poblacional por no estar demostrado su balance coste-efectividad positivo.
INTERVENCIONES NO FARMACOLOGICAS
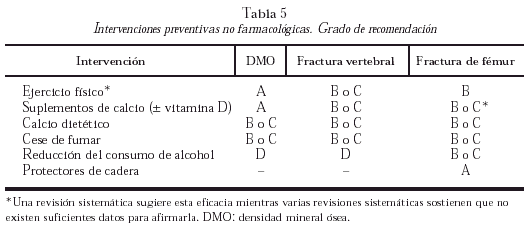
Como medidas poblacionales, son aplicables los consejos generales de promoción de la salud. Tanto en población general como en sujetos de riesgo, mujeres postmenopáusicas en este caso, es aconsejable un aumento de la actividad física, el cese de hábito tabáquico y el aumento en la ingestión de calcio, a pesar de que no se ha evaluado su efecto sobre la reducción de fracturas. Las diferentes intervenciones, y su grado de recomendación, se resumen en la tabla 5.
Los programas de intervención combinada sobre varios factores de riesgo de caída en ancianos han demostrado eficacia, por lo que disminuyen el factor aleatorio fundamental de fractura (grado de recomendación A).
INTERVENCIONES FARMACOLOGICAS
La mujeres cercanas a la menopausia, con factores de riesgo y valores densitométricos en el intervalo definido anteriormente como osteopenia, en ausencia de fractura, son susceptibles de recibir un tratamiento preventivo.
Para la prevención de la pérdida de masa ósea, los estrógenos, el etidronato, el alendronato y el raloxifeno han demostrado ser eficaces (grado de recomendación A). Para la prevención de fracturas vertebrales en mujeres con osteopenia hay datos de eficacia para raloxifeno (grado A) y estrógenos (grado B-C). Para prevención de fracturas de fémur tan sólo hay datos para estrógenos (grado B-C). Sin embargo, se trata de mujeres sin enfermedad y con riesgo bajo de fractura. Dados los potenciales efectos secundarios y el elevado número necesario de pacientes a tratar para evitar un evento, su utilización se debe restringir a casos muy concretos, excepto que el tratamiento se justifique por otros factores diferentes al de la prevención de osteoporosis.
Los fármacos para el tratamiento de la osteoporosis han demostrado eficacia tan sólo en ensayos clínicos con tratamientos prolongados, en general de al menos dos a tres años. El médico y la paciente deben ser conscientes de la dudosa o nula utilidad de pautas inferiores a dicho período. Se debe asegurar la adherencia al tratamiento mediante el establecimiento de una buena relación médico-paciente y una explicación detallada del tratamiento a seguir.
La eficacia de los diferentes fármacos no es comparable entre sí. Dado que no existen ensayos aleatorizados que comparen frente a frente diversas alternativas, datos provenientes de ensayos distintos no son comparables por las diferencias de población estudiada, diseño, intervención y mediciones. Por tanto no se pueden jerarquizar los fármacos en función de la magnitud de su efecto y las decisiones sobre el uso de uno de ellos se deben basar en los datos de eficacia, el objetivo terapéutico deseado, la tolerabilidad, los efectos asociados positivos o negativos y la opinión informada de la paciente.
CALCIO Y VITAMINA D
El calcio es un requerimiento nutricional básico del hueso. En mujeres postmenopáusicas se recomienda la ingesta de al menos 1.500 mg/día para conseguir un balance metabólico equilibrado. Administrado como suplementos de la dieta ordinaria de la paciente hasta alcanzar esta cifra, es una medida recomendable y la mayoría de ensayos clínicos con asignación aleatoria (ECA) sobre los diferentes fármacos administran conjuntamente al menos 500 mg de calcio al día. Es aconsejable, por ser más fisiológico, dividir la administración de calcio en dos tomas.
En mujeres postmenopáusicas con ingesta deficiente, los suplementos farmacológicos disminuyen la pérdida ósea y el riesgo de fractura vertebral (nivel de evidencia 1b). Dosis de 1.000 mg al día muestran un descenso muy pequeño aunque significativo del riesgo de fractura de fémur (nivel de evidencia 2a).
El calcitrol y el alfacalcidiol disminuyen la pérdida ósea y la incidencia de fractura vertebral (nivel de evidencia 2a) aunque no se ha demostrado su eficacia en la postmenopausia reciente (nivel de evidencia 1b). La vitamina D asociada a calcio disminuye la incidencia de fractura de fémur y no-vertebral en población anciana aislada con niveles insuficientes de vitamina D (nivel de evidencia 2a).
TERAPIA HORMONAL SUSTITUTIVA
La terapia hormonal sustitutiva (THS) reemplaza la deprivación hormonal por el cese de actividad ovárica.
Hay datos de eficacia sobre DMO provenientes de ECA, si bien los ensayos dirigidos a reducir el riesgo de fractura, y específicamente la fractura vertebral, son escasos y la mayoría de la información sobre este aspecto procede de estudios observacionales o de un ECA con limitaciones metodológicas (nivel de evidencia 2a y 2b respectivamente). Cuando se inicia el tratamiento antes de los 60 años de edad tiene eficacia en la reducción de fracturas no vertebrales (nivel de evidencia 1a).
El tratamiento induce un ligero pero significativo incremento del riesgo de cáncer de mama, más patente en tratamientos prolongados (nivel de evidencia 2a) y de enfermedad tromboembólica (nivel de evidencia 1b).
RALOXIFENO
El raloxifeno es un modulador selectivo del receptor estrogénico (SERM).
Reduce la pérdida ósea lumbar y femoral así como el riesgo de fractura vertebral (nivel de evidencia 1). No ha demostrado eficacia en la prevención de fracturas no vertebrales.
El raloxifeno incrementa el riesgo de tromboembolismo venoso de forma similar a los estrógenos. Disminuye el riesgo de cáncer de mama con receptor estrogénico positivo en población de bajo riesgo, como son mujeres osteoporóticas, y tienen efectos positivos sobre algunos factores de riesgo cardiovascular (nivel de evidencia 1b para todos los datos).
Análisis de subgrupos no predeterminados (post hoc) han mostrado eficacia natifracturaria precoz (nivel de evidencia 2b).
TIBOLONA
La tibolona actúa de forma similar a los estrógenos de administración oral sobre el tejido óseo.
Es eficaz para prevenir la pérdida ósea (nivel de evidencia 2b). No existen datos de eficacia sobre fracturas.
Es eficaz en el control de los sofocos (nivel de evidencia 1b) por lo que puede ser una alternativa para mujeres en que las pérdidas menstruales cíclicas con THS son mal toleradas.
BISFOSFONATOS
Etidronato
El etidronato es un biofosfonato no aminado que se administra por vía oral, en ciclos quincenales cada tres meses.
Tiene efecto positivo sobre la DMO lumbar y de fémur. Disminuye el riesgo de fractura vertebral sin mostrar eficacia sobre fractura no vertebral (nivel de evidencia 1a).
Alendronato
El alendronato en un aminobisfosfonato que se administra por vía oral.
Tiene efecto positivo sobre la DMO lumbar y femoral. Disminuye el riesgo de fractura vertebral, no vertebral y de fémur (nivel de evidencia 1a). La administración de una dosis única semanal tiene eficacia análoga a la dosis diaria sobre la DMO (nivel de evidencia 1b) y puede mejorar la adherencia al tratamiento.
Los efectos secundarios más frecuentes son gastrointestinales y se deben seguir estrictamente las normas de administración para evitar lesiones esofágicas potencialmente importantes. Su baja absorción intestinal hace relevante su administración en ayunas.
Análisis de subgrupos no predeterminados (post hoc) han mostrado eficacia antifracturaria precoz (nivel de evidencia 2b).
Risedronato
El risedronato es un aminobisfosfonato que se administra por vía oral.
Tiene efecto positivo sobre la DMO lumbar y femoral. Disminuye el riesgo de fractura vertebral y no vertebral (nivel de evidencia 1b). Ha demostrado reducción de riesgo de fractura de fémur en un ECA diseñado ad hoc para dicho resultado de interés (nivel de evidencia 1b).
Estudios endoscópicos demuestran una baja toxicidad sobre la mucosa digestiva (nivel de evidencia 2b). Su baja absorción intestinal hace relevante su administración separada de la ingesta, a varias horas del día.
Análisis de subgrupos no predeterminados (post hoc) han mostrado eficacia antifracturaria precoz (nivel de evidencia 2b).
Otros bisfosfonatos
Otros bisfosfonatos están en fase de desarrollo preclínico.
Existen estudios, de validez variable, que demuestran un efecto positivo sobre DMO de ibandronato, clodronato, pamidronato y zoledronato.
No hay datos publicados sobre reducción de fracturas.
El tiludronato no demostró eficacia sobre DMO ni sobre fracturas en un ECA (nivel de evidencia 1b).
OTROS AGENTES INHIBIDORES DE LA RESORCIÓN
Calcitonina
La calcitonina es una hormona que inhibe reversiblemente la actividad osteoclástica.
Tiene un débil efecto positivo sobre la DMO lumbar y femoral (nivel de evidencia 1b). Administrada por vía transnasal es eficaz en la reducción de fracturas vertebrales (nivel de evidencia 2b), en un efecto no dosis-dependiente. Los datos sobre la reducción de fracturas no vertebrales proceden de estudios no aleatorizados (nivel de evidencia 3b).
La calcitonina tiene efecto analgésico moderado demostrado en ECA de calidad variable (nivel de evidencia 3).
Flavonoides
Los flavonoides son agentes antirresortivos con efecto positivo controvertido sobre la masa ósea. No hay datos de eficacia sobre fracturas.
AGENTES PROMOTORES DE LA FORMACION
Parathormona
La hormona paratiroidea administrada intermitentemente tiene efectos positivos sobre la DMO.
El fragmento 1-34 de la hormona (recombinante) ha demostrado eficacia sobre la DMO y disminución de la incidencia de fractura vertebral y no vertebral administrada en inyección subcutánea diaria.
La hipercalcemia transitoria leve es el efecto adverso más significativo (nivel de evidencia para todos los datos 1b).
Flúor
Las sales del flúor tienen un efecto promotor de la formación ósea trabecular.
Tienen eficacia en inducir incremento de los valores de DMO. Sin embargo no reducen el riesgo de fractura vertebral y aumentan, a los cuatro años de uso, el de fractura no vertebral a dosis altas. Las dosis bajas (20 mg) pueden reducir la fractura vertebral tras cuatro años de tratamiento.
Inducen efectos secundarios gastrointestinales fundamentalmente.
La administración asociada de vitamina D anula el beneficio del flúor. Cuando se usa asociado a THS mejora su efecto sobre fractura vertebral (nivel de evidencia 1a para todos los datos).
Esteroides anabolizantes
Los esteroides anabolizantes tienen eficacia sobre la DMO (nivel de evidencia 2b). No hay datos de eficacia sobre fracturas y su uso está limitado por sus efectos secundarios.
COMBINACIONES DE FARMACOS
Diversos ECA han analizado la eficacia de combinaciones de fármacos sobre la DMO, demostrando, en general, un efecto aditivo. No hay datos que demuestren que las combinaciones mejoran la eficacia antifracturaria de los fármacos individuales. La posibilidad de sumar efectos secundarios así como el aumento de coste desaconsejan el uso de las combinaciones de fármacos.
Una excepción general a esta regla, ya mencionada, sería la adición de calcio y, en determinadas poblaciones de riesgo, vitamina D, a los diversos fármacos.
CONSISTENCIA DE LAS RECOMENDACIONES
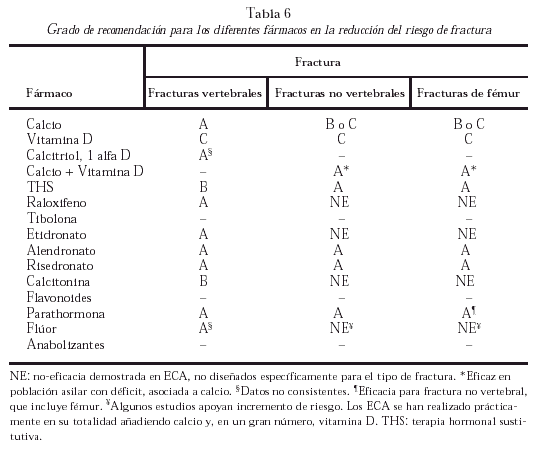
En función de los niveles de evidencia, los diferentes fármacos presentan los grados de recomendación, para cada una de las fracturas especificadas, que se resumen en la tabla 6. Todos ellos tienen eficacia sobre la DMO, con un grado de recomendación A. Se debe resaltar que los datos de falta de eficacia para determinada(s) fractura(s) se derivan de ECA diseñados para objetivos primarios distintos, generalmente fractura vertebral.
CONSIDERACIONES SOBRE EL COSTE-EFECTIVIDAD DEL TRATAMIENTO
La relación entre el coste del tratamiento y sus beneficios en salud debe considerarse siempre a la hora de hacer recomendaciones. Esto es especialmente importante en tratamientos preventivos o crónicos donde la evaluación del coste del tratamiento, el coste de los efectos adversos o de la no-adherencia, tienen un impacto claro en los resultados esperados en condiciones de práctica clínica habitual a la hora de evitar eventos futuros. Se han realizado diversos análisis coste-efectividad basados en modelos de proyección futura de los costes incurridos en pacientes con fractura osteoporótica, que demuestran que el tratamiento es coste-efectivo tanto en la fractura femoral como vertebral. Sin embargo, los resultados de estos estudios deben por el momento interpretarse con cautela debido a las suposiciones que se incluyen en los mismos. El único estudio basado en los métodos de metaanálisis usados por la Colaboración Cochrane realizado en Canadá indica que el alendronato y la calcitonina tienen una relación coste-efectividad similar y que son más coste-efectivos que etidronato en la prevención secundaria de fractura vertebral, femoral y de antebrazo, si bien su validez viene fuertemente limitada por la diferente eficacia demostrada por dichos fármacos. No existen estudios coste-efectividad comparando con otros tratamientos ni en otros contextos nacionales.
ALGORITMOS DE DECISION CLINICA
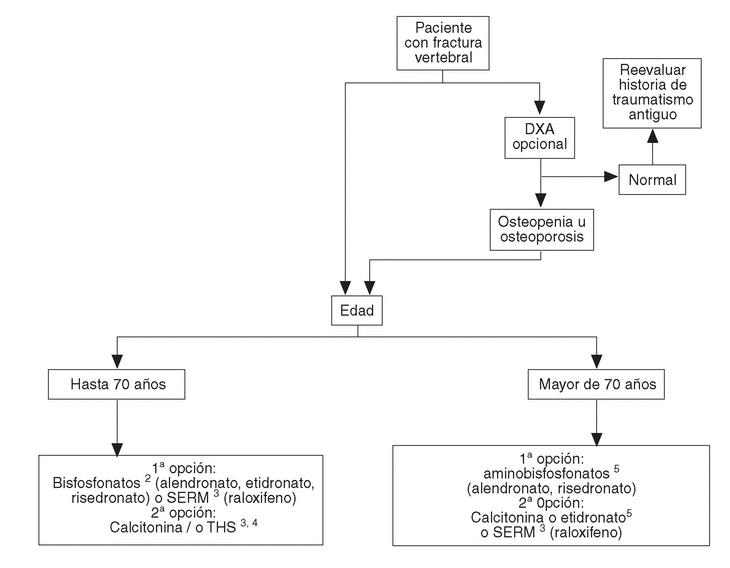
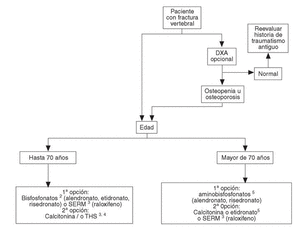
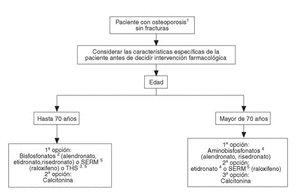
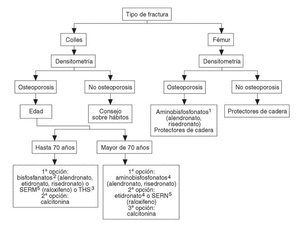
Se han desarrollado los siguientes algoritmos sobre problemas clínicos en los que se realizan recomendaciones explícitas: a) paciente con fractura vertebral (en la figura 1 se desarrolla el algoritmo de paciente con fractura vertebral); b) paciente con osteoporosis, sin fracturas, y c) paciente con fractura no vertebral.
Fig. 1. Paciente con fractura vertebral1.1Se entiende fractura que ha acontecido de forma espontánea o tras un traumatismo mínimo en un paciente en que se ha descartado de forma razonable la existencia de enfermedades distintas de la osteoporosis. 2Si se valora un riesgo muy elevado de fractura de fémur, los aminobisfosfonatos pueden ser de primera elección. Valorar historia de enfermedad péptica gástrica o esofágica.3Contraindicados en riesgo de enfermedad tromboembólica venosa.4En postmenopáusicas recientes y/o con síntomas climatéricos, THS puede ser de primera elección. Contraindicados en historia o riesgo de cáncer de mama.5Valorar historia de enfermedad péptica gástrica o esofágica.DXA: absorciometría radiológica de doble energía. SERM: modulador selectivo del receptor estrogénico; THS: terapia hormonal sustitutiva.
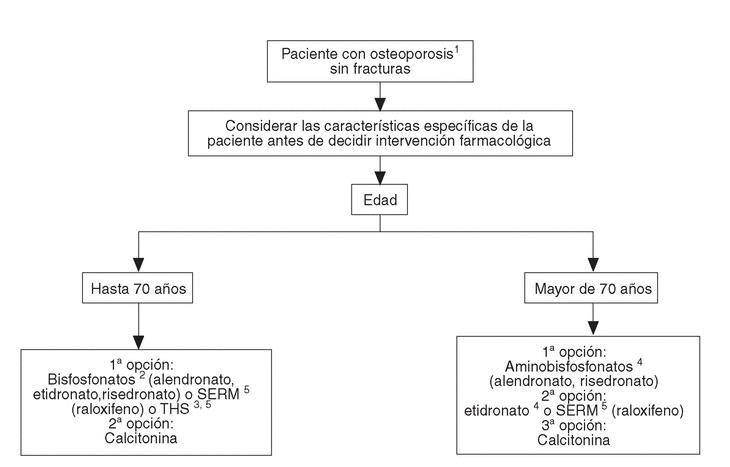
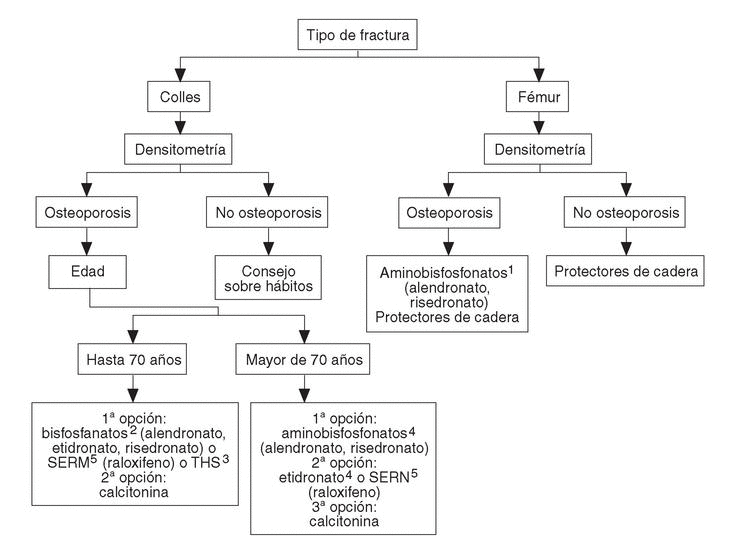
A las pacientes que consultan sobre riesgo de osteoporosis/agrupación de factores de riesgo se les debe realizar una densitometría y, en caso de tener osteoporosis, aplicar la figura 2, en la que se desarrolla el algoritmo de paciente con osteoporosis sin fracturas. A las pacientes ancianas frágiles, sin fracturas, se les debe aplicar un programa combinado de prevención de caídas y en caso de diagnosticar osteoporosis por densitometría, las traslada a la figura 3, en la que se puede observar el algoritmo de paciente con fractura no vertebral.
Fig. 2. Paciente con osteoporosis sin fracturas.* *Estos pacientes tienen un riesgo muy bajo de fractura, lo que comporta un número elevado de pacientes a tratar para evitar una fractura. Se deben, por tanto, considerar cuidadosamente los costes, aceptabilidad y potenciales efectos secundarios frente a las reducidas disminuciones de riesgo absoluto que se obtienen. 1Se entiende diagnosticada por absorciometría radiológica de doble energía (DXA). A partir de los 65 años es preferible la medición en cadera. 2Si se valora un riesgo muy elevado de fractura de fémur, los aminobisfosfonatos pueden ser de primera elección. 3En postmenopáusicas recientes y/o con síntomas climatéricos, THS puede ser de primera elección. Contraindicada en historia o riesgo de cáncer de mama.4Valorar historia de enfermedad péptica gástrica o esofágica.5Contraindicados en riesgo de enfermedad tromboembólica venosa.SERM: modulador selectivo del receptor estrogénico; THS: terapia hormonal sustitutiva.
Fig. 3. Paciente con fractura no vertebral (Colles o fémur).En ancianas se debe valorar si sus condiciones individuales permiten un tratamiento farmacológico.1Valorar historia de enfermedad péptica gástrica o esofágica. Contraindicados en pacientes encamados obligados a permanecer en decúbito.2,3,4,5Ver figura 2.
En todos los casos debe asegurarse una ingesta adecuada de calcio (incluyendo suplementos si fuera necesario), y administrarse vitamina D en las mujeres con riesgo de deficiencia (ancianas, baja exposición solar, dietas inadecuadas).
En los algoritmos desarrollados los tratamientos se ordenan en función de ser primera o segunda opción (en una ocasión, tercera). En los fármacos se hace mención del grupo farmacológico y del principio o principios activos, citándolos por orden alfabético, sin que ello indique orden de preferencia.
CONTRAINDICACIONES DE LOS PRINCIPALES FARMACOS APROBADOS
Las contraindicaciones establecidas por las autoridades reguladoras que se exponen en las fichas técnicas de los diferentes fármacos recomendados en esta guía se resumen en el anexo.
GLOSARIO TERMINOLOGICO Y DE SIGLAS
Best Evidence: publicación secundaria que recoge resúmenes estructurados con comentarios de publicaciones primarias seleccionadas para cumplir criterios de rigor metodológico.
CMO: contenido mineral óseo (BMC, bone mineral content).
DXA: absorciometría radiológica de doble energía. Sinónimos: DXA, densitometría ósea radiológica.
DMO: densidad mineral ósea (BMD, bone mineral density.
Densitometría ósea: cualquier método de medición del contenido mineral del hueso.
ECA: ensayo clínico con asignación aleatoria.
Fractura de fémur: fractura no patológica, cervical o trocantérea, que asienta en el tercio proximal del fémur. Sinónimo: fractura de cadera.
Fractura osteoporótica: la producida por traumatismo mínimo en hueso desmineralizado no patológico (neoplasia, lesión localizada). Se acepta en cualquier hueso, excepto macizo facial y cráneo.
Fractura vertebral: hundimiento total o parcial, no patológico, del cuerpo vertebral. Sinónimo: deformidad vertebral.
GPC: Guía de Práctica Clínica.
Índice T (t-score): valor densitométrico que representa el número de desviaciones estándar que se aparta el sujeto respecto al promedio de los valores de un grupo poblacional de adultos jóvenes del mismo sexo.
Librería Cochrane: recurso electrónico formado por la Colaboración Cochrane, internacional, sin ánimo de lucro y que realiza revisiones sistemáticas, elabora productos y mantiene un registro de ensayos clínicos.
MBE: medicina basada en la evidencia (EBM, Evidence-Based Medicine). Sinónimo: medicina basada en pruebas.
MEDLINE: Base de datos bibliográficos de la National Library of Medicine.
NNT: número necesario a tratar o número necesario de pacientes a tratar.
OMS: Organización Mundial de la Salud.
RR: riesgo relativo.
SERM: regulador selectivo del receptor estrogénico (Selective Estrogen Receptor Modulator).
THS: tratamiento hormonal sustitutivo. Se restringe al uso de hormonas ováricas.
GRUPO DE TRABAJO DE LA SEIOMM
Las recomendaciones recogidas en esta GPC reflejan la opinión colectiva del Grupo de Trabajo, basada en la evidencia científica recogida, analizada y tabulada por el grupo ad hoc. El nivel de evidencia que sustenta cada recomendación está explícitamente recogido en la versión amplia de la presente Guía.
Grupo de expertos: Dr. J. Calaf (Ginecólogo), Dr. J. Cannata (Nefrólogo), Dr. B. Díaz (Internista), Dr. M. Díaz Curiel (Internista), Dr. A. Díez Pérez (Internista), Dr. J. González Macías (Internista), Dra. N. Guañabens (Reumatóloga), Dr. F. Hawkins (Endocrinólogo), Dr. A. Morales (Reumatólogo), Dr. M. Muñoz Torres (Endocrinólogo), Dr. X. Nogués (Internista), Dr. J.M. Nolla (Reumatólogo), Dra. P. Orozco (Médico de Familia), Dr. R. Pérez Cano (Internista), Dr. J. del Pino (internista), Dr. J.M. Quesada (Endocrinólogo) y Dr. M. Sosa (Internista).
Experto en economía de la salud: Dr. X. Badia Llach.
Grupo responsable de la búsqueda y lectura crítica bibliográfica: Dr. M. Ángel de la Cal: Coordinador. Dra. A. Monegal y Dr. G. Vallecillo.
AGRADECIMIENTOS
Las reuniones y revisión sistemática de la literatura han sido financiadas por una ayuda externa, independiente a la elaboración de la Guía, del laboratorio Merck Sharp & Dohme de España.
ANEXO
Estrógenos orales
Embarazo. Neoplasia mamaria o estrogenodependiente, metrorragias no diagnosticadas, hepatopatías graves, enfermedad tromboembólica recurrente. Contraindicaciones relativas: enfermedad fibroquística mamaria, miomas uterinos, endometriosis e historia familiar de cáncer mamario.
Estrógenos transdérmicos
Carcinoma de mama o endometrio; endometriosis; sangrado vaginal de origen desconocido; lesión hepática grave; tromboflebitis activa o procesos tromboembólicos; hipersensibilidad a los estrógenos o a los componentes del preparado farmacológico. Embarazo y lactancia.
Progestágenos (medroxiprogesterona)
Tromboflebitis y fenómenos tromboembólicos, hepatopatías graves, metrorragias y menorragias no diagnosticadas, aborto retenido y en casos de sensibilidad conocida a acetato de medroxiprogesterona.
Raloxifeno
No se debe administrar a mujeres que pudieran quedar embarazadas o que no hubieran presentdo la menopausia. Antecedentes pasados o actuales de episodios tromboembólicos venosos, incluyendo trombosis venosa profunda, embolia pulmonar y trombosis venosa de la retina. Hipersensibilidad al raloxifeno u otros ingredientes del comprimido. Alteración hepática, incluyendo colestasis. Alteración renal severa. Sangrado uterino inexplicado. No se debe utilizar raloxifeno en pacientes con cáncer de endometrio o de mama porque no se ha comprobado su seguridad en estos grupos de pacientes.
Tibolona
Embarazo o lactancia. Tumores hormonodependientes conocidos o sospechados. Trastornos cardiovasculares o cerebrovasculares, como tromboflebitis, procesos tromboembólicos o historial previo de tales trastornos. Sangrado vaginal de etiología desconocida. Trastornos hepáticos graves.
Etidronato
Intolerancia conocida a etidronato. Osteomalacia. Insuficiencia renal grave.
Alendronato
Anormalidades esofágicas que retrasan el vaciamiento esofágico, como las estenosis o la acalasia. Imposibilidad de permanecer en posición sentada erguida o en bipedestación durante al menos 30 minutos. Hipersensibilidad a cualquier componente del producto. Hipocalcemia. En pacientes con aclaramiento de creatinina < 35 ml/min.
Risedronato
Hipersensibilidad conocida a risedronato sódico o a cualquiera de sus excipientes. Hipocalcemia. Embarazo y lactancia. Insuficiencia renal grave (aclaramiento de creatinina < 30 ml/min).
Calcio + vitamina D
Hipersensibilidad a algunos de los componentes. Hipercalcemia. Hipercalciuria. Insuficiencia renal grave.
Calcitonina
Hipersensibilidad a la calcitonina o a cualquiera de los componentes del preparado. Embarazo y lactancia. Congestión/rinitis en administración nasal.
BIBLIOGRAFIA RECOMENDADA
AACE clinical practice Guidelines for the prevention and treatment of postmenopausal osteoporsis. J Fla Med Assoc 1996; 83: 552-66.
ANCC. Australian National Consensus Conference 1996. The prevention and management of osteoporosis. Consensus Statement. Med J Aust 1997;167: S1-S15.
Ankjaer-Jensen A, Johnell O. Prevention of osteoporosis: cost-effectiveness of different pharmaceutical treatments. Osteoporos Int 1996; 6: 265-75.
Ball C, Sackett D, Phillips B, Haynes B, Straus S. Levels of Evidence and Grades of Recommendations. NHS R&D Centre for Evidence-Based Medicine. 1999.
Bauer DC, Glüer CC, Cauley JA, Vogt TM, Ensrud KE, Genant HK, Black DM, for the study of osteoporotic fractures research group. Broadband ultrasound attenuation predics fractures strongly. Arch Intern Med 1997; 157: 629-34
Beardsworth SA, Kearney CE, Purdie DW. Prevention of postmenopausal bone loss at lumbar spine and upper femur with tibolone: a two-year randomised controlled trial. Br J Obstetrics Gynaecol 1999; 106: 678-83.
Berard A, Bravo G, Gautier P. Meta-analysis of the effect of physical activity on the prevention of bone loss in postmenopausal women. Osteoporosis Int 1997; 7:331-7.
Best L, Milne R. Bisphosphonates (alendronate and etidronate) in the management of osteoporosis. Southampton: Wessex Institute for Health Research and Development. DEC Report, 1998. N.o 79.
Bjarnason NH. Tibolone prevention of bone loss in late postmenopausal women. J Clin Endocrinol Metab. 1996; 81: 2419-22.
Bone HG, Downs RWJr, Tucci JR, Harris ST, Weinstein RS, Licata AA, et al. Dose-response relationships for alendronate treatment in osteoporotic elderly women. J Clin Endocrinol Metab 1997; 82: 265-74.
Cadarette SM, Jaglal SB, Kreiger N, McIsaac WJ, Darlington GA, Tu JV. Development and validation of the osteoporosis risk assessment instrument to facilitate selection of women for bone densitometry. CMAJ 2000; 16: 1289-94.
Cardona JM, Pastor E. Calcitonin versus etidronate for the treatment of postmenopausal osteoporosis: a meta-analysis of published clinical trials. Osteoporosis Int 1997; 7: 165-74.
Catalan Calcitonin Working Group. Use of calcitonin in idiopathic osteoporosis. Barcelona: Catalan Agency for Health Technology Assessment. Health Council of the Netherlands Gezondheidsraad (GR). IN95002. 1995
Chrischilles EA, Dasbach EJ, Rubenstein LM, Cook JR, Tabor HK, Black DM. The effect of alendronate on fracture-related healthcare utilization and costs: the fracture intervention trial. Osteoporos Int 2001;12:654-60.
Clemmesen B, Ravn P, Zegels B, Taquet AN, Christiansen C, Reginster JY. A 2-year phase II study with 1-year of follow-up of risedronate (NE-58095) in postmenopausal osteoporosis. Osteoporosis Int 1997; 7: 488-95.
Compston JE, Papapoulos SE, Blanchard F. Report on osteoporosis in the European Community: current status and recommendations for the future of the Working Party from European Union Member States. Osteoporosis Int 1998; 8: 531-4.
Cornuz J. Smoking, smoking cesation and risk of hip fracture in women; Am J Med; 1999; 106; 311-4.
Cosman F, Nieves J, Woelfert L, Shen V, Lindsay R. Alendronate does not block the anabolic effect of PTH in postmenopausal osteoporotic women. J Bone Min Res 1998; 13: 1051-5.
Cosman F, Lindsay R. Is parathyroid hormone a therapeutic option for osteoporosis? A review of the clinical evidence. Calcif Tissue Int. 1998; 62:475-80.
Coyle D, Cranney A, Lee KM, Welch V, Tugwell P. Cost-effectiveness of nasal calcitonin in postmenopausal women: use of Cochrane Collaboration methods for meta-analysis within economic evaluation. Pharmacoeconomics 2001; 19: 565-5.
Cranney A, Coyle D, Welch V, Lee KM, Tugwell P. A review of economic evaluations in osteoporosis. Arthritis Care Res 1999; 12: 425-34.
Cummings SR, Nevitt MC, Browner WS, Stone K, Fox KM, Ensurd KE, et al. Risk factors for hip fracture in white women. Study of Osteoporotic Fractures Research Group. N Engl J Med 1995; 332: 767-73.
Cumming DS, Nevitt MC. Calcium for prevention of osteoporotic fractures in postmenopausal women. J Bone Min Res 1997; 12: 1321-9.
Cummings SR, Browner WS, Bauer D, Stone K, Ensrud K, Jamal S, et al. Endogenous hormones and the risk of hip and vertebral fractures among older women. Study of Osteoporotic Fractures Research Group. N Engl J Med 1997; 339: 733-8.
Cummings SR, Black DM, Thomson DE, Applegate WB, Barrett-Connor E, Muslinen TA. Effect of alendronate on risk fracture in women with low bone density but without vertebral fractures: results from the Fracture Intervention Trial. JAMA 1998; 280: 2077-82.
Dargent-Molina P, Hans D, Schott AM et al. Separate and combined predictive value of measurements of bone fragility and fall risk. Osteoporos Int 1996; 6: 86.
Delmas PD. Effects of raloxifene on bone mineral density, serum cholesterol concentrations and uterine endometrium in post menopausal women. N Engl J Med 1997; 337: 1641-7.
Díaz MN; The influence of family history of hip fracture on the risk of vertebral deformity in men and women. Bone 1997; 20: 145-9.
Díaz Curiel M, Carrasco JL, Honorato J, Pérez Cano R, Rapado A, Ruiz Martínez I. Study of bone mineral density in lumbar spine and femoral neck in a spanish population. Osteoporosis Int 1997; 7: 59-64.
Eastell R. Treatment of postmenopausal Osteoporosis: N Engl J Med 1998; 338: 736-46.
Eddy DM, Johnstone Jr CC, Cummings, et al. Osteoporosis: a review of the evidence for prevention and diagnosis, and treatment and cost-effectiveness analysis. Osteoporos Int 1998; 8 (S4): S1-S80.
Eiken P, Kolthoff N, Nielsen SP. Effect of 10 years' hormone replacement therapy on bone mineral content in postmenopausal women. Bone 1996;19 (S1):191S-3.
Ellerington MC, Hillard TC, Whitcroft SI, Marsh MS, Lees B, Banks LM, et al. Intranasal salmon calcitonin for the prevention and treatment of postmenopausal osteoporosis. Calcif Tissue Int 1996; 59: 6-11.
Espallargues M, Estrada MD, Sola M, Sampietro-Colom L, del Río L, Granados A. Guidelines for the indication of bone densitometry in the assessment of fracture risk. Barcelona: Catalan Agency for Health Technology Assessment (CAHTA). Swedish Council on Technology Assessment in Health Care (SBU). BR99005.1999. 19
Espallargues M, Sampietro-Colom L, Estrada MD, Sola M, del Rio L, Setoain J, Granados A. Identifying bone-mass-related risk factors for fracture to guide bone densitometry measurements: a systematic review of the literature. Osteoporos Int 2001;12:811-22.
Ettinger B, Black DM, Mitlak BH, et al. For the Multiple Outcomes of Raloxifene Evaluation (MORE) Investigators. Reduction of vertebral fracture risk in postmenopausal women with osteoporosis treated with raloxifene. Results from a 3-year randomized clinical trial. JAMA 1999; 282: 637-45.
Feskanich D. Protein consumption and bone fractures in women. Am J Epidemiol 1996; 143: 472-9.
Finkelstein JS, Klibanski A, Arnold AL, Toth TL, Hornstein MD, Neer RM. Prevention of estrogen deficiency-related bone loss with human parathyroid hormone (1-34): a randomized controlled trial. JAMA. 1998; 280: 1067-73.
Friedman Asch E, Smith, LG. Osteoporosis. In Diagnostic Strategies for Common Medical Problems 1999: 438-49. Best Evidence [CD-ROM 2000]. Philadelphia: American College of Physicians. American Society of Internal Medicine.
Fujita T. Clinical Guidelines for the treatment of osteoporosis in Japan. Calcif Tissue Intern 1996; 59 (S1): S34-7.
Fujita T, Inoue T, Morii H, Morita R, Norimatsu H, Orimo H, et al. Effect of an intermittent weekly dose of human parathyroid hormone (1-34) on osteoporosis: a randomized double-masked prospective study using three dose levels. Osteoporosis Int 1999; 9: 296-306.
Garg P P, Kerlikowske K, Subak L, Grady D. Hormone replacement therapy and the risk of epithelial ovarian carcinoma: a meta-analysis. Obstetrics Gynecol 1998; 92: 472-9.
Garnero P, Hausherr E, Chapuy MC, Marcelli C, Grandjean H, Muller C, et al. Markers of bone resorption predict hip fracture in elderly women: the EPIDOS Prospective Study. J Bone Miner Res 1996 ; 11:1531-8.
Garton M J, Cooper C, Reid D. Perimenopausal bone density screening: will it help prevent osteoporosis? Maturitas 1997; 26: 35-43.
Geelhoed E, Harris A, Prince R. Cost-effectiveness analysis of hormone replacement therapy and life-style intervention for hip fracture. Aust J Public Health 1994; 18: 153-60.
Genant HK. Interim report and recommendations of the World Health Organization Task-force for Osteoporosis. Osteoporosis Int 1999; 6: 259-64.
Gennari C, Adami S, Agnusdei D, Bufalino L, Cervetti R, Crepaldi G, et al. Effect of chronic treatment with ipriflavone in postmenopausal women with low bone mass. Calcified Tissue International 1997; 61 (1): S19-22.
Giannini S. Continuous and cyclical clodronate therapies and bone density on posmenopausal bone loss. Obstet Gynecol 1996; 88: 431-6.
Gillespie WJ, Avenell A, Henry DA, O'Connell DL, Robertson J. Vitamin D and vitamin D analogues for preventing fractures associated with involutional and post-menopausal osteoporosis (Cochrane Review). In: The Cochrane Library, Issue 1, 2001. Oxford: Update Software.
Gillespie LD, Gillespie WJ, Cumming R, Lamb SE, Rowe BH. Interventions for preventing falls in the elderly (Cochrane Review). In: The Cochrane Library, Issue 1, 2001. Oxford: Update Software.
Gregg EW. Physical activity and osteoporotic fractures risk in older women; Ann Intern Med 1998; 129: 81-8.
GRIO. Rapport du Comité Scientifique du GRIO. Revue du Rheum 7-8 bis. Miller PD; Guidelines for the Clinical Utilization of bone mass measurement in the adult population. Calcif Tissue Int 1994;57: 251-2.
Gonnelli S, Cepollaro C, Montomoli M, Gennari L, Montagnani A, Palmieri R, et al. Treatment of postmenopausal osteoporosis with recombinant human growth hormone and salmon calcitonin a placebo controlled study; Clin Endocrinol (Oxf); 1997; 46: 55-61.
Guañabens N, Farrerons J, Perez-Edo L, Monegal A, Renau A, Carbonell J, et al. Cyclical etidronate versus sodium fluoride in established postmenopausal osteoporosis: a randomized 3 year trial. Bone 2000; 27: 123-8.
Haguenauer D, Welch V, Shea B, Tugwell T, Wells G. Fluoride for treating postmenopausal osteoporosis (Cochrane Review). In: The Cochrane Library, Issue 1, 2001. Oxford: Update Software.
Hanley DA, Josse RG. Prevention and management of osteoporosis: Consensus statements from the Scientific Advisory Board of the Osteoporosis Society of Canada. Can Med Assoc J 1996; 155: 921-1133.
Hans D, Dargent-Molina P, Schott AM, Sebert JL, Cormier C, Kotzki PO, et al. For the EPIDOS prospective study group. Lancet 1996; 348: 511-14.
Harris ST, Watts NB, Genant HK, McKeever CD, Hangartner T, Keller M, et al. Effects of risedronate treatment on vertebral and nonvertebral fractures in women with postmenopausal osteoporosis: a randomized controlled trial. Vertebral Efficacy with Risedronate Therapy (VERT) Study Group. JAMA 1999; 282: 1344-52.
Harris ST, Eriksen E, Davidson M, Ettinger B, Moffet Jr AH, Baylink DJ, et al. Effect of combined risedronate and hormone replacement therapies on bone mineral density in postmenopausal women. J Clin Endocrinol Metab 2001; 86: 1890-7.
Hayward RSA, Wilson MC, Tunis SR, Bass EB, Guyatt G. User's guides to the medical literature. VIII. How to use clinical practice guidelines. A. Are the recommendations valid? JAMA 1995; 274: 570-4.
Heikkinen JE, Selander KS, Laitinen K, Arnala I, Vaananen HK. Short-term intravenous bisphosphonates in prevention of postmenopausal bone loss. J Bone Min Res 1997; 12: 103-10.
Herd RJ, Balena R, Blake GM, Ryan PJ, Fogelman I. The prevention of early postmenopausal bone loss by cyclical etidronate therapy: a 2-year, double-blind, placebo- controlled study. Am J Med 1997; 103: 92-9.
Hodsman AB, Fraher LJ, Watson PH, Ostbye T, Stitt LW, Adachi JD, et al. A randomized controlled trial to compare the efficacy of cyclical parathyroid hormone versus cyclical parathyroid hormone and sequential calcitonin to improve bone mass in postmenopausal women with osteoporosis. J Clin Endocrinol Metab 1997; 82: 620-8.
Hodsman AB, Kisiel M, Adachi JD, Fraher LJ, Watson PH. Histomorphometric evidence for increased bone turnover without change in cortical thickness or porosity after 2 years of cyclical hPTH(1-34) therapy in women with severe osteoporosis. Bone 2000; 27: 311-8.
Holloway L. Skeletal effects of cyclic recombinant human growth hormone. J Clin Endocrinol Metab 1997: 82; 1111-7.
Homik J, Hailey D. Quantitative ultrasound for bone density measurement (English). Alberta Heritage Foundation for Medical Research. Alberta Heritage Foundation for Medical Research (AHFMR). 1896956114. HTA 11. 1998.
Homik J, Hailey D. Selective testing with bone density measurement (English). Alberta Heritage Foundation for Medical Research. Basque Office for Health Technology Assessment (Osteba).1896956122. Health Technology Br. 1999.
Houg FS. Guidelines for the early detection of osteoporosis and prediction of fractures. Council of the National Osteoporosis Foundation.; SAMJ 1996; 86: 1113-6.
INAHTA. Efectividad de la medida de densidad ósea y de los tratamientos asociados en la prevención de fracturas. 1996.
Johnston CC Jr, Slemenda CW, Melton LJ. III Clinical use of bone densitometry. N Engl J Med 1991;324:1105-9.
Kanis J, Devogelaer JP, Gennari C. Practical guide for the use of mineral measurements in the assessment of treatment of osteoporis: A position paper of the European Foundation for Osteoporosis and Bone disease. Osteoporosis Int 1996; 6: 256-61.
Kanis JA, Delmas P, Burckhard P, Cooper C, Torgerson D. Guidelines for diagnosis and management of osteoporosis. Osteoporosis Int 1997; 7: 390-406.
Kapetanos G. A double blind study intranasal calcitonin for osteoporosis. Acta Orthop Scand 1997; 275 (S1): 108-11.
Karpf DB, Shapiro DR, Seeman E, Ensrud K E, Johnston CC, Adami S, et al. Prevention of nonvertebral fractures by alendronate: a meta-analysis. JAMA 1997; 277: 1159-64.
Kaufman JM. Prevention and treatment of postmenopausal osteoporosis. National Consensus of the Belgian Bone Club. November 1996: Clinical Rheum 1997; 16: 343-5.
Kelley G. Aerobic exercise and lumbar spine bone mineral density in postmenopausal women: a meta-analysis. J Am Geriatrics Soc 1998; 46: 143-52.
Kelley GA. Exercise and regional bone mineral density in postmenopausal women: a meta-analytic review of randomized trials. Am J Phys Med Rehabil 1998; 77: 76-87.
Kelley GA. Aerobic exercise and bone density at the hip in postmenopausal women: a meta-analysis. Preventive Med 1998; 27: 798-807.
Komulainen MH, Kroger H, Tuppurainen MT, Heikkinen AM, Alhava E, Honkanen R, et al. HRT and Vit D in prevention of non-vertebral fractures in postmenopausal women; a 5 year randomized trial. Maturitas 1998; 31: 45-54.
Lanza F, Schwartz H, Sahba B, Malaty HM, Musliner T, Reyes R, et al. An endoscopic comparison of the effects of alendronate and risedronate on upper gastrointestinal mucosae. Am J Gastroenterol 2000; 95: 3112-7.
Lauritzen JB, Petersen MM, Lund B. Effect of external hip protectors on hip fractures. Lancet 1993; 341: 11-3.
Law MR, Hackshaw AK. A meta-analyisis of cigarette smoking, bone mineral density and risk of hip fracture: recognition of a major effect. BMJ 1997; 315: 841-6.
Levinson W. Primary Prevention of Postmenopausal Osteoporosis. JAMA 1998; 280: 1821-2.
Lindsay R, Nieves J, Henneman E, Shen V, Cosman F. Subcutaneous administration of the amino-terminal fragment of human parathyroid hormone-(1-34): kinetics and biochemical response in estrogenized osteoporotic patients. J Clin Endocrinol Metab. 1993; 77:1535-9.
Lindsay R, Nieves J, Formica C, Henneman E, Woelfert L, Shen V, et al. Randomised controlled study of effect of parathyroid hormone on vertebral-bone mass and fracture incidence among postmenopausal women on oestrogen with osteoporosis. Lancet 1997; 350: 550-5.
Lufkin EG, Whitaker MD, Nickelsen T, Argueta R, Caplan RH, Knickerbocker RK, et al. Treatment of established postmenopausal osteoporosis with raloxifene: a randomized trial. J Bone Min Res 1998; 13: 1747-54.
Lydick E, Cook K, Turpin J, Melton M, Stine R, Byrnes C. Development and validation of a simple questionnaire (SCORE) to facilitate identification of women likely to have low bone density. Am J Managed Care. 1998; 4: 37-48.
Macedo JM, Macedo CR, Elkis H, De Oliveira IR. Meta-analysis about efficacy of anti-resorptive drugs in post-menopausal osteoporosis. J Clin Pharm Ther 1998; 23: 345-52.
Marshall D, Johnell O, Wedel H. Meta-analysis of how well measures of bone mineral density predict occurrence of osteoporotic fractures. BMJ 1996; 312: 1254-9.
Masud T, Mulcahy B, Thompson AV, Donnelly S, Keen RW, Doyle DV, et al. Effects of cyclical etidronate combined with calcitriol versus cyclical etidronate alone on spine and femoral neck bone mineral density in postmenopausal osteoporotic women. Ann Rheum Dis 1998; 57: 346-9.
McClung M, Clemmesen B, Daifotis A, Gilchrist NL, Eisman J, Weinstein RS, et al. Alendronate prevents postmenopausal bone loss in women without osteoporosis. A double-blind, randomized, controlled trial. Ann Intern Med 1998; 128: 253-61.
McClung MR, Geusens P, Miller PD, Zippel H, Bensen WG, Roux C, et al. Effect of risedronate on the risk of hip fracture in elderly women. Hip Intervention Program Study Group. N Engl J Med 2001; 344: 333-40.
Meunier PJ, Confavreux E, Tupinon I, Hardouin C, Delmas PD, Balena R. Prevention of early postmenopausal bone loss with cyclical etidronate therapy (a double-blind, placebo-controlled study and 1-year follow-up). J Clin Endocrinol Metab 1997; 82: 2784-91.
Meunier PJ. Diagnosis and Management of Osteoporosis in Postmenopausal Women: Clinical Guideline. Clinical Therap 1999; 21: 1025-44.
Meunier PJ. Evidence-based medicine and osteoporosis. A comparison of fractures risk reduction data from osteoporosis randomised clinical trials. IJPC 1999; 53:122-9.
Meunier PJ, Vignot E, Garnero P, Confavreux E, Paris E, Liu-Leage S, et al. Treatment of postmenopausal women with osteoporosis or low bone density with raloxifene. Raloxifene Study Group. Osteoporos. Int 1999; 10: 330-6.
Michaëlson K, Baron JA, Farahmand BY, Johnell O, Magnusson C, Person PG, et al. On behalf of the Swedish hip fracture study group. BMJ 1998; 316: 1858-63.
Miller PD. Consensus of an International Panel on the Clinical Utility of Bone Mass Measurements in the Detection of low bone mass in the adult population. Calcif Tissue Int 1996; 58: 207-14.
Miller P, Bonnick SL, Rosen CJ. For the Society of Clinical Densitometry. Clinical utility of bone mass measurements in adults: Consensus of an international panel. Sem Arthritis Rheum 1996; 25: 361-72.
Miller PD, Watts NB, Licata AA, Harris ST, Genant HK, Wasnich RD, et al. Cyclical etidronate in the treatment of postmenopausal osteoporosis: efficacy and safety after seven years of treatment. Am J Med 1997; 103: 468-76.
Morley DC, Wheatley T. Education intervention designed to reduce risk factors for the development of osteoporosis and subsequent fragility fractures in post menopausal women. Sussex: Mid Sussex National Health Service Trust: 1998. p. 1-13.
Mortensen L, Charles P, Bekker PJ, Digennaro J, Johnston CC Jr. Risedronate increases bone mass in an early postmenopausal population: two years of treatment plus one year of follow-up. J Clin Endocrinol Metab 1998; 83: 396-402.
Mussolino ME. Phalange bone density and hip fracture risk. Arch Intern Med 1997; 157: 629-34.
Naves Diaz M. The influence of alcohol consumption on the risk of vertebral deformity European vertebral osteoporosis study group. Osteoporis Int 1997; 7: 65-71.
Neer RM, Arnaud CD, Zanchetta JR, Prince R, Gaich GA, Reginster JY, et al. Effect of Parathyroid Hormone (1-34) on fractures and bone mineral density in postmenopausal women with osteoporosis. N Engl J Med 2001; 344: 1434-41.
NOF. Osteoporosis: Review of the evidence for prevention, diagnosis, and treatment and cost-effectiveness analysis. Springer: National Osteoporosis Foundation; 1998.
Norlund A. Prevention of osteoporosis- a cost-effectiveness analysis regarding fractures. Scand J Rheumatol 1996; 25: 42-5.
Ohta H, Komukai S, Makita K, Masuzawa T, Nozawa S. Effects of 1-year ipriflavone treatment on lumbar bone mineral density and bone metabolic markers in postmenopausal women with low bone mass. Hormone Res 1999; 51: 178-83.
Parker MJ, Gillespie LD, Gillespie WJ. Hip protectors for preventing hip fractures in the elderly (Cochrane Review). In: The Cochrane Library, Issue 1, 2001. Oxford: Update Software.
Pavlov PW, Ginsburg J, Kicovic PM, van der Schaaf DB, Prelevic G, Bennink HJ. Double-blind, placebo-controlled study of the effects of tibolone on bone mineral density in postmenopausal osteoporotic women with and without previous fractures. Gynecol Endocrinol 1999; 13: 230-7.
Pouilles JM, Tremollieres F, Roux C, Sebert JL, Alexandre C, Goldberg D, et al. Effects of cyclical etidronate therapy on bone loss in early postmenopausal women who are not undergoing hormonal replacement therapy. Osteoporosis Int 1997; 213: 8.
Prince RL. Practice Guidelines for the treatment of osteoporosis. Calcif Tissue Intern 1996; 59 (S1): S20-3.
Ravn P. The effect on bone markers of different doses of ibandronate: a new bisphosphonate for prevention and treatment of postmenopausal osteoporosis. Bone 1996; 19: 527-33.
Ravn P, Christensen JO, Baumann M, Clemmesen B. Changes in biochemical markers and bone mass after withdrawal of ibandronate treatment: prediction of bone mass changes during treatment. Bone 1998; 22: 559-64.
Recker RR, Davies KM, Dowd RM, Heaney RP. The effect of low-dose continuous estrogen and progesterone therapy with calcium and vitamin D on bone in elderly women. A randomized, controlled trial. Ann Intern Med 1999; 130: 897-904.
Reeve J, Meunier PJ, Parsons JA, Bernat M, Bijvoet OL, Courpron P, et al. Anabolic effect of human parathyroid hormone fragment on trabecular bone in involutional osteoporosis: a multicentre trial. BMJ 1980; 280: 1340-4.
Reginster JY. Harmonization of clinical practice guidelines for the prevention and treatment of osteoporosis and osteopenia in Europe: A difficult challenge. Calcif Tissue Intern 1996; 59 (S1): S24-29.
Reginster JY, Agnusdei D, Gennari C, Kicovic PM. Association of tibolone and fluoride displays a pronounced effect on bone mineral density in postmenopausal osteoporotic women. Gynecol Endocrinol 1999; 13: 361-8.
Reginster J, Minne HW, Sorensen OH, Hooper M, Roux C, Brandi ML, et al. Randomized trial of the effects of risedronate on vertebral fractures in women with established postmenopausal osteoporosis. Vertebral Efficacy with Risedronate Therapy (VERT) Study Group. Osteoporosis Int 2000; 11: 83-91.
Rittmaster RS, Bolognese M, Ettinger MP, Hanley DA, Hodsman AB, Kendler DL, et al. Enhancement of bone mass in osteoporotic women with parathyroid hormone followed by alendronate. J Clin Endocrinol Metab. 2000; 85: 2129-34.
Rockville, MD. Agency for Health Care Research and Quality (AHRQ). Bone densitometry for estrogen deficient women - nonsystematic review. Agency for Health Care Research and Quality (AHRQ). 1998.
Rosner A J, Grima D T, Torrance G W, Bradley C, Adachi J D, Sebaldt R J, et al. Cost-effectiveness of multi-therapy treatment strategies in the prevention of vertebral fractures in postmenopausal women with osteoporosis. Pharmacoeconomics 1998; 14: 559-73.
Ross PD, Davis JW, Epstein RS, Wasnich RD. Preexisting fractures and bone mass predict vertebral fracture incidence in women. Ann Intern Med 1991; 114: 919-23.
Royal College of Physicians. Osteoporosis: Clinical Guidelines for the prevention and treatment. 1999.
Sackett DL, Ricahrdson WS, Rosenbenrg W, Haynes RB, editores. Evidence-based Medicine. How to practice and teach EBM. New York: Churchill Livingstone; 1997.
Schneider DL, Barrett-Connor EL, Morton DJ. Timing of postmenopausal estrogen for optimal bone mineral density. The Rancho Bernardo study. JAMA 1997;277: 543-7.
Schott AM, Cormier C, Hans D, Favier F, Hausherr E, Dargent Molina P, et al. How hip and whole body bone mineral density predict hip frature. Osteoporosis Int 1998; 8: 247-54.
Scott PJ. Consensus viewpoint on the treatment of postmenopausal osteoporosis.: New Zealand Med J 1997; 110: 397-9.
Sosa M. El Documento Canario sobre la Osteoporosis. 1998.
Sosa M. Genetic polimorphysm of vitamin D receptor and osteoporosis; Med Clin (Barc), 1998; 110: 646-50.
Stock JL, Bell NH, Chesnut CH 3rd, Ensrud KE, Genant HK, Harris ST, et al. Increments in bone mineral density of the lumbar spine and hip and suppression of bone turnover are maintained after discontinuation of alendronate in postmenopausal women. Am J Med 1997; 103: 291-7.
Studd J, Arnala I, Kicovic PM, Zamblera D, Kroger H, Holland N. A randomized study of tibolone on bone mineral density in osteoporotic postmenopausal women with previous fractures. Obstetrics Gynecol 1998; 92: 574-9.
Thamsborg G, Jensen JE, Kollerup G, Hauge EM, Melsen F, Sorensen OH. Effect of nasal salmon calcitonin on bone remodeling and bone mass in postmenopausal osteoporosis. Bone 1996; 18: 207-12.
The writing Group for the PEPI study. Effects of hormone therapy on Bone mineral density. Results from the Postmenopausal estrogen/progestin interventions (PEPI) trial. JAMA 1996;276: 1389-96.
Thiebaud D, Burckhardt P, Kriegbaum H, Huss H, Mulder H, Juttmann JR, et al. Three monthly intravenous injections of ibandronate in the treatment of postmenopausal osteoporosis. Am J Med 1997; 103: 298-307.
Tsai KS, Hsu SH, Yang RS, Cheng WC, Chieng P. The effectiveness of cyclic and continuous oral clodronate therapy on bone density and markers in osteopenic postmenopausal women. Calcif Tissue Int 1999; 64: 384-8.
Tucci JR. Effect of three years alendronate treatment in postmenopausal women with osteoporosis. Am J Med 1996; 101: 488-501.
Vestergaard P, Hermann AP, Gram J, Jensen LB, Kolthoff N, Abrahamsen B, et al. Improving compliance with hormonal replacement therapy in primary osteoporosis prevention. Maturitas 1997; 28: 137-45.
Weiss SR, Ellman H, Dolker M, for the Trasdermal Estradiol Investigator group for preventing postmenopausal bone loss. A randomized controlled trial of four doses of transdermal estradiol for preventing postmenopausal bone loss. Obstet Gynecol 1999; 94: 330-6.
Wimalawansa SJ. A four-year randomized controlled trial of hormone replacement and bisphosphonate, alone or in combination, in women with postmenopausal osteoporosis. Am J of Med 1998; 104: 219-26.
Wolff I, van Croonenborg JJ, Kemper HC, Kostense PJ, Twisk JW. The effect of exercise training programs on bone mass: a meta-analysis of published controlled trials in pre- and postmenopausal women. Osteoporosis Int 1999; 9: 1-12.
World Health Organization. Assessment of fracture risk and its application to screening for postmenopausal osteoporosis. Technical Report Series 843. 1994. Geneva: WHO.