INTRODUCCIÓN
La osteoporosis es una enfermedad que se caracteriza por una disminución de la masa ósea o la presencia de una fractura por fragilidad. Esta reducción del tejido óseo se acompaña de una alteración de la microarquitectura del hueso que conlleva una disminución de la resistencia ósea y una mayor susceptibilidad para el desarrollo de fracturas1. Cuando se rompe el equilibrio del remodelado óseo y disminuye la mineralización ósea aparece la osteopenia, que puede progresar a osteoporosis. Existen varias técnicas no cruentas para medir la masa ósea o la densidad de la masa ósea (DMO), pero se utiliza de manera estandarizada la absorciometría de rayos X de energía dual (DEXA). La DMO se expresa en gramos de mineral por unidad de superficie (cm2). Aunque se puede utilizar para medir cualquier lugar del esqueleto, las determinaciones habitualmente se realizan en la columna lumbar y la cadera.
La DMO se puede expresar en referencia a la desviación estándar de la media (DE), en valores Z score (puntuación Z, toma como referencia la DMO de la población joven en el momento de máxima masa ósea) y T score (puntuación T, referencia la DMO de la población con la misma edad y sexo que el paciente). Basándose en numerosos estudios epidemiológicos que correlacionaban el riesgo de una disminución de la DMO con un incremento en la incidencia de fracturas, la Organización Mundial de la Salud (OMS) propuso las siguientes categorías2: a) DEXA normal para DMO > -1 DE; b) osteopenia para DMO entre -1 y -2,5 DE; c) osteoporosis para DMO < -2,5 DE, y d) osteoporosis grave o establecida si se añaden fracturas.
DMO EN UN PACIENTE INFECTADO POR EL VIH
PREVALENCIA
En los estudios realizados con posterioridad a la introducción del tratamiento antirretroviral (TARV) se demuestra que la prevalencia de osteopenia y osteoporosis en la población infectada por el virus de la inmunodeficiencia humana (VIH) está incrementada respecto a la población no infectada3-10.
En un metaanálisis10 se revisaron 20 estudios publicados en lengua inglesa para determinar la odds ratio de una DMO reducida y la osteoporosis en pacientes con y sin infección por el VIH. En los pacientes con infección por VIH, la prevalencia de osteopenia fue del 67% y la de osteoporosis del 15%, con un riesgo de 6 y 3 veces de osteopenia y osteoporosis, respectivamente, frente a la población general.
FACTORES DE RIESGO
En la población general existen numerosos factores de riesgo para el desarrollo de osteoporosis. Se trata de una enfermedad multifactorial, en la que la edad y la menopausia son los principales predisponentes, existiendo otros factores, como por ejemplo la toma prolongada de esteroides, el consumo de tabaco o la infección por el VIH, entre otros (tablas 1 y 2).
En los pacientes con infección por el VIH, además de los factores clásicos, hay que añadir el tiempo de evolución de la enfermedad, habiéndose comunicado en distintos trabajos la mayor prevalencia de osteoporosis en pacientes con carga viral elevada y linfocitos T CD4+ bajos. Estudios recientes describen una menor DMO en mujeres seropositivas frente a mujeres sanas, tanto en premenopáusicas como en perimenopáusicas o posmenopáusicas11, y en población infantil. En este último grupo la repercusión de la infección por el VIH sobre la masa ósea puede ser incluso mayor que en el adulto, dado que la masa ósea depende de aquella que se tuvo al completar el desarrollo (siendo ésta menor en la población VIH) y de las pérdidas sufridas posteriormente12.
PATOGÉNESIS
En los pacientes con infección crónica por el VIH hay un aumento del recambio óseo (se incrementa la destrucción de tejido óseo por parte de los osteoclastos y aumenta el número de unidades de remodelación ósea)13. En distintos trabajos se constata que hay un aumento de los marcadores de resorción ósea mientras que los de formación (osteocalcina, fosfatasa alcalina ósea, péptidos carboxi y aminoterminales del procolágeno de tipo I) están disminuidos y esto empeora conforme avanza la infección por el VIH7.
Se considera que la acción del VIH sobre el hueso ocurre de forma indirecta, mediada por una elevada producción de citoquinas proinflamatorias (interleucina [IL]-1, IL-6 o factor de necrosis tumoral [TNF]) que aumentan la actividad osteoclástica. Además del efecto sobre la secreción de citoquinas, el VIH estimula la liberación del receptor del activador del factor nuclear kappa B (RANKL). Este receptor es una citoquina secretada por las células T y los osteoblastos, que estimula la pérdida de masa ósea al favorecer la diferenciación de los osteoclastos. Los estadios avanzados de la infección VIH (CD4 < 20 células/ml) se correlacionan con niveles altos de TNF y con una elevación de marcadores de resorción ósea, lo que podría explicar la mayor pérdida de masa ósea en estos pacientes14.
ETIOLOGÍA
Infección por el VIH y factores asociados a ésta
Dentro de las distintas causas que encontramos para explicar la osteoporosis en el paciente con infección por VIH15, tenemos en primer lugar la propia infección y factores que están intrínsecamente relacionados con ella, como son: la malnutrición (síndrome de emaciación o wasting syndrome), bajo peso, sedentarismo, una mayor tasa de tabaquismo, enolismo, hepatopatías y adicción a drogas por vía parenteral, entre otros. El consumo de heroína se ha asociado con una mayor frecuencia de hipogonadismo e insuficiencia suprarrenal de origen central y una menor respuesta a la hormona de crecimiento; también se plantea su acción directa sobre los osteoblastos16. Recientemente se ha visto que la hepatitis viral supone un mayor riesgo de presentar una menor DMO en mujeres, pero no en hombres17.
Edad
Uno de los mayores factores de riesgo en la población infectada por el VIH es la edad. Gracias al TARV la supervivencia de estos pacientes ha aumentado considerablemente. En este sentido, a los efectos provocados a largo plazo por el propio VIH o por el TARV, hay que sumar los efectos que la edad pueda tener en la contribución a presentar una menor DMO.
Tratamiento antirretroviral
Por último, y en tercer lugar, está la influencia del TARV sobre la DMO. Las familias más estudiadas han sido los inhibidores de la proteasa, los inhibidores de la transcriptasa inversa análogos de nucleósidos/nucleótidos y los inhibidores de la transcriptasa inversa no análogos de nucleósidos. Al hacer esta revisión no hemos encontrado ningún estudio sobre los nuevos fármacos antirretrovirales (inhibidores de la integrasa, inhibidores de la fusión o la entrada) y su relación con la DMO.
1. Inhibidores de la proteasa: inicialmente se achacó la osteopenia a un efecto secundario de estos inhibidores, pero con posterioridad se ha demostrado que mantienen e incluso aumentan la masa ósea6,18,19.
2. Inhibidores de la transcriptasa inversa no análogos de nucleósidos: no se ha encontrado interacción con respecto a la masa ósea20.
3. Inhibidores de la transcriptasa inversa análogos de nucleósidos: los fármacos más antiguos de esta familia (zidovudina, estavudina y didanosina) producen toxicidad mitocondrial, que a su vez produce hiperlactatemia y acidosis, que debe tamponarse con los cristales de hidroxiapatita, lo que conlleva una pérdida de masa ósea21.
El tenofovir (TDF), mediante un mecanismo diferente a la acisdosis láctica, está relacionado con la DMO, como se detalla a continuación.
TENOFOVIR Y ENFERMEDAD ÓSEA
El TDF está indicado en combinación con otros fármacos antirretrovirales para el tratamiento de la infección por el VIH en adultos mayores de 18 años. También está indicada su utilización para el tratamiento de la infección crónica por la hepatitis B (VHB) en adultos con enfermedad compensada, con evidencia de replicación viral, persistencia de elevación de las transaminasas y evidencia histológica de actividad inflamatoria y/o fibrosis hepática.
Esta revisión pretende detallar los estudios que aportan información sobre la relación del TDF y los diferentes parámetros óseos: DMO, biomarcadores y fracturas óseas. Todos los estudios que citamos son en pacientes con infección por VIH. No hemos encontrado ningún estudio en pacientes con infección por el VHB.
El TDF afecta a la función del epitelio tubular renal22 y probablemente las alteraciones óseas estén asociadas en parte a la tubulopatía proximal renal que produce el fármaco. El TDF, ante situaciones que disminuyan su metabolismo o provoquen descenso del filtrado glomerular, se convierte en nefrotóxico y puede llevar a un deterioro irreversible de la función renal23. Existe una hipofosfatemia como expresión de una tubulopatía denominada síndrome de Fanconi, que se caracteriza por: proteinuria, glucosuria, fosfaturia e hipofosfatemia, hiperpotasuria e hipopotasemia, y acidosis metabólica. La fosfaturia crónica provoca osteopenia con hormona paratiroidea (PTH) suprimida. En un estudio realizado en macacos, se observó que la administración prolongada y a altas dosis de TDF se relacionaba con alteraciones típicas del síndrome de Fanconi y osteomalacia24. Por lo tanto, algunos autores sugieren que la asociación del TDF con el hueso está relacionada de forma indirecta con las alteraciones renales que produce. En los estudios pre-clínicos en que se administraba el TDF a dosis altas, la toxicidad ósea observada era en forma de osteomalacia (monos) y una DMO reducida (gatos y perros). La osteomalacia era reversible una vez que se bajaba la dosis de TDF o se suspendía el fármaco. Los estudios realizados en ratas y en monos sugerían que existía una disminución en la absorción de fosfato, con la consiguiente reducción de la DMO. El mecanismo de la toxicidad ósea no se conoce.
Los primeros ensayos clínicos que observaron un efecto deletéreo del TDF sobre el hueso fueron: en adultos, el estudio Gilead 903, y en niños, un estudio longitudinal de 18 niños infectados por el VIH que demostró que existía un descenso significativo en la DMO durante las 48 semanas de tratamiento con TDF25.
A continuación se detallan los estudios más importantes publicados hasta la fecha que evalúan la utilización de TDF (como parte de un régimen antirretroviral) y su asociación con la DMO, la osteopenia, la osteoporosis y las fracturas.
ESTUDIO GILEAD 903
El estudio Gilead 90326 fue un estudio aleatorizado en fase III, que comparó la eficacia y la seguridad del TDF frente a estavudina (d4T) en combinación con efavirenz (EFV) y lamivudina (3TC) en pacientes con infección por el VIH que no habían recibido previamente tratamiento antirretroviral. A todos los pacientes se les midió la DMO de columna lumbar y de cadera al inicio del estudio y cada 24 semanas.
En un análisis por intención de tratar (a las 144 semanas), la proporción de pacientes con carga viral del VIH indetectable era del 68% en el grupo del TDF y del 62% en el de d4T. Entre los tratados con TDF fueron menos frecuentes tanto la toxicidad global relacionada con la disfunción mitocondrial como la neuropatía periférica o la lipodistrofia. Este estudio apoyó el uso de TDF + 3TC + EFV frente a d4T + 3TC + EFV como terapia de inicio.
En general, este estudio demostró una alta prevalencia de osteopenia (según los criterios de la OMS) en los más de 600 pacientes incluidos en el estudio. A la semana 144, con respecto a la DMO de la columna lumbar existía un descenso medio mayor en los pacientes que tomaban TDF (-2,2% ± 3,9) en comparación con los que tomaban d4T (-1% ± 4,6). Por el contrario, los cambios en la DMO en la cadera fueron parecidos en los dos grupos de tratamiento (-2,8% ± 3,5 en el grupo de TDF y -2,4% ± 4,5 en el grupo de d4T). En ambos la reducción máxima de la DMO ocurrió en las primeras 24-48 semanas de comenzar el estudio, y esta reducción se mantuvo hasta la semana 144.
Además, hubo aumentos significativos en los niveles de 4 marcadores bioquímicos del metabolismo óseo (fosfatasa alcalina ósea sérica, osteocalcina sérica, telopéptido C sérico y telopéptido N urinario) en el grupo de TDF con relación al grupo de d4T, lo que sugiere mayor resorción ósea. Los niveles séricos medios de PTH y de vitamina D 1,25 también fueron más altos en el grupo que recibió TDF. Excepto por la fosfatasa alcalina ósea, los valores de estos marcadores se mantuvieron dentro del rango normal.
ESTUDIO GILEAD 903E
Después de completar las 144 semanas del estudio 903, se enrolaron algunos pacientes en un estudio de extensión (estudio 903E) a 336 semanas (7 años). En esta fase de extensión, 86 de los pacientes que se aleatorizaron a recibir TDF en el primer estudio continuaron recibiéndolo en la formulación combinada, y 85 de los pacientes que en un principio recibieron d4T cambiaron a un régimen con TDF. Durante la fase de extensión, todos los pacientes recibieron calcio y suplementos de vitamina D. Cassetti et al presentaron los resultados de seguridad de los pacientes que continuaron con el régimen de TDF27.
En los pacientes que estuvieron 7 años con TDF hubo un cambio medio en la DMO de -1,5% en columna lumbar y de -2,6% en cadera (los dos p < 0,01). Los cambios ocurrieron durante las semanas 24 y 48. Después de 7 años con el régimen que incluía TDF, 5 pacientes presentaron fracturas óseas, ninguna de ellas relacionada con la utilización de TDF.
En el grupo de pacientes que cambiaron del régimen que contenía d4T a TDF, 4 años después del cambio hubo un descenso significativo en la DMO media de la cadera (-1,6%; p < 0,001) y no significativo en la columna lumbar (-0,1%; p = 0,87). No hubo fracturas óseas patológicas y un paciente presentó una fractura a consecuencia de un traumatismo y no relacionada con el TDF.
ESTUDIO SWEET
Fue un ensayo clínico en el que 230 pacientes en tratamiento durante al menos 6 meses con zidovudina (AZT) + 3TC y EFV y con carga viral indetectable, se aleatorizaron a seguir con el mismo régimen o recibir TDF + emtricitabina (FTC) (coformulado) y EFV28. A las 24 semanas se observó una mejoría en las cifras de hemoglobina y en el perfil lipídico en la rama de TDF, manteniéndose la respuesta al tratamiento.
En el CROI de 2009 el grupo de Graeme Moyle presentó un subestudio denominado «subestudio DEXA». Uno de los objetivos fue valorar si se producía un cambio en la DMO en la columna lumbar o en la cadera después de modificar el régimen de AZT a TDF. En ambos grupos de tratamiento (AZT frente a TDF) los cambios de la DMO, respectivamente en cadera (-0,008 frente a -0,003; p = 0,019) y en columna lumbar (-0,024 frente a -0,001; p = 0,36), fueron parecidos en la semana 48. Se concluyó que durante el periodo de estudio no hubo cambios significativos en la DMO en la columna lumbar o en la cadera. Por lo tanto, los pacientes del ensayo no mostraban aumento del riesgo relativo para presentar fracturas con los fármacos tomados durante 48 semanas.
ESTUDIO STEAL
Fue un ensayo aleatorizado, abierto, a 96 semanas y de no inferioridad, diseñado para comparar la eficacia y seguridad de TDF + FTC (Truvada®) con las de abacavir (ABC) + 3TC (Kivexa®) en pacientes infectados por el VIH en nivel indetectable29. Se incluyeron 360 pacientes en tratamiento e indetectables durante al menos 12 semanas. El objetivo principal fue estudiar la proporción de fallos virológicos (carga viral > 400) a la semana 96 en un análisis por intención de tratar.
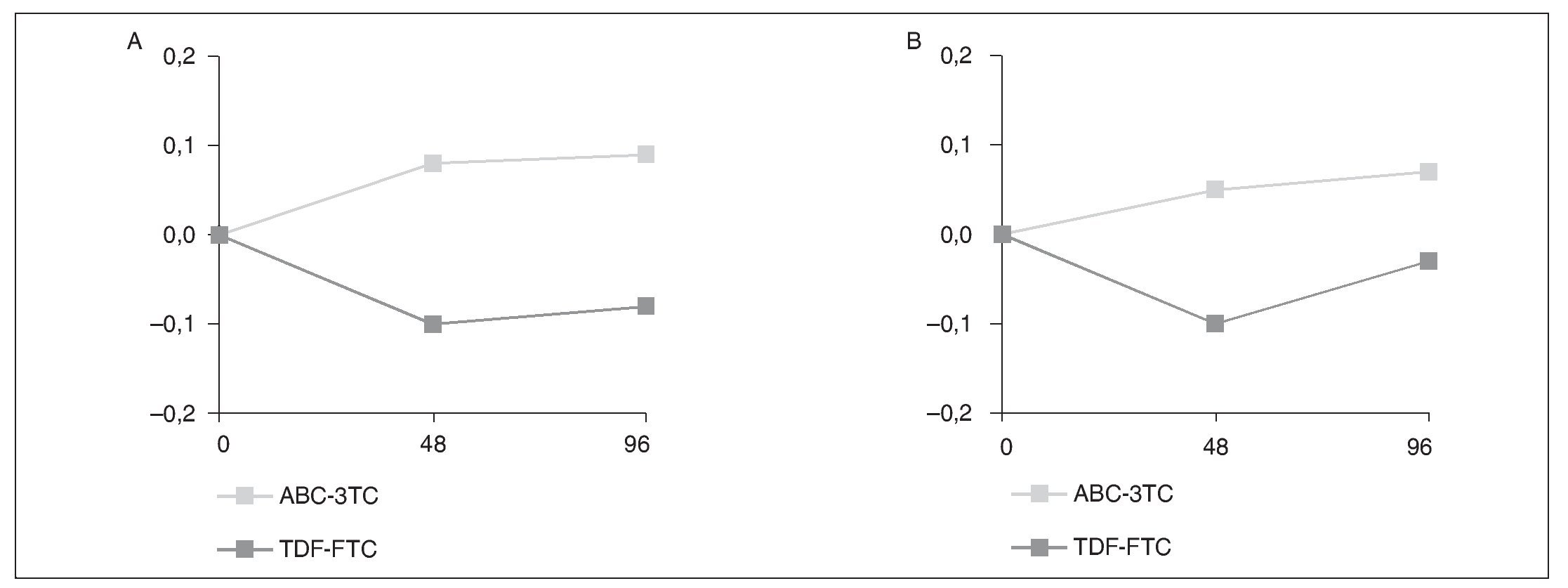
El estudio mostró que después de 96 semanas en tratamiento y en un análisis por intención de tratar, existía una diferencia significativa de alteraciones óseas (osteopenia, osteoporosis, fractura o tratamiento nuevo) en el grupo que recibió TDF en comparación con el que recibió ABC (el 27% frente al 14%; p = 0,032). Además, el grupo que utilizó TDF se asoció con una mayor pérdida de la DMO (T score de cadera derecha: p < 0,0001 frente a basal; T score lumbar: p = 0,02 frente a basal) como se muestra en la figura 1.
Fig. 1. Cambio en la densidad mineral ósea en el estudio STEAL. A. El primer panel muestra los cambios en el T score de la cadera izquierda a la semana 48 (p < 0,0001) y a la semana 96 (p < 0,0001). B. El segundo panel muestra los cambios en el T score de la columna lumbar a la semana 48 (p < 0,002) y a la semana 96 (p < 0,023). ABC: abacavir; FTC: emtricitabina; TDF: tenofovir; 3TC: lamivudina.
ESTUDIO RAVE
Fue un estudio fase IV, aleatorizado, abierto y multicéntrico, diseñado para comparar los efectos de sustituir AZT o d4T por TDF o ABC en los pacientes con lipoatrofia moderada-grave. El objetivo primario fue valorar el cambio en la masa grasa de las extremidades. También se evaluaron los cambios en la DMO basal y a las semanas 24 y 48 de la inclusión. A la semana 48 no hubo cambios significativos de la DMO en ambos grupos. Se observó osteopenia en 13 (27%) de los pacientes con TDF y en 7 (16%) de los pacientes con ABC (p = 0,32). Tampoco se observaron fracturas óseas.
ESTUDIO SMART
El estudio SMART (Strategies for Management of Anti-Retroviral Therapy) es el mayor estudio aleatorizado hasta la fecha en pacientes infectados por el VIH. Se diseñó para comparar la seguridad y eficacia de dos estrategias de tratamiento antirretroviral: terapia intermitente (guiada por el recuento de CD4) o terapia continua. Los objetivos primarios fueron la aparición de enfermedades oportunistas y muerte por cualquier causa30.
En el estudio participaron más de 5.400 pacientes y se terminó de forma prematura después de un análisis interno que revelaba que los pacientes que interrumpían el tratamiento no solo presentaron una mayor tasa de enfermedad relacionada con sida, sino que también fueron más propensos a sufrir complicaciones que se consideraban relacionadas con la terapia antirretroviral, como problemas cardiovasculares, hepáticos y renales.
En el subestudio (SMART Body Composition Sub-Study) presentado en el ICAAC de 2008 participaron 275 pacientes y se analizó el cambio de la DMO medido por DEXA y por escáner cuantitativo. En ambos grupos, la terapia intermitente y la terapia continua presentaban, respectivamente, el 43 y el 40% una DMO baja y el 4,3 y el 3,1% osteoporosis. En este subestudio concluyeron que el TARV se asocia a un descenso en la DMO y a posibilidad de fracturas comparado con la terapia intermitente. De 56 pacientes tratados con TDF desde el inicio y después de casi dos años, éste no se asoció a pérdida de DMO31.
ESTUDIO BICOMBO
Estudio español, aleatorizado y abierto, que incluyó a más de 300 pacientes que recibían TARV, con supresión virológica durante un mínimo de 6 meses y que fueron aleatorizados a sustituir los análogos del régimen por una de las dos combinaciones de análogos (ABC + 3TC) o (FTC + TDF)32. El estudio se diseñó para evaluar la no inferioridad de ambas combinaciones respecto a fracaso terapéutico y fallo virológico. Al final, no se demostró la no inferioridad del ABC + 3TC con respecto a la de TDF + FTC. Se realizó un subestudio que incluyó a 45 pacientes para determinar el cambio de la DMO a la semana 96. Las alteraciones en la DMO fueron similares en ambos grupos, siendo la diferencia entre ellos no significativa (p = 0,217).
OTROS ESTUDIOS
Jones et al presentaron un estudio observacional de 104 pacientes en el que se compararon 57 pacientes infectados por el VIH y 47 pacientes sin infección, todos ellos mayores de 55 años33. Se concluyó que los pacientes con infección por el VIH presentaban una DMO menor en comparación con los pacientes no infectados por el VIH. La utilización de TDF se asociaba de forma significativa a un descenso de la DMO de columna lumbar, mientras que la utilización de inhibidores de la proteasa se asociaba con una menor DMO en cadera.
En un estudio muy reciente llevado a cabo en la universidad de Johns Hopkins y financiado por el laboratorio que comercializa el ABC + 3TC (Kivexa®), se evaluó si existían diferencias entre pacientes que comenzaban un régimen que contenía TDF con otro régimen sin TDF. La infección por el VIH avanzada se asociaba a un aumento de la resorción ósea con el inicio del tratamiento. La utilización de TDF, inhibidores de la proteasa y unos niveles basales de TNF altos se asociaba de forma independiente con un aumento de la osteocalcina.
En un estudio publicado muy recientemente34, Calmy et al determinaron qué factores se asociaban a una DMO disminuida y calcularon el riesgo de fractura a 10 años utilizando la ecuación de FRAX de la OMS. Se estudiaron 153 pacientes con infección por el VIH, el 98% eran hombres y 67 (44%) tomaban TDF. En el análisis multivariante, los inhibidores de la proteasa se asociaban de forma significativa con una DMO baja (odds ratio, 2,69; intervalo de confianza del 95%, 1,09-6,63). La utilización de TDF se asociaba con un aumento en la actividad osteoblástica y osteoclástica. El riesgo medio de fractura a 10 años fue del 1,2% para fracturas de cadera y del 5,4% para cualquier fractura mayor.
En un análisis post-marketing35 se recogieron los efectos adversos comunicados voluntariamente hasta el 2005. Se estimó que la tasa de alteraciones óseas graves en pacientes con TDF era de 1,1 entre 100.000 personas/año. Esta incidencia no es real, ya que la comunicación no se realiza en todos los casos y ésta es voluntaria.
CONCLUSIONES
En los pacientes infectados por el VIH la prevalencia de osteopenia y osteoporosis es alta. Aparte de los factores de riesgo generales de enfermedad ósea, existen otros como el propio virus y el tratamiento antirretroviral que posiblemente ocupen gran parte de la investigación en el campo del VIH. Los estudios que se han presentado en esta revisión son recientes y habrá que esperar más tiempo para poder aclarar la relación entre el tratamiento antirretroviral (sobre todo el TDF) y la enfermedad ósea (descenso de la DMO, osteopenia, osteoporosis y fracturas óseas). Hasta el momento se desconoce el impacto real sobre la salud ósea y el riesgo de fracturas que tienen los cambios en la DMO y en los marcadores bioquímicos de resorción ósea asociados con el uso de TDF. El TDF es un fármaco eficaz, seguro y muy utilizado en el tratamiento del VIH, por lo que hasta la fecha se recomienda hacer un seguimiento de la densidad ósea en pacientes infectados por el VIH que tengan antecedentes de fracturas patológicas o que estén en riesgo sustancial de osteopenia.
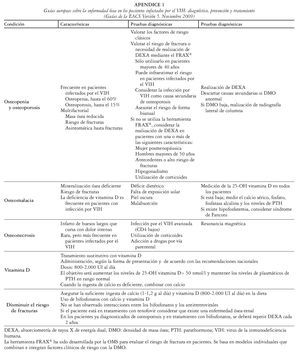
En el apéndice se muestran las últimas recomendaciones de la Sociedad Europea de Sida sobre la prevención, diagnóstico y tratamiento de la enfermedad ósea en los pacientes infectados por el VIH
Correspondencia: P. Ryan Murúa. Servicio de Medicina Interna.
Hospital Infanta Leonor.
C/ Gran Vía del Este, 80.
28031 Madrid. España.
Correo electrónico: pabloryan@gmail.com