INTRODUCCIÓN
La enfermedad ósea dePaget (EOP) es un trastorno de etiología desconocida, queafecta aproximadamente a más del 5% de la poblaciónmayor de 50 años1 y que se caracteriza por unaalteración en el remodelado óseo con unaresorción ósea muy activa, y una formaciónosteoblástica de igual intensidad pero desorganizada, que dalugar a un tejido óseo anómalo y con propiedadesestructurales alteradas.
Los bifosfonatos (BFF),previamente denominados difosfonatos, son unos compuestos,análogos bioquímicos de los pirofosfatos,desarrollados en las dos últimas décadas para eltratamiento de los trastornos que cursan con aumento de laresorción ósea2,3. Los bifosfonatos sonpotentes inhibidores de la resorción ósea y seconsideran actualmente como el tratamiento de elección en laEOP4,5.
El primer bifosfonato empleadoen el tratamiento de la enfermedad de Paget fue eletidronato (ácido1-hidroxietil-1,1-bifosfónico o HEBP). Sin embargo, suabsorción digestiva variable y su capacidad de inhibir lamineralización ósea a dosis elevadas6 o entratamientos de larga duración7 ha limitado suuso en la EOP.
Posteriormente se handesarrollado otros nuevos bifosfonatos, más potentes yprácticamente sin efectos sobre la mineralizaciónósea, a las dosis habituales4,5,8,9, denominadosde «segunda generación». Han sido utilizados conéxito en el tratamiento de las hipercalcemiasmalignas10-12, mieloma múltiple13,metástasis óseas14,osteoporosis15,16 y en la EOPactiva2,3,17,18. Entre ellos tenemos elpamidronato (3-amino-1-hydroxi-propil-1,1-bifosfónicoo APD) y el clodronato (ácidodiclorometil-bifosfónico o CL2MBP). El clodronatoes el segundo fármaco desarrollado tras el etidronato, y esdiez veces más potente que éste. Ha sido ampliamenteutilizado en oncología pero no se dispone por el momento depautas terapéuticas definitivas para el tratamiento de laEOP. Se ha administrado tanto por vía oral, con los mismosproblemas digestivos que el resto de bifosfonatos, como porvía intravenosa17,19,20, que permite alcanzarconcentraciones elevadas en el hueso más rápidamente,asegurando un alto nivel de eficacia.
El pamidronato es cien vecesmás potente que el etidronato y habitualmente se administrade forma intravenosa, a dosis variables según la actividadde la enfermedad, si bien no existen pautas terapéuticasestandarizadas universalmente. En caso de recaídas, se havisto que la mayoría de los pacientes responden nuevamenteal tratamiento, incluso tras varios años del ciclo inicial,si bien el descenso de los marcadores óseos es menospronunciado que con el primer ciclo21.
Recientemente se hanincorporado nuevos bifosfonatos al tratamiento de la EOP entre losque tenemos el tiludronato22 y elalendronato23, con resultados satisfactorios, ysiguen apareciendo además nuevos preparados, como elrisedronato24, ibandronato yzolendronato4, con espectativasesperanzadoras.
Con el propósito deevaluar la evolución de los distintos parámetros delmetabolismo mineral óseo y la seguridad del tratamiento conpamidronato en infusión intravenosa en pacientes con EOPbioquímicamente activa realizamos un estudio prospectivo enpacientes que recibían un ciclo de tratamiento porvía intravenosa. Así mismo se estudió, deforma similar, la respuesta a un segundo ciclo de tratamientointravenoso de pamidronato en un grupo de pacientes que presentaronuna reactivación clínica y bioquímica de laEOP a los dos años del tratamiento inicial.
PACIENTES YMÉTODOS
Fueron incluidos en el estudiopacientes diagnosticados de EOP, seguidos en nuestra consulta entre1993-1996, que presentaban una actividad bioquímicaimportante, definida por concentraciones de fosfatasa alcalinatotal (FAT) superiores al triple del valor normal máximo, yque habían sido resistentes al tratamiento previo concalcitonina y/o etidronato. El diagnóstico de EOP serealizó mediante datos analíticos y estudioradiológico de las regiones afectadas en el estudio deextensión de la enfermedad, realizado mediantegammagrafía ósea (tecnecio-99). Antes del tratamientose obtuvo consentimiento informado de todos los pacientes porescrito y se siguieron las normas establecidas para lautilización de fármacos como «usocompasivo».
En todos los pacientes serealizaron determinaciones de marcadores de formación yresorción ósea, estos últimos tanto en sangrecomo en orina. Entre los primeros se utilizó la fosfatasaalcalina total (FAT, medida mediante autoanalizador Hitachi 737,valores normales 90-280 U/l), y entre los de resorción, lafosfatasa ácida tartrato resistente (FATR, medida medianteautoanalizador Hitachi 737, valores normales 0-6,5 U/l), en sangre,y la piridinolina (Pyr, por ELISA, en relación con laexcreción de creatinina, valores normales < 24 nM/mM Cr),en orina de 24 horas. Así mismo se determinaron otrosparámetros del metabolismo óseo como los niveles de25-OH vitamina D (valores normales > 10 ng/ml); hormonaparatiroidea (PTH, por RIA, valores normales 10-40 pg/ml) y calcioiónico (valores normales 1,15-1,3 mmol/l). Todas estasdeterminaciones se realizaron antes de iniciar el tratamiento(basal), a la semana, al mes, a los tres y a los seis meses delmismo.
El tratamiento serealizó en régimen hospitalario, recibiendo lospacientes un ciclo de 15 mg diarios de pamidronato diluidos en 500ml de suero fisiológico (Cl Na 0,9%) en infusióncontinua durante cuatro horas, durante cinco díasconsecutivos (total: 75 mg de pamidronato). Al inicio deltratamiento se administraban 10.000 UI de vitamina D, que semantenían durante dos o tres semanas en aquellos pacientescon valores iniciales por debajo de 10 ng/ml. Se añadierontambién suplementos diarios de 500 mg de calcio.
Durante el tratamiento serealizaron controles analíticos sistemáticos queincluían hemograma y bioquímica sanguínea,así como determinación del calcio iónico, afin de evitar posibles efectos secundarios del tratamiento(trastornos hematológicos, hipocalcemia, etc.). Serealizó también un control de la temperatura, ante laposible aparición de fiebre.
Durante el estudio elúnico fármaco permitido fue el paracetamol comoanalgésico en dosis inferiores a 4 g/d.
Ningún pacientehabía recibido tratamiento en los seis meses previos concalcitonina o bifosfonatos, ni presentaban ninguna enfermedad oestaban tomando fármacos que interfirieran en el metabolismomineral óseo.
Los pacientes en los que losvalores de FAT se elevaron más de un 50% por encima delvalor mínimo alcanzado tras el primer ciclo de tratamiento,a los dos años de haber recibido el mismo, recibieron unsegundo ciclo de infusión intravenosa. Se realizaron lasmismas determinaciones analíticas respecto al metabolismoóseo y con la misma periodicidad.
En cuanto al estudioestadístico, los valores de FAT, FATR y Pyr se expresarondescriptivamente con sus correspondientes desviacionestípicas, y como porcentajes de descenso respecto a losvalores basales. Como prueba de comparación de medias seutilizó el estudio de medidas repetidas mediante la pruebano paramétrica de Friedman y contrastes múltiplesasociados con dicha prueba. Se consideró que el tratamientoera efectivo si la FAT disminuía al 50% de su valorbasal.
RESULTADOS
Un total de catorce pacientes,nueve mujeres y cinco varones (edad media 72,5 ± 7,6años), con EOP reunían las condiciones del estudio yfueron incluidos. De los pacientes, doce tenían una EOPpoliostótica y en dos era monostótica. Lascaracterísticas demográficas y clínicas de lospacientes, así como el tratamiento previo administrado seexpresan en la tabla 1. Los valores medios de FAT al inicio deltratamiento eran once veces superiores al valor máximoinicial (3.116 U/l).
| Tabla 1 Características clínicas y demográficasde los catorce pacientes que recibieron el primer ciclo detratamiento | ||||||
| Paciente | Edad(años) | Sexo | Tipo deafectación | Tiempodesde el diagnóstico (años) | Localización afectaciónpagética | Tratamientos previos |
| 1 | 64 | V | Poli | 8 | Pelvis, fémur, escápula | E,C |
| 2 | 62 | V | Poli | 3 | Calota, ilíaco | E,C |
| 3 | 63 | M | Poli | 12 | Pelvis, fémur, húmero,vértebras | E,C |
| 4 | 79 | M | Mono | 4 | Calota craneal | E,C |
| 5 | 64 | V | Poli | 5 | Húmero, ilíaco | E,C |
| 6 | 69 | M | Poli | 3 | Fémur, sacro, vértebras, radio | E,C |
| 7 | 81 | V | Poli | 5 | Calota, clavícula, escápula, sacro,vértebras, fémur, húmero | E,C |
| 8 | 75 | M | Mono | 4 | Calota craneal | E,C |
| 9 | 73 | M | Poli | 2 | Calota, macizo facial | C |
| 10 | 69 | M | Poli | 12 | Fémur, ilíaco | E,C |
| 11 | 79 | M | Poli | 2 | Calota, pelvis, vértebras | E |
| 12 | 86 | M | Poli | 4 | Pelvis, vértebras | E,C |
| 13 | 72 | M | Poli | 10 | Fémur, tibia | C |
| 14 | 79 | M | Poli | 6 | Fémur, pelvis, vértebras | E,C |
| V: varón;M: mujer; Poli: enfermedad poliostótica; Mono: enfermedadmonostótica; E: etidronato; C: calcitonina. | ||||||
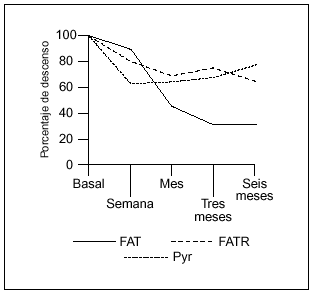
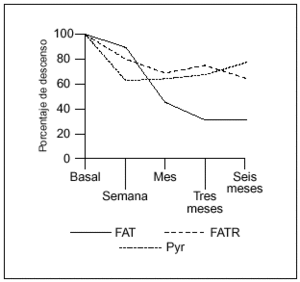
La administración porvía intravenosa de pamidronato en pacientes con EOP produjouna reducción tanto de los marcadores de formacióncomo de resorción ósea. Los niveles de FAT, FATR yPyr, en las determinaciones realizadas tras el primer ciclo detratamiento, se expresan en forma de media ±desviación estándar (DE). Las medias de losparámetros analizados siguen un curso descendente que seexpresa en porcentaje (%) de descenso respecto a los valoresbasales, tras la administración del primer ciclo (tabla 2,fig. 1).
| Tabla 2 Niveles séricos y urinarios demarcadores bioquímicos del metabolismo óseo (media± DE) y porcentaje de reduccióntras administración de primerciclo intravenoso | |||||
| Basal | Semana | Mes | Tres meses | Seis meses | |
| FAT | 3.116 ± 1.891 | 2.754 ± 1.908 (NS) | 1.398 ± 927 (NS) | 953 ± 577 ** | 962 ± 659 ** |
| (%de reducción) | (11,6%) | (55,1%) | (69,4%) | (69,1%) | |
| FATR | 6,1 ± 2,4 | 3,9 ± 0,99 (NS) | 4,02 ± 0,97 (NS) | 3,8 ± 0,9 ** | 3± 0,7 ** |
| (%de reducción) | (36%) | (34,1%) | (37,7%) | (50,8%) | |
| Pyr | 186,5 ± 110 | 118,9 ± 55 (NS) | 109,8 ± 59 * | 101,9 ± 42 * | 112,3 ± 39 (NS) |
| (%de reducción) | (36,2%) | (41,1%) | (45,3%) | (39,7%) | |
| DE:desviación estándar; FAT: fosfatasa alcalina total(U/l); FATR: fosfatasa ácida tartrato resistente (U/l); Pyr:piridinolina (nM/mM Cr); NS: no significativo. | |||||
| % dereducción = (valor basal valor obtenido / valorbasal) * 100. | |||||
| * p ¾ 0,05;** p ¾ 0,01. | |||||
Figura 1. Curvaevolutiva de descenso de los valores de fosfatasa alcalina total(FAT), fosfatasa ácida tartrato resistente (FATR) ypiridinolina (Pyr), tras el primer ciclo de tratamiento, a lo largode los seis meses de estudio.
Los marcadores deresorción fueron los que descendieron en mayorcuantía inicialmente, con un 36% a la semana del tratamiento(tanto la FATR como la Pyr) frente a un 11,6% la FAT.Posteriormente la FAT fue el parámetro de mayor respuesta.Los niveles de FAT siguieron un curso descendente durante todo elperíodo de estudio estabilizándose a partir deltercer mes. El descenso en los valores de FAT alcanzó unporcentaje por encima del 50% respecto a su valor basal al mes deiniciado el tratamiento y próximo al 70% a partir del tercermes (69,4% a los tres meses y 69,1% a los seis meses), siendoestadísticamente significativa la diferencia entre losvalores medios basales y los obtenidos a los tres y seis meses deltratamiento (p ¾ 0,01).
De los pacientes con EOPmonostótica, en el primer ciclo, uno respondió deforma muy espectacular, alcanzando los valores de FAT másbajos de los catorce pacientes incluidos en el estudio a los tresmeses del tratamiento (5.880 U/l valor basal, 590 U/l a los tresmeses), y el otro, si bien respondió al tratamiento, no tuvoun descenso tan significativo.
De los catorce pacientes,sólo dos (14%) consiguieron alcanzar cifras de FAT dentrodel rango normal.
Respecto a la FATR y la Pyr eldescenso en sus valores alcanzó una pendiente máximaa la semana y se estabilizó después. El descenso enlos valores de FATR superó el 50% a los seis meses, si biena partir del tercer mes alcanzó significaciónestadística (p ¾ 0,01), mientras que la Pyralcanzó su mayor descenso a los tres meses sin llegar a serdel 50% (45,8%), si bien fue significativo al mes y tres meses deltratamiento (p ¾ 0,05) (fig.1).
Los valores de PTH aumentaronmás del doble respecto al valor basal al mes de iniciado eltratamiento (88,38 pg/ml) y disminuyeron posteriormente a cifrascasi normales de forma similar al comportamiento que tuvieron losvalores del calcio iónico.
Respecto a los niveles devitamina D se produjo un descenso del 5,6% a la semana y a partirde entonces el aumento porcentual respecto al valor basal, en lasotras determinaciones, fue respectivamente: 42,5% (un mes), 40,7%(tres meses) y 19,4% (seis meses).
En cuanto a los efectossecundarios observados tras el primer ciclo, sólo dospacientes presentaron leucopenia transitoria, con cifras enningún caso inferiores a 3.000 como número total, yotros dos presentaron sintomatología seudogripal conartromialgias, astenia y febrícula que desapareciócon tratamiento analgésico y antitérmico(paracetamol).
En seis pacientes fue necesariala administración de un segundo ciclo de tratamiento conpamidronato por vía intravenosa a los dos años dehaber administrado el primero debido a una reagudizaciónclínica (dolor óseo) y bioquímica, con aumentode las cifras de FAT. De ellos, cuatro eran mujeres y dos varones,con una edad media de 75,3 ± 6,3 años. En cincopacientes la enfermedad era poliostótica y en unomonostótica.
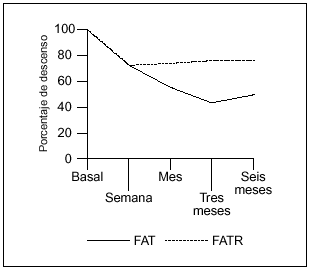
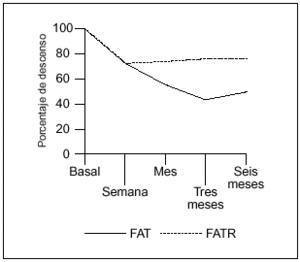
Las cifras medias de FAT alinicio del tratamiento eran seis veces superiores al valor superiornormal (2.151 U/l). Como en el primer ciclo, se produjo un descensoen los marcadores de formación y resorciónósea, excepto en los valores de Pyr a partir del tercer mes.Los valores de FAT, FATR y Pyr, en los seis pacientes, se expresande la misma forma que en el primer ciclo, como media ±desviación estándar (DE). Las medias de losparámetros analizados siguieron un curso descendente (salvoen el caso de los valores de Pyr a los tres y seis meses), y seexpresan en porcentaje (%) de descenso respecto a los valoresbasales (tabla 3, fig. 2).
| Tabla 3 Nivelesséricos y urinarios de marcadores bioquímicos delmetabolismo óseo (media ± DE) y porcentaje dereducción tras administración del segundo ciclointravenoso | |||||
| Basal | Semana | Mes | Tresmeses | Seismeses | |
| FAT(% de reducción) | 2.433 ± 913 | 1.780 ± 846 (NS) (26,8%) | 1.387 ± 797 (NS) (43%) | 1.022 ± 643 ** (58%) | 1.193 ± 825 * (51%) |
| (FATR % de reducción) | 5,4 ± 0,9 | 3,9 ± 0,4 (NS) (27,7%) | 4± 0,5 (NS) (26%) | 4,1 ± 0,6 (NS) (24%) | 4,1 ± 1,3 (NS) (24%) |
| Pyr(% de reducción) | 166,5 ± 42 | 122,2 ± 34 (NS) (26,6%) | 112,8 ± 25 (NS) (32,2%) | 246,2 ± 172 (NS) (* 47,8%) | 185,2 ± 106 (NS) (* 11,2%) |
| DE:desviación estándar; FAT: fosfatasa alcalina total(U/l); FATR: fosfatasa ácida tartrato resistente (U/l); Pyr:piridinolina (nM/mM Cr); NS: no significativo. | |||||
| % dereducción = (valor basal valor obtenido / valorbasal) * 100. | |||||
| * p ¾ 0,05;** p ¾ 0,01. | |||||
Figura 2. Curvaevolutiva de descenso de los valores de fosfatasa alcalina total(FAT) y fosfatasa ácida tartrato resistente (FATR), tras elsegundo ciclo de tratamiento, a lo largo de los seis meses deestudio.
El descenso inicial (a lasemana) en los valores de FATR y Pyr, respecto a la FAT, fue muchomenor comparado con el que se produjo en el primer ciclo. La FATfue nuevamente el parámetro que mejor respondió, conniveles significativos por debajo del 50% del valor basal a lostres meses de iniciado el tratamiento (p ¾ 0,01)manteniéndose a los seis meses (p ¾ 0,05). Sinembargo, el descenso no fue tan marcado como en el primer ciclo. Enel caso del segundo ciclo, el único paciente con enfermedadmonostótica era el mismo que había respondido deforma espectacular al primer ciclo y obtuvo con el segundo unarespuesta similar, alcanzando los valores de FAT más bajosdel grupo de pacientes (2.325 U/l valor basal, 620 U/l a los tresmeses).
Respecto a la FATR y la Pyr nose encontraron diferencias significativas. La FATR noconsiguió un descenso por encima del 30% durante elperíodo de estudio, y en cuanto a la Pyr, logró undescenso por encima del 30% al mes del tratamiento,observándose a partir de entonces un aumento progresivo desus niveles respecto al valor basal del 48% y 11,2% a los tres yseis meses del mismo.
La PTH aumentó respectoal valor basal, por encima del 50% en el primer mes de tratamiento(61,2 pg/ml), manteniéndose por encima del 40% durante elresto del estudio, de forma diferente al comportamiento durante elprimer ciclo, en el que descendió a valores normales. Elcalcio iónico se comportó de forma similar al primerciclo.
Entre los efectos secundariosobservados tras la administración del segundo ciclo,sólo un paciente presentó leucopenia transitoria, quecedió espontáneamente durante el seguimiento. Estepaciente además había presentado tambiénleucopenia tras la administración del primer ciclo, si biennunca llegó a ser inferior a 3.000 leucocitos ennúmero absoluto.
Se comprobó, por tanto,un menor descenso de los parámetros de formación yresorción ósea respecto al primer ciclo detratamiento en todos los pacientes que recibieron un segundociclo.
DISCUSIÓN
Actualmente se siguedesconociendo la etiología de la EOP, si bien existensospechas fundadas de un posible origenvírico25,26 junto con una cierta susceptibilidadgenética, no definida claramente todavía. Por ello,el tratamiento de la enfermedad va encaminado a tratar de detenerla actividad osteoclástica aumentada y anormal que seobserva en las fases activas del proceso. Durante años seutilizaron la calcitonina27-29 y eletidronato30, si bien la aparición de casosresistentes a la primera31 y los efectos sobre lamineralización ósea del segundo6 obligarona la búsqueda de alternativas terapéuticas. Deahí la aparición de los nuevos bifosfonatos, como elclodronato y el pamidronato. El pamidronato es un fármacopotente que se utiliza desde hace varios años para eltratamiento de la EOP2,3,18 y que presenta la ventaja desu administración por vía intravenosa con unaexcelente respuesta terapéutica que permite mantener unaremisión completa y prolongada en la mayoría de lospacientes, a veces con un único ciclo de tratamientointravenoso. Se han utilizado muchas pautas distintas detratamiento, y es difícil ofrecer una orientaciónconcreta sobre la pauta óptima a utilizar. Se han utilizadodiversos regímenes de tratamiento intravenoso17,32-44, con dosis diarias que oscilan entre 10 y 105mg. La dosis total empleada en los distintos regímenes hasido utilizada bien como una sola dosis37,41,43 orepartida en tres17 o cinco días40, obien administrada semanal40 o mensualmente45,según la experiencia de los distintos autores. Estudiosrecientes demuestran que el uso de una dosis única de 105 mges tan eficaz como el tratamiento con una dosis total de 165-210 mgfraccionada en cuatro infusiones37. Se ha comparado eltratamiento con pamidronato por vía intravenosa frente altratamiento con dos pautas orales, no encontrándosediferencias en la respuesta entre los grupos, con la ventaja de laadministración por vía intravenosa durante diezdías frente a la administración oralcontinua38.
Si bien existen numerososestudios en la literatura mundial sobre la efectividad deltratamiento con pamidronato en la EOP, son escasos los existentesen nuestro país17,46.
Los diferentes estudiosrealizados han encontrado un descenso en los valores de FAT queoscila entre un 60%-70% al año detratamiento36,38,40. En nuestro estudio, se obtuvieronresultados similares a partir del tercer mes de tratamiento tras elprimer ciclo, llegando casi al 70%, si bien, con el segundo ciclono se consiguió en ningún momento alcanzar el 60%. Escierto, que los estudios previos obtienen resultados medios de undescenso entre el 60%-70% al año del tratamiento, y ennuestro caso en cambio, los resultados se valoraron a los seismeses.
Sánchez Garmendia etal46, utilizando la misma dosis de pamidronato,alcanzaron un descenso en porcentaje de FAT ligeramente inferior alnuestro en la evaluación al mes, tres y seis meses (35,7%,59,5% y 64,2% respectivamente, frente a un 55,1%, 69,4% y 69,1% ennuestro estudio), si bien los valores medios iniciales de FAT eranprácticamente la mitad de
los de nuestro estudio (1.687 frente a 3.116). En este estudio seevaluó el descenso al año, siendo inferior al 60%(53,9%).
En otro estudio en el que seutilizaron dosis mayores de pamidronato (90 mg entotal)17 y en el que se valoraban los resultados con lamisma periodicidad que en el nuestro, se obtuvo una respuesta algosuperior en el descenso de los valores de FAT a los seis meses detratamiento. En este estudio, en cambio, los pacientes incluidospresentaban cifras basales de FAT que no alcanzaban cuatro veces elvalor normal máximo. No se pudo comparar la respuesta en losmarcadores de resorción ósea, pues se utilizóla eliminación urinaria de hidroxiprolina en lugar de lapiridinolina.
Respecto al porcentaje depacientes que normalizaron las cifras de FAT el resultado fueclaramente inferior respecto a otros estudios46,fundamentalmente por que los valores iniciales de FAT eran, ennuestro estudio, muy superiores.
Casi todos los autoresestán de acuerdo en que la EOP con actividadbioquímica debe ser tratada con el fin de evitartambién la aparición de complicaciones irreversibles,como deformidades, fracturas y aparición deartropatía secundaria5. Se ha propuesto que enpacientes con EOP con actividad leve y cifras de FAT del doble delrango superior de la normalidad, una única dosis de 60 mgparece ser suficiente. Si los valores de FAT son cuatro veces elvalor normal y la actividad de la EOP es moderada se recomiendaadministrar un total de 90 mg repartidos en tres díasconsecutivos (30 mg/día, durante tres días). En casode afectación grave se utilizan 180 mg y en algunos casosdosis mayores32. En general se recomienda no sobrepasarlos 60 mg/d, si bien como hemos visto, se han utilizado dosisúnicas de 105 mg sin efectos secundarios reseñables37,41.
En nuestro estudio utilizamosuna dosis total de 75 mg, repartidos en cinco días, similara la empleada en estudios previos en los que se habíaconseguido un descenso medio del 60% en las cifras deFAT40. Cabe destacar que en nuestro caso se trataba depacientes con cifras medias de FAT de once veces el valor normal enel primer ciclo de tratamiento, indicando una enfermedad grave,diferente a estudios previos en los que normalmente los valoresmedios de FAT pretratamiento eran de cinco veces el valor normal,por lo que la dosis total empleada (75 mg) debería habersido mayor, a fin de obtener un porcentaje superior de pacientesque normalizaran sus cifras de FAT.
Se han demostradomejorías con el tratamiento con pamidronato en lamayoría de los pacientes, consiguiéndose unanormalización de los parámetros bioquímicos deremodelado óseo, algunos de ellos durante períodossuperiores a dos años. Generalmente la reducción delos marcadores bioquímicos es más precoz y de mayorintensidad en los casos de EOP localizada que en las formaspoliostóticas, debido al marcado tropismo de losbifosfonatos por las zonas de intenso remodelado óseo,incorporándose de forma predominante en estas zonas dondeactúan durante años. Todos se concentran focalmenteen las áreas afectadas dado el alto recambio óseolocal, siendo ésta probablemente la causa principal de suefecto duradero. Debido a esta afinidad, es razonable pensar que aigualdad de dosis los pacientes con menor número de lesionespresentan una mayor concentración de bifosfonatos y mayorefecto de los mismos. En nuestro estudio de los dos pacientes conenfermedad monostótica, uno obtuvo una respuestaespectacular a ambos ciclos de tratamiento, comparado con lasformas poliostóticas, y el otro, aunque respondió altratamiento, no lo hizo de forma tan llamativa. Los efectos de losdistintos bifosfonatos son cuantitativamente similares, residiendolas diferencias en su potencia y perfil de efectosadversos21.
En general, el descenso de losmarcadores de resorción es más precoz que el de losde formación. Esto es debido a que el efecto sobre laresorción precede al ejercido sobre la formación, loque sugiere que la disminución de la formación essecundaria debido al acoplamiento entre ambos procesos. En nuestroestudio, se produjo también un descenso inicial mayor en losmarcadores de resorción ósea (FATR y Pyr) respecto alos de formación, si bien a partir del mes de tratamiento seinvirtieron los valores, manteniéndose el descenso de FATpor encima del 50% desde el primer mes y durante el resto delestudio. En los pacientes que recibieron un segundo ciclo detratamiento, se observó inicialmente una menor diferencia encuanto al descenso de los valores de FATR respecto a la FAT, ysólo a partir del tercer mes los valores de FAT alcanzaronun descenso por encima del 50%. Los valores de FATR no llegaron aalcanzar un descenso del 30% respecto al valor basal y los de Pyralcanzaron un descenso por encima del 30% al mes del tratamiento yposteriormente experimentaron un aumento respecto al valor basal apartir del tercer mes. Existen estudios que han encontrado unarespuesta similar a la administración de un segundo ciclo detratamiento41,43.
La eficacia del tratamiento semonitoriza mediante alguno de los parámetrosbioquímicos del recambio óseo, y si bien lahidroxiprolina urinaria resulta ser un marcador mejor para evaluarel efecto agudo del tratamiento que la FAT, esta última esmucho más fácil de determinar y más barata,por lo que probablemente sea el marcador bioquímico deelección en el seguimiento de estos pacientes.
El objetivo del tratamiento esdisminuir el recambio óseo hasta valores normales, y pareceexistir una relación entre la disminución delrecambio con el tratamiento y la duración del efecto delmismo. Esto suele producirse a los seis meses para la FAT. Esdifícil estipular cuándo se debe restablecer eltratamiento, si bien se ha sugerido que sería cuando losmarcadores bioquímicos aumentan al menos un 25%. En general,en la mayoría de los pacientes el tratamiento sigue siendoefectivo tras la administración de más de un ciclopor reactivación de la enfermedad, aunque el descenso en losmarcadores bioquímicos analizados es cada vez menosintenso.
Los efectos secundarios quepueden aparecer durante el tratamiento son en generalleves47. Puede producirse una tromboflebitis local (15%de los pacientes) en la zona de venopunción debido a laextravasación del compuesto38, en caso de que elvolumen líquido sea insuficiente. En cuanto a los efectosgenerales, puede producirse un cuadro seudogripal con fiebre,artromialgias y astenia. Sin embargo el efecto adverso másfrecuente es la aparición de un acceso febril, autolimitado,en el 25%-50% de los pacientes, generalmente a los dos o tresdías de la infusión y tras dosis moderadas oaltas33. En ocasiones aparecen trastornoshematológicos, fundamentalmente la aparición deleucopenia transitoria, en general después de la primerainfusión. La aparición de hipocalcemia es otro de losposibles efectos secundarios que pueden aparecer. Lainhibición de la resorción ósea por eltratamiento intravenoso provoca un descenso inicial en los nivelesséricos de calcio ionizado y del fósforo yconsecuentemente un aumento de la secreción de PTH, de formacompensadora, así como de la 1,25 (OH)2 vitaminaD. Con el objeto de evitar el aumento de PTH, algunos autoresaconsejan la administración conjunta de 0,5-1 g de calciodurante el tratamiento. También se utilizan en ocasiones400-800 unidades al día de vitamina D.
En general, con las dosishabituales no suele producirse alteración de lamineralización ósea, si bien con dosis acumuladas de180-360 mg sí parece que puedan existiralteraciones48. Por el contrario, otros trabajosrealizados en animales han demostrado un aumento de lamineralización ósea tras el tratamiento conpamidronato, de forma similar a los pacientes tratados conflúor, es decir, aumentando la densidad pero disminuyendo laresistencia del hueso49. Sin embargo, no se conoce elefecto a largo plazo de este tratamiento utilizado de formacontinuada.
En conclusión, estetrabajo confirma los resultados previos sobre la utilidad deltratamiento con pamidronato por vía intravenosa en la EOP,debido a su fácil administración, sus escasos efectossecundarios, y que en la mayoría de los pacientes permitemantenerlos libres de tratamiento durante al menos dos años,por lo que se convierte en una alternativa eficaz y segura en eltratamiento de los pacientes con EOP con actividadbioquímica marcada o resistente a otras alternativasterapéuticas27,45,50-52. Actualmente se tiende aadministrar en una sola dosis o a lo sumo en dos o tresdías, con lo que en muchos casos evita incluso lahospitalización del paciente, al convertirse en untratamiento para administrar en hospitales de día, lo quepermite un importante ahorro económico. También esimportante el hecho de que permite prescindir de un tratamientodiario, lo cual es muy importante en este grupo de pacientes, queen general son mayores de 65 años y que presentan otrasmuchas patologías que precisan distintos tratamientos. Comohemos visto también, la administración de un segundociclo de tratamiento fue menos efectiva en todos los pacientes,comprobándose un menor descenso de los parámetros deformación y resorción ósea.