La osteoporosis postrasplante causa una importante morbilidad en la creciente población de supervivientes del trasplante hepático. Los fármacos inmunosupresores habitualmente empleados son uno de los principales responsables de la osteoporosis postrasplante. La vitamina D y sus análogos sintéticos podrían ser útiles en el período postrasplante, ya que a sus efectos protectores a nivel óseo se añade su papel inmunomodulador, en particular de la inmunidad mediada por células T, lo que podría permitir no sólo disminuir la dosis de inmunosupresores, sino también colaborar en la prevención de la aparición de rechazo crónico.
La actividad biológica de la 1,25-(OH)2D3 se ha asociado tradicionalmente con la homeostasis del calcio y del fósforo y con el mantenimiento de la arquitectura del esqueleto. El calcitriol ejerce sus funciones por medio del receptor de vitamina D (VDR). El VDR es un factor de transcripción dependiente de ligando que pertenece a la superfamilia de los receptores nucleares de hormonas esteroideas/tiroideas. El hecho de que el VDR se encuentre también presente en otras células además de en el intestino, hueso, riñón y glándula paratiroides disparó la búsqueda a partir de la década de los ochenta de otras acciones de la 1,25-(OH)2D3 no relacionadas con el calcio. Actualmente existen evidencias de que el VDR está implicado en la proliferación celular, así como en los procesos de diferenciación e inmunomodulación1.
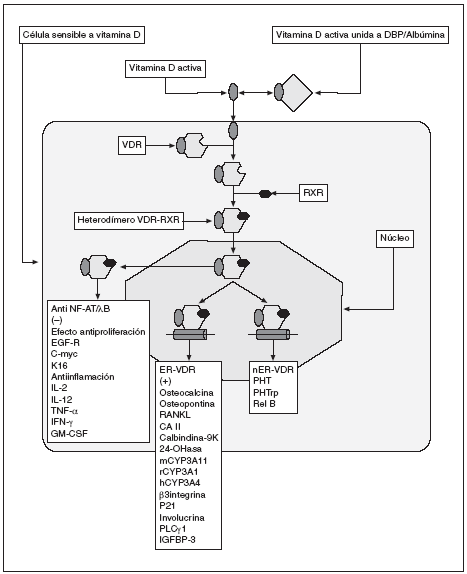
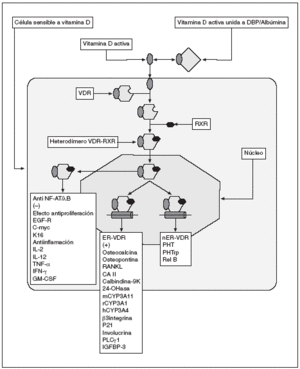
El VDR es un factor de transcripción dependiente de ligando que puede modular la expresión de los genes sensibles a 1,25-(OH)2D3 por tres vías diferentes (fig. 1). Puede activar la expresión de ciertos genes por medio de su unión a los elementos de respuesta a vitamina D (VDRE) presentes en sus regiones promotoras2, puede regular de forma negativa la expresión de otros genes uniéndose a fragmentos de ADN llamados VDRE «negativos» (nVDRE)3 y puede inhibir la expresión de algunos genes antagonizando la acción de ciertos factores de transcripción, tales como NF-AT y NF-kB. En la figura 1 se muestran genes cuya expresión es inducida por ligandos del VDR y que contienen un VDRE en sus regiones promotoras. Entre ellos se encuentran los genes de la osteocalcina, osteopontina, RANKL y anhidrasa carbónica II, que están implicados en la formación de la matriz ósea extracelular y en el remodelado óseo4. Otros genes que contienen un VDRE en sus regiones promotoras y que activan su expresión en respuesta a la 1,25-(OH)2D3 son la molécula de adhesión celular ß3 integrina, el gen supresor tumoral p21, calcibindina-9k, 24-hidroxilasa, CYP3A4, involucrina, PLC* 1 e IGFBP-3. En la figura 1 también se muestran genes regulados a la baja en respuesta a la 1,25-(OH)2D3 y sus análogos sintéticos. Los productos de estos genes tienen funciones hiperproliferativas e inflamatorias, lo que indica que muchos de los efectos terapéuticos de la 1,25-(OH)2D3 y sus análogos se deben a su efecto negativo sobre la transcripción de ciertos genes. Los ligandos de VDR inhiben la expresión de citocinas como IL-2 (células T y células mononucleares en sangre periférica [PBMC]), IL-12 (mielomonocitos), TNF-* (PBMC), INF-* (PBMC) y GM-CSF (PBMC)5,6. Entre los genes con actividad proliferativa que son inhibidos por los ligandos de VDR se encuentran: EGF-receptor (queratinocitos), c-myc (queratinocitos),y K16 (placas psoriasis). La PTH (células paratiroideas) y PTHrP (osteoblastos y queratinocitos) que se implican en la homeostasis mineral son también regulados a la baja por ligandos VDR. Rel B (un componente de NF-*B) experimenta regulación a la baja por 1,25-(OH)2D3 en células dendríticas.
Fig. 1. Representación esquemática del transporte, interacción con receptor y efectos directos e indirectos de vitamina D activa. VDR: receptor de vitamina D; RxR: receptor de ácido retinoico X; ER-VDR: elemento de respuesta al VDR; nER-VDR: elemento de respuesta negativa de VDR.
Al disponer de estos nuevos datos se plantean potenciales aplicaciones terapéuticas de los ligandos de VDR en enfermedades inflamatorias (artritis reumatoide, artritis psoriásica), patología dermatológica (psoriasis, queratosis actínica, dermatitis seborreica, etc.), cáncer (próstata, colon, mama, mielodisplasia y leucemia), hiperparatiroidismo secundario y enfermedades autoinmunes (lupus eritematoso sistémico, diabetes mellitus tipo 1, esclerosis múltiple y trasplante de órganos), osteoporosis1, etc.
Nos centraremos en el papel desempeñado por la 1,25-(OH)2D3 en el trasplante, concretamente en el hepático y en la osteoporosis postrasplante.
La estrategia habitualmente empleada para la prevención del rechazo de trasplante implica el uso de agentes inmunosupresores como corticosteroides y ciclosporina. La 1,25-(OH)2D3 ejerce varios efectos inmunomoduladores como la inhibición de la proliferación de linfocitos T7, regulación a la baja de las citocinas IL-2 e INF-*8 y maduración y supervivencia de células dendríticas9. Basándose en estas observaciones se han desarrollado numerosos modelos experimentales incluyendo trasplantes de corazón, hígado10, islotes pancreáticos11 y piel, para evaluar el papel de la 1,25-(OH)2D3 y sus análogos solos o en combinación con otros agentes inmunosupresores.
En 2001 Redaelli et al10 investigaron el efecto inmunosupresor de la 1,25-(OH)2D3 sola y en combinación con bajas dosis de ciclosporina A en trasplantes hepáticos vascularizados en ratas. Se midieron la función y la supervivencia del trasplante, el rechazo histológico, las concentraciones de IL-2, IL-4, IL-10 e IL-12 en suero y en el órgano trasplantado. Observaron que la 1,25-(OH)2D3 incrementaba la supervivencia del trasplante de forma dosisdependiente. La bilirrubina sérica, aspartato transaminasa (AST) y lactato deshidrogenasa (LDH) fueron significativamente menores en los animales tratados con 1,25-(OH)2D3. El calcitriol disminuía las concentraciones de IL-2 e IL-12 en suero y en el trasplante, e incrementaba las de IL-4 e IL-10 en este último. El índice de actividad de rechazo 10 días después del trasplante fue significativamente menor en las ratas tratadas con 1,25-(OH)2D3 en altas o bajas dosis en comparación con los controles. La combinación de dosis altas o bajas de 1,25-(OH)2D3 y ciclosporina prolongaba la supervivencia del trasplante cuando se comparaba con bajas dosis de ciclosporina A en monoterapia. Después de tres semanas se desarrolló hipercalcemia en ratas tratadas con altas dosis de 1,25-(OH)2D3. Concluyeron que la 1,25-(OH)2D3 prolonga la supervivencia tras el trasplante hepático en ratas disminuyendo la severidad del rechazo agudo5,6.
Aunque estos hallazgos son interesantes, quizá el principal interés se encuentre en la prevención del rechazo crónico, ya que los tratamientos inmunosupresores actuales permiten un buen control del rechazo agudo de trasplante, sin embargo el rechazo crónico continúa siendo un importante problema médico. La inducción de una tolerancia estable al trasplante aún no se ha alcanzado. Algunos autores sugieren la aplicación de la 1,25-(OH)2D3 y sus análogos en la inducción de tolerancia y prevención del rechazo crónico dadas sus propiedades inmunomoduladoras12. En esta línea de investigación del rechazo crónico se ha observado que la inflamación de la adventicia y la hiperplasia de la íntima en el trasplante de aorta en ratas se inhibía gracias al tratamiento con ligando del VDR13. La 1,25-(OH)2D3 inhibe la proliferación de células T inducida por antígenos, así como la producción de citocinas14. Las células presentadoras de antígeno, en particular las células dendríticas, son el principal objetivo de la acción inmunosupresora de la 1,25-(OH)2D3.
Aparte de su función inmunosupresora en el trasplante, la 1,25-(OH)2D3 y sus análogos han mostrado importantes efectos en la prevención de pérdida de masa ósea, así como en la mejoría de la calidad del hueso después del trasplante de órganos15-17.
El hueso es uno de los principales tejidos diana de las acciones de la forma hormonalmente activa de la vitamina D, los ligandos del VDR regulan tanto la formación como la resorción ósea. Por ello se han utilizado calcitriol y alfacalcidiol en el tratamiento de la osteoporosis y osteomalacia, y algunos ligandos del VDR (ED-71, Ro-26-9228 y 2MD) se hallan en desarrollo preclínico/clínico para el tratamiento de la osteoporosis. Parte de los efectos anabólicos de los ligandos del VDR en el hueso consisten en el aumento de la absorción intestinal de calcio e inhibición de la síntesis de la PTH. Sin embargo, el mecanismo de los efectos anabólicos de la 1,25-(OH)2D3 sobre el hueso no está suficientemente esclarecido. Clásicamente se ha considerado a la 1,25-(OH)2D3 un estimulador de la resorción ósea, porque induce la osteoclastogénesis al aumentar la expresión de RANKL en las células del estroma de la médula ósea. Sin embargo, in vivo, los ligandos del VDR disminuyen la resorción ósea e incrementan la formación de hueso en animales ovariectomizados y mujeres osteoporóticas. Por lo tanto, la 1,25-(OH)2D3 puede favorecer la resorción en un estado normal, y potenciar la formación ósea así como la actividad antirresortiva en un estado osteoporótico. Una paradoja similar se ha observado en la piel, en donde los ligandos del VDR inhiben la proliferación de queratinocitos en piel con psoriasis, pero inducen la proliferación de la epidermis en una piel normal1.
El VDR se expresa en altos niveles en osteoblastos primarios y en varias líneas celulares osteoblásticas; esto podría ser la clave para explicar los efectos anabólicos de la 1,25-(OH)2D3 y sus análogos sintéticos18. La osteoporosis implica la pérdida de los componentes mineral y orgánico del hueso. La 1,25-(OH)2D3 incrementa la expresión de osteocalcina y osteopontina en osteoblastos, contribuyendo a la formación de la matriz ósea (fig. 1). Existen numerosas referencias en la literatura acerca de la prevención y disminución de fracturas vertebrales y del incremento en la densidad mineral ósea (DMO) corporal total en mujeres con osteoporosis en tratamiento con vitamina D. Un reciente metaanálisis muestra que la administración de suplementos orales de vitamina D en el rango de 700-800 UI/día (frente a las dosis de 400-600 UI/día, que no mostraron efecto) parece reducir el riesgo de fractura de cadera y fracturas no vertebrales en aproximadamente un 25% en pacientes ancianos ambulatorios y hospitalizados19. Por otra parte, el uso de vitamina D activa como tratamiento para la osteoporosis se halla limitado por su estrecho margen de seguridad, debido al riesgo de desarrollar hipercalcemia e hipercalciuria, a no ser que los pacientes sean cuidadosamente monitorizados20. Estos efectos no deseados se deben a un incremento en la absorción de calcio a nivel intestinal que incrementa los niveles de calcio en orina y sangre, lo que podría favorecer la mineralización de las partes blandas y la formación de litiasis renal.
Antes del injerto los pacientes con enfermedad hepática crónica presentan una disminución de la DMO, un aumento en el número de fracturas y un metabolismo mineral alterado (se incrementan los marcadores urinarios de resorción y disminuyen los metabolitos de la vitamina D y la osteocalcina)21. Varios factores contribuyen al desarrollo de enfermedad ósea, especialmente la malnutrición, la inmovilización y los cambios hormonales que tienen lugar en la hepatopatía crónica. Esta pérdida de masa ósea se acelera después del trasplante22. Varios mecanismos incrementan la resorción ósea en este período. Factores con influencia negativa en el metabolismo del hueso como malnutrición, inmovilización e inflamación son importantes en el primer período después del trasplante. El tratamiento farmacológico, de modo especial la corticoterapia, es uno de los principales factores responsables de la pérdida de masa ósea (disminución de la absorción intestinal de calcio, hiperparatiroidismo secundario, etc.). Existe evidencia de que los marcadores de resorción ósea aumentan en función de la dosis de tratamiento inmunosupresor23.
La pérdida de hueso y las fracturas son mayores en los primeros 6-12 meses postrasplante. La DMO de la columna disminuye del 2%-24% durante el primer año, la tasa de fractura se incrementa del 24% al 65%, sobre todo en costillas y vértebras. Las mujeres con cirrosis biliar primaria parecen tener más riesgo. A diferencia de la enfermedad ósea de bajo turnover, que aparece en la osteoporosis inducida por glucocorticoides, en el período postrasplante se encuentra un estado de turnover alto24.
En un estudio realizado por Trautwein et al en el 2000 se observó que durante los primeros 24 meses postrasplante los niveles de osteocalcina se incrementan significativamente, indicando una aceleración de la formación ósea. El procolágeno (otro marcador de formación ósea) también se incrementa, aunque sin significación estadística comparada con niveles pretrasplante. Además los niveles de procolágeno y osteocalcina estaban bajo el rango de la normalidad. En contraste, durante los primeros 24 meses postrasplante la resorción (indicada por la concentración de telopéptido ICTP) estaba significativamente aumentada. Por lo tanto, la osteoporosis postrasplante se halla sobre todo en relación con un aumento de la resorción ósea25.
En vista de los resultados de incremento de riesgo de osteoporosis y fracturas postrasplante habría que considerar el tratamiento preventivo en los receptores de trasplante hepático. Se debería iniciar el tratamiento incluso antes del trasplante, o al menos inmediatamente después del mismo, ya que la mayoría de pérdida ósea ocurre durante este período. Por el momento, la terapia antirresortiva con bifosfonatos parece ser la aproximación más prometedora para la prevención y tratamiento de la osteoporosis24.
El mecanismo por el que la 1,25-(OH)2D3 previene la osteoporosis postrasplante se debe probablemente a su efecto sobre el hiperparatiroidismo causado por el uso de corticosteroides o ciclosporina. Además, las propiedades inmunomoduladoras de la 1,25-(OH)2D3 pueden permitir disminuir la dosis de ciclosporina y/o corticoides, lo que potencialmente contribuiría a una mejora en la pérdida de hueso relacionada con el trasplante24. Los ligandos de VDR tienen efectos pleiotrópicos sobre el sistema inmune. En particular, sus efectos sobre las células dendríticas parecen inducir células dendríticas tolerantes, resultando en anergia de células T. Por estos motivos todos los estudios preclínicos sugieren que la 1,25-(OH)2D3 y sus análogos pueden emplearse potencialmente para la prevención del rechazo del trasplante26. El desafío para el futuro es desarrollar ligandos de VDR sin efecto secundario hipercalcémico.
Por otra parte, las pérdidas óseas varían ampliamente entre pacientes con idénticos regímenes inmunosupresores y similares períodos de inmovilidad postrasplante. Una posible explicación es el polimorfismo en el VDR. Los genotipos del VDR se asocian significativamente con los cambios de DMO en el postrasplante hepático. Pacientes con genotipo Bb o BB mostraron una pérdida ósea vertebral sustancialmente mayor que pacientes con genotipo bb27. Varios estudios publicados, incluido algún metaanálisis, sugerían que la DMO no se asociaba con los polimorfismos del receptor de vitamina D (VDRGP). En 1999 Gong et al28 realizaron un metaanálisis en el que concluyeron que la DMO se asocia con VDRGP con altos niveles de confianza, y que fallos en la detección de dicha asociación se deben principalmente a factores no genéticos (edad, sexo, menopausia, osteoporosis, etc.) y, posiblemente, a la heterogeneidad genética de las poblaciones estudiadas.
El déficit de vitamina D a menudo es infradiagnosticado, o erróneamente diagnosticado. Hay tres motivos principales29; en primer lugar se cree que tanto la exposición solar como la ingesta en la dieta de vitamina D es adecuada, y por tanto que los europeos y americanos no tienen riesgo de tal déficit. Los datos nos dicen lo contrario. El 32% de los adultos sanos con edades entre los 18 y los 29 años presentaban déficit de vitamina D a finales de invierno en Boston30. Con respecto a la población europea se conoce desde hace tiempo la tendencia a la hipovitaminosis D que existe en los países nórdicos, sin embargo hay menos información disponible acerca del estatus de vitamina D en los países mediterráneos. Varios estudios realizados en España han constatado que existe una alta prevalencia de hipovitaminosis D. En centros de Atención Primaria, González-Clemente et al hallaron una prevalencia de déficit de vitamina D (< 10 ng/ml de calcifediol) del 35% entre la población mayor de 65 años31. En centros de especialidades se han encontrado cifras similares. En consultas de Reumatología, Aguado et al demostraron una prevalencia del 35% para niveles de calcifediol < 10 ng/ml, 64% para niveles < 15 ng/ml y 87% para niveles < 20 ng/ml32. En una unidad de osteoporosis, Mezquita et al hallaron una prevalencia del 39% para niveles de calcifediol < 15 ng/ml33. En segundo lugar, los médicos, en las analíticas de rutina, obtienen valores de calcio; si lo encuentran en el rango de la normalidad asumen que la vitamina D es suficiente, lo que no siempre es correcto. Por último muchos médicos para determinar el estatus de vitamina D solicitan los valores de 1,25-dihidroxivitamina D. El valor de 1,25-(OH)2D3 no sólo no mide el estatus de vitamina D, sino que puede conducir a error al hacer creer que el paciente tiene suficiente vitamina D. Cuando hay un déficit de esta vitamina se produce un incremento de PTH, lo que incrementa la producción renal de 1,25-(OH)2D3, cuya concentración en sangre periférica puede ser normal o incluso elevada34. El metabolito de la vitamina D, que se debería medir para determinar su estatus, es la 25(OH)D o calcifediol, que es la principal forma circulante de vitamina D.
Se ha observado desde hace tiempo que las personas que viven en latitudes altas muestran un incremento en el riesgo de padecer muchas enfermedades crónicas, incluyendo los principales tipos de cáncer, esclerosis múltiple e hipertensión29. En 1979 Rostand35 indicaba que las personas que vivían a latitudes altas, tanto en Estados Unidos como en Europa, mostraban un mayor riesgo de hipertensión arterial. A finales de los años ochenta y en los inicios de los noventa varios investigadores señalaron un incremento en el riesgo de muerte por cáncer de colon, próstata, y mama en poblaciones de latitudes altas en Estados Unidos y Europa36,37. En un estudio retrospectivo Ahonen et al38 hallaron que los varones comenzaban a desarrollar cáncer de próstata a la edad media de 52 años, mientras que varones con mayor exposición solar a lo largo de sus vidas comenzaban a desarrollar cáncer de próstata entre 3 y 5 años más tarde.
Tradicionalmente se ha menospreciado el papel de la 1,25-(OH)2D3, especialmente en los países mediterráneos, al suponer que la calidad y cantidad de horas solares y la ingesta dietética aseguraban unos adecuados niveles de vitamina D, y al desconocer el amplio espectro de acción de la 1,25-(OH)2D3 con el consiguiente potencial terapéutico.